二氯乙酸通过减少糖酵解抑制大肠癌细胞增殖
2017-11-01肖慧杰王轶卓刘铜军
肖慧杰,王轶卓,于 威,刘铜军
(1.吉林大学中日联谊医院,吉林 长春130033;2.吉林大学第一医院;3.吉林大学第二医院)
二氯乙酸通过减少糖酵解抑制大肠癌细胞增殖
肖慧杰1,王轶卓2,于 威1,刘铜军3*
(1.吉林大学中日联谊医院,吉林 长春130033;2.吉林大学第一医院;3.吉林大学第二医院)
目的探讨二氯乙酸对大肠癌细胞的增殖抑制作用机制。方法使用梯度浓度的二氯乙酸作用于大肠癌细胞,二氯乙酸的浓度分别为1、5、10 mmol/L,另设阴性对照组(加等体积培养基)。MTT法检测不同浓度二氯乙酸对大肠癌细胞增殖抑制情况。Western Blot方法检测实验组大肠癌细胞中HK-Ⅱ、PDH、Kv1.5、Caspase3、Caspase9的表达情况。使用乳酸试剂盒检测大肠癌细胞中乳酸的生成量。结果二氯乙酸对大肠癌细胞增殖具有明显的抑制作用,10 mmol/L组的肿瘤细胞生存率仅为对照组的20%。Western Blot检测发现二氯乙酸作用下大肠癌细胞中Caspase3及Caspase9表达增加,证实二氯乙酸诱导大肠癌细胞凋亡。HK-Ⅱ表达量明显减少,乳酸生成量减少,证实减少了大肠癌细胞的葡萄糖酵解。结果还发现二氯乙酸作用的细胞中Kv1.5蛋白表达量明显高于对照组,可能使电压门控的钾离子通道明显增加并使线粒体膜电位复极。结论二氯乙酸通过抑制大肠癌细胞糖酵解发挥增殖抑制作用。
二氯乙酸;大肠癌;糖代谢;凋亡
(ChinJLabDiagn,2017,21:1824)
研究显示通过二氯乙酸(DCA)靶向抑制PDK促进了肿瘤细胞的代谢形式由糖酵解转化为氧化磷酸化并且抑制了肿瘤的生长[1-3]。这一发现显示PDK/PDH轴可能对肿瘤细胞的代谢生长起一定的作用。将酵解转化为有氧代谢,降低线粒体膜电位,增加ROS生成,这种变化可以发生在肿瘤细胞内[4]。PDH将丙酮酸转化为乙酰辅酶A,然后进入三羧酸循环,通过电子传递链完成电子传递,产生能量ATP,PDH是此过程中的关键酶之一,一定程度上决定细胞进行葡萄糖有氧代谢的量和速度,有试验证实实体瘤细胞中PDH表达降低[5,6]。DCA可以抑制肿瘤细胞增殖,但其对正常组织细胞并不表现出上述作用,对人体没有毒性。本文探讨DCA对大肠癌细胞的增殖抑制作用机制。
1 材料与方法
1.1材料DMEM培养基、胰蛋白酶、小牛血清购于Gibco 公司;DCA购于Sigma 公司;HK-Ⅱ、PHD、Kv1.5、Caspase3、Caspase9抗体及lactic acid kit、ROS kit购于Dako公司。
1.2方法
1.2.1细胞培养 直肠癌细胞HT-29常规培养于含10%的含小牛血清的DMEM培养液中,置于二氧化碳浓度5%,37℃恒温培养箱内培养。
1.2.2MTT 将细胞培养于96孔板内,每孔细胞数约为1×104,每孔体积约为200 μl,每3孔为一组。DCA的实验浓度分别为1 mmol/L、5 mmol/L及10 mmol/L,设阴性对照组,只给予培养基但不添加DCA溶液。作用时间结束后进行MTT检测,每孔加MTT 10 μl,浓度为5 g/L ,继续孵育2小时后终止培养,弃去上清液,每孔加入二甲亚砜200 μl,将96孔板置于微量振荡器上摇震5 min,摇震过程中避光进行。震荡结束后采用分光光度计进行检测,读取490 nm 波长处吸光度。
1.2.3Western Blot 取对数生长HT-29细胞分别接种于直径3 cm培养皿中,待细胞覆盖率达约90%时进行实验,在实验组培养皿中加入DCA溶液,浓度分别为1 mmol/L,5 mmol/L和10 mmol/L,对照组加入等体积的培养液,放回孵箱内继续孵育4小时。去上清用PBS冲洗3次,使用细胞裂解液于冰上裂解细胞,作用时间为30 min。收集细胞于EP管内,取少量上清进行蛋白定量(BCA 蛋白定量法具体参照试剂盒说明书),用细胞裂解液将各组蛋白稀释至等浓度。将细胞裂解液与上样缓冲液等体积混合,置标本于100℃水浴中煮沸5 min,取蛋白30 μg上样后进行凝胶电泳后进行转膜至硝酸纤维素膜,转膜电压为50V,转膜时间为90 min。于4℃冰箱内使用5% 脱脂牛奶封闭过夜,加入浓度为1∶500的一抗于4℃冰箱孵育过夜,后使用TPBS润洗3次,加入浓度为1∶5 000的二抗于室温孵育2小时,后使用TPBS润洗3次,使用PBS洗涤1次,后使用ECL发光试剂盒暗室发光、显影、定影。
1.2.4乳酸测定 取对数生长期的HT-29细胞用胰酶消化后接种于96孔板中,每孔细胞数约为1×104,每3孔为一组,DCA的实验浓度分别为1 mmol/L、5 mmol/L、10 mmol/L,设对照组加等体积培养基。将96孔板放回孵箱内继续孵育4小时。使用96孔板检测乳酸生成量,将不同浓度的标准品50 μl加入孔内,样本孔先后加入细胞培养基10 μl及样本稀释液40 μl,空白孔不加。然后于标准品孔和样本孔内分别加入辣根过氧化物酶(HRP)标记的检测抗体100 μl,空白孔不加。后使用封板膜封闭96孔板,并将其放回37℃孵箱内孵育60 min。取出96孔板,弃去上清在吸水纸上拍干,分别于每个孔内加满洗涤液,静置1 min后甩去洗涤液,在吸水纸上拍干,重复上述操作5 次。然后于每孔内加入底物A和底物B 各50 μl,使用铝箔覆盖96孔板,达到避光的目的,并将其放回37℃孵箱内孵育15分钟。孵育完成后每孔加入终止液50 μl,在450 nm波长处测定各孔的OD值,测量读数经细胞总蛋白平衡后进行统计分析。

2 结果
2.1DCA抑制大肠癌细胞增殖
实验组细胞培养液DCA浓度为1、5、10 mmol/L,对照组不加DCA,培养4小时,使用MTT法检测细胞数,设定对照组细胞数为100%,实验组结果与对照组结果的比值为实验组数据,以百分数的形式呈现。实验组细胞数明显低于对照组,此现象于3个梯度浓度的DCA作用组被观察到,其中最高浓度实验组HT-29细胞的生存率仅为对照组的20%。随着DCA溶液浓度的升高各组细胞的生存率逐渐降低,并呈现出浓度依赖趋势(图1)。

图1 DCA对HT-29细胞的增殖抑制作用
2.2DCA增加HT-29细胞Caspase9、Caspase3表达,通过诱导凋亡发挥抗增殖作用
DCA的抗增殖作用已经在MTT实验中得到证实,为了判断DCA抗大肠癌细胞增殖作用是否通过诱导细胞凋亡的发生,通过Western Blot方法检测实验细胞中凋亡特异蛋白Caspase9和Caspase3。DCA实验组大肠癌细胞中Caspase蛋白表达均高于对照组。说明DCA通过诱导凋亡发挥抗增殖作用(图2A、图2B)。

图2A DCA增加HT-29细胞中Caspase9表达量

图2B DCA增加HT-29细胞中Caspase3表达量
2.3DCA减少乳酸生成,减少葡萄糖酵解
为了观察DCA对大肠癌细胞葡萄糖代谢的作用,明确其是否改变了大肠癌细胞葡萄糖代谢模式,检测了不同浓度作用下及对照组大肠癌细胞中乳酸生成量,同时用细胞数进行平衡。分别设立3个DCA梯度浓度1、5、10mmol/L,作用时间为4小时,孵育完成后于镜下计数细胞,然后使用乳酸检测试剂盒测定各组乳酸生成量并除以相应的细胞数进行平衡,以对照组数值为100%,各实验组数据比较对照组得出相应的百分数。结果显示单位细胞数中乳酸生成量随着DCA浓度的增加而减少,10 mmol/L组的实验数值最低,仅为43.3%。说明在DCA作用下大肠癌细胞葡萄糖酵解的比例减少(图3)。

图3 DCA减少HT-29细胞乳酸生成量
2.4DCA影响葡萄糖代谢相关蛋白表达
HK-Ⅱ是葡萄糖酵解第一步反应的关键酶,在多数肿瘤细胞中该酶均高表达,与较高的葡萄糖酵解率相吻合,DCA可以降低大肠癌细胞的葡萄糖酵解率,本实验通过Western Blot方法检测实验组及对照组大肠癌细胞中HK-Ⅱ表达量变化,结果显示实验组中HK-Ⅱ表达明显减少同时呈现出浓度依赖性。PDH可以催化丙酮酸不可逆的氧化脱羧转化成乙酰辅酶A进入三羧酸循环,实验组与对照组中PDH表达量的比较发现DCA实验组细胞中PDH表达增加,可以进一步解释DCA增加大肠癌细胞葡萄糖有氧代谢同时减少葡萄糖酵解(图4A,图4B)。
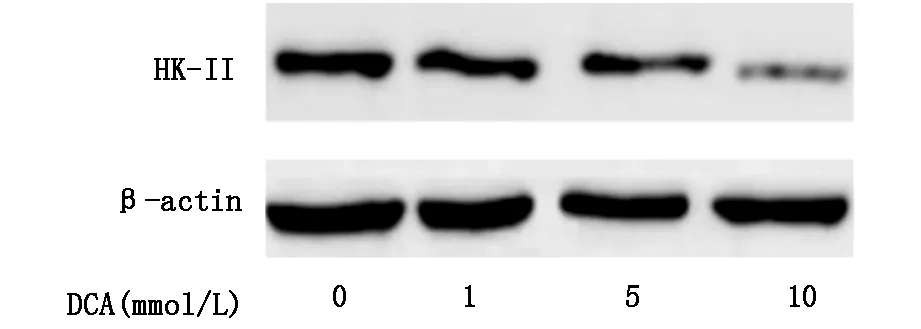
图4A DCA降低HT-29细胞中HK-Ⅱ表达量
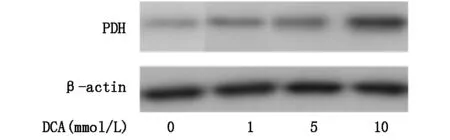
图4B DCA增加HT-29细胞中PDH表达量
2.5DCA增加Kv1.5表达
本实验中用梯度浓度的DCA作用大肠癌细胞HT-29,用Western Blot方法检测Kv1.5的蛋白表达水平,结果发现实验组细胞中Kv1.5蛋白表达量明显高于对照组。由于电压门控的钾离子通道明显增加,线粒体膜电位差变小,大肠癌细胞中明显超极化的线粒体膜发生了复极反应,这样线粒体的功能可能得到恢复,可以正常的进行葡萄糖有氧代谢,而不仅仅是葡萄糖酵解(图5)。
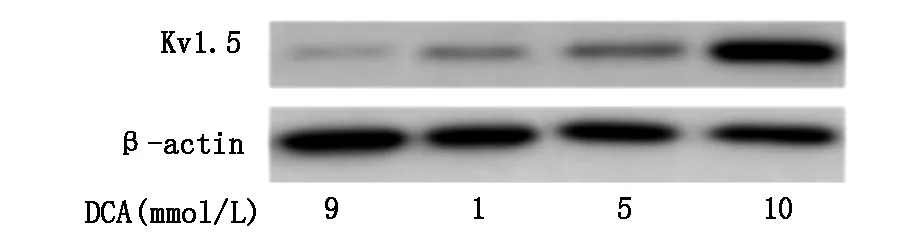
图5 DCA增加HT-29细胞中Kv1.5的表达量
3 讨论
多种肿瘤细胞的能量代谢都表现出一个相似的现象,那就是线粒体超极化同时降低电压门控通道蛋白的表达量,进而表现出抗凋亡特性。DCA是一种小分子无机物,它可以作用于线粒体使其去极化,在体内实验及体外实验中均表现出了诱导凋亡和抑制肿瘤细胞生长的作用[7,8]。DCA可以明显的增加葡萄糖有氧代谢而降低糖酵解的比例,DCA通过恢复线粒体膜电位和增加电压门控通道蛋白表达这两种方法来发挥上述作用。
“有氧糖酵解”这个词于1930年首先被瓦伯格提出,用来描述肿瘤细胞的一种代谢特征,即使在氧气供应充足的情况下仍然选择通过葡萄糖酵解的代谢方式提供能量,这种具有普遍性现象在多种肿瘤细胞中被观察到,可以称为肿瘤细胞的一大特征。人们尚且不清楚有氧糖酵解与肿瘤细胞的抗凋亡现象之间的关系,究竟是有氧糖酵解导致了肿瘤细胞的不死状态还是肿瘤细胞的不死性导致了有氧糖酵解。但是多数学者认为[9,10],肿瘤细胞的这种代谢特征可能成为抗肿瘤治疗的一个有效靶点,针对这一现象的研究工作也大量开展。我们的实验结果显示DCA作用下大肠癌细胞中乳酸生成量明显减少,表明DCA作用下的大肠癌细胞的葡萄糖酵解率明显降低(图3)。同时我们观察到DCA有效抑制了大肠癌细胞增殖,随着DCA浓度的增加肿瘤细胞生存率逐渐降低(图1)。这个结果提示了通过改变大肠癌细胞葡萄糖代谢模式可以发挥抗增殖作用,而且DCA具有上述作用。
肿瘤细胞的抗凋亡现象包括多种机制。目前的研究结果逐渐聚焦于由于线粒体功能受损导致的电压依赖通道的低表达是肿瘤细胞抗凋亡的原因。关闭钾离子通道并降低钾离子通道表达量导致细胞内高钾导致了毒性诱导细胞凋亡。但是有些研究结果证明钾离子通道过度打开也可以导致肿瘤细胞凋亡[11,12],这是完全相反的现象,这可能与不同的肿瘤类型有关。在我们此次实验中观察到Kv1.5表达增加后肿瘤细胞凋亡增加了(图5),提示在大肠癌细胞中,DCA可以增加Kv1.5表达量可能诱导大肠癌细胞凋亡。
肿瘤细胞特异的葡萄糖代谢模式可能成为抗肿瘤治疗的新的靶点,在单独使用此类药物或联合其余药物使用时都表现出良好的抗肿瘤增殖的作用。DCA是这样一种理想的药物,可以恢复肿瘤细胞线粒体膜电位,恢复其正常的生理功能,改变葡萄糖代谢模式,减少糖酵解比例,增加葡萄糖有氧代谢即进入三羧酸循环进行充分代谢获取能量。此次实验中发现在DCA作用下糖酵解相关蛋白表达明显降低, PDH表达明显增加,这样可以使更多的丙酮酸经过转化后进入三羧酸循环并供能。值得关注的现象是DCA降低糖酵解比例时降低了乳酸生成量,这样肿瘤细胞生长环境的pH值发生了变化,而且单位质量的葡萄糖生成的ATP量明显增加,上述两种变化是否能够对肿瘤细胞增殖产生影响仍然需要进一步验证。
[1]Liu W,Jiang J,Lou L.Design,synthesis and anticancer activity of diam(m)ine platinum(Ⅱ) complexes bearing a small-molecular cell apoptosis inducer dichloroacetate[J].J Inorg Biochem,2015,146:14.
[2]Shen H,Decollogne S,McDonald KL.Dual-targeting of aberrant glucose metabolism in glioblastoma[J].J Exp Clin Cancer Res,2015 ,34:14.
[3]Li C,Meng G,Su L,Chen A,et al.Dichloroacetate blocks aerobic glycolytic adaptation to attenuated measles virus and promotes viral replication leading to enhanced oncolysis in glioblastoma[J].Oncotarget,2015,6(3):1544.
[4]Bhat TA,Kumar S,Chaudhary AK,et al.Restoration of mitochondria function as a target for cancer therapy[J].Drug Discov Today,2015,20(5): 635.
[5]Kim JW,Tchernyshyov I,Semenza GL,et al.HIF-1-mediated expression of pyruvate dehydrogenase kinase: a metabolic switch required for cellular adaptation to hypoxia[J].Cell Metab,2006,3(3):177.
[6]Ferriero R,Iannuzzi C,Manco G,et al.Differential inhibition of PDKs by phenylbutyrate and enhancement of pyruvate dehydrogenase complex activity by combination with dichloroacetate[J].J Inherit Metab Dis,2015,38(5):895.
[7]Bonnet S,Archer SL,Allalunis-Turner J,et al.A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth[J].Cancer Cell,2007,11(1):37.
[8]McMurtry MS,Bonnet S,Wu X,et al.Dichloroacetate prevents and reverses pulmonary hypertension by inducing pulmonary artery smooth muscle cell apoptosis[J].Circ Res,2004,95(8):830.
[9]Shavit R,Ilouze M,Feinberg T,et al.Mitochondrial induction as a potential radio-sensitizer in lung cancer cells-a short report[J].Cell Oncol (Dordr),2015 ,38(3):247.
[10]Prabhu A,Sarcar B,Miller CR,et al.Ras-mediated modulation of pyruvate dehydrogenase activity regulates mitochondrial reserve capacity and contributes to glioblastoma tumorigenesis[J].Neuro Oncol,2015,17(9):1220.
[11]Ru Q,Tian X,Wu YX,et al.Voltage-gated and ATP-sensitive K+ channels are associated with cell proliferation and tumorigenesis of human glioma[J].Oncol Rep,2014 ,31(2):842.
[12]Comes N,Bielanska J,Vallejo-Gracia A,et al.The voltage-dependent K(+) channels Kv1.3 and Kv1.5 in human cancer[J].Front Physiol,2013,4:283.
Dichloroaceticacidinhibitstheproliferationofcolorectalcancercellsbyreducingglycolysis
XIAOHui-jie,WANGYi-zhuo,YUWei,etal.
(China-JapanUnionHospitalofJilinUniversity,Changchun130033,China)
ObjectiveTo investigate the inhibitory effect of DCA on the proliferation of colorectal cancer cells.MethodsThe gradient concentration of DCA was used to treat colorectal cancer cells,and the gradient concentration of DCA was 1,5,10mmol/L,and the other was the negative control group (with equal volume medium).MTT method was used to detect the proliferation inhibition of colorectal cancer cells with different concentrations of DCA.Western Blot method was used to detect the expression of HK-Ⅱ,PDH and Kv1.5 in colorectal cancer cells.Lactic acid kit was used to detect the production of lactic acid in colorectal cancer cells with different concentrations of DCA.ResultsDCA significantly inhibited the proliferation of colorectal cancer cells,and the survival rate of tumor cells in 10mmol/L group was only 20%.Western Blot showed that the expression of Caspase3 and Caspase9 in colorectal cancer cells was increased by DCA,which confirmed that DCA could induce the apoptosis of colorectal cancer cells.The expression of HK-Ⅱ was significantly reduced,and the amount of lactic acid production was reduced,and glycolysis was reduced.The amount was significantly higher than the control group the expression of Kv1.5 protein in DCA cells,because the voltage gated potassium channels increased significantly,the mitochondrial membrane hyperpolarization repolarization response significantly in colorectal cancer cells.ConclusionDCA can inhibit the proliferation of glucose in colorectal cancer cells by inhibiting glucose metabolism.
dichloroacetic acid;colorectal cancer;glucose metabolism;apoptosis
R735.3+4
A
2017-03-29)
吉林省科学技术厅计划处青年科研基金项目(20140520029JH)
*通讯作者
1007-4287(2017)10-1824-04
