一株植物内生细菌促进香菇木腐菌糖化秸秆的研究*
2017-11-01叶凯霞赵庆新康贻军王欢莉
叶凯霞,赵庆新,康贻军,沈 敏,王欢莉
(1.盐城师范学院江苏沿海生物工程研究所,江苏 盐城 224051;2.南京工业大学食品与轻工业学院,南京 211800)
一株植物内生细菌促进香菇木腐菌糖化秸秆的研究*
叶凯霞1,2,赵庆新1**,康贻军1,沈 敏1,王欢莉1
(1.盐城师范学院江苏沿海生物工程研究所,江苏 盐城 224051;2.南京工业大学食品与轻工业学院,南京 211800)
香菇类木腐菌利用水稻秸秆的基本过程,包括清除果胶与木质素屏障、释放纤维素和半纤维素、降解纤维素和半纤维素、利用单糖等,其中清除屏障释放纤维素和半纤维素、降解纤维素和半纤维素为糖化过程。在香樟内生菌Bacillus spp WP7和香菇(Lentinus edodes)菌株SH2184共转化水稻秸秆体系中,在香菇菌的定植期,菌丝生长速度是对照组的279%;共转化体系的发酵物总还原糖释放量比对照组提高了185.0%,葡萄糖释放量比对照组提高了262.5%,非葡萄糖释放量比对照组提高了139.0%;共转化体系的发酵物中果胶酶活性是对照组的127.3%,纤维素酶活与对照组接近;木聚糖酶活是对照组的75%。根据结果分析,植物内生菌释放的果胶酶可能是共转化秸秆体系中葡萄糖和其它单糖释放量提高的原因之一,从而进一步促进香菇菌菌丝定植期的生长速度;另外,该植物内生菌本身可能产生抑制木糖酶活性的物质或抑制木糖酶表达的信号物质。
植物内生细菌;促进;香菇木腐菌;糖化秸秆
农作物秸秆的利用是实现农业循环发展的重要环节,秸秆转化的方向有多糖类食品物品、能源(生物乙醇、甲醇、甲烷)、饲料、肥料、食 (药)用真菌菌体等多个方向,上述各方向转化遇到的共性问题是如何有效去除秸秆屏障,秸秆屏障(straw barrier)是指秸秆细胞壁中包裹在纤维素和半纤维素网络表面和沉积在网孔中的一些物质,在秸秆转化过程中,它们阻碍纤维素和半纤维素的释放与糖化[1-2]。
香菇等木腐菌糖化利用水稻秸秆纤维素与半纤维素的基本过程,与其它方向的秸秆纤维素与半纤维素利用过程类似,主要包括清除屏障释放纤维素和半纤维素、纤维素和半纤维素糖化、单糖的利用等三阶段,其中清除屏障释放纤维素和半纤维素是其第一步,也是限速步骤[3-5]。秸秆利用过程中,清除秸秆屏障的主要方法有物理法、化学法和生物法,物理法能源消耗大,化学法带来环境次生污染,微生物法具有低能耗和低污染的优势[1-3]。目前,用来去除秸秆屏障的微生物主要有白腐菌和肠道菌等,白腐菌主要用在秸秆能源领域[6],肠道菌主要用在食用菌与药用菌秸秆转化领域[7]。在腐生真菌降解利用秸秆领域,破除秸秆屏障的机制研究主要涉及腐生真菌本体的基因与酶研究[8-10]和肠道菌破除屏障的基因与酶研究[4,7],而且重点聚焦木质素及其降解酶类。现有研究报道表明,使用肠道菌破除降解秸秆屏障的方法,对蘑菇等草腐菌具有较好的协同效果,但对于香菇的协同效果较差[8,11]。其主要原因,一方面可能是源自木腐菌和草腐菌的基因与蛋白酶的差异,因为香菇属于木腐菌,与草腐菌相比,在基因组方面存在显著的差异,导致香菇类木腐菌对主要农作物秸秆(水稻秸秆、小麦秸秆和玉米秸秆等禾本科秸秆)降解能力差,不能破除一些特殊的屏障物质;另一方面,可能是由于肠道菌菌群的基因组成与表达特性,不能与香菇属木腐菌的基因与酶蛋白之间形成互补。
本课题初步研究了1种植物内生细菌促进香菇菌糖化水稻秸秆的机理,报道如下。
1 材料与方法
1.1 菌株
本研究所用菌株为香樟内生菌Bacillus spp WP7(简称WP7),由盐城师范学院江苏沿海生物工程研究所分离保存;所用香菇菌株2184(SH2184)由连云港石湖食用菌有限公司提供。
1.2 主要试剂与材料
木聚糖酶与果胶酸降解酶的底物木聚糖与果胶来自SIGMA公司;酵母提取物与胰蛋白胨来自OXOID公司;葡萄糖测定试剂盒来自苏州科铭生物技术有限公司;木屑、麸皮、水稻秸秆由连云港石湖食用菌有限公司提供。秸秆用前预处理,将秸秆剪成1 cm~2 cm小段,用2%NaOH浸泡24 h,清水洗至中性,晾干。
1.3 培养基的配制
LB液体培养基配方(1 000 mL):NaCl 10 g、蛋白胨10 g、酵母提取物5 g[12]。
香菇一级种培养基(PDA)配方见参考文献 [13]。
香菇二级种与三级种培养基配方为:果树木屑39%、秸秆39%、麦麸20%、石膏1%、蔗糖1%,含水量为60%。秸秆使用前预处理,将秸秆剪成1 cm~2 cm小段,用2%NaOH浸泡24 h,清水洗至中性,晾干。在温度121℃,1.5大气压条件下,灭菌20 min。
香菇糖化秸秆培养基配方:秸秆78%、麦麸20%、石膏1%、蔗糖1%,含水量为60%。在121℃,1.5大气压条件下,灭菌20 min。
1.4 细菌菌种制备
提前1 d进行细菌的活化,使用LB液体培养基,37℃培养,200 r·min-1,培养10 h,第2天转接培养8 h,用无菌的生理盐水清洗后备用。
1.5 香菇菌种制备
香菇一级种制备:用PDA培养基进行香菇一级种的扩接和放大,静置,无光,温度25℃,培养8 d;香菇二级种制备:将香菇一级种接种到二级种培养基中,静置,无光,温度25℃,培养25 d;香菇三级种制备:将香菇二级种接种到三级种培养基中,静置,无光,温度25℃,培养25 d。
1.6 细菌与香菇联合转化秸秆
将用无菌生理盐水清洗后的细菌菌种和香菇三级种同时接种到香菇糖化秸秆培养基,静置,无光,温度25℃,培养6 d,测量菌丝生长速度、培养物中还原糖量和有关多糖酶的活性。
1.7 定植期生长速度测定
在细菌与香菇共转化秸秆的第6天,测量试验组(内生菌与香菇共转化水稻秸秆)和对照组(香菇菌SH2184独自转化水稻秸秆)转化瓶不同部位内菌丝的生长长度,计算平均长度和菌丝生长速度。
1.8 联合转化体系的糖样品和酶样品的制备
取10 mg培养物,加10 mL的10 mmol·L-1磷酸缓冲液(pH7.5) 重新悬浮,温度0条件下抽提2 h,14 000 r·min-1条件下离心10 min,收集上清,作为联合转化体系的糖样品和酶样品。
1.9 葡萄糖与还原糖检测
葡萄糖根据试剂盒说明书,还原糖检测体系为:上清0.5 mL,加入0.5 mL dinitrosalicylic acid(DNS)试剂[14],然后检测520 nm处的吸收值,再根据标准曲线回归方程,换算得到还原糖浓度。
1.10 酶活检测
纤维素酶酶活检测的反应体系为:反应液0.5 mL,内含 20 mmol·L-1磷酸缓冲液 (pH 7.5),0.1%纤维素钠和适量的酶,在40℃反应10 min。为了检测反应体系中产生的还原糖量,加0.5 mL的dinitrosalicylic acid(DNS) 试剂终止反应,然后检测520 nm处的吸收值,再根据标准曲线回归方程,换算得到还原糖浓度,计算裂解细胞上清的每毫升体积所含的总酶活,再计算相对于每毫升菌体培养液体积的总酶活。一个酶活单位定义为每分钟释放的还原糖等同1 mol葡萄糖(galacturonicacid)的酶量。
木聚糖酶活检测的反应体系为:反应液0.5 mL,内含20 mmol·L-1磷酸缓冲液(pH 7.5),0.1%木聚糖和适量的酶,在40℃反应10 min。为了检测反应体系中产生的还原糖的量,加0.5 mLDNS试剂终止反应,然后检测520 nm处的吸收值,再根据标准曲线回归方程,换算得到还原糖浓度,计算裂解细胞上清的每毫升体积所含的总酶活,再计算相对于每毫升菌体培养液体积的总酶活。一个酶活单位定义为每分钟释放的还原糖等同1 mol木糖的酶量。
果胶酸裂解酶活检测的反应体系为:0.5 mL反 应液,内含 20 mmol·L-1Tris-HCl(pH7.5)、1 mmol·L-1CaCl2、0.1%果胶酸和适量的酶,在40℃反应10 min。为了检测反应体系中产生的还原糖的量,加0.5 mLDNS试剂终止反应,然后检测520 nm处的吸收值,再根据标准曲线回归方程,换算得到还原糖浓度,计算裂解细胞上清的每毫升体积所含的总酶活,再计算相对于每毫升菌体培养液体积的总酶活。一个酶活单位定义为每分钟释放的还原糖等同1 mol半乳糖醛酸的酶量[12]。
2 结果与分析
2.1 共转化秸秆体系中香菇菌丝定植期的生长速度
香菇菌丝生长速度见表1。定植期为6 d,测量6 d内菌丝生长的长度,计算6 d菌丝的生长速度。以香菇独自转化秸秆为对照(作为100%)。
在植物内生菌WP7和香菇SH2184共转化水稻秸秆体系中,在香菇的定植期,菌丝生长速度是2.21 mm·d-1,是对照组的279%,接近300%。
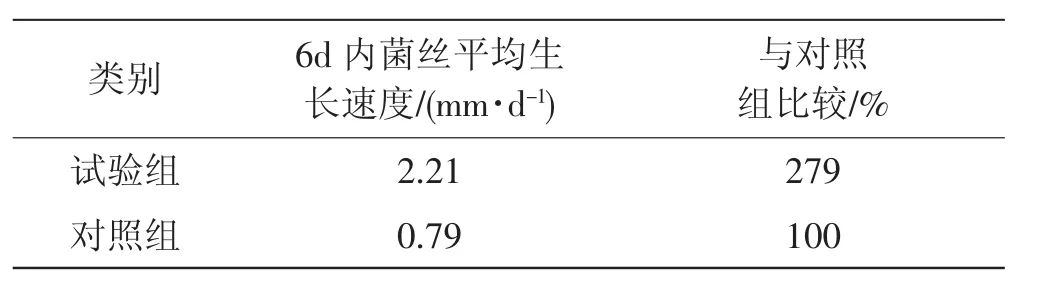
表1 香菇菌丝生长速度Tab.1 Growth rate of Lentinus edodes mycelium
2.2 共转化秸秆体系中还原糖的释放
在植物内生菌WP7和香菇SH2184共转化水稻秸秆体系中,对菌丝生长区的培养物中糖释放进行检测见图1。
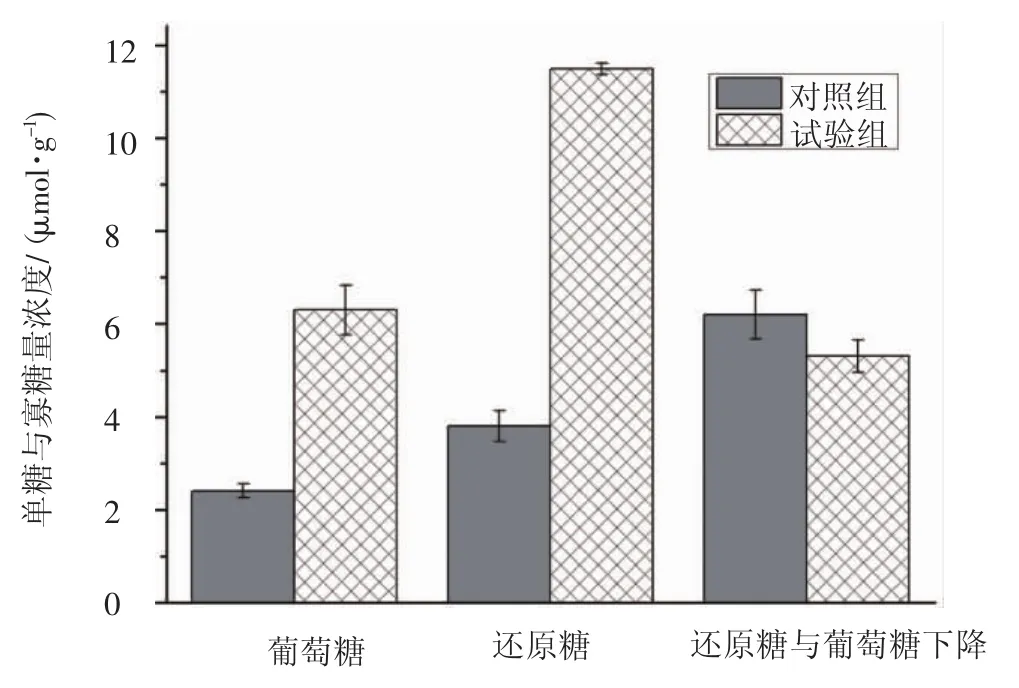
图1 植物内生菌(WP7) 与香菇(SH2184) 共转化水稻秸秆的发酵物中糖化效果Fig.1 Saccharification effect on the system of plant endophytic bacteria(WP7)and Lentinus edodes(SH2184)degrading and transforming rice straw
共转化体系的发酵物中总还原糖释放量为11.5 mol·g-1,其中葡萄糖释放量为 6.3 mol·g-1,非葡萄糖释放量为5.3 mol·g-1(图1)。共转化体系的发酵物总还原糖释放量比对照组提高了185.0%,葡萄糖释放量比对照组提高了262.5%,非葡萄糖释放量比对照组提高了139.0%。
2.3 共转化秸秆体系中几类多糖降解酶活性
植物内生菌(WP7) 与香菇(SH2184) 共转化水稻秸秆的发酵物中,果胶酶、纤维素酶与木聚糖活性见图2。
在植物内生菌WP7和香菇SH2184共转化水稻秸秆体系中,对菌丝生长区培养物中几种多糖降解酶的活性检测表明,共转化体系发酵物中纤维素酶活为430 U·g-1,与对照组接近;木聚糖酶活为210 U·g-1,是对照组的75%,降低了25%;果胶酶活性是对照组的127.3%,增加了27.3%。
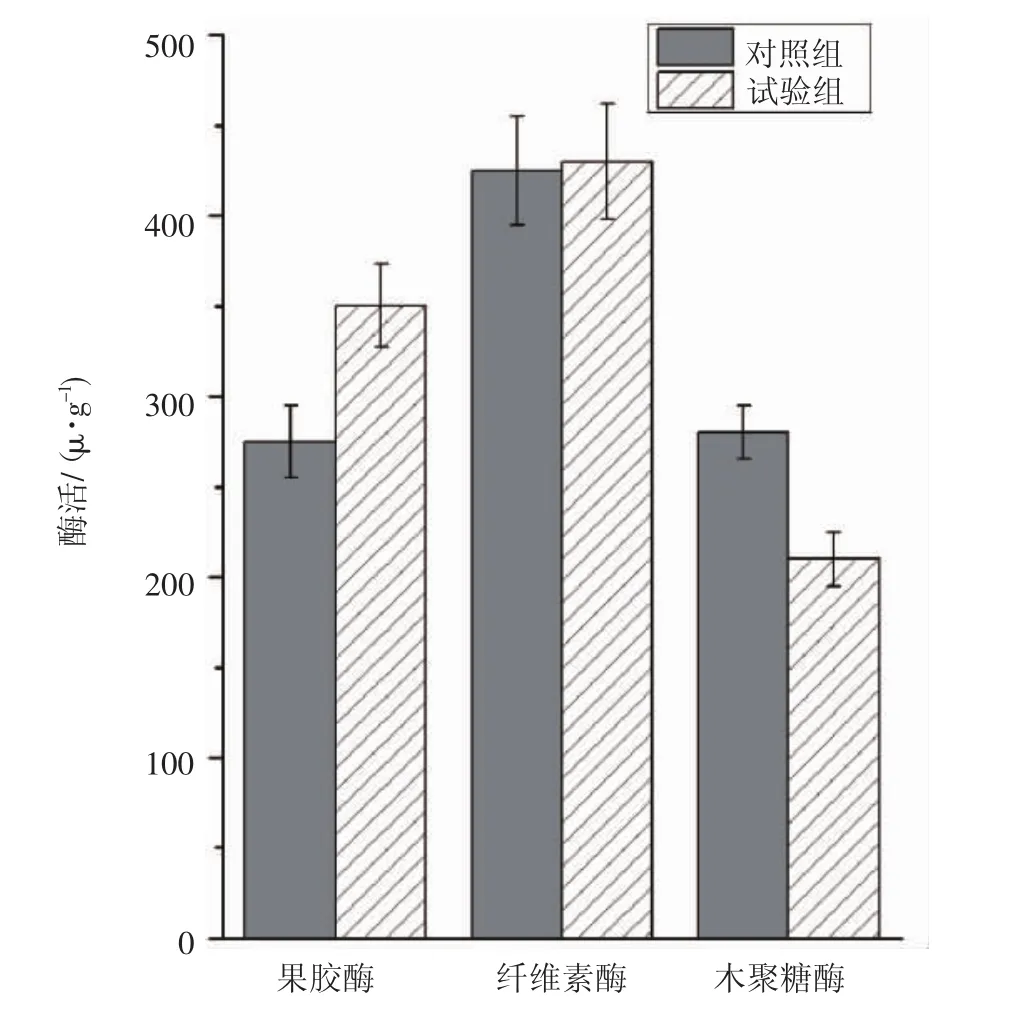
图2 植物内生菌(WP7) 与香菇(SH2184) 共转化水稻秸秆发酵物中果胶酶、纤维素酶与木聚糖活性Fig.2 Enzyme activity of pectinase,cellulase and xylanase from the system of plant endophytic bacteria(WP7)and Lentinus edodes(SH2184)degrading and transforming rice straw
2.4 WP7细菌天然状态下产几类多糖降解酶的效果
正常培养条件下,植物内生菌WP7在LB培养基中果胶酶、纤维素酶与木聚糖酶活性见图3。
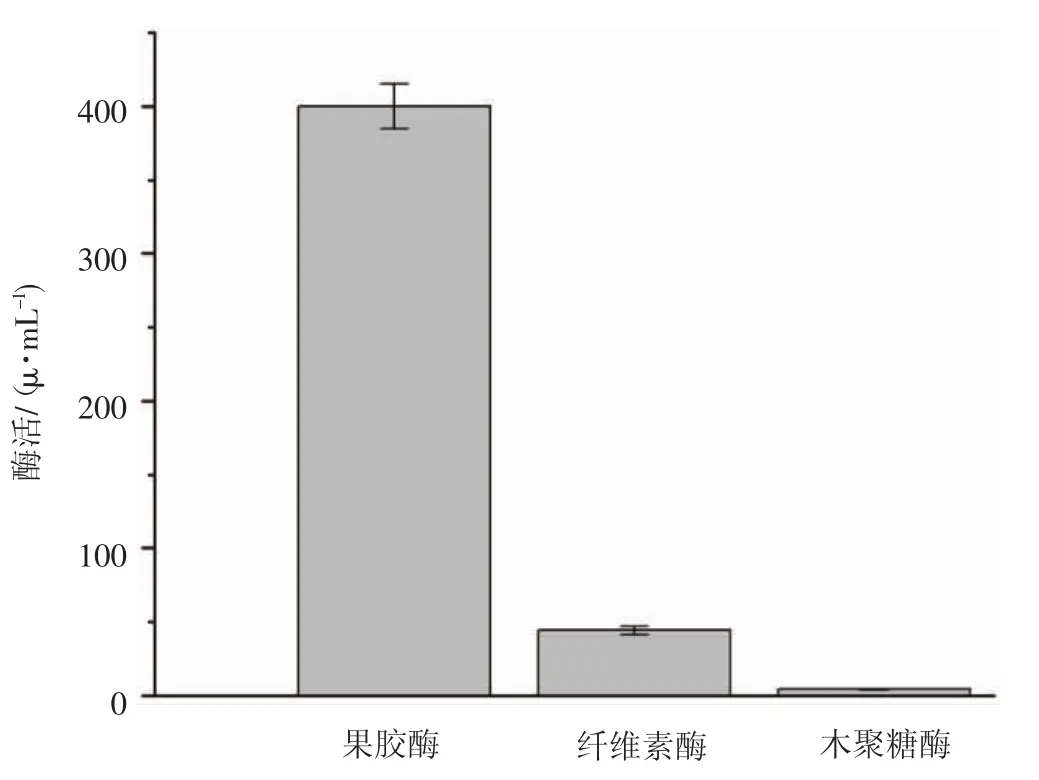
图3 植物内生菌WP7在LB培养基中果胶酶、纤维素酶与木聚糖酶活性Fig.3 Enzyme activity of pectinase,cellulase and xylanase from the culture of WP7 in LB medium
从图3可以看出,果胶酶活性达到400 U·mL-1,纤维素酶活仅仅为44 U·mL-1,而且未检测到木聚糖酶活。
3 讨论
3.1 共转化秸秆体系中葡萄糖释放量提高可能是香菇菌菌丝定植期生长速度增加的原因之一
香菇菌菌丝的定植期生长速度易受到培养基质中容易吸收的成分,特别是葡萄糖和木糖等单糖的影响。共转化体系的发酵物中总还原糖释放量检测表明,共转化体系的发酵物总还原糖释放量比对照组提高了185.0%,进一步检测显示葡萄糖的提高量高于木聚糖等非葡萄糖的提高量(葡萄糖释放量和非葡萄糖释放量分别比对照组提高262.5%和139.0%)。
3.2 植物内生菌释放的果胶酶可能是共转化秸秆体系中葡萄糖释放量提高的原因之一
对在植物内生菌WP7和香菇SH2184共转化水稻秸秆培养物中几种多糖降解酶的活性检测表明,植物内生菌WP7使用仅增加了共转化体系的果胶酶活性,与对照组相比增加了27.3%,结果提示,果胶酶可能是引起共转化秸秆体系中葡萄糖释放量提高的重要原因;进一步对植物内生菌WP7的天然产酶特性进行研究表明,正常培养条件下在LB培养基中,果胶酶活性达到为400 U·mL-1,纤维素酶活仅为44 U·mL-1,未检测到木聚糖酶活,进一步验证果胶酶可能是引起共转化秸秆体系中葡萄糖释放量提高的重要原因。前人研究显示,果胶是植物细胞壁材料中的重要成分[14-15],本文通信作者前期研究成果显示,果胶对细胞壁的硬化具有重要的作用[16],在秸秆降解中会影响纤维素酶和半纤维素酶的作用。关于消除秸秆降解细菌的果胶酶的研究显示,消除秸秆降解细菌的果胶酶基因会显著降低细菌对秸秆的利用效果[17],另外关于香菇等木腐菌果胶酶的研究显示,香菇木腐菌产果胶酶的效率很低,在10 U·mL-1左右[18]。所以,本研究使用细菌果胶酶在该细菌和香菇共转化秸秆系统中,对香菇菌转化秸秆可能是一种重要的协同因子。
3.3 共转化体系木聚糖酶活性下降和非葡萄糖还原糖增加的原因
在植物内生菌WP7和香菇SH2184共转化水稻秸秆培养物中几种多糖降解酶的活性检测中,发现植物内生菌WP7使用还降低了共转化体系中木聚糖酶活性,而且植物内生菌本身的木糖酶的活性也未检测到,说明植物内生菌本身可能产生抑制木糖酶活性的物质或抑制木糖酶表达的信号物质。导致共转化体系中非葡萄糖还原糖增加的原因,可能是果胶酶等因素增加了培养物中已有木聚糖酶等半纤维素酶与底物的接触机会。
[1]Yunqin Lina,b,Xumeng Gea,Zhe Liua,Yebo Lia.Integration of Shiitake cultivation and solid-state anaerobic digestion for utilization of woody biomass[J].Bioresource Technol,2015,182(4):128-135.
[2]Vetchinkina EP,Gorshkov VI,Ageeva MV,et al.Activity and expression of laccase,tyrosinase,glucanase,and chitinase genes during morphogenesis of Lentinus edodes[J].Mikrobiologiia,2015,84(1):78-89.
[3]Daehwan C,Minseok C,Adam MG,et al.Direct conversion of plant biomass to ethanol by engineered Caldicellulosiruptor bescii[J].Proc Natl Acad Sci USA,111(24):8931-8936.
[4]López-Abelairas M,álvarez Pallín M,Salvachúa D,et al.Optimisation of the biological pretreatment of wheat straw with white-rot fungi ethanol production[J].Bioprocess Biosyst Eng,2013,36(9):1251-1260.
[5]Toquero C,Bolado S.Effect of four pretreatments on enzymatic hydrolysis and ethanol fermentation of wheat straw.Influence of inhibitors and washing[J].Bioresource Technol,2014,157(4):68-76.
[6]Cianchetta S1,Di Maggio B,Burzi PL,et al.Evaluation of selected white-rot fungal isolates for improving the sugar yield from wheat straw [J].Appl Biochem Biotechnol,2014,173(2):609-623.
[7]Isikhuemhen OS,Mikiashvilli NA.Lignocellulolytic enzyme activity,substrate utilization,and mushroom yield by Pleurotus ostreatus cultivated on substrate containing anaerobic digester solids[J].J Ind Microbiol Biotechnol.2009,36(11):1353-1362.
[8]Elisashvili V,Kachlishvili E,Asatiani MD.Shiitake medicinal mushroom,Lentinus edodes(Higher Basidiomycetes)productivity and lignocellulolytic enzyme profiles during wheat straw and tree leaf bioconversion[J].Int J Med Mushrooms,2015,17(1):77-86.
[9]Kim KH,Ka KH,Kang JH,et al.Identification of single nucleotide polymorphism markers in the laccase gene of shiitake mushrooms(Lentinula edodes)mycobiology[J].Mycobiology,2015,43(1):75-80.
[10]Whiteford JR,Thurston CF.The molecular genetics of cultivated mushrooms[J].Adv Microb Physiol,2000,42(1):1-23.
[11]Rigoberto GH,Norberto C,Gerardo M.Improvement of yield of the edible and medicinal mushroom Lentinula edodes on wheat straw by use of supplemented spawn[J].Braz J Microbiol,2014,45(2):467-474.
[12]Zhao QX,Yuan S,Zhang YL,et al.Expression,purification and characterization of pectate lyase A from Aspergillus nidulans in Escherichia coli[J].World J Microbiol Biotechnol,2007,23(8):1057-1064.
[13]胡化广,赵庆新.食用菌栽培 [M].南京:南京大学出版社,2013:30-31.
[14]Xiao C1,Anderson CT.Roles of pectin in biomass yield and processing for biofuels[J].Front Plant Sci,2013,4(67):1-7.
[15]Caffall KH,Mohnen D.The structure,function,and biosynthesis of plant cell wall pectic polysaccharides[J].Carbohydr Res,2009,344(14):1879-1900.
[16]Zhao QX,Yuan S,Wang X,et al.Restoration of mature etiolated cucumber hypocotyl cell wall susceptibility to expansin by pretreatment with fungal pectinases and EGTA in vitro[J].Plant Physiol,2008,147(8):1874-1885.
[17]Chung D,Pattathil S,Biswal AK,et al.Deletion of a gene cluster encoding pectin degrading enzymes in Caldicellulosiruptor bescii reveals an important role for pectin in plant biomass recalcitrance[J].Biotechnol Biofuels,2014,7(1):147.
[18]Leatham GF.Extracellular enzymes produced by the cultivated mushroom Lentinus edodes during degradation of a lignocellulosic medium[J].Appl Environ Microl,1985,50(4):859-867.
《中国食用菌》声明
近期,有部分网站盗用《中国食用菌》期刊的名义,发布《中国食用菌》期刊论文,索要审稿费或者推荐作者改投他刊,《中国食用菌》特提醒广大作者和读者,目前《中国食用菌》网站正在建设中,投稿仍为邮箱投稿,投稿邮箱为zgsyj2005@163.com,编辑部电话为0871-65151099,以避免上当受骗。
本刊受理稿件时不收取审稿费,只有论文被录用后才收取版面费。
中国食用菌杂志编辑部
2017年9月10日
One Plant Endophytic Bacteria Promoting on Lentinus edodes Wood-rotting Fungi Saccharifying Rice Straw
YE Kai-xia1,2,ZHAO Qing-xin1,KANG Yi-jun1,SHEN Min1,WANG Huan-li1
(1.Bioengineering Institute of Jiangshu Costal,Yancheng Teachers University,Yancheng 224051,China;2.College of Food Science and Light Industry,Nanjing Tech University,Nanjing 211800,China)
The process of Lentinus edodes wood-rotting fungi degrading and transforming rice straw was composed of breaking the straw barrier(such as pectin and lignin)to release cellulose and hemicellulose,saccharifying cellulose and hemicellulose to monose and oligosaccharide,and transforming monose to other substances.In the system of plant endophytic bacteria and L.edodes transforming rice straw,the growth rate of L.edodes mycelium during 6 d colonization was 279%of the control system.Compared with the control group,the release amount of the total reduction sugar,glucose and non-glucose from the system of plant endophytic bacteria and L.edodes was increased by 185.0%,139.0%and 262.5%,respectively.The activity of pectinase and xylanase from the system of plant endophytic bacteria and L.edodes was 127.3%and 75%of that in the control group,and the cellulase activity was close to that of the control group.This results might implied that the pectin from the plant endophytic bacteria might be an important factor for promoting the release amount of glucose and other monosaccharide,which further promote the growth rate of L.edodes mycelium during the colonization period.Additionally,plant endophytic bacteria might produce one or more substance for inhibiting the activity of xylanase or for depressing the expression of xylanase genes.
plant endophytic bacteria;promote;Lentinus edodes wood-rotting fungi;saccharifying rice straw
S646.1
A
1003-8310(2017)05-0067-05
10.13629/j.cnki.53-1054.2017.05.016
国家自然科学基金项目(41501256);江苏省盐土生物资源重点实验室(JKLBS2012023)。
叶凯霞(1993-),女,在读硕士研究生,主要研究方向为木质纤维素糖化。E-mail:
**通信作者:赵庆新(1966-),博士,教授,主要从事微生物工程与蛋白工程研究。E-mail:zhaoqingxinjs@aliyun.com
2017-07-10
