光照胁迫下广叶绣球菌菌丝基因差异表达的初步分析*
2017-11-01肖冬来王宏雨林衍铨
肖冬来,张 迪,马 璐,王宏雨,林衍铨
(福建省农业科学院食用菌研究所,福建 福州 350014)
光照胁迫下广叶绣球菌菌丝基因差异表达的初步分析*
肖冬来,张 迪,马 璐,王宏雨,林衍铨**
(福建省农业科学院食用菌研究所,福建 福州 350014)
利用高通量测序技术对黑暗和光照下广叶绣球菌(Sparassis latifolia)菌丝进行RNA-Seq分析,比较光照胁迫下的差异表达基因,并对差异基因进行GO功能分析和KEGG pathway分析。结果表明,光照胁迫下显著性差异表达的基因328个,其中,上调、下调表达的基因数分别为157个和171个。差异表达基因的GO注释表明,生物学过程主要为细胞过程、代谢过程、单一生物过程,而分子功能主要为催化、结合和转运子活性。KEGG pathway功能分析结果表明,差异基因主要集中在次级代谢产物合成、淀粉和蔗糖代谢和谷胱甘肽代谢通路中。
广叶绣球菌;转录组;GO功能分析;差异表达基因
广叶绣球菌(Sparassis latifolia Y.C.Dai&Zheng Wang)[1],隶属于多孔菌目(Polyporales) 绣球菌科(Sparassidacea) 绣球菌属(Sparassis),是1种珍稀食(药)用真菌,广叶绣球菌中的β-葡聚糖能提高人体免疫力,具有抗癌、防癌特殊功效[2]。光照在食用菌菌丝生长、原基形成和产量、子实体形态等[3-4]过程都发挥着重要的调控作用。
广叶绣球菌对光照的需求要高于其它的食用菌,适宜的光照是原基分化与子实体生长发育的必要条件,不同的光质和光量影响广叶绣球菌菌丝生长速度和原基形成率[5]。Yang等[6]克隆了1个广叶绣球菌蓝光受体基因,光照可诱导该基因的表达,为光照诱导子实体发育的研究提供参考。本研究利用转录组测序技术分析了光照条件下广叶绣球菌基因差异表达,以期进一步为广叶绣球菌的光响应机制研究提供科学参考。
1 材料和方法
1.1 供试菌株和参考基因组
供试广叶绣球菌菌株“闽绣1号”为福建省农业科学院食用菌研究所保藏。参考基因组为本单位测序完成的广叶绣球菌菌株“闽绣1号”基因组,该数据尚未公开。
1.2 样品制备
利用打孔器在活化的绣球菌PDA培养皿上,呈圆周形选取菌龄一致,直径约7 mm的菌块接种至表面铺有玻璃纸的9 cm PDA培养皿。25℃黑暗培养20 d后,将培养皿置于装有LED白色光源的培养箱中25℃培养48 h(调整透过培养皿盖的光强度为300 lx),黑暗培养的菌丝为对照组。无菌玻璃棒刮取菌丝后液氮急冻保存备用。
1.3 差异表达基因分析
光照组和黑暗处理组样品送至北京安诺优达基因科技有限公司提取总RNA、构建文库,利用Illumina HiSeq平台测序。基因表达量利用FPKM(fragments per kilobase per millon mapped fragments)值进行评估。采用DEGSeq v1.18.0[7]进行基因差异表达分析,比较光照组与黑暗组,并选取|log2Ratio|≥1和q<0.05的基因作为差异表达基因,得到上调、下调基因个数。根据差异表达基因在每个样品里的表达量,取以2为底的对数后,利用R软件(v3.1.1)对差异表达基因进行分层聚类分析。
1.4 GO功能分类注释与显著性富集分析
根据GO数据库(Gene Ontology,http://www.geneontology.org/),利用软件Blast2GO得到差异表达基因对应的GO条目。针对GO数据库中第2层的条目,统计差异表达基因在该条目里的个数,并计算百分比。根据计算每个条目的基因数目,然后应用超几何检验,找出与整个基因组背景相比,差异表达基因显著富集的GO条目。计算得到的p-value通过校正之后,以q<0.05为阈值,满足此条件的GO条目定义为在差异表达基因中显著富集的GO条目。
1.5 代谢通路分析与显著性富集分析
利用 KEGG(Kyoto Encyclopedia of Genes and Genomes)数据库(http://www.kegg.jp/)分析差异基因参与的pathway,对KEGG中每个Pathway应用超几何检验进行富集分析,找出差异表达基因显著性富集的Pathway,计算得到的p-value通过校正之后,以q<0.05为阈值,满足此条件的pathway定义为在差异表达基因中显著富集的pathway。
2 结果与分析
2.1 差异基因的筛选
光照组和黑暗组共有11 029个转录本可定位到参考基因组(广叶绣球菌基因组测序结果预测为12 471个基因,数据尚未公开)。以黑暗组为对照,共筛选出差异表达基因328个,其中,上调、下调表达的基因数分别为157个和171个,差异表达显著的部分基因见表1。
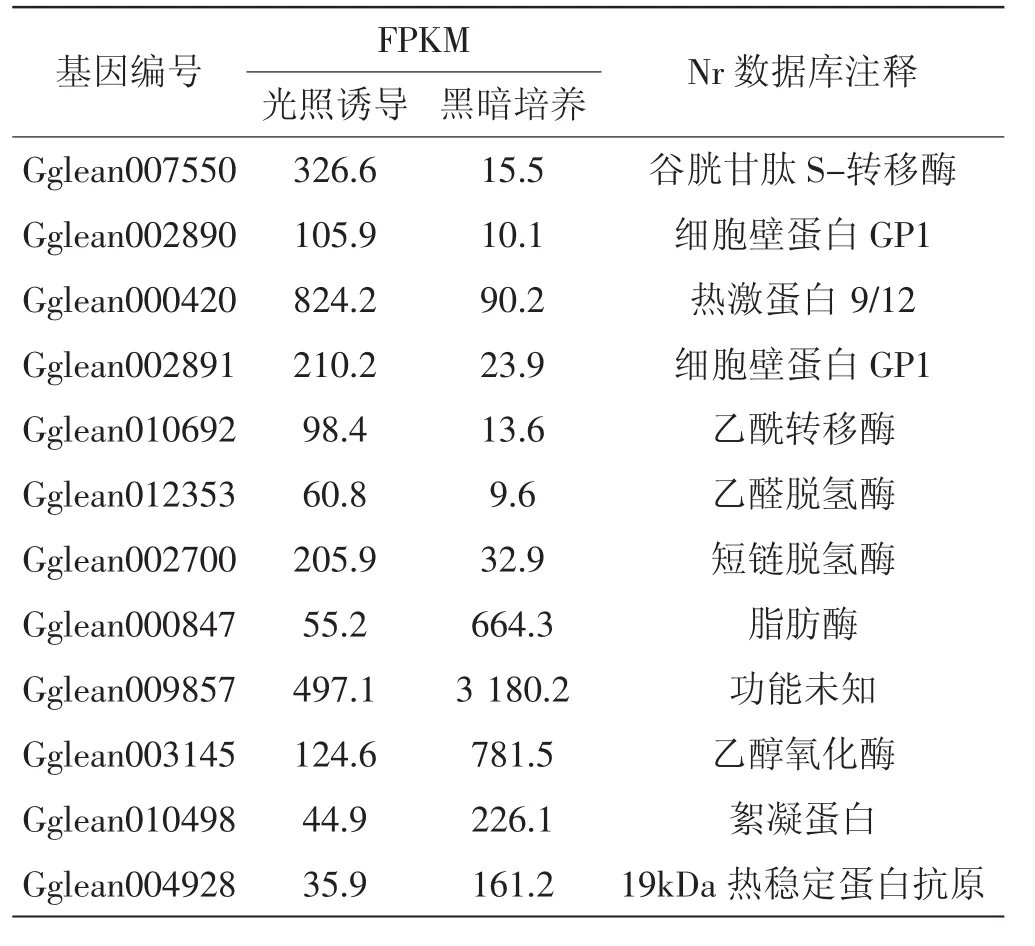
表1 部分显著差异表达的基因Tab.1 Some significantly differentially expressed genes
2.2 差异基因的GO功能分析
差异表达基因的GO功能分析和GO注释富集分析见图1、表2。
差异表达基因的GO功能分析显示,在生物学过程 (biological process) 分类中,细胞过程(cellular process)、代谢过程 (metabolic process) 和单一生物过程(single-organism process)所占比例较高,分别占总差异蛋白的19.8%、21.6%和16.5%。在细胞组分分类中差异表达基因在细胞组分(cell part)、细胞器(organelle)和膜组分(membrane part)类型所占比例较高,分别占总差异蛋白的16.5%、7.3%和5.5%。在分子功能组分中,催化(catalytic)、结合(binding)和转运子(transporter)活性类型所占比例较高,分别占总差异蛋白的28.7%、16.2%和3.0%。
GO功能显著性富集分析表明,显著富集的功能有:生物学过程下的多糖分解过程(polysaccharide catabolic process)、碳水化合物代谢过程(carbohy-drate metabolic process) 和多糖代谢过程(polysaccharide metabolic process);分子功能下的水解酶活性(hydrolase activity)、氧化还原酶活性(oxidoreductase activity)、催化活性 (catalytic activity)、β-甘露糖苷酶活性(beta-mannosidase activity)、单加氧酶活性(monooxygenase activity) 和半乳糖苷酶的活性(galactosidase activity);细胞组分下的胞外区域 (extracellular region)。

图1 差异表达基因的GO功能分析Fig.1 Functional annotation of differentially expressed genes according to GO analysis
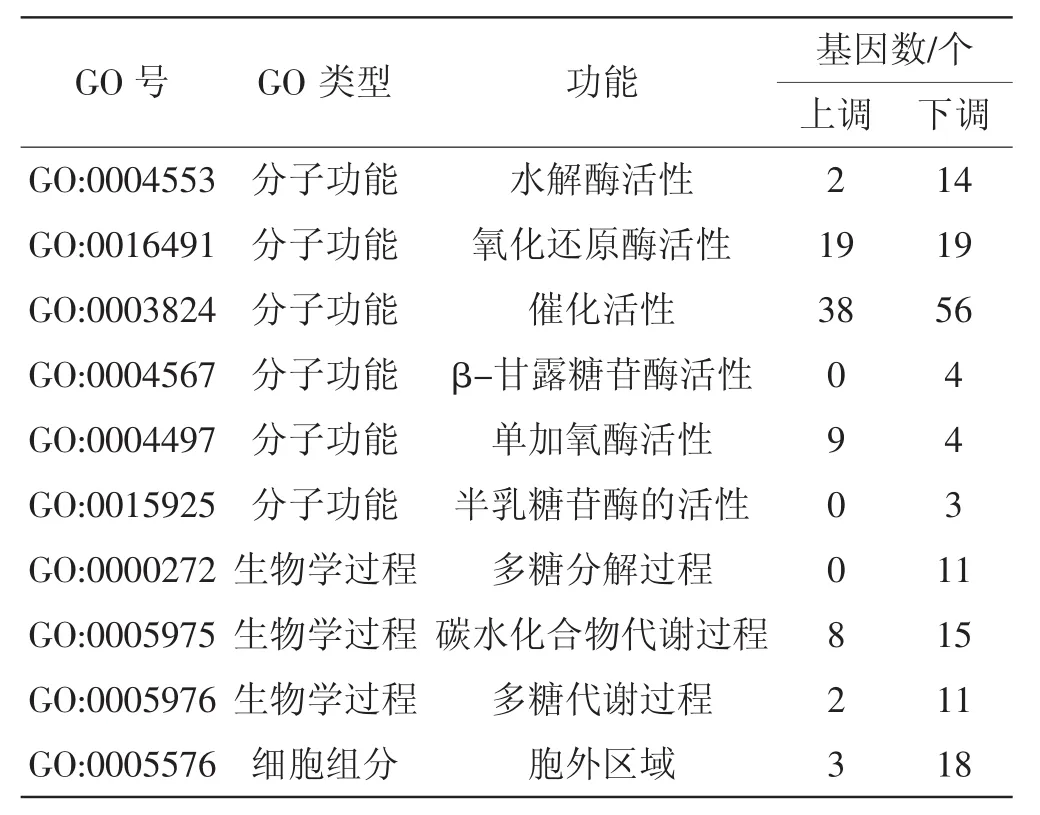
表2 GO注释富集分析Tab.2 GO enrichment analysis
2.3 差异基因的KEGG pathway分析
对差异基因进行pathway分析发现,差异基因可注释到30条pathway上,差异基因数目较多的pathway分别为次级代谢产物合成(biosynthesis of secondary metabolite,涉及10个差异基因)、淀粉和蔗糖代谢(starch and sucrose metabolism,涉及4个差异基因)、谷胱甘肽代谢(glutathione metabolism,涉及3个差异基因)、半胱氨酸和蛋氨酸代谢(cysteine and methionine metabolism,涉及3个差异基因)。经KEGG pathway富集分析显示,未检测到显著富集的pathway。
3 结论与讨论
本研究通过转录组测序分析,得到广叶绣球菌在光照和黑暗培养下差异基因328个,这些基因可能参与了广叶绣球菌对光照的响应调控。广叶绣球菌的发育过程是一个多因素调控的生命过程,除了自身的遗传特性作为其调控发育的基础外,外界栽培条件如栽培基质、温度、光照等均可影响其生长发育。目前,关于光照调控广叶绣球菌发育的分子机制研究还很少[6],本研究将所有差异表达基因进行GO注释和功能聚类分析,在显著富集的生物学功能分类中,多糖分解、碳水化合物代谢和多糖代谢涉及的基因下调数量大于上调数量,推测光照可能影响了绣球菌菌丝碳水化合物降解能力。胞外酶活性在一定程度上可反映菌株生长的快慢和对基质的利用率[8]。应正河等[5]的研究表明绣球菌菌丝在黑暗条件下生长速度最快,显著高于不同光质下菌丝的生长速度。
谷胱甘肽、蛋氨酸和甲硫氨酸参与了多种环境胁迫的响应,同时蛋氨酸和甲硫氨酸对细胞的分化和功能的产生有着重要的影响[9-11]。KEGG代谢通路分析结果显示谷胱甘肽代谢、半胱氨酸和蛋氨酸代谢通路中均含有3个关键差异基因。其中2个谷胱甘肽S-转移酶在光照诱导下表现上调,而半胱氨酸和蛋氨酸代谢通路中编码3个关键基因腺苷高半胱氨酸酶(adenosylhomocysteinase)、s-腺苷甲硫氨酸合成酶(s-adenosylmethionine synthetase)、氨基环丙基甲酸甲酯氧化酶(aminocyclopropanecarboxylate oxidase) 均表现下调,相关差异基因在光响应中的分子机制还需进一步研究。
综上所述,本研究应用转录组测序技术,初步分析了光照诱导下广叶绣球菌菌丝基因表达变化情况、差异表达基因的GO分类和代谢过程,研究结果为进一步分析广叶绣球菌光响应的分子机制,探讨差异基因与菌丝发育的调控关系提供科学数据。
[1]Dai YC,Wang Z,Binder M,et al.Phylogeny and a new species of Sparassis(Polyporales,Basidiomycota):evidence from mitochondrial atp6,nuclear rDNA and rpb2 genes[J].Mycologia,2006,98(4):584-92.
[2]Kimura T.Natural products and biological activity of the pharmacologically active cauliflower mushroom Sparassis crispa[J].Bio Med Research International,2013,2013 (11):167-169.
[3]黄兵.不同光质LED对白灵菇商品性状及产量的影响[D].长春:吉林农业大学,2015.
[4]白雪萍,赵丽,周军,等.杏鲍菇子实体发育形态的光调控机制研究[J].湖北农业科学,2016(9):2275-2278.
[5]应正河,林衍铨,马璐,等.不同光质光量对绣球菌菌丝生长及原基形成的影响[J].福建农业学报,2013,28(6):538-540.
[6]Yang C,Ma L,Ying ZH,et al.Sequence analysis and expression of a blue-light photoreceptor gene,slwc-1 from the cauliflower mushroom Sparassis latifolia[J].Current Microbiology,2017,74(4):469-475.
[7]Wang L,Feng Z,Wang X,et al.DEGseq:an r package for identifying differentially expressed genes from RNA-seq data[J].Bioinformatics,2010,26(1):136-138.
[8]安琪,吴雪君,吴冰,等.不同碳源和氮源对金针菇降解木质纤维素酶活性的影响[J].菌物学报,2015,34(4):761-771.
[9]肖清铁,王经源,郑新宇,等.水稻根系响应镉胁迫的蛋白质差异表达[J].生态学报,2015,35(24):8276-8283.
[10]吕焕青,王志敏,汤青林,等.多胺生物合成途径中两个关键酶基因研究进展[J].生物技术通报,2015,31(2):61-64.
[11]Jiang HW,Liu M,Chen IC,et al.A glutathione S-transferase regulated by light and hormones participates in the modulation of Arabidopsis seedling development[J].Plant P-hysiology,2010,154(4):1646-1658.
英国:橡树下发现“黑色钻石”之称的珍稀黑松露
前不久,英国德文郡史蒂夫先生无意在一棵橡树下挖到了10多颗有“厨师的黄金”之称的珍稀黑松露。据了解,黑松露是1种生长于地下的野生食用真菌,含有丰富的蛋白质、维生素、18种氨基酸以及人体必需微量元素,具有极高的营养保健价值。黑松露每年在全世界产量非常稀少,因此价格相当昂贵,堪比黄金。在中国西南藏族、彝族等少数民族地区,黑松露也被当地人作为增强体力、治疗疾病的“黑色钻石”。
在国外,黑松露常见于在法国、意大利和西班牙的森林中,每千克价格高达2 000英镑,除此品种之外,原产于于意大利的白松露也尤为珍稀,2007年一场拍卖会上,一块重达3.3磅(约1.5 kg)的白松露以16.5万英镑价格成交。
中国食用菌商务网
2017.09.04
Preliminary Study on Differentially Expressed Genes of Sparassis latifolia under Light Inducing
XIAO Dong-lai,ZHANG Di,MA Lu,WANG Hong-yu,LIN Yan-quan
(Institute of Edible&Medicinal Fungi,Fujian Academy of Agricultural Sciences,Fuzhou 350014,China)
The transcriptomes of Sparassis latifolia mycelium under light or dark inducing were compared using the whole genome sequence of Sparassis latifolia as a reference.Both light and dark inducing mycelium were subjected to RNA sequencing and exposed to GO function and KEGG pathway analysis.The results showed that a total of 328 genes were identified as believable.Among them,157 genes were up-regulated and 171 genes were down-regulated.The GO classification showed that,the differentially expressed genes were mostly enriched in cellular process,metabolic process,single-organism process biological pathway and catalytic,binding,transporter molecular functions.KEGG pathway analysis showed that the differentially expressed genes were involved in biosynthesis of secondary metabolites,starch and sucrose metabolism,glutathione metabolism.
Sparassis latifolia;transcriptome;GO function analysis;differentially expressed gene
S646.9
A
1003-8310(2017)05-0060-04
10.13629/j.cnki.53-1054.2017.05.014
福建省属公益类科研院所基本科研专项(2015R1020-5);福建省自然科学基金(2016J01133)。
肖冬来(1981-),男,博士,助理研究员,主要从事食用菌栽培生理研究。E-mail:xdljiangsu@163.com
**通信作者:林衍铨(1963-),男,大专,研究员,主要从事食用菌栽培研究。E-mail:lyq-406@163.com
2017-07-13
