1例结核性脑膜炎患者的药学监护
2017-10-25徐瑜萍朱剑萍
徐瑜萍 朱剑萍

[摘要] 探讨1例结核性脑膜炎患者抗结核治疗过程中出现药物性肝损伤和过敏反应的病例,分析抗结核药物的选择及应用。临床药师参与该患者的诊治过程,协助临床医生共同制定抗结核治疗方案,并从不良反应、疗效评估、用药教育等方面作为切入点为患者实施全程化药学监护。临床药师通过参与临床实践,利用自身专业优势为患者提供个体化的药学监护,提高了患者治疗过程的安全性和有效性。
[关键词] 结核性脑膜炎;不良反应;药学监护;临床药师
[中图分类号] R529.3 [文献标识码] B [文章编号] 1673-9701(2017)23-0088-04
[Abstract] The article discussed a case of tuberculous meningitis patient appeared drug-induced liver injury and allergic reaction in the process of anti-tuberculozed treatment, analyzed the selection and application of anti-TB drugs. Clinical pharmacists join in the diagnosis and treatment, assist doctors to formulate a anti-TB treatment scheme, and carry out pharmaceutical care from the adverse reactions, efficacy evaluation, medication education and other aspects as a starting point. Clinical pharmacists participate in the clinical practice, use their professional advantage to provide individualized pharmaceutical care for patient, can improve the effectiveness and safety of treatment process.
[Key words] Tuberculous meningitis; Adverse reactions; Pharmaceutical care; Clinical pharmacist
结核性脑膜炎是结核分枝杆菌引起的以脑膜受累为主的特异性炎症,其致死率、致残率高,是严重的肺外结核病。结核性脑膜炎病情凶险,联合用药多、治疗疗程长、易复发或耐药。抗结核治疗过程中可能会出现各种不同程度的药物不良反应,如药物性肝损伤、过敏反应等[1-3]。本文临床药师参与1例结核性脑膜炎患者的诊治过程,对该患者实施全程个体化药学监护,现将临床实践总结报道如下。
1 临床资料
患者,女,48岁,因“头痛7 d,发热伴呕吐5 d”入院。患者7 d前无明显诱因下出现头部顶枕颞部持续性胀痛,无发热畏寒,无意识障碍,无恶心呕吐,无肢体活动不利。5 d前自觉发热,且出现呕吐,呕吐物为胃内容物,非喷射性。2 d前至当地医院就诊,查体温最高为38.5℃,血常规提示CBC 5.03×109/L,CRP 4.57 mg/L,PCT 0.033 ng/mL。行腰穿检查,提示脑脊液压力340 cmH2O,脑脊液生化:葡萄糖1.53 mmol/L,微量蛋白321 mg/dL,氯化物121.6 mmol/L,脑脊液常规:白细胞计数220/μL,中性82%,颅脑CT未见明显异常。当地予头孢曲松针2 g q12h抗感染,甘露醇针降颅压等治疗,现为求进一步诊治来院就诊,急诊拟“颅内感染”收住入院。
2 结果
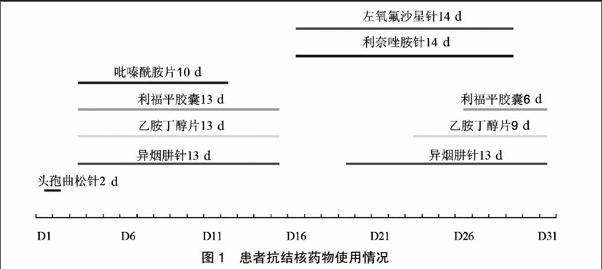
D3:查体:颈抵抗阳性。T-sport强阳性,我院脑脊液检查倾向结脑,首先考虑结核性脑膜炎,予异烟肼针+利福平胶囊+吡嗪酰胺片+乙胺丁醇片四联诊断性抗结核治疗,同时予地塞米松针静注防止脑膜粘连。
D9:查体:颈抵抗较前变弱。查肝功能:肝酶轻度升高,予加用复方甘草酸苷针护肝降酶对症治疗。
D12:患者肝酶显著升高,考虑抗结核药物导致的药物性肝损伤,首先考虑吡嗪酰胺片,予以停用,同时加用还原型谷胱甘肽针静滴加强护肝降酶治疗。
D16:查体:前胸、颜面部、腰背部可见成片淡红色斑丘疹,有些皮疹融合成片。查肝功能:肝酶胆酶显著升高。患者出现发热、皮疹,首先考虑抗结核药物导致的过敏反应,予治疗上暂停异烟肼针、利福平胶囊、乙胺丁醇片,改为左氧氟沙星针联合利奈唑胺针静滴抗结核治疗,同时加用西替利嗪片抗过敏,腺苷蛋氨酸针护肝利胆治疗。
D19:复查肝功能较前改善,皮疹已完全消退,加用异烟肼针静滴抗结核治疗。
D23:复查肝功能较前明显好转,无皮疹出现,排除异烟肼过敏,加用乙胺丁醇片口服抗结核治疗。
D26:患者无皮疹出现,暂无过敏反应,加用利福平胶囊口服抗结核治疗。
D31:患者逐一加用异烟肼、乙胺丁醇、利福平抗结核药物,未再出现皮疹。患者经抗结核治疗后临床各项指标均明显恢复,症状好转,予带药出院。
患者住院期间抗结核药物使用情况见图1,生化指标监测见表1,脑脊液转归情况见表2。
3 讨论
3.1 药学监护点一:抗结核药物的选择
目前,国内外对结核性脑膜炎的实验研究较少,尚未有随机对照试验确立治疗中枢神经系统结核的最佳药物组合、药物剂量或治疗持续时间,其治疗参照肺内结核的治疗方案[4]。由于感染部位的特殊性,治疗原则:一方面要遵循早期、联合、适量、规律、全程的化疗原则;另一方面要选择具有杀菌作用且能透過血脑屏障,在脑脊液中有较高浓度的药物。一线抗结核药物有异烟肼、利福平、吡嗪酰胺、乙胺丁醇、链霉素,二线药物有对氨基水杨酸、氟喹诺酮类、氨基糖苷类药物、利奈唑胺等。WHO建议应至少3联,常用HRZ,耐药菌株可加用第4 种如链霉素或乙胺丁醇[5]。英国感染学会在结核性脑膜炎治疗指南中提出2HRZE(S/氟喹诺酮类)/10HR方案(数字代表月数)[6]。中华医学会《临床诊疗指南结核病学分册》建议结核性脑膜炎初始采用3HRZES/9HRZE方案,总疗程12~18个月[7]。
考虑该患者为年轻女性、急性起病、初次用药等因素,确定其抗结核治疗方案为异烟肼针 0.6 g qd ivgtt、利福平胶囊 0.45 g qd po、吡嗪酰胺片 0.5 g tid po、乙胺丁醇片 0.75 g qd po。患者于治疗过程中出现药物性肝损伤、皮疹等不良反应,根据抗结核药所致药物性肝损伤诊断与处理专家建议[8],临床药师建议临床医师立即停止该治疗方案,予二线抗结核药物利奈唑胺针 0.6 g q12h ivgtt+左氧氟沙星针 0.6 g qd ivgtt 抗结核治疗,并采取护肝、抗过敏等对症支持治疗。根据专家建议[8],对于肝损伤合并过敏反应(同时有发热、皮疹等)的患者,综合判断患者的肝损伤程度、有无肝损伤相关危险因素和结核病严重程度等,待机体过敏反应全部消退后再逐个试用抗结核药物。该患者D19皮疹已完全消退,复查肝功能较前改善,临床药师建议逐一加用异烟肼、乙胺丁醇、利福平抗结核药物,患者未再出现皮疹等过敏反应,予护肝治疗下肝功能未再出现异常。
3.2药学监护点二:不良反应监护
苏长海等[1]研究发现抗结核药物不良反应最常受累器官是胃肠道系统(28.9%)、肝胆系统(23.7%)、中枢及外周神经系统(15.5%)和皮肤及附属器官(13.4%)。临床药师于治疗期间密切监测患者血常规、肝肾功能、电解质、尿酸水平,关注患者有无流感样症状、视力异常、胃肠道反应、过敏反应等。
该患者予HRZE四联诊断性抗结核治疗,治疗过程中出现肝功能损害和过敏反应。D9患者肝酶轻度升高,治疗上加用复方甘草酸苷针护肝降酶对症治疗。D12患者肝酶显著升高,ALT>5倍ULN,考虑抗结核药物导致的药物性肝损伤,首先考虑肝损伤发生频率高的吡嗪酰胺片,根据抗结核药所致药物性肝损伤诊断与处理专家建议[8],予以停用,同时加用还原型谷胱甘肽针静滴加强护肝治疗。D16患者肝酶胆酶显著升高,ALT>5倍ULN且出现发热及全身过敏反应,临床药师建议立即停用异烟肼针、利福平胶囊、乙胺丁醇片,改为二线抗结核药物左氧氟沙星针联合利奈唑胺针静滴抗结核治疗,同时加用西替利嗪片抗过敏,腺苷蛋氨酸针护肝、利胆治疗。患者予积极护肝降酶、抗过敏治疗后,肝功能逐渐恢复正常、过敏症状好转。患者肾功能、电解质、尿酸水平未出现明显异常,亦无其他不良反应。
3.3药学监护点三:抗感染方案疗效评估
临床药师每日关注患者体温、颈抵抗、头晕头痛等,定期监测患者脑脊液生化及常规,及时评估抗感染治疗方案的有效性。患者予抗结核治疗后,体温趋于正常,头晕头痛症状好转,颈抵抗转阴,脑脊液生化及常规趋于正常,提示抗感染方案有效。
3.4药学监护点四:用药交代
针对该患者的用药方案,临床药师给予相应的用药交代:嘱患者加强营养,多饮水,注意休息,预防感冒,避免劳累;避免食用奶制品、富含酪胺的食物及饮料;避免光照,以防发生光敏反应;利福平胶囊于清晨空腹顿服,服药后大小便、唾液、痰液、泪液等可呈橘红色,属正常现象。
4 小结
结核性脑膜炎病情凶险,联合用药多、治疗疗程长,治疗过程中可能会出现各种不同程度的药物不良反应,导致治疗过程中断、换药、停药,甚至危及到生命。这不仅使患者治疗依从性降低,还有产生耐药菌株的隐患,增加耐药结核的发生率,直接影响结核病的治疗及控制效果[9-12]。
冼翠平[9]对2058例肺结核患者进行回顾性分析,380例(18.5%)出现药物不良反应,以位听神经损害、皮疹、肝损害为主(91.6%)。因药物不良反应中断治疗者44例(11.6%),为未出现药品不良反应病例中断治疗者的3.1倍,其中肝损害是患者中断治疗的主要因素。李国航[10]对924例住院肺结核患者进行临床分析,302例(32.7%)出现药物不良反应,以肝损害、位听神经损害、血液学异常及胃肠反应为主(82.1%)。因药物不良反应终止治疗者44例(14.6%),位听神经损害和肝损害是患者终止治疗的主要因素。缪志伟[11]对1226例肺结核患者进行临床分析,159例(12.97%)出现药物不良反应。因药物不良反应中断治疗者18例,更换药物者33例,终止治疗者24例,更改服药方式者23例,减少药物剂量者8例。因此在抗结核治疗中要全面了解可能出现的不良反应,并注意观察及时处理,使患者能够坚持完成治疗,避免发生严重的后果。
抗结核药物大多数经过肝脏代谢,且有潜在的肝细胞毒性,是临床上引起药物性肝损伤的常见药物。抗结核药物所致肝损伤的发病率约为2%~28%,其差异可能与种族、地理位置、诊断标准、病毒性肝炎的流行等因素相关,我国ATLI 发生率约为8%~30%[13-15]。抗结核药物所致肝损伤是抗结核药物最常见也最严重的不良反应,特别是在高龄、肝病史、饮酒、营养不良以及HIV 感染患者中极易发生[16-19],可以表现为无症状性转氨酶升高,也可呈急性肝炎表现,部分患者甚至可能发生肝功能衰竭而死亡[20,21]。
因此临床药师应做全程个体化的药学监护[22]:①抗结核治疗前应详细了解病史,综合评估患者的病情和肝损伤危险因素,排查肝脏基础疾病及可能影响肝脏功能的相关全身性疾病。②抗结核治疗前及治疗中应做血常规和肝功能检查。③有高危因素的患者需谨慎选用抗结核药物,尽量少用或慎用肝损害发生频率较高的抗结核药物,可酌情保肝治疗。④避免联合使用增强肝毒性的其他藥物。⑤治疗期间嘱患者禁止饮酒、充足营养、合理作息等。
针对该患者,临床药师积极参与,协助临床医生共同制定抗结核治疗方案,并从药物选择、不良反应、疗效评估、用药交代等方面作为切入点为患者开展药学监护,提高了患者治疗过程的安全性和有效性。
[参考文献]
[1] 苏长海,季晖,卢立山,等.抗结核药物不良反应及其危害[J].中国医院药学杂志,2010, 30(2):176-178.
[2] 石富国,古明,马世平. 一线主要抗结核药不良反应分布特点文献分析[J]. 中国药物警戒,2011,8(7):434-437.
[3] 端木宏谨,陆宇. 抗结核药不良反应概述[J]. 医药导报,2008,27(3):214-220.
[4] 赵伟杰,付雷,李破,等. 抗结核药物及方案对结核性脑炎治疗作用及药物的药代动力学/药效学研究[J].中华临床医师杂志,2011,5(5):1333-1338.
[5] World Health Organization.Treatment of tuberculosis:Guidelines for national programmers[M]. 4th edition.Geneva:WHO,2003:313.
[6] Thwaites G,Fisher M,Hemingway C,et al. British Infection Society guidelines for the diagnosis and treatment of tuberculosis of the central nervous system in adults and children[J]. Journal of Infection,2009,59(3):167-187.
[7] 中华医学会. 临床诊疗指南结核病分册[M]. 北京:人民卫生出版社,2005.
[8] 中华医学会结核病学分会. 抗结核药所致药物性肝损伤诊断与处理专家建议[J]. 中华结核和呼吸杂志,2013, 36(10):732-736.
[9] 冼翠平. 药物不良反应对肺结核病人全程规律治疗的影响[J]. 广东药学,2003,13(3): 55-57.
[10] 李國航. 302例肺结核患者药物副作用临床分析[J]. 实用医技杂志,2006,13(6): 970-972.
[11] 缪志伟. 抗结核药物不良反应对治疗的影响及防治策略[J]. 河北医药,2013,(19): 2931-2933.
[12] 屠德华. 试论耐药结核病的发生[J]. 中华结核和呼吸杂志,2007,30(6):403-405.
[13] Tostmann A,Boeree MJ,Aarnoutse RE,et al. Antituberculosis drug-induced hepatotoxicity: Concise up-to-date review[J]. Journal of Gastroenterology & Hepatology,2008, 23(2):192-202.
[14] Baghaei P,Tabarsi P,Chitsaz E,et al. Incidence,clinical and epidemiological risk factors, and outcome of drug-induced hepatitis due to antituberculous agents in new tuberculosis cases[J]. American Journal of Therapeutics,2010,17(1):17.
[15] Larrey D. Epidemiology and individual susceptibility to adverse drug reactions affecting the liver[J]. Seminars in Liver Disease,2002,22(2):145.
[16] Kunst H,Khan KS. Age-related risk of hepatotoxicity in the treatment of latent tuberculosis infection:A systematic review[J]. International Journal of Tuberculosis & Lung Disease the Official Journal of the International Union Against Tuberculosis & Lung Disease,2010,14(11):1374-1381.
[17] Hoffmann CJ,Charalambous S,Thio CL,et al. Hepatotoxicity in an African antiretroviral therapy cohort:The effect of tuberculosis and hepatitis B[J]. Aids,2007,21(10): 1301-1308.
[18] Warmelink I, ten Hacken NH, Ts VDW,et al. Weight loss during tuberculosis treatment is an important risk factor for drug-induced hepatotoxicity[J]. British Journal of Nutrition,2011,105(3):400.
[19] Lima MF,Melo HR. Hepatotoxicity induced by antituberculosis drugs among patients coinfected with HIV and tuberculosis[J]. Cadernos De Saúde Pública,2012,28(4):698-708.
[20] Shang P,Xia Y,Liu F,et al. Incidence,Clinical Features and Impact on Anti-Tuberculosis Treatment of Anti-Tuberculosis Drug Induced Liver Injury(ATLI) in China[J]. Plos One, 2011,6(7):e21836.
[21] Andrade RJ,Lucena MI. Drug-induced hepatotoxicity[J]. New England Journal of Medicine, 2003,349(20):1974.
[22] 杨勇,刘心霞. 抗结核药所致药物性肝损伤患者的药学监护[J]. 世界华人消化杂志,2015,(19):3060-3068.
(收稿日期:2017-04-01)
