盐胁迫对南方泡桐基因表达的影响
2017-10-25李冰冰赵振利邓敏捷曹亚兵董焱鹏范国强
李冰冰,赵振利,邓敏捷,曹亚兵,董焱鹏,范国强
(河南农业大学泡桐研究所,河南 郑州 450002)
盐胁迫对南方泡桐基因表达的影响
李冰冰,赵振利,邓敏捷,曹亚兵,董焱鹏,范国强
(河南农业大学泡桐研究所,河南 郑州 450002)
为阐明泡桐多倍体的耐盐分子机制,以南方泡桐二倍体及对应的四倍体为试验材料,以白花泡桐基因组为参考序列,利用RNA-Seq测序技术,研究了盐处理前后南方泡桐四倍体和对应二倍体的基因表达变化。通过比对分析,共鉴定出与盐胁迫相关的差异表达基因2 940个。对这些差异基因进行GO功能分类,结果显示差异基因共参与了39个分类,集中在细胞、结合、催化等分类功能区的数量最多。KEGG代谢通路分析发现,这些差异表达基因主要参与了Plant hormone signal transduction, Carbon metabolism, Biosynthesis of amino acid等,其中编码MYB、WRKY、bZIP、ATPase等的基因差异表达显著。表明这些基因可能是潜在的盐胁迫响应基因。采用qRT-PCR技术验证了随机挑选的9个差异表达基因,结果与转录组测序数据趋势一致。
南方泡桐;盐胁迫;差异表达基因;转录组
盐胁迫作为重要的非生物胁迫之一,是限制农林业生产的一个重要因素[1]。目前,干旱和半干旱地区约7%的土地(10亿hm2)受到盐分的胁迫影响,并且面积呈现出不断增加的趋势[2-3]。土壤中的盐分含量过高将造成植物离子失衡和高渗胁迫,导致作物生长缓慢、产量下降,甚至萎蔫死亡。Na+、Cl-是造成植物渗透失衡和离子特异性损害的关键离子[4]。研究表明,多类转录因子基因参与植物非生物胁迫进程,其中也包括盐胁迫适应调节机制,如改变植物形态,改变代谢物,合成抗氧化酶和激素等相关抗逆因子,有利于植物适应盐胁迫或其他非生物胁迫的不利环境[5]。与盐胁迫相关的基因及转录因子有WRKY、MYB和HSP等。随着现代生物技术的发展与应用,新一代高通量测序技术可以准确的反映出基因在各种非生物胁迫环境下的应答机制。因此,使用高通量测序技术对研究植物的耐盐机制具有重要意义[6-7]。泡桐(Paulowniaspp.)为落叶乔木,现有9个种2个变种,是中国本土重要的速生用材树种,木材广泛应用于建筑、家具、乐器和各种工艺品的制作,大量种植泡桐对提高中国的经济水平和改善生态环境具有极其重要的意义[8]。但是,土壤盐渍化严重危害了泡桐的正常生长发育,所造成的巨大的经济和生态问题亟待解决。近年来,虽然对不同倍性泡桐在盐胁迫下进行了转录组、miRNA、蛋白质组等组学研究,并鉴定到了一些与响应盐胁迫相关的基因、miRNA以及蛋白质[9-11]。然而,泡桐的耐盐分子机制仍不清楚。以基因组为背景的转录组测序,能降低计算强度并提高基因注释的准确性。因此,本研究以白花泡桐基因组为背景,利用RNA-Seq技术对盐处理下二倍体及四倍体南方泡桐进行转录组测序,分析盐胁迫下不同倍性南方泡桐的基因表达变化,以期为阐明泡桐多倍体的耐盐分子机制奠定理论基础。
1 材料与方法
1.1 试验材料
以河南农业大学林木生物技术实验室培养的南方泡桐(Paulowniaaustralis)二倍体(N2)及其四倍体(N4)的组培苗为材料。材料在温度为(25±2)℃,光照强度为130 μmol·m-2·s-1,光照周期为16 h/8 h(光/暗)下培育30 d,而后移植到室外培养 30 d后选择生长一致植株单株栽植于装有等量普通园土的营养钵中,正常生长50 d进行70 mmol·L-1NaCl处理,每组3个生物学重复。具体处理步骤如下:(1)称取3份等质量的NaCl;(2)取1份完全溶解于水中后完全溶于水后施入园土中,钵底垫有托盘,将渗水重新倒入钵中,避免盐分损失,每3 d进行1次,共计 3 次;(3)在每次NaCl处理时,N2,N42个对照组只加入等量的水;(4)NaCl处理后,每2 d加1次水,在土壤含水量维持在75%下继续培养20 d;(5)分别在0、15 d时对处理的幼苗顶端完全展开的第二对叶片进行取样,将盐处理15 d后的样品分别命名为N2-0.4、N4-0.4,然后用液氮迅速冷冻保存与-80 ℃冰箱中备用。
1.2 总RNA的提取
本试验采用TRLzol试剂进行总RNA提取,具体步骤如下:
取50 mg处理的南方泡桐组培苗放入冷冻的研钵中研磨成粉末状;待液氮完全挥发后,将研磨好的粉末状样品转至离心管中,加1 mL预冷(4 ℃)的TRLzol试剂,使用涡旋振荡器充分混匀,室温放置5 min;用12 000 r·min-1的离心机离心5 min,弃沉淀;在离心管中加入200 μL氯仿混匀,室温静置15 min,12 000 r·min-1离心15 min(4 ℃条件下),使液相分离;将步骤(4)中的上清液转到1个新离心管中,加入0.5 mL的异丙醇,充分混匀放置于室温下5~10 min,4 ℃条件下用12 000 r·min-1离心机离心10 min;弃上清液后,在离心管中加入1 mL的75%乙醇,在4 ℃下8 000 r·min-1离心5 min;再次弃去上清液,真空干燥5~10 min或室温条件下晾干,加入30 μL RNA-free H2O后,可以得到水溶解RNA;把得到的总RNA放置于-80 ℃超低温冰箱进行储存备用。总RNA使用Agilent 2100生物分析仪和NanoDrop 2000超微量分光光度计进行质量检测。
1.3 南方泡桐cDNA文库构建以及高通量测序
提取样品总RNA并使用DNase I消化DNA后,用带有Oligo(dT)的磁珠富集真核生物mRNA,在适温下将mRNA打断成短片段,以打断后的mRNA为模板合成一链cDNA,然后配制二链合成反应体系合成二链cDNA,并使用试剂盒纯化回收、粘性末端修复、cDNA的3末端加上碱基“A”并连接接头,然后进行片段大小选择,最后进行PCR扩增;构建好的文库用Agilent 2100 Bioanalyzer和ABI StepOnePlus Real-Time PCR System质检合格后,使用 Illumina HiSeqTM 2000测序仪进行测序。转录组测序流程图如图1所示。

图1 转录组测序流程图Fig.1 Transcriptome sequencing process
1.4 数据分析处理
由Illumina HiSeqTM2000测序所得的数据称为raw reads或raw data,去除含adapter、含N和低质量reads,得到clean reads。使用Bowtie将clean reads比对到参考基因序列,进行差异基因分析,并对筛选出的样品间差异表达基因,进行GO功能富集分析、KEGG pathway富集分析。本研究中,将P≤0.05且差异倍数(fold-change)在2倍以上的基因定义为差异表达基因。P值越小,差异倍数越大,则表明表达差异越显著。
1.5 差异表达基因qRT-PCR验证
对70 mmol·L-1NaCl处理的N2和N4差异表达基因进行qRT-PCR验证,总RNA提取方法参照1.2提取的方法。首先需要将所验证的差异表达基因利用Beacon Designer version 7.7 (Premier Biosoft International,Ltd. Palo Alto,CA,USA)进行引物设计(表 1),反转录合成cDNA的第一条链,整个反应体系为: 反应体系总体积为20 μL,每20 μL中含有1 μL的模板,正向和反向引物各0.4 μM,cDNA 1 μL,7.0 μL ddH2O。扩增程序为:95 ℃,1 min;95 ℃,15 s;然后57 ℃,15 s;40个循环。每个样品3次重复。以18S rRNA作为内参进行校正,数据处理使用2-△△Ct法计算相对表达量。

表1 QRT-PCR验证的9个差异表达基因的引物序列 Table 1 Primers of quantitative RT-PCR analysis of co-regulated differentially expressed genes
2 结果与分析
2.1 测序结果分析
利用高通量测序,对南方泡桐二倍体(N2、)、四倍体(N4)、二倍体盐处理(N2-0.4)和四倍体盐处理(N4-0.4)进行Illumina测序,分别得到了raw reads 44 966 742条、66 115 272条、38 601 906条和 39 625 810条,总碱基长度分别为4 271 027 400 bp、6 207 579 584 bp、3 734 143 114 bp、3 821 414 790 bp。去除低质量、包含N的reads后,4个文库共得到clean reads数量分别为:42 287 400条、61 461 184条、36 971 714条、37 835 790条,clean reads占total reads总数的比例为94.04%、92.96%、95.78%、95.48%。经过高通量测序得到的4个文库clean reads,可用于下一步分析。
2.2 比对统计
将上述测序得到的南方泡桐4个文库中的clean reads比对到泡桐参考基因组上,可以匹配到白花泡桐基因组上的clean reads占total reads的比例分别为69.66%(N2)、67.81%(N4)、69.77%(N2-0.4)、71.25%(N4-0.4)(表2)。比对比例未能达到100%,也说明了不同种样品间是有一定差异的。
2.3 测序数据评价
由南方泡桐4个转录组文库的reads在基因上的分布情况(图2)可以看出,各个库reads在基因上的分布是均匀的,证明了转录组测序质量较高。对下一步深入挖掘分析奠定基础。
2.4 南方泡桐差异表达基因(DEGs)分析
根据方法1.4中差异表达基因筛选标准,在N2与N4中鉴定出8 055个DEGs,4 706个为上调基因,3 349个为下调基因。为进一步了解这些差异基因的功能,对8 055个DEGs进行Nr注释,之后进行GO(Gene Ontology)功能分类。结果表明8 055个差异基因参与了50个GO分类(图3A),其中代谢过程、细胞组分、催化活性等条目所包含的差异基因数量最多,为进一步了解这些差异基因所参与的生物学功能,对差异基因进行KEGG pathway分析(表 3),结果显示5 086个DEGs参与了132条代谢通路,其中显著性富集的pathway(P≤0.05)有19条,如Carbon metabolism、Biosynthesis of amino acids等通路。在N4-0.4与N4中(图 3B)鉴定出7 467个DEGs,其中1 644个上调基因,5 823个为下调基因。对这些DEGs进行Nr注释,之后进行了GO功能分类,表明7 464个差异基因参与了49个分类,其中细胞组分、代谢过程、细胞、催化活性等差异基因数量最多。KEGG pathway分析表明这些DEGs共参与19个KEGG代谢通路并显著性差异,其中Ribosome biogenesis in eukaryotes、Circadian rhythm-plant和ABC transporters等高度富集。在N2-0.4与N4(图3C),对5 630个(上调基因2 509个,下调基因3 121个)差异表达基因进行Nr注释和GO功能分类。结果表明,差异基因参与了48个GO分类,其中细胞过程、代谢过程、结合、催化活性等基因数量最多。利用KEGG数据库进行富集分析, 3 523个DEGs共参与23个代谢通路, 其中Biosynthesis of secondary metabolites、Zeatin biosynthesis等代谢通路高度富集。

表2 Clean reads与参考基因及基因组比对统计 Table 2 The statistics of clean reads mapped to reference gene and genome

图2 read在基因位置分布情况(A: N2;B: N2-0.4; C: N4;D: N4-0.4)Fig.2 The distribution of reads in gene (A: N2;B: N2-0.4; C: N4;D: N4-0.4)
同样对N2-0.4与N2(图3D)的数据进行Nr注释和GO功能分类,结果表明,差异基因共参与47个GO分类,代谢过程、细胞组分、结合、催化活性等基因数量最多。对这些差异基因进行 KEGG富集分析,共有3246个DEFGs参与33个代谢通路。其中,Plant hormone signal transduction、Biosynthesis of secondary metabolites、Metabolic pathways等高度富集。

表3 南方泡桐4个文库差异表达基因KEGG Pathway富集分析Table 3 KEGG Pathway enrichment analyses of different expression genes between four libraries in Paulownia australis

续表 Continuing table
注:比率为差异表达基因数量与总基因数量的比。
Notes:Ratio represents the ratio of the number of differentially expressed genes to the total number of genes.

图3 差异表达基因的GO 分类 Fig.3 Go classification of differentially expressed genes
2.5 与盐胁迫相关的差异表达基因(DEGs)分析
为找出N2与N4盐胁迫密切相关的的差异表达基因,本研究对N2与N4、N4-0.4与N4、N4-0.4与N2-0.4、N2-0.4与N2对比组进行进一步分析(图4)。在N2-0.4与N2和N4-0.4与N4共鉴定出10 127个差异表达基因可能是与盐胁迫响应有关的,其中2 506个是共有的DEGs,特有的DEGs分别为2 660、4 961个,并对10 127个差异表达基因进行Nr注释,之后进行GO功能分类(图4A),结果表明,10 127个与盐胁迫相关的差异基因参与41个GO分类,其中参与细胞组分分类中,细胞和细胞组分差异基因数量最多,胞外区基因数量最少;参与分子功能的差异基因分类,结合、催化活性基因数量最多,转录调节剂最少;生物学过程中,细胞过程、刺激响应、代谢过程、生物调节差异基因数量最多,细胞自噬数量最少。在N4-0.4与N2-0.4和N2与N44个文库中,共鉴定出3 555个共有的差异表达基因。(图4B)并对其进行Nr注释和GO功能分类,表明差异基因共参加40个分类,其中细胞组分的分类中,细胞和细胞组分基因数量最多,胞外区的最少;结合、催化在分子功能分类中的基因数量最多;在生物学过程功能分类中,细胞过程和代谢过程差异基因数量最多,细胞自噬基因数量最少。

细胞组分: 1:细胞;2:细胞部分;3:胞膜;4:胞外区;5:胞外区部分;6:大分子复合体;7:膜封闭腔;8:细胞器;9:细胞器部分。分子功能: 1:抗氧化性;2:结合;3:催化;4:电子传递;5:酶调节;6:金属离子;7:分子转导;8:结构分子;9:转录调节;10:翻译调节;11:转运。生物学过程:1:解剖结构形成;2:生物附着;3:生物调节;4:细胞自噬;5:细胞组分生物合成;6:细胞组分组织;7: 细胞过程;8:细胞死亡;9:发育过程;10:胞内定位的建立;11:生长;12:免疫系统过程;13:细胞内定位;14:代谢过程;15:涉及多个有机体的过程;16: 涉及多细胞有机体的过程;17:色素沉积;18:生殖;19:生殖过程; 20: 对刺激的反应;21:节律性过程。
Cellular componen:1:Cell;2:Cell part;3:Envelope;4:Extracellular region;5:Extracellular region part; 6:Macromolecular complex; 7:Membrane-enclosed lumen; 8:Organelle ;9:Organelle part . Molecular function:1:Antioxidant; 2:Binding; 3:Catalytic;4:Electron carrier; 5:Enzyme regulator; 6:Metallochaperone; 7:Molecular; 8:Structural molecule; 9:Transcription regulator; 10:Translation regulator; 11:Transporter.Biological process:1:Anatomical structure formation;2:Biological adhension;3:Biological regulation;4:Cell killing;5:Cellular component biogenesis;6:Cellular component organization;7:Cellular process; 8:Death;9:Developmental process;10:Establishment of localization;11:Growth;12:Immune system process;13:Localization;14:Metabolic process;15:Multi-organism process;16:Multicellular organismal process;17:Pigmentation;18:Reproduction;19:Reproductive process;20:Response of stimulus;21:Rhythmic process.

细胞组分: 1:细胞;2:细胞部分;3:胞膜;4:胞外区;5:胞外区部分;6:大分子复合体;7:膜封闭腔;8:细胞器;9:细胞器部分。分子功能: 1:抗氧化性;2:结合;3:催化;4:电子传递;5:酶调节;6:分子转导;7:结构分子;8:转录调节;9:翻译调节;10:转运。生物学过程:1:解剖结构形成;2:生物附着;3:生物调节;4:细胞自噬;5:细胞组分生物合成;6:细胞组分组织;7: 细胞过程;8:细胞死亡;9:发育过程;10:胞内定位的建立;11:生长;12:免疫系统过程;13:细胞内定位;14:代谢过程;15:涉及多个有机体的过程;16: 涉及多细胞有机体的过程;17:色素沉积;18:生殖;19:生殖过程; 20: 对刺激的反应;21:节律性过程。
Cellular componen: 1:Cell ;2:Cell part; 3:Envelope;4:Extracellular region;5:Extracellular region part; 6:Macromolecular complex; 7:Membrane-enclosed lumen; 8:Organelle; 9:Organelle part. Molecular function:1:Antioxidant; 2:Binding;3:Catalytic;4:Electron carrier;5:Enzyme regulator; 6:Molecular transducer; 7:Structural molecule; 8:Transcription regulator; 9:Translation regulator; 10:Transporter Biological process:1:Anatomical structure formation;2:Biological adhension;3:Biological regulation; 4:Cell killing;5:Cellular component biogenesis;6:Cellular component organization; 7:Cellular process;8:Death;9:Developmental process;10:Establishment of localization; 11:Growth; 12:Immune system process; 13:Localization; 14:Metabolic process;15:Multi-organism process;16:Multicellular organismal process; 17:Pigmentation; 18:Reproduction; 19:Reproductive process; 20:Response of stimulus;21:Rhythmic process.
图4盐胁迫相关的差异表达基因GO分类
Fig.4GocategoryofDEGsrelatedtosaltstress
在N2与N4和N4-0.4与N2-0.4两对比组中,鉴定出共有差异表达基因3 555个,在排除不同倍性引起的差异后,得到2 940个DEGs,这些DEGs反映了南方泡桐二倍体及四倍体对盐胁迫的不同响应。为进一步了解差异基因的功能,对这些差异基因进行Nr注释,之后进行GO功能分类(图5)。结果表明,这些差异基因共涉及39个功能分类,其中细胞组分的分类中,细胞和细胞组分基因数量最多,胞外区的最少;结合、催化在分子功能分类中的基因数量最多;在生物学过程功能分类中,细胞过程和代谢过程差异基因数量最多。此外,在4个比较组中共鉴定出来615个差异表达基因。
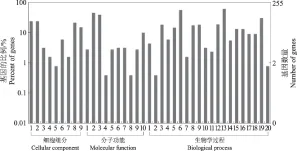
细胞组分: 1:细胞;2:细胞部分;3:胞膜;4:胞外区;5:胞外区部分;6:大分子复合体;7:膜封闭腔;8:细胞器;9:细胞器部分。分子功能: 1:抗氧化性;2:结合;3:催化;4:电子传递;5:酶调节;6:分子转导;7:结构分子;8:转录调节;9:翻译调节;10:转运。生物学过程:1:解剖结构形成;2:生物附着;3:生物调节;4:细胞组分生物合成;5:细胞组分组织;6:细胞过程;7:细胞死亡;8:发育过程;9:胞内定位的建立;10:生长;11:免疫系统过程;12:细胞内定位;13:代谢过程;14:涉及多个有机体的过程;15:涉及多细胞有机体的过程;16:色素沉积;17:生殖18:生殖过程; 19:对刺激的反应;20:节律性过程。
Cellular componen: 1:Cell;2:Cell part;3: Envelope;4:Extracellular region;5: Extracellular region part;6:Macromolecular complex;7:Membrane-enclosed lumen; 8:Organelle;9:Organelle part .Molecular function: 1:Antioxidant; 2:Binding; 3:Catalytic;4:Electron carrier; 5:Enzyme regulator;6:Molecular transducer;7:Structural molecule;8:Transcription regulator; 9:Translation regulator; 10:Transporter. Biological process:1:Anatomical structure formation; 2:Biological adhension; 3:Biological regulation; 4:Cellular component biogenesis; 5:Cellular component organization; 6:Cellular process; 7:Death; 8:Developmental process; 9:Establishment of localization; 10:Growth; 11:Immune system process; 12:Localization;13:Metabolic process;14:Multi-organism process;15:Multicellular organismal process;16:Pigmentation; 17:Reproduction;18:Reproductive process;19:Response of stimulus;20:Rhythmic process.
图5在N2与N4和N4-0.4与N2-0.4中盐胁迫相关的差异表达基因GO分类
Fig.5GocategoryofDEGsrelatedtosaltstressinN2vsN4andN4-0.4vsN2-0.4
2.6 差异基因qRT-PCR验证
为了验证高通量测序结果的可靠性,本试验随机挑选了9个差异表达基因进行qRT-PCR验证,具体包括protein phosphatase 2C、fructose 1,6 bisphosphate aldolase、transcription factor bHLH87-like、MYB transcription factor、WRKY-liketranscription factor、plasma membrane H+-ATPase、26S proteasome ATPase regulatory subunit 、DNA-binding protein NtWRKY3、protein FD-like。qRT-PCR结果显示除转录因子bHLH87-like外,MYB等转录因子表达量情况与高通量测序结果保持一致,说明测序结果准确可靠(图6)。

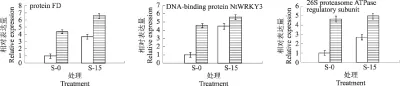
图6 差异表达基因的qRT-PCR 验证(S-0: 对照;S-15: 盐处理15 d)Fig.6 Validation of differentially expressed genes with quantitative RT-PCR(S-0: control;S-15: salt treatment for 15 d)
3 讨论
随着全球盐渍化面积的不断扩大,植物遭受盐胁迫的危害也日益严重,盐胁迫作为非生物胁迫之一,严重地限制了植物的生长发育,对可持续农业和林业的发展造成不可逆的经济损失,并且对良好生态环境的发展也造成了一定的影响[12-13]。本研究利用Illumina/Solexa测序技术,通过比较不同倍性南方泡桐对照组和处理组,筛选出了2 940个可能与盐胁迫下相关的DEGs。对这些DEGs进行GO功能分类,结果表明差异基因共参与了39个分类,基因数量主要集中在细胞、结合、催化等分类功能区。进一步分析表明这些差异基因参与了ABC transporters(ko02010)、Carbon metabolism(ko01200)、Plant hormone signal transduction(ko04075)、Biosynthesis of amino acid(ko01230)等代谢通路,这些通路将有助于我们更好的深入了解盐胁迫下植物复杂的调控网络。
在盐胁迫下,植物依赖于许多关键代谢物的产生和运输来保持细胞质中离子的平衡,通常在在这个过程中需要细胞快速合成渗透物质,在高效的离子运输机制下进行转运,以维持细胞正常生长的电化学势。植物在盐胁迫下为了应对渗透失衡和离子毒害,当Na+进入细胞后,ATPase将会通过驱动Na+/H+逆向转运产生驱动力来转运Na+,减少由于Na+的积累而对细胞所造成的损害,将有利于植物重建细胞离子平衡和维持电化学势平衡[14]。本研究中南方泡桐二倍体及四倍体盐处理的转录组测序结果表明,包括ATP binding cassttte (ABC)transporter, ATPase(PAU009856.1,PAU004974.1,PAU023141.1), ion transporter等编码膜转运相关蛋白的DEGs在四倍体盐胁迫响应下是显著上调的,表明N4在盐胁迫下更能维持细胞的离子平衡。
Transcription Factors (TFs) 在植物生长和胁迫处理下起着至关重要的作用[15]。MYB和WRKY家族被认为参与了非生物胁迫,在玉米中,与木质素合成相关的基因的表达受到MYB31和MYB42的过表达的抑制,其表现为木质素含量降低高达45%,此时植物叶、茎和根生长趋势明显增强[16-17]。有研究表明,StMYB1R-1的表达增强了干旱相关基因RD28、AtHB-7等的表达,这表明了StMYB1R-1作为转录因子参与了干旱相关基因的活化。对其进行northern-blot的深入分析表明,除了响应干旱胁迫以外,StMYB1R-1在响应几种不同的胁迫时转录水平明显增加,尤其是在盐胁迫早期StMYB1R-1表达量明显增加,这表明MYB基因可能通过影响木质素合成或者与耐盐相关基因特异性结合来参与高盐胁迫[18]。在本研究中,编码MYB家族转录因子的基因(PAU010915.1,PAU001021.1,PAU026979.1,PAU017920.1)在四倍体盐处理中是差异表达的,且表达倍数显著高于盐处理的二倍体泡桐。说明四倍体南方泡桐在盐胁迫下比二倍体耐受性更强。
WRKY转录因子被认为是抑制赤霉素(GA)信号通路,激活脱落酸(ABA)信号通路并可以调节植物中的其他信号通路,GA和ABA是盐胁迫反应的重要调节因子[19-20]。在本研究中,编码WRKY转录因子的基因(PAU011504.1 、PAU005872.1)参与了GA和ABA信号转导,表明GA和ABA可能通过参与信号转导通路来影响植物对盐胁迫的响应,并且这些转录因子编码的差异基因在N4-0.4文库中是差异表达的,在与(N2-0.4)库相比差异倍数较高。这些结果说明在盐胁迫下,N4与N2文库相比,四倍体会编码更多的转录因子来响应盐胁迫,对植物的生长进行一系列调节。
bZIP转录因子含有与特异DNA结合的碱性结构域,其C末端序列高度保守,N末端序列与反式活化活性相关,可以与DNA直接结合。在拟南芥中,bZIP14和bZIP37亚族分类为Group A,Group A通过顺式元件参与ABA或者胁迫信号响应[21]。此外,bZIP转录因子家族的活化可以引起ABA依赖性磷酸化,进而引发植物对各种胁迫的应答[22]。本研究中,在N4-0.4与N2-0.4文库中鉴定出来编码bZIP基因的DEGs(PAU010522.2),并在四倍体中的表达量显著高于二倍体。说明四倍体泡桐对盐胁迫的调控机制比二倍体更有优势。
总之,本研究通过高通量测序技术,对南方泡桐二倍体及对应的四倍体,在盐胁迫下进行转录组变化研究,鉴定出了与盐胁迫相关的差异表达基因及代谢通路,通过进一步的分析,将为抗逆性品种的培育奠定一定的理论基础。
[1] ZHU J K. Plant salt tolerance [J]. Trends in Plant Science, 2001, 6(2) :66-71.
[2] MÜHLING KH, LUCHLI A. Interaction of NaCl and Cd stress on compartmentation pattern of cations, antioxidant enzymes and proteins in leaves of two wheat genotypes differing in salt tolerance[J]. Plant and Soil, 2003, 253(1) :219-231.
[3] AGARWAL P K, SHUKLA P S, GUPTA K, et al. Bioengineering for salinity tolerance in plants: state of the art [J]. Molecular Biotechnology , 2013, 54(1) :102-123.
[4] MUNNS R, TESTER M. Mechanisms of salinity tolerance [J]. Annual Review of Plant Biology, 2008, 59 :651-681.
[5] WANG L, MO Q, WANG J. MIrExpress: A database for gene coexpression correlation in immune cells based on mutual information and pearson correlation [J]. Journal of Immunology Research, 2015, 30(1):1-10.
[6] YING S, ZHANG D F, FU J, et al. Cloning and characterization of a maize bZIP transcription factor, ZmbZIP72, confers drought and salt tolerance in transgenic Arabidopsis. [J]. Planta, 2012, 235(2) :253-266.
[7] WANG W, VINOCUR B, ALTMAN A. Plant responses to drought, salinity and extreme temperatures: towards genetic engineering for stress tolerance [J]. Planta, 2003, 218(1) :1-14.
[8] 范国强, 王安亭, 王国周,等. 接干和施肥对不同初植苗高泡桐幼树主干生长影响的研究 [J]. 林业科学研究, 2000, 13(6) :628-633.
[9] 曹亚兵, 赵振利, 翟晓巧,等. 白花泡桐二倍体及四倍体响应盐胁迫的蛋白质组变化的研究 [J].河南农业大学学报, 2016, 50(5) :609-619.
[10] 王园龙, 曹林, 邓敏捷,等. 利用高通量测序分析白花泡桐盐胁迫相关microRNAs [J]. 河南农业大学学报, 2016 , 50(4) :461-467.
[11] FAN G Q, WANG L, DENG M .Changes in transcript related to osmosis and intracellular ion homeostasis in paulownia tomentosa under salt stress [J]. Frontiers in Plant Science, 2016, 7 :384-391.
[12]马进,郑钢.利用转录组测序技术鉴定紫花苜蓿根系盐胁迫应答基因 [J]. 核农学报, 2016, 30(8) :1470-1479.
[13] 彭振, 何守朴, 龚文. 陆地棉幼苗NaCl 胁迫下转录因子的转录组学分析 [J]. 作物学报,2017, 43(3) :354-370.
[14] WU B, HU Y, HUO P, et al. Transcriptome analysis of hexaploid hulless oat in response to salinity stress [J] . Plos One, 2017, 12(2) :e0171451.
[15] WITZEL K, WEIDNER A, SURABHI G K, et al. Salt stress-induced alterations in the root proteome of barley genotypes with contrasting response towards salinity [J]. Journal of Experimental Botany, 2009, 60(12) :3545-3557.
[16] LINDEMOSE S,OSHEA C, JENSEN M K, et al. Structure, Function and networks of transcription factors involved in abiotic stress responses [J]. International Journal of Molecular Sciences, 2013, 14(3) :5842-5878.
[17] FORNALÉ S, SONBOL F M, MAES T, et al. Down-regulation of the maize and Arabidopsis thaliana caffeic acid O-methyl-transferase genes by two new maize R2R3-MYB transcription factors[J]. Plant Molecular Biology, 2006, 62(6) :809-823.
[18] SHIN D, MOON S J, HAN S, et al. Expression of StMYB1R-1, a novel potato single MYB-like domain transcription factor, increases drought tolerance [J]. Plant Physiology, 2011, 155(1):421-432.
[19] RUSHTON P J, SOMSSICH I E, RINGLER P, et al. WRKY transcription factors [J]. Trends in Plant Science, 2010, 15(5) :247-258.
[20] SUBHASIS S, THAKUR J K. Importance of mediator complex in the regulation and integration of diverse signaling pathways in plants [J]. Frontiers in Plant Science, 2015, 6(7) :388-394.
[21] LOPEZ-MOLINA L, MONGRAND S, CHUA N H. A postgermination developmental arrest checkpoint is mediated by abscisic acid and requires the ABI5 transcription factor in Arabidopsis [J]. Proceedings of the National Academy of Sciences of the United States of America, 2001, 98(8) :4782-4787.
[22] YOSHIDA T, FUJITA Y, SAYAMA H, et al. AREB1, AREB2, and ABF3 are master transcription factors that cooperatively regulate ABRE-dependent ABA signaling involved in drought stress tolerance and require ABA for full activation [J]. Plant Journal for Cell & Molecular Biology, 2010, 61(4) :672-685.
EffectofsaltstressongeneexpressionsofdifferentgenotypesofPaulowniaaustralis
LI Bingbing, ZHAO Zhenli, DENG Minjie, CAO Yabing, DONG Yanpeng, FAN Guoqiang
(Institute of Paulownia, Henan Agricultural University, Zhengzhou 450002,China)
To elucidate the molecular mechanism of polyploidyPaulowniaresponse to salt stress, RNA-Seq technology was used to research changes of genes in response to salinity tolerance in tetraploidPaulowniaaustralisand its diploid withPaulowniareference genome sequences. A total of 2 940 differentially expressed genes related to salt stress were identified in four libraries. GO function classification showed that the differentially expressed genes were involved in 39 categories, and most of them involved in cells, binding, catalysis and other classifications. KEGG pathway analysis indicated that these differentially expressed genes were mainly involved in the synthesis of plant hormone signal transduction,carbon metabolism,and biosynthesis of amino acid.Among these differentially expressed genes, MYB,WRKY,and bZIP,ATPase were differentially expressered,suggesting that these genes may be potential genes of salt response. In addition,quantitative real-time PCR(qRT-PCR)technology was used to validate the expression data measured by RNA-seq for nine randomly selected differentially genes.These results suggested that the RNA-seq dataset was dependable.
Paulowniaaustralis; salt stress; differentially expressed genes; transcriptome
2017-03-12
国家公益性林业行业科研专项(201004002)
李冰冰(1993-),女,河南禹州人,硕士研究生,主要从事泡桐生物技术研究工作。
范国强(1964-),男,河南禹州人,教授,博士,博士生导师。
1000-2340(2017)04-0471-10
S792.43
A
(责任编辑:蒋国良)
