银杏叶提取物对大鼠内耳组织及蜗神经核线粒体DNA4834bp缺失突变的影响
2017-10-25黄海林刘
黄海林刘 俊
·论 著·
银杏叶提取物对大鼠内耳组织及蜗神经核线粒体DNA4834bp缺失突变的影响
黄海林1刘 俊2
目的 观察银杏叶提取物对大鼠内耳组织及蜗神经核线粒体(mt)DNA4834bp缺失突变的影响。方法 取24月龄SD大鼠20只,随机分为实验组和对照组,各10只,分别用银杏叶提取物100mg/(kg·d)、等体积生理盐水灌胃,3个月后处死。干预前后分别测试两组大鼠ABR,荧光定量PCR检测线粒体DNA4834bp缺失率,并观察其与老年听力损失的关系。结果 干预后实验组ABR 阈移(3.91±3.73)dB peSPL,对照组 ABR 阈移(9.64±2.59)dB peSPL,两组比较,差异有统计学意义(P<0.05)。与对照组比较,实验组蜗神经核、内耳组织线粒体DNA4834bp缺失率降低(0.2466±0.1335 比 1.0461±0.3423,0.3507±0.158 比 1.0202±0.2269,P<0.05)。结论 银杏叶提取物能抑制大鼠听觉器官线粒体DNA4834bp缺失突变,减少mtDNA的氧化损伤,改善线粒体功能,改善听力,从而延缓大鼠老年性耳聋进展。
大鼠;老年性耳聋;银杏叶提取物;氧化损伤;线粒体DNA4834bp;内耳;耳蜗核
1 实验材料
1.1 实验动物 SPF级SD老龄大鼠20只(24月龄),平均体质量(647.83±10.35)g,所有动物均无噪声暴露史及其它药物使用史,无中耳炎。大鼠由华中科技大学同济医学院提供,饲养于浙江中医药大学实验动物中心,医学动物许可证号:SCXK(沪)2013-0016,全封闭SPF级状态下标准饲料饲养。
1.2 主要试剂 银杏叶提取物(商品名:金纳多滴剂;规格:30mL/支):德国威玛舒培药厂提供;PCR引物合成:上海生工生物有限公司;PBS缓冲液:上海永叶生物科技有限公司;SYBR Premix Ex TaqTMⅡ(RR420A):TaKaRa生物科技公司;10%水合氯醛:浙江省中医院提供;Taq酶、蛋白酶k、琼脂糖:TaKaRa生物科技公司。
1.3 主要仪器 GSI Audera脑干诱发电位仪:美国GSI公司;电子天平:上海天平仪器厂;台式离心机:THERMO Electron(美国)公司;Model DK-8D 恒温水浴:上海森信实验仪器有限公司;BIO-RAD iQ5实时荧光定量PCR仪凝胶成像:BIO-RAD公司;SW-CJ-1F超净工作台:苏州苏净集团安泰公司;玻璃匀浆器:江苏海门健康实验器材有限公司;体视显微镜:南京南派有限公司;眼科手术器械:江苏康华医疗器械厂;紫外线核酸检测仪:Thermo(美国)公司。
2 实验方法
2.1 实验分组 20只老龄SD大鼠(24月龄)随机分为两组,实验组10只,银杏叶提取物100mg/(kg·d)灌胃。对照组10只,等量体积生理盐水灌胃。SPF条件下饲养,常温(22±2℃)、常湿(50%~60%)下标准饲料饲养,自由饮水,连续饲养90天后处死。
2.2 大鼠ABR反应阈测定 实验开始前1天及实验结束前1天分别进行ABR反应阈测试,测定方法参照孔维佳建立方法进行[10]。测试前两组大鼠用10%水合氯醛按照0.4mL/kg腹腔内注射麻醉,使用GSI Audera脑干诱发电位仪测试,测试电极采用直径0.38mm,长13mm针灸针。电极安放位置:记录电极置于待测耳乳突部皮下,参考电极置于对侧耳乳突皮下,地极置于颅顶皮下,耳机置于测试耳外耳道。参数设置:刺激声为Click声,刺激重复频率为11.1/s,叠加 300 次,扫描时间 10ms,间期 100μs。声刺激强度以100dB peSPL开始,开始强度按10dB peSPL递减,观察Ⅲ波波形变化,接近阈值时按5dBpeSPL递减。阈值以Ⅲ波波形消失,成重复出现时的刺激声强为该测试耳阈值,刺激声强单位:dB peSPL。ABR测试采用单盲法,即测试者不知大鼠用药情况及分组。ABR阈移为治疗前后阈值差。
2.3 内耳组织及蜗神经核mtDNA提取
2.3.1 内耳组织mtDNA提取 两组大鼠ABR测试结束后立即麻醉断头处死,提取双侧听泡,置于4℃预冷的充氧无钙镁细胞外液中(0.1mol/L PBS,pH 7.4),体视显微镜下剥去骨性蜗壳,解剖出耳蜗Corti器、血管纹、螺旋神经节等内耳组织。分别置入匀浆管中加入 100μL匀浆液(pH7.4,0.01mol/L Tris-HCI,0.1Mmol/L,0.01mol/L蔗糖),在检测 mtDNA 缺失率时两侧内耳耳蜗Corti器、血管纹、螺旋神经节可以作为同一个样本匀浆后提取总DNA,步骤如下:(1)在匀浆管中加入 1000μL RIPA 裂解液(强);(2)加入蛋白酶K,至终浓度10mg/mL,摇匀混合,55℃水浴过夜消化;(3)加入等体积饱和酚,温和振荡10min,12 000g 0℃离心 10min;(4)留取水相,加入等体积酚-氯仿-异戊醇(25:24:1),剧烈震荡,抽提1~2次;(5)留取水相,加入等体积氯仿,颠倒混匀,抽提1次;(6)留取水相,加入两倍体积预冷的无水乙醇和1/10体积3M醋酸钠,-20℃保存1h;(7)离心12 000g,0℃,10min;(8)加入 75%乙醇 1mL 洗涤 1次,12 000g,0℃,离心 5min,弃上清,空气干燥;(9)所得DNA溶于50μL TE溶液,-20℃保存备用。
2.3.2 蜗神经核mtDNA提取 两组大鼠麻醉立即断头,于中线处剪开颅骨,将脑组织轻轻从颅骨中取出,注意保留双侧小脑旁绒球以定位蜗神经核。蜗神经核定位:根据Georage Paxinos and Charles Watson[11]制定的定位方法,蜗神经核位于延髓嘴侧端的背外侧面,包括背侧核和腹侧核。解剖中以小脑旁绒球为定位标志,如图1(封二)。取脑组织(蜗神经核)100mg,同一只大鼠两侧蜗神经核混合到一起作为一个样本,置入匀浆器中,加入2mL匀浆液(pH7.4,0.01mol/L Tris-HCI,0.1mmol/L,0.01mol/L 蔗糖)匀浆至无明显组织块存在(冰浴操作)。匀浆液4℃离心1000g 10min,取上清0℃离心12 000g 15min,弃去上清,沉淀物即为脑组织线粒体。脑线粒体DNA提取步骤同内耳组织。取2μL DNA样本溶液稀释至50μL,用紫外线核酸检测仪器检测A260/A280纯度值并测定其浓度大小。
2.4 实时荧光定量PCR检测 PCR引物设计:根据大鼠线粒体基因序列,利用Primer premier 5.0分析设计,由大连宝生生物工程有限公司(TaKaRa)帮助合成,引物设计见表1。
实时定量荧光 PCR反应体系为 25μL,DNA 3μL,每个引物 0.5μL(10μm/L),SYBR 12.5μL,无菌蒸馏水 8.5μL。反应条件:首次94℃预变性 2min,然后94℃变性30s,68℃退火30s,共40个循环,根据溶解曲线检测扩增产物特异型,根据荧光扩增曲线确定CT值,保存数据及图片。
表1 引物设计
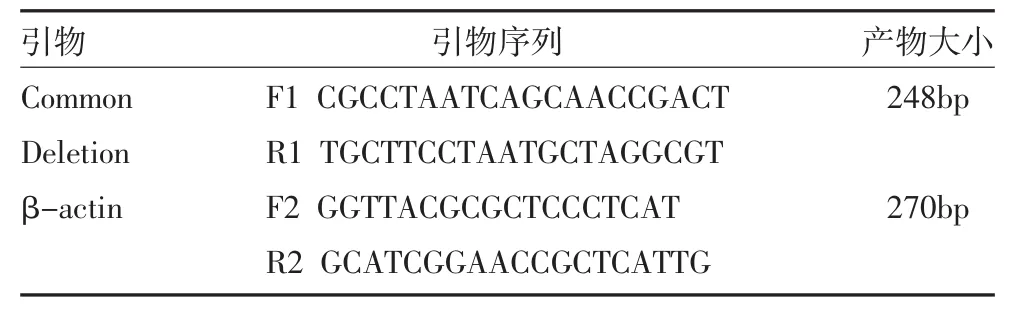
表1 引物设计
?
2.5 统计学方法 统计软件采用SPSS17.0。使用相对定量法(2-△△Ct)对mtDNA4834进行定量分析,以β-actin为内参基因,目的基因的表达量即mtDNA4834bp普遍缺失量。△△Ct值=实验组△Ct值-对照组△Ct,2-△△Ct值,表示实验组目的基因表达量与对照组目的基因表达量比值,即目的基因mtDNA4834bp 缺失率。计量资料以(x±s)表示,采用 t检验,以P<0.05为差异有统计学意义。
3 结果
3.1 用药前后ABR反应阈改变 用药后实验组ABR 反应阈阈移为(3.91±3.73)dB peSPL,对照组ABR 反应阈阈移为(9.64±2.59)dB peSPL,两组比较差异有统计学意义(P<0.01),见图 2(封二);ABR 阈移图形见图3(封二)。
3.2 蜗神经核和内耳组织mtDNA4834bp缺失率实验组大鼠蜗神经核与内耳组织mtDNA4834bp缺失率分别为(0.2466±0.1335)、(0.3507±0.1588);对照组大鼠蜗神经核与内耳组织mtDNA4834bp缺失率分别为(1.0461±0.3423)、(1.0202±0.2269),两组比较差异有统计学意义(P<0.05)。见图 4(封二)。
3.3 RT-PCR扩增产物电泳图 RT-PCR后,取扩增产物10μL,1.5%琼脂糖凝胶电泳,以溴化乙锭染色,电压100V,电泳30min后行凝胶成像扫描结果,见图 5(封二)。
4 讨论
4.1 线粒体DNA缺失突变和听力损失关系 老年性聋是机体衰老过程在听觉器官的表现。研究[12]发现,线粒体DNA突变与老年性聋的发生关系密切。人类mtDNA在8483~13459bp之间存在着13bp的重复序列,在氧化应激刺激下,容易发生断裂,在修复时由于两端重复序列,产生DNA两条链下游环,该碱基环富含鸟嘌呤碱基,对自由基极其敏感,一旦受到ROS攻击,该环降解即容易导致“误认”,发生4977bp片段缺失,此机制被称为线粒体重组滑行错配学说[13]。大鼠 mtDNA8103~12937bp之间也存在16bp的直接重复序列,故大鼠也存在类似缺失突变(mtDNA4834bp)的常见缺失(common deletion,CD)。该缺失突变编码包括 ND3、ND4、NDS、COⅢ、ATPaseB、ATPase6等[14]基因,影响呼吸链有关亚单位蛋白的合成,从而形成有缺陷的呼吸链,ATP产生不足导致蜗内离子失平衡,内环境紊乱,最终导致内耳毛细胞非特异性损害,引起听力下降[15]。Bai等[16]报道,在老年聋患者的颞骨中发现mtDNA4977缺失发生率为82.4%(14/17),而正常听力对照组的颞骨mtDNA4977缺失率为47.1%(8/17),两组间差异显著,提示mtDNA4977缺失与老年聋的可能关系。戴朴等[17]检测了老年人颞骨mtDNA4977缺失,发现老年聋患者的mtDNA4977缺失发生率高于老年对照组。大量研究发现老年性聋患者线粒体DNA4977bp缺失突变发生率比相同年龄的正常人高。刘红[18]在检测老年性耳聋患者毛干中mtDNA4977bp突变率时发现,重度耳聋患者线粒体DNA缺失量为(33.68±10.30)%,轻度耳聋患者线粒体DNA缺失量为(11.97±4.12)%。刘俊等[19]在研究大鼠脑内耳组织mtDNA时发现mtDNA4834片段缺失率为60%,在青年组大鼠未发现mtDNA4834的缺失。
4.2 银杏叶提取物作用机制探讨 中药银杏(ginkgo biloba)属银杏科,是我国的特产植物。早在1975年,人们就将银杏叶提取物(EGB761)应用于临床。在衰老过程中,因抗氧化物酶活性下降以及自身DNA 碱基切除修复(base excision repair,BER)的衰退,导致大量ROS不能完全被清除而在机体中积累下来[20]。不断累积的ROS破坏生物膜产生丙二醛(malonaldehyde,MDA),同时超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)活性随着年龄增长而降低,所以一般用MDA、SOD、GPX作为反映老化的指标,反映机体氧化损伤的程度[21]。研究证实,银杏叶提取物治疗后血清SOD、GSH显著升高,MDA明显下降,提示该药物能清除体内过多的自由基,抑制细胞膜的脂质等生物大分子发生过氧化反应作用[22]。大多数学者认为,内耳耳蜗毛细胞和螺旋神经节退变是老年性耳聋的关键。其具体病理变化主要包括四个方面[23]:(1)耳蜗螺旋神经节细胞、神经纤维退变及变性;(2)耳蜗内外毛细胞萎缩消失,同时伴随支持细胞的减少;(3)血管纹基底膜增厚、钙化、变性导致弹性减退引起能量传导减少且ATP产生不足;(4)听觉中枢相对应的核团细胞萎缩,减少及神经纤维变性。银杏叶提取物对耳鸣和耳聋的药理作用主要包括:(1)降低血液黏稠度,增加内耳血流,改善耳蜗血流变情况,降低毛细胞损伤程度,从而保护内耳毛细胞,改善听力[24];(2)具有抗氧化作用,清除过多自由基,保护细胞膜,从而保护线粒体功能[25];(3)具有增加缺血组织对氧气和葡萄糖的供应量,促进其对氧的利用率[26]。本实验结果提示,实验组大鼠蜗神经核、内耳组织mtDNA4834b缺失率较对照组降低(P<0.05),表明银杏叶提取物能够显著减低mtDNA4834bp缺失率,且实验组比对照组ABR听阈阈值明显减小(P<0.01),表明银杏叶提取物能延缓老龄大鼠听功能下降,提示银杏叶提取物可以改善线粒体功能,延缓衰老。
综上所述,银杏叶提取物能够清除自由基,减少线粒体DNA缺失突变,保护线粒体功能,改善听力,延缓老年聋的发生发展损伤,从而达到治未病目的。因此,研究银杏叶提取物对听觉器官线粒体DNA缺失突变的影响,对老年聋的防治有重要的意义,且与治未病的理念相一致。
[1] Yamasoba T,Lin FR,Someya S,et al.Current concepts in age-related hearing loss:epidemiology and mechanistic pathways[J].Hear Res,2013,303(9):30-38.
[2] Mao Z,Zhao L,Pu L,et al.How well can centenarians hear[J].PLoS One,2013,8(6):e65565.
[3]E Fransen,N Lemkens,L Van Laer,et al.Age-related hearing impairment(ARHI):environmental risk factors and genetic prospects[J].Exp Gerontol,2003,38(4):353-359.
[4] Malik AN,Czajka A.Is mitochondrial DNA content a potential biomarker of mitochondrial dysfunction[J].Mitochondrion,2013,13(5):481-492.
[5] Sequeira A,Martin MV,Rollins B,et al.Mitochondrial mutations and polymorphisms in psychiatric disorders[J].Front Genet,2012,3:103.
[6] NM Druzhyna,GL wilson,SP Ledous.Mitochondrial DNA repair in aging and disease[J].Mech Ageing Dev,2008,129(7-8):383-390.
[7]黄维义,张英,陈蓉.银杏叶提取物抗心肌缺血再灌注损伤作用的研究[J].现代医学,2006,34(3):183-186.
[8] Kusmic C,Basta G,Lazzerini G,et al.The effect of Ginkgo biloba in isolated ischemic/reperfused rat heart:a link between vitamin E preservation and prostaglandin biosynthesis[J].J Cardiovasc Pharmacol,2004,44(3):356-362.
[9]张文高,颜廷和,李岱龙,等.银杏叶提取物对老龄大鼠的抗氧化作用研究[A].世界中医药学会联合会老年医学专业委员会.世界中联第三届中医、中西医结合老年医学学术大会论文集[C].世界中医药学会联合会老年医学专业委员会,2010:4.
[10]孔维佳,汪吉宝,钟乃川.豚鼠耳蜗电图及听觉脑干电位同步记录法的探讨[J].临床耳鼻咽喉科杂,1989,3:148-152.
[11] Massopust LC.The rat brain instereotaxic co-ordinates in anatomical record[J].Wlley-Liss,1956,124(2):10158-0012.
[12] Tengan CH,Gabbai AA,Shanske S,et al.Oxidative phosphorylation dysfunction does not increase the rate of accumulation of age-related mtDNA deletions in skeletal muscle[J].Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis,1997,379(1):1-11.
[13]EA Schon,R Rizzuto,CT Moraes,et al.A direct repeat is a hotspot for large-scale deletion of human mitochondrial DNA[J].Science,1989,244(4902):346-349.
[14] Chen B,Zhong Y,Peng W,et al.Age-related changes in the central auditory system:comparison of D-galactoseinduced aging rats and naturally aging rats[J].Brain Res,2010,1344(1344):43-53.
[15]Grossmanll,Shoubridge EA.Mitochondrial geneties and human disease[J].Bioessay,1996,18(12):983-991.
[16]Bai U,Seidman MD.A specific mitochondrial DNA deletion(mtDNA4977)is identified in a pedigree of a family with hearing loss[J].Hear Res,2001,154(1-2):73-80.
[17]戴朴,姜泗长,顾瑞,等.内耳缺血及线粒体DNA缺失与老年性耳聋发病的关系[J].中华医学杂志,2000,80(12):16-19.
[18]刘红.毛干中线粒体DNA 4977bp缺失突变与老年性聋功能损害程度的关系[D].山东大学,2014.
[19]刘俊,孔维佳,刘贞荣.线粒体DNA大片段缺失与老年性聋的关系[J].临床耳鼻咽喉科杂志,2003,17(11):678-680.
[20]Chen JH,Hales C,Ozanne SE.DNA damage,cellular senescence and organismal ageing:causal or correlative[J].Nucleic Acids Res,2007,35(22):7417-7428.
[21]Otova B,Kalvach Z,Snejdrlova M.Biological mechanisms of aging[J].Cas Lek Cesk,2006,145(9):688-694.
[22]覃红斌.银杏叶提取物对老年大鼠的抗衰老研究[J].湖北民族学院学报(医学版),2007,04:13-14.
[23] Willott JF,Hnath Chisolm T,Lister JJ.Modulation of presbycusis:current status and future directions[J].Audiol Neurootol,2001,6:231-249.
[24]T Yoshitake,S Yoshitake,J Kehr.The Ginkgo biloba extract EGb 761 and its main constituent flavonoids and ginkgolides increase extracellular dopamine levels in the rat prefrontal cortex[J].British Journal of Pharmacology,2010,159(3):659-668.
[25]彭华.3,3-亚氨基二丙腈的豚鼠耳蜗毒性及金纳多对3,3-亚氨基二丙腈致耳蜗毒性作用的实验研究[D].第一军医大学,2002.
[26] Tziridis K,Korn S,Ahlf S.Protective effects of Ginkgo biloba extract EGb 761 against noise trauma-induced hearing loss and tinnitus development[J].Neural Plast,2014,2014(2):427298.
Effect of Ginkgo Biloba Extract on Mitochondrial DNA4834bp Deletion in the Inner Ear and Cochlear Nucleus of the Brain of Rats
HUANG Hailin1,LIU Jun2
1 Department of Ear-Nose-Throat,Jinhua Central Hospital,Jinhua(321000),China;2 Department of Ear-Nose-Throat,Zhejiang Chinese Medical Hospital,Hangzhou(310000),China.
ObjectiveTo investigate the effect of Ginkgo Biloba(EGB761) extract on mitochondrial DNA4834bp deletion in inner ear tissue and cochlear nucleus of the brain.MethodsTwenty SD rats at 24 months of age were randomly divided into two group:experimental group(EGB761 group,n=10),which were
gastric infusion of EGB761 at the concentration of 100mg(/kg·d)for 12 weeks and control group(saline group,n=10),which were infused the same volume saline.All rats were sacrificed at the end of treatment.Auditory brainstem response(ABR) was detected before and after the treatment.The deletion of mitochondrial DNA4834bp in the inner ear and cochlear nucleus of the brain was respectively identified by real-time PCR and its relationship with the ABR threshold shift was observedResultsA significant difference in ABR threshold shift was found between the experimental groupand control group (3.91±3.73dB peSPL vs 9.64±2.59dB peSPL,P<0.05).The mitochondrial DNA 4834bp common deletion mutation in cochlear nucleus and the inner ear of experimental group was both lower than those in the control group(0.2466±0.1335 vs 1.0461±0.3432;0.3507±0.158 vs 1.0202±0.2269;P<0.05).ConclusionEGB761 can inhibit the increaseof mitochondrial DNA deletion in the inner ear and cochlear nucleus of the brain to retard presbycusis in the aged rats by protecting mitochondrial DNA from oxidative damage.
rats;presbycusis;EGB761;oxidative damage;mitochondrial DNA4834bp;inner ear;cochlear nucleus
浙江省中医药科技计划项目(No.2009CB017);浙江省医药卫生科技计划项目(No.2009B120)
1浙江省金华市中心医院耳鼻喉科(金华 321000);2浙江省中医院耳鼻喉科(杭州310000)
刘俊,E-mail:liujunmn18@sina.com
(收稿:2017-03-09 修回:2017-04-26)
老年性耳聋(presbycusis)是指随着年龄的增长,双耳逐渐出现的感音神经性耳聋,主要是以高频听力下降为主的听力损失,又称为年龄相关性听力损失(age-related hearing loss,AHL)[1]。随着人口老龄化,老年性聋已成为当今世界共同面临的问题,是成人听力障碍的最常见原因。据资料统计,美国70岁以上的老年人中60%伴有听力障碍,而超过80岁老人中听力障碍达到80%以上[2],这使老年人的生活质量明显下降,因此,对老年聋的防治工作具有重要意义。大多数学者认为老年聋的发生机制主要包括遗传因素和环境因素[3],但具体病因迄今尚未阐明。线粒体(mt)作为细胞的能量工厂,在产生能量同时可产生活性氧自由基(reactive oxygen species,ROS)[4]。大量的ROS堆积使mtDNA受到氧化损害,发生大片段缺失突变,最终导致内耳ATP产生不足,线粒体功能紊乱,造成不可逆听力损失[5]。虽然生物体衰老过程无法避免,但我们可以通过干预措施减少ROS对线粒体的氧化损伤,从而减少和预防DNA突变的发生,延缓衰老[6]。研究[7]表明,银杏叶提取物具有多种生理活性,其中主要成分银杏内酯类具有拮抗血小板活化因子(PAF)、改善血流动力学与血液流变学作用;而银杏黄酮主要作用是直接捕捉和清除超氧阴离子、氧自由基等活性氧,阻断和终止自由基连锁反应链,发挥抗脂质过氧化,并能抑制自由基的产生[8]。研究[9]表明,银杏叶提取物(EGb761)能减少老龄大鼠内耳血管纹损伤,保护听力,延长衰老进程。本实验观察银杏叶提取物对老年大鼠线粒体DNA缺失突变的影响及作用机制。
