类泛素蛋白FAT10对人肾上皮细胞α-烯醇酶共价修饰的初步研究
2017-10-24陈圳川冷泠季守平
陈圳川,冷泠,季守平
军事医学科学院 野战输血研究所组织工程研究室,北京 100850
类泛素蛋白FAT10对人肾上皮细胞α-烯醇酶共价修饰的初步研究
陈圳川,冷泠,季守平
军事医学科学院 野战输血研究所组织工程研究室,北京 100850
目的:构建带Flag标签的α-烯醇酶(ENO1)基因以及带Myc标签的人白细胞抗原F相关转录物10(FAT10)基因的真核表达质粒载体,鉴定ENO1和FAT10在人肾上皮细胞株HEK293中的表达,检测类泛素蛋白FAT10是否共价修饰ENO1。方法:以人宫颈癌细胞系HeLa的cDNA为模板进行PCR,得到eno1目的片段,与分别经EcoRⅤ和SalⅠ酶切的pFlag-CMV载体连接得到重组质粒pFlag-CMV-eno1并进行鉴定测序;以人脑组织cDNA文库为模板进行PCR,得到fat10目的片段,与分别经EcoRⅠ和XhoⅠ酶切的pCMV-Myc载体连接得到重组质粒pCMV-Myc-fat10并进行鉴定并测序。将重组质粒用脂质体法转染HEK293细胞,用Western印迹检测ENO1和FAT10蛋白的表达。将重组质粒共转染HEK293细胞,用免疫共沉淀检测FAT10对ENO1的修饰情况。结果:重组克隆载体内的eno1和fat10序列与GenBank报告的序列完全一致;转染HEK293细胞后,ENO1和FAT10蛋白过表达;FAT10能够共价修饰ENO1。结论:类泛素蛋白FAT10共价修饰ENO1,为肿瘤的发生、发展及迁移的研究提供了新的研究思路。
α-烯醇酶(ENO1);人白细胞抗原F相关转录物10(FAT10);真核表达;共价修饰
α-烯醇酶(α-enolase,ENO1)是由2个含433个氨基酸残基、相对分子质量约47 000的亚单位构成的二聚体[1],作为糖酵解酶在细胞质中起催化作用,催化2-磷酸-D-甘油酸在糖酵解途径中脱水成磷酸烯醇丙酮酸[2]。在细胞膜上,ENO1可作为影响细胞迁移的纤溶酶原受体[3-4]。有文献报道,α-烯醇酶在癌症转移中具有显著作用[2],在膜上表达的α-烯醇酶能促进ECM降解和癌细胞的侵袭[3,5],靶向敲除在膜表达的α-烯醇酶能够有效抑制肿瘤的转移[6]。
人白细胞抗原F相关转录物10(human leuko⁃cyte antigen F-associated transcript 10,FAT10),是相对分子质量为18 000的类泛素蛋白,可介导底物被26S蛋白酶体降解[7-8]。多项研究发现FAT10在各种癌症如胃肠癌、肝癌、胰腺导管腺癌和人神经胶质瘤中高表达[9],FAT10表达的变化可诱导与肿瘤形成相关的异常细胞生长[9-10]。这些都表明FAT10可能在癌症的发生发展中发挥重要作用[7,11-12]。最近的研究表明,FAT10基因敲除后的小鼠表现出寿命延长以及患肥胖病几率减少等现象,提示FAT10在影响衰老和慢性疾病的免疫代谢调节中发挥作用[13-14],但具体机制不甚清楚。本研究旨在探讨FAT10是否能够共价修饰ENO1,从而参与肿瘤的发生发展过程。
1 材料与方法
1.1 材料
大肠杆菌DH5α感受态菌株购于天根生物技术公司;限制性内切酶EcoRⅤ和SalⅠ、T4DNA连接酶购于NEB公司;ExTaq酶购于TaKaRa公司;PCR产物回收试剂盒购于威格拉斯公司;质粒提取试剂盒购于OmegaBiotek公司;Myc标签抗体和Flag标签抗体购于CST公司。
1.2 pFlag-CMV-eno1标签载体的构建
根据GenBank数据库提供的ENO1氨基酸序列,分别在上、下游引物中引入EcoRⅤ和SalⅠ酶切位点。上游引物为5'-CGGATATCTTCTTCAGG TCTGGGAAGTATG-3',下游引物为5'-CCGGTCG ACGGTTGCAGGACTTCTCGTTC-3'。以人宫颈癌细胞系HeLa的cDNA为模板进行PCR(94℃预变性3 min;94℃ 30 s,65℃ 45 s,72℃ 1.5 min,30个循环;72℃延伸10 min)。PCR扩增产物行1%琼脂糖凝胶电泳,紫外灯下观察结果并拍照。用试剂盒回收扩增的目的片段,并与经EcoRⅤ和SalⅠ双酶切的pFlag-CMV载体连接,转化大肠杆菌DH5α菌株,阳性克隆经测序正确后提取质粒。
1.3 pCMV-Myc-fat10标签载体的构建
根据人类蛋白质参考数据库(human protein reference database,HPRD)提供的FAT10氨基酸序列,分别在上、下游引物中引入EcoRⅠ和XhoⅠ酶切位点。上游引物为5'-CTCTCGAGTCAATGGCT CCCAATGCTTCC-3',下游引物为5'-GGCGAATT CTCTCACCCTCCAATACAATAA-3'。以人脑组织cDNA文库为模板进行PCR(94℃预变性3 min;94℃ 30 s,65℃ 45 s,72℃ 1.5 min,35 个循环;72℃延伸10 min)。PCR 扩增产物行1%琼脂糖凝胶电泳,紫外灯下观察结果并拍照。用试剂盒回收扩增的目的片段,并与经EcoRⅠ和XhoⅠ双酶切的pCMV-Myc载体连接,转化大肠杆菌DH5α菌株,阳性克隆经测序正确后提取质粒。
1.4 细胞培养及质粒转染
将培养的HEK293细胞接种到细胞培养皿中,加入含10%胎牛血清和双抗的新鲜DMEM培养基培养24 h,细胞融合度为70%时更换新鲜无血清无双抗培养基,将质粒与脂质体按体积比1∶3混合,每个培养皿中转入质粒3 μg,6 h后换上新鲜的含10%胎牛血清和双抗的DMEM培养基,48 h后加入细胞裂解液,收集细胞,提取蛋白,SDS-PAGE分离,随后进行免疫印迹分析。
1.5 免疫共沉淀
重组载体共转染48 h后,将HEK293细胞用PBS洗涤3次,加入细胞裂解液裂解细胞,裂解产物在4℃下与目的抗体孵育4 h后离心(4℃,2500 r/min,5 min);将蛋白A/G琼脂糖加入裂解产物,于4℃进一步孵育4 h;收集和洗涤结合的蛋白质,将样品煮沸10 min,SDS-PAGE分离,随后进行免疫印迹分析。
2 结果
2.1 pFlag-CMV-eno1质粒的构建及序列检测
以人宫颈癌细胞系HeLa的cDNA为模板进行PCR,扩增产物的1%琼脂糖凝胶电泳结果见图1,扩增片段约为1305 bp,与GenBank所示的分子质量完全吻合。用试剂盒回收扩增的目的片段,并与经EcoRⅤ和SalⅠ双酶切的pFlag-CMV载体连接。对重组质粒pFlag-CMV-eno1进行序列检测,其部分测序结果见图2。

图1 eno1片段PCR产物琼脂糖电泳图

图2 重组质粒pFlag-CMV-eno1部分测序图
2.2 pCMV-Myc-fat10质粒的构建及序列检测
以人脑组织cDNA库为模板进行PCR,扩增产物的1%琼脂糖凝胶电泳结果见图3,扩增片段约为971 bp,与GenBank所示分子质量完全吻合。用试剂盒回收扩增的目的片段,并与经EcoRⅠ和XhoⅠ双酶切的pFlag-CMV载体连接。对重组质粒pCMV-Myc-fat10进行序列检测,其部分测序结果见图4。

图3 fat10片段PCR产物琼脂糖电泳图
图4 重组质粒pCMV-Myc-fat10部分测序图
2.3 目的蛋白在293细胞中的表达
将构建的质粒pFlag-CMV-eno1和pCMVMyc-fat10用脂质体法分别转入HEK293细胞,48 h后加入细胞裂解液,收集细胞,提取蛋白。Western印迹结果显示,质粒组pFlag-CMV-eno1在相对分子质量约47 000处有单一条带(图5),pCMV-Myc-fat10在相对分子质量约17 000处有单一条带(图6)。

图5 Western印迹检测重组质粒pFlag-CMV-eno1在293细胞中的表达

图6 Western印迹检测重组质粒pCMV-Myc-fat10在293细胞中的表达
2.4 FAT10能够共价修饰ENO1
将构建的质粒pFlag-CMV-eno1和pCMVMyc-fat10用脂质体法共转入HEK293细胞,48 h后加入细胞裂解液,裂解产物在4℃与Flag抗体孵育4 h后2500 r/min离心5 min,将蛋白A/G琼脂糖加入裂解产物,4℃进一步孵育4 h,收集和洗涤结合的蛋白质,将样品煮沸10 min,行SDSPAGE分离,随后进行免疫印迹分析。结果见图7,在相对分子质量约65 000处有一条带,而ENO1-FAT10共轭体大小也为65 000。提示FAT10能够共价修饰ENO1。
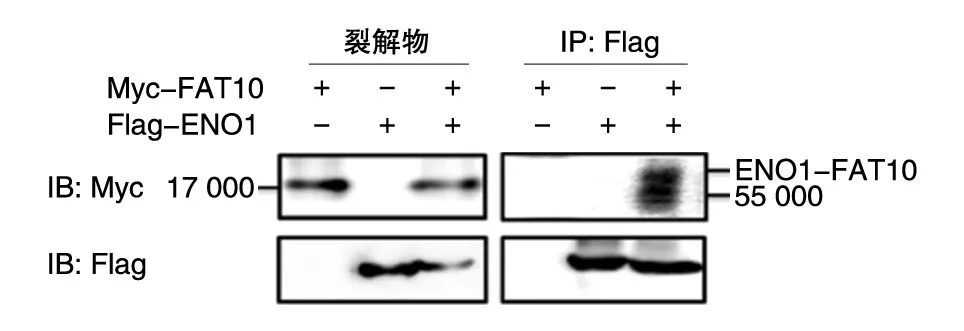
图7 免疫共沉淀检测蛋白FAT10共价修饰ENO1
3 讨论
ENO1在癌症转移中有显著作用。ENO1从细胞质转移到细胞表面结合纤溶酶原(PLG)以增强细胞周质纤维蛋白溶酶的产生和细胞运动性。在肺癌、结肠癌和急性髓细胞样白血病中,ENO1表达上调。FAT10能介导靶蛋白的降解及细胞凋亡,其表达能够被p53负调控,多项研究表明FAT10在各种癌症中高表达,并可能在癌症中发挥重要作用。我们构建了pFlag-CMV-eno1和pCMV-Myc-fat10表达质粒,并将这2种质粒共转入HEK293细胞,通过免疫沉淀发现在细胞中FAT10能够共价修饰ENO1。这提示我们FAT10可能通过共价修饰ENO1影响和调控肿瘤的发生和转移。目前,尚有许多问题待阐明,比如,类泛素蛋白FAT10共价修饰ENO1如何调控肿瘤的迁徙能力,其中是否依赖蛋白酶体水解系统;FAT10和ENO1共同参与的信号通路有哪些等等。以上具体的作用机制还不清楚,值得进行深入探究,为癌症的发生与发展提供新的研究方向。
[1]Kumari S,Malla R.New insight on the role of plas⁃minogen receptor in cancer progression[J]. Cancer Growth Metastasis,2015,8:35-42.
[2]Pancholi V.Multifunctional alpha-enolase:its role in diseases[J].Cell Mol Life Sci,2001,58(7):902-920.
[3]Diaz-Ramos A,Roig-Borrellas A,Garcia-Melero A,etal.alpha-Enolase,a multifunctionalprotein:its role on pathophysiological situations[J].J Biomed Bio⁃technol,2012,2012:156795.
[4]Ciancarelli I,De Amicis D,Di Massimo C,et al.In⁃fluence of intensive multifunctional neurorehabilitation on neuronal oxidative damage in patients with Hunting⁃ton's disease[J].Funct Neurol,2015,30(1):47-52.
[5]Butterfield D A,Lange M L.Multifunctional roles of enolase in Alzheimer's disease brain:beyond altered glucose metabolism[J].J Neurochem,2009,111(4):915-933.
[6]Seweryn E,Pietkiewicz J,Szamborska A,et al.Eno⁃lase on the surface ofprockaryotic and eukaryotic cells is a receptor for human plasminogen[J].Postepy Hig Med Dosw(Online),2007,61:672-682.
[7]Ren J,Kan A,Leong S H,et al.FAT10 plays a role in the regulation of chromosomal stability[J].J Biol Chem,2006,281(16):11413-11421.
[8]Snyder A,Alsauskas Z,Gong P,et al.FAT10:a nov⁃el mediator of Vpr-induced apoptosis in human immu⁃nodeficiency virus-associated nephropathy[J].JVirol,2009,83(22):11983-11988.
[9]Lee C G,Ren J,Cheong I S,et al.Expression of the FAT10 geneishighlyupregulated in hepatocellular carcinoma and other gastrointestinal and gynecological cancers[J].Oncogene,2003,22(17):2592-2603.
[10]Aichem A,Groettrup M.The ubiquitin-like modifier FAT10 in cancer development[J].Int J Biochem Cell Biol,2016,79:451-461.
[11]Tian H,Gao Z,Li H,et al.DNA damage response--a double-edged sword in cancer prevention and can⁃cer therapy[J].Cancer Lett,2015,358(1):8-16.
[12]Zhang D W,Jeang K T,Lee C G.p53 negatively reg⁃ulates the expression of FAT10,a gene upregulated in various cancers[J]. Oncogene, 2006,25(16):2318-2327.
[13]Canaan A,DeFuria J,Perelman E,et al.Extended lifespan and reduced adiposity in mice lacking the FAT10 gene[J].Proc Natl Acad Sci USA,2014,111(14):5313-5318.
[14]de Medina-Redondo M,Meraldi P.The spindle assem⁃bly checkpoint:clock or domino[J]? Results Probl Cell Differ,2011,53:75-91.
A Preliminary Study on the Covalent Modification of α-Enolase in Human Renal Epithelial Cells by Ubiquitin-Like Protein FAT10
CHEN Zhen-Chuan,LENG Ling,JI Shou-Ping*
Tissue Engineering Lab,Beijing Institute of Transfusion Medicine,Beijing 100850,China
Objective:Through co-express two eukaryotic plasmids carrying Flag-tagged α-enolase(ENO1) gene and Myc-tagged F-related transporter 10(FAT10) gene to detect modification of ENO1 by FAT10 in HEK293 cell lines.Methods:Theeno1target fragment was obtained by PCR from the cDNA of HeLa cells and inserted into pFlag-CMV vector,and the constructed plasmid pFlag-CMV-eno1 was identified by sequencing.Thefat10frag⁃ment was obtained by PCR from human brain tissue cDNA library as template,and cloned into pCMV-Myc vec⁃tor,and the constucted plasmid pCMV-Myc-fat10 was identified by sequencing.The two recombinant plasmids were co-transfected into HEK293 cell lines by liposome method,and Western blotting was used to detect the ex⁃pression of ENO1 and FAT10 protein,and the co-immunoprecipitation method was used to detect whether ENO1 and FAT10 proteins could interact in cells.Results:Theeno1sequence andfat10sequence in the recombinant cloning vector were identical with those reported data by GenBank.ENO1 and FAT10 proteins significantly ex⁃pressed in HEK293 cell lines,and ENO1 was covalently modified by Ubiquitin protein FAT10.Conclusion:ENO1 is covalently modified by Ubiquitin protein FAT10 in HEK293 cell lines,which is a clue to study the de⁃velopment and immigration of tumor cells.
α-enolase(ENO1);human leukocyte antigen F-associated transcript 10(FAT10);eukaryotic expres⁃sion;covalent modification
Q78
A
1009-0002(2017)05-0614-04
10.3969/j.issn.1009-
*Corresponding author,E-mail:jishouping@yahoo.com
2017-03-02
陈圳川(1992- ),男,硕士研究生,(E-mail)14789866055@163.com
季守平,(E-mail)jishouping@yahoo.com
