一株产几丁质脱乙酰酶诱变菌株的培养基配方及发酵条件优化
2017-10-24秦汪艳李永成
秦汪艳,李永成*
(海南大学 食品学院,海南 海口 570228)
一株产几丁质脱乙酰酶诱变菌株的培养基配方及发酵条件优化
秦汪艳,李永成*
(海南大学 食品学院,海南 海口 570228)
以一株海洋来源产几丁质脱乙酰酶(CDA)的丝状真菌(Penicilium janthinellum)1-5-2为出发菌株,经紫外线诱变后获得一高产CDA菌株UV-210S。通过单因素试验得出该诱变菌株的最佳培养基配方为麦芽糖1.3%,牛肉浸膏2.6%,NaH2PO40.3%,CaCl20.1%,胶体几丁质0.5%;最佳发酵工艺条件为NaCl 1.5%,初始pH值为9.0,发酵温度30℃,摇床转速180 r/min,CDA最佳收集时间为72 h。经培养基配方及发酵条件优化后该诱变菌株的最高CDA酶活为16.76 U/mL,相比优化前的酶活提高了52%。
几丁质脱乙酰酶;发酵;培养基;条件优化;酶活
几丁质(chitin)是由N-乙酰-2-氨基-2-脱氧-D-葡萄糖胺通过β-1,4糖苷键连接聚合而成的高聚物,是地球上含量丰富的可再生多糖[1-2]。主要存在于动物的甲壳和骨组织以及真菌和植物的细胞壁中,也存在于一些绿藻中;主要有支撑骨架,保护细胞的作用[3]。壳聚糖(chitosan)是几丁质脱去乙酰基后所形成的产物,壳聚糖分子因其大量游离的氨基和碱性阳离子而比几丁质具有更好的溶解性[4]和生物可降解性[5]。此外,壳聚糖还具有其他优良的性能,如抑菌性[6]、保湿性、吸附性、降低胆固醇等,在食品、医药、轻工、印染、环保和农业等领域应用广泛,具有很大的开发和推广潜力[7-9]。
目前,工业上制备壳聚糖的方法主要是浓碱热解几丁质脱除乙酰基,该法存在严重的环境污染问题,且获得的壳聚糖产品中乙酰基的脱除程度不一致,导致产品品质均一性差。酶法生产壳聚糖作为一种新型绿色环保的脱乙酰方法,反应条件温和,能耗值相对较低[10-11],可获得脱乙酰程度均一稳定的产品,因此,运用几丁质脱乙酰酶(chitin deacetylase,CDA)生产壳聚糖将是行业未来的发展方向。
目前,以海洋真菌为来源的CDA文献并不多,高产CDA的菌株报道也很少见,且海洋来源的微生物具有耐高渗透压和耐盐等优良的性能[12-13],为发酵生产CDA提供很大的便利。因此本试验以一株海洋丝状真菌为出发菌株,对紫外线诱变后获得的CDA高产菌株UV-210S进行单因素试验以获得其最佳培养基配方和最佳的产酶条件,为今后的工业化生产发酵CDA奠定基础。
1 材料与方法
1.1 材料与试剂
菌种:诱变菌株UV-210S,其出发菌株为从海口东寨港红树林土壤中筛选获得的海洋丝状真菌(Penicilium janthinellum)1-5-2,4℃于冰箱中保存。
初始发酵培养基:酵母浸膏0.5%,葡萄糖0.4%,磷酸二氢钾0.15%,胶体几丁质0.1%,NaCl 1.4%,初始pH 6.0。121℃高压蒸汽灭菌16 min。
种子培养基:酵母浸膏0.5%,葡萄糖0.25%,硫酸铵0.4%,磷酸二氢钾0.15%,NaCl 1.0%,初始pH 6.0。121℃高压蒸汽灭菌16 min。
1.2 仪器与设备
LRH-250A生化培养箱:韶关市泰宏医疗器械有限公司;HZQ-X300C摇床:上海一恒科学仪器公司;TGL-16M离心机:上海卢湘仪离心机仪器有限公司;GM-1.0A隔膜真空泵:天津市津腾实验设备有限公司;T6新世纪紫外可见分光光度计:北京普析通用有限公司。
1.3 方法
1.3.1 种子液的制备
斜面菌种在恒温培养箱中于30℃培养5~6 d,待产孢后,用5 mL 0.85%生理盐水刮下孢子,将孢子液倒入装液量为50mL/250mL的种子瓶中,180r/min摇床振荡培养36h用于发酵[14]。
1.3.2 CDA粗酶液的提取
将发酵液在低温条件下进行抽滤,滤液即为胞外酶提取液。在抽滤所得的菌丝体中加入15mL预冷的0.05mol/L磷酸盐缓冲液(pH 7.0)和少量石英砂,在低温环境中快速碾磨,浆液立即在4℃、6 000 r/min条件下离心20 min,所得上清液即为胞内酶提取液[15]。
1.3.3 几丁质脱乙酰酶酶活的测定
在具塞试管中加入1 mL 200 mg/L的对硝基乙酰苯胺溶液,3mL0.05mol/L的磷酸盐缓冲液(pH7.0),50℃水浴处理10 min后加入1 mL酶液,摇匀后于50℃酶促反应15 min,最后沸水浴10 min灭酶活终止反应,若出现浑浊现象,在6 000r/min条件下离心10min,于波长400nm处测定吸光度值。空白对照组添加1 mL灭活酶液,其余同上。几丁质脱乙酰酶酶活定义:在该反应条件下每小时产生1 μg对硝基苯胺所需要的酶量定义为1个酶活力单位(U/mL)[16]。
1.3.4 培养基配方的优化
发酵培养方法:种子液按2%的接种量接种于装液量为50 mL/250 mL发酵瓶中,30℃、180 r/min摇床振荡培养72 h,测定其CDA酶活及菌丝体干质量。
碳源的确定:将碳源的种类设定为葡萄糖、麦芽糖、乳糖、淀粉、蔗糖。选取最佳碳源,将其添加量设定为0.1%、0.5%、0.9%、1.3%、1.7%、2.1%,考察碳源对菌株发酵产CDA的影响。
氮源的确定:氮源的种类设定为酵母浸膏、牛肉浸膏、蛋白胨、草酸铵、硫酸铵。选取最佳氮源,将其添加量设定为0.2%、0.8%、1.4%、2.0%、2.6%、3.2%,考察氮源对菌株发酵产CDA的影响。
无机盐的确定:将发酵液中的无机盐调整为MgSO4、CuSO4、CaCl2、NaH2PO4、KH2PO4、MnSO4、ZnSO4、BaCl2、FeCl3,考察无机盐对菌株发酵产CDA的影响。
胶体几丁质的确定:发酵液中胶体几丁质的添加量为0、0.2%、0.5%、0.8%、1.1%、1.4%,考察胶体几丁质添加量对发酵产CDA的影响。
渗透压的确定:根据NaCl的加入量来调节渗透压的大小,NaCl的加入量设定为0.1%、0.8%、1.5%、2.2%、2.9%、3.6%,考察渗透压对发酵产CDA的影响。
1.3.5 发酵条件的优化
pH的确定:灭菌前将发酵液中的pH调整为5、6、7、8、9,考察pH对发酵产CDA的影响。
发酵温度的确定:振荡培养温度设定为26℃、28℃、30℃、32℃、34℃、36℃,考察发酵温度对发酵产CDA的影响。
摇床转速的确定:摇床转速分别设定为100 r/min、120 r/min、140 r/min、160 r/min、180 r/min、200 r/min,考察摇床转速对发酵产CDA的影响。
2 结果与分析
2.1 胞外CDA与胞内CDA的对比
分别测定胞外及胞内CDA酶活,结果见表1。由表1可以看出,胞外CDA酶活在发酵过程中始终高于胞内CDA酶活。胞内和胞外CDA酶活均在72 h时达到最高,分别为2.5 U/mL和11.05 U/mL,故酶的最佳收集时间为72 h。胞外CDA酶活显著高于胞内CDA酶活,故以下试验酶的研究以胞外CDA酶活计。

表1 诱变菌株胞外CDA与胞内CDA酶活比较Table 1 Comparison of activity of extracellular CDA and intracellular CDA from the mutant strains
2.2 发酵培养基对菌生长与CDA合成的影响
2.2.1 碳源的影响
微生物对碳源的利用具有选择性[17],试验采用5种碳源,探讨其对CDA酶活的影响,结果见图1(a)。由图1(a)可知,以麦芽糖为碳源时,胞外CDA酶活最高,为7.41 U/mL,淀粉次之,为6.5 U/mL,葡萄糖作为碳源时酶活最低。因此,以麦芽糖为碳源,进行麦芽糖添加量对该诱变菌株产CDA酶影响的考察。
麦芽糖的添加量对CDA酶活的影响如图1(b)所示。由图1(b)可知,麦芽糖添加量在0.1%~1.3%范围内,CDA酶活随麦芽糖浓度的增加而稳步上升,在麦芽糖添加量为1.3%时,CDA酶活达到最高,为7.41 U/mL,麦芽糖添加量>1.3%后,CDA酶活呈逐渐下降趋势。分析其原因主要是当麦芽糖浓度较低时导致碳源匮乏,生物量处在较低的水平,对CDA的合成造成一定的影响;过高的麦芽糖浓度对CDA的合成造成一定的碳源阻遏作用,使酶活下降[18]。因此,最适麦芽糖添加量为1.3%。
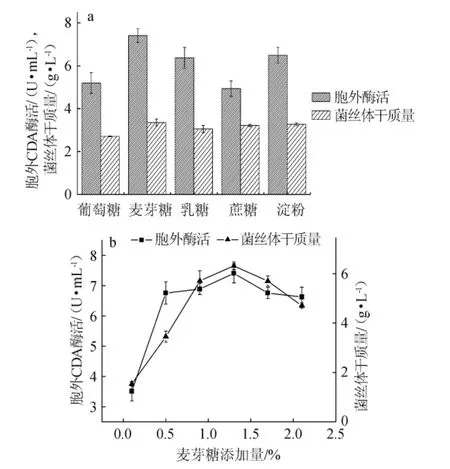
图1 碳源种类(a)与麦芽糖添加量(b)对诱变菌株CDA酶活和生物量的影响Fig.1 Effects of kinds of carbon source(a)and maltose addition(b)on the activity of CDA and biomass of the mutant strain
2.2.2 氮源的影响

图2 氮源种类(a)与牛肉浸膏添加量(b)对诱变菌株CDA酶活和生物量的影响Fig.2 Effects of kinds of nitrogen source(a)and beef extract addition(b)on the activity of CDA and biomass of the mutant strain
不同氮源种类对CDA酶活的影响,结果见图2(a)。由图2(a)可知,有机氮作为氮源时CDA酶活以及生物量明显高于无机氮源,可能是有机氮源中富含微生物生命活动所需的生长因子和微量元素,在生长过程中更易被微生物吸收利用或对CDA酶本身具有激活作用[19]。对比牛肉浸膏与酵母浸膏的CDA酶活和生物量的关系,发现生物量并不是影响酶活大小的唯一因素[20]。以牛肉浸膏作为氮源时,CDA酶活显著高于其他氮源,为7.15 U/mL,因此以牛肉浸膏为氮源,对牛肉浸膏最佳的添加量进行探讨。
氮源的添加量对CDA酶活的影响如图2(b)所示。由图2(b)可知,以牛肉浸膏为氮源时,在添加量0.1%~2.6%范围内,菌体对氮源的需求较大,随着牛肉浸膏添加量在0.2%~2.6%范围内的上升,CDA酶活以及微生物的生物量也随之上升,并在牛肉浸膏添加量为2.6%时CDA酶活达到最高,为15.85U/mL,牛肉浸膏添加量>2.6%后,高浓度的氮源不利于菌体的生长和代谢产物的积累,对产CDA酶水平有一定抑制作用,酶活降低。因此,最适牛肉浸膏添加量为2.6%。
2.2.3 无机盐的影响
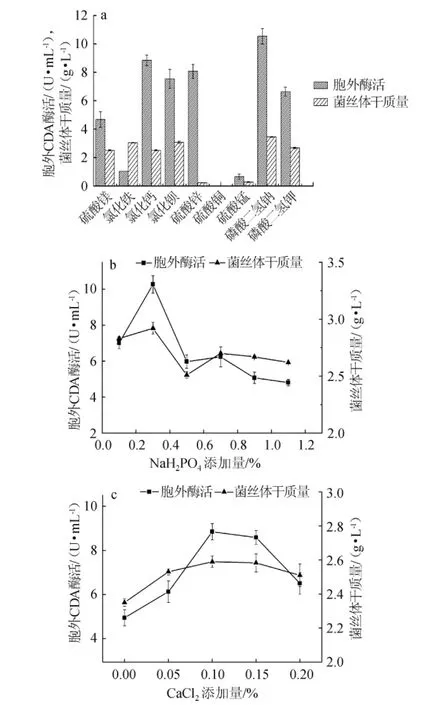
图3 金属离子种类(a)、NaH2PO4(b)和CaCl2(c)添加量对诱变菌株CDA酶活和生物量的影响Fig.3 Effects of kinds of metal ions(a),NaH2PO4addition(b)and CaCl2 addition(c)on the activity of CDA and biomass of the mutant strain
不同种类的金属离子对CDA酶活的影响,结果见图3(a)。由图3(a)可知,不同种类的金属离子对CDA酶的产生有不同的影响;Ca2+、Ba2+、Zn2+、Na+对产CDA均有促进作用,可能是这些金属离子对CDA酶的产生具有一定的激活作用或作为酶的组成部分对维持CDA酶的活性结构具有重要意义。Mg2+对CDA酶的促进作用不明显。Fe3+、Cu2+、Mn2+对产CDA酶有明显的抑制作用,具体的抑制机理善不明确。有报道称可能是CDA酶与某些金属离子螯合形成的底物对CDA酶活会造成较大的影响,使酶活降低[21]。当金属盐的加入量为11mmol/L时,NaH2PO4对菌株产CDA酶的影响最大,为10.53 U/mL,CaCl2次之,为8.84 U/mL。因此以NaH2PO4、CaCl2为无机盐,分别探讨其最佳的添加量。
NaH2PO4的添加量对CDA酶活的影响,结果见图3(b)。由图3(b)可知,当发酵液中NaH2PO4的加入量为0.3%,CDA酶活最高,为10.27 U/mL。分析其原因主要是NaH2PO4提供微生物生长所必需的Na+和磷元素外,还能调节发酵液的pH,使之稳定在一定的范围内。因此,选择NaH2PO4的最适添加量为0.3%。
CaCl2的添加量对CDA酶活的影响,结果见图3(c)。由图3(c)可知,添加量为0~0.1%时,CDA酶活随CaCl2添加量升高而稳步上升,并在CaCl2添加量为0.1%时CDA酶活达到最高,为8.84U/mL。CaCl2的添加量>0.1%后,CDA酶活开始下降,说明Ca2+对CDA酶的产生具有双重调节作用。因此选择CaCl2的最适添加量为0.1%。
2.2.4 胶体几丁质添加量的影响
胶体几丁质的添加量对CDA酶活的影响,结果见图4。由图4可知,未添加胶体几丁质时,CDA酶活处于较低水平,添加胶体几丁质后酶活骤然上升,说明几丁质作为CDA酶的作用底物对CDA的合成具有诱导作用;当发酵液中胶体几丁质的添加量为0.5%时,CDA酶活达到最高,为6.89U/mL,胶体几丁质的添加量>0.5%后,CDA酶活呈下降趋势。因此胶体几丁质的最适添加量为0.5%。

图4 胶体几丁质的添加量对诱变菌株CDA酶活和生物量的影响Fig.4 Effect of colloidal chitin addition on the activity of CDA and biomass of the mutant strain
2.3 培养条件对菌生长与CDA合成的影响
2.3.1 渗透压的影响
根据NaCl的添加量来调节培养基的渗透压。不同NaCl的添加量对CDA酶活的影响,结果见图5。由图5可知,NaCl添加量为1.5%时,CDA酶活最高,为5.46 U/mL。当NaCl添加量>1.5%后,生物量的变化趋势不显著,而CDA酶活呈现微弱的下降趋势。分析其原因可能是诱变体菌株的原始出发菌株是从海边红树林筛选获得,有较好的耐盐性,渗透压调节能力较强。因此NaCl最适添加量为1.5%。

图5 NaCl添加量对诱变菌株CDA酶活和生物量的影响Fig.5 Effect of NaCl addition on the activity of CDA and biomass of the mutant strain
2.3.2 发酵液初始pH的影响
不同的发酵液初始pH对CDA酶活的影响,结果见图6。由图6可知,发酵液初始pH对CDA酶活及生物量均有较大影响。pH为9时,CDA酶活最高,为14.55 U/mL。pH在5~6时,酶活与生物量呈上升趋势,pH在7~9内,生物量随pH上升而下降,而CDA酶活呈上升趋势。分析其原因主要是该诱变菌株属于真菌类,偏酸性的环境促进其生长,而在发酵过程中,该诱变真菌产生大量的酸性物质,被碱性发酵液中和后,更适于CDA的产生。
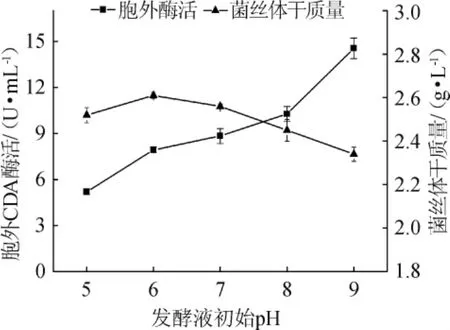
图6 初始pH对诱变菌株CDA酶活和生物量的影响Fig.6 Effect of initial pH on the activity of CDA and biomass of the mutant strain
2.3.3 发酵温度的影响
不同发酵温度对CDA酶活的影响,结果见图7。由图7可知,诱变菌株的最佳产酶温度为30℃,此时胞外CDA酶活为7.02 U/mL,因此可将后续的发酵温度设定在30℃。
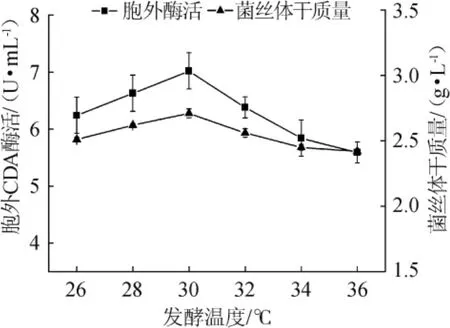
图7 发酵温度对诱变菌株CDA酶活和生物量的影响Fig.7 Effect of fermentation temperature on the activity of CDA and biomass of the mutant strain
2.3.4 摇床转速的影响
不同摇床转速对CDA酶活的影响,结果见图8。由图8可知,当转速为100 r/min时,菌体的生长以及CDA酶活均处于较低的水平。该丝状真菌为好氧性真菌,转速过低,发酵瓶内的溶氧量不足导致菌丝体代谢异常而影响酶的产量。随着摇床转速上升至180r/min,酶活及生物量有所增长,摇床转速>180r/min之后,CDA酶活以及生物量有所下降。因此,将后续的发酵摇床转速设定为180 r/min。
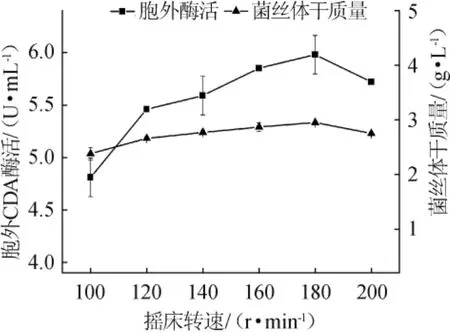
图8 摇床转速对诱变菌株CDA酶活和生物量的影响Fig.8 Effect of shaker rotate speed on the activity of CDA and biomass of the mutant strain
3 结论
本试验通过单因素法对诱变菌株UV-210S产CDA的培养基配方和发酵条件进行了优化,得出产CDA最佳培养基配方为麦芽糖1.3%,牛肉浸膏2.6%,NaH2PO40.3%,CaCl20.1%,胶体几丁质0.5%;最佳的发酵培养条件为NaCl 1.5%,初始pH 9,发酵温度30℃,摇床转速180 r/min,CDA收集时间72 h。经发酵优化后该诱变菌株的最高CDA酶活为16.76 U/mL,相比优化前的酶活提高了52%。
目前,生物法降解几丁质制备壳聚糖的方法仍处于实验室阶段,还无法大批量的投入工业化生产。就本试验优化后的结果来看,CDA的产率远达不到工业生产的水平,仍需要进行深入的探讨来改善其产酶特性,提高CDA的产率和增强CDA的稳定性。
[1]姚 磊.甘蓝夜蛾中两种不同类型几丁质脱乙酰基酶基因的克隆与表达研究[D].哈尔滨:东北农业大学,2011.
[2]HIRANO T,SUGIYAMA K,SAKAKI Y,et al.Structure-based analysis of domain function of chitin oligosaccharide deacetylase fromVibrio parahaemolyticus[J].Feb Lett,2015,589(1):145-151.
[3]HOANG K C,LAI T H,LIN C S,et al.The chitinolytic activities of Streptomycessp.TH-11[J].Int J Mol Sci,2010,12(1):56-68.
[4]熊 晶.产几丁质酶菌株的筛选与鉴定及几丁质酶酶学性质研究[D].长沙:中南大学,2009.
[5]LEE M,CHEN B Y,DEN W.Chitosan as a natural polymer for heterogeneous catalysts support:A short review on its applications[J].Appl Sci,2015,5(4):1272-1283.
[6]吴清平,陈 威,张菊梅,等.壳聚糖衍生物抗菌活性研究进展[J].食品科学,2009,30(5):269-272.
[7]谢 宇.壳聚糖及其衍生物制备与应用[M].北京:中国水利水电出版社,2010:1-3.
[8]KAUR S,DHILLON G S.The versatile biopolymer chitosan:potential sources,evaluation of extraction methods and applications[J].Crit Rev Microbiol,2014,40(2):155-175.
[9]王美娜,李苑新,蔡 兴.羧甲基壳聚糖的性能及应用概况[J].中国实验方剂学杂志,2015,21(1):228-232.
[10]闵 婷,倪孟祥.几丁质脱乙酰酶(CDA)的研究进展[J].药物生物技术,2011,18(1):89-94.
[11]YOUNES I,GHORBEL-BELLAAJ O,NASRI R,et al.Chitin and chitosan preparation from shrimp shells using optimized enzymatic deproteinization[J].Process Biochem,2012,47(12):2032-2039.
[12]付 星,闫巧娟,江正强,等.高产几丁质酶巴伦葛兹类芽孢杆菌的筛选和发酵条件优化[J].微生物学通报,2015,42(4):625-633.
[13]DEBASHISH G,MALAY S,BARINDRA S,et al.Marine enzymes[J].Adv Biochem Eng Biotechnol,2005,96(96):189-218.
[14]屠 洁,刘冠卉,徐桂娥,等.紫外诱变选育壳聚糖酶高产菌株的初步研究[J].中国酿造,2010,29(11):106-109.
[15]PAREEK N,VIVEKANAND V,SAROJ S,et al.Purification and characterization of chitin deacetylase fromPenicillium oxalicumSAEM-51[J].Carbohyd Polym,2012,87(2):1091-1097.
[16]王 超,杜 冰,谢蓝华,等.表面活性剂辅助酶法提取黄芪黄酮的工艺优化[J].食品工业科技,2014,35(23):227-231.
[17]祖国仁,辛雪娇,陈 莉,等.海洋细菌胞外多糖高产菌株的复合诱变选育及培养条件研究[J].中国酿造,2009,28(10):55-58.
[18]岳洪霞.Rhodococcussp.Y104产几丁质脱乙酰酶的分离纯化[D].济南:山东轻工业学院,2010.
[19]张菁菁.几丁质脱乙酰酶菌株的选育[D].西安:陕西科技大学,2012.
[20]刘丽萍.几丁质脱乙酰酶产生菌的筛选[D].泰安:山东农业大学,2007.
[21]任文彬,蒋桂芳,张世清,等.发酵条件对拟青霉E7菌株产脱乙酰几丁质酶的影响[J].农业环境科学学报,2006,25(3):812-816.
Optimization of medium formulas and fermentation conditions of a chitin deacetylase-producing mutant strain
QIN Wangyan,LI Yongcheng*
(College of Food Science and Technology,Hainan University,Haikou 570228,China)
Using a chitin deacetylase(CDA)-producingPenicilium janthinellum1-5-2 from ocean as original strain,strain UV-210S with high CDA-producing was obtained after ultraviolet mutation.By single factor experiments,the optimum medium formulas of strain UV-210S was maltose 1.3%,beef extract 2.6%,NaH2PO40.3%,CaCl20.1%and colloidal chitin 0.5%.The optimum fermentation conditions were NaCl 1.5%,initial pH 9.0,fermentation temperature 30℃,shaker oscillation rate 180 r/min,CDA optimum collection time 72 h.Under the optimum medium formulas and fermentation conditions,the highest CDA activity produced by the mutant strain was 16.76 U/ml,which was 52%higher than that of before optimization.
chitin deacetylase;fermentation;medium;conditions optimization;enzyme activity
TS201.3
0254-5071(2017)09-0050-05
10.11882/j.issn.0254-5071.2017.09.011
2017-07-06
海南省自然科学基金项目(20163065)
秦汪艳(1991-)女,硕士研究生,研究方向为发酵工程。
*通讯作者:李永成(1964-)男,教授,博士,研究方向为微生物发酵。
