免疫衰老在艾滋病发病中的作用及治疗策略研究进展①
2017-10-24郑宏毅郑永唐
郑宏毅 郑永唐
(中国科学院昆明动物研究所,昆明 650223)
免疫衰老在艾滋病发病中的作用及治疗策略研究进展①
郑宏毅 郑永唐
(中国科学院昆明动物研究所,昆明 650223)
由于HIV感染引起的病理特征同免疫系统的衰老之间具有众多相似性,近年来免疫衰老(Immunosenescence)成为了HIV研究领域的前沿。一方面免疫系统的衰老会减弱免疫反应和免疫监视能力,造成机体对感染性疾病更加敏感和丧失疫苗响应能力[1,2]。另一方面HIV持续复制及其引发的慢性免疫活化(Immune activation)与炎症(Inflamm-ation)又会进一步加速免疫衰老,即使长期的抗逆转录病毒治疗也难以遏制这一过程,最终增加感染者罹患老年病和发展为艾滋病的风险[3]。因此,研究免疫衰老可能将成为探索艾滋病发病机制和治疗方案的关键。
1 免疫衰老
衰老过程中免疫系统的各类细胞在表型和功能上均产生了不同程度的变化,引起老年人对多种疾病愈加敏感,这一过程称之为免疫衰老。早在1969年就首次由Roy Walford博士提出这一概念[4,5]。近年来的研究表明,免疫衰老并非单一的功能衰退,而是一种重塑(Remolding)过程,即一些功能减弱甚至丧失,然而另一些却维持不变甚至增强。例如衰老引起的胸腺萎缩、初始(Naive) T细胞进行性减少和体液免疫反应能力减弱体现出了免疫系统功能的衰退,然而多种天然免疫组分的功能没有发生明显变化,反而Ⅰ型细胞因子的分泌、炎性衰老(Inflammaging)和巨细胞病毒(Cytomegalovirus,CMV)特异性的记忆性T细胞寡克隆扩增得到显著加强[6,7]。但是免疫衰老并非中老年人所特有,其他应激条件也会加速免疫衰老。例如胸腺切除、病毒(CMV、HIV、HBV等)慢性感染和自身免疫性疾病等也会使年轻人呈现免疫衰老的特征[8]。
目前的技术手段还难以准确评价免疫衰老,但普遍认为衰老过程中骨髓造血干细胞输出减少和由于T祖细胞迁移到胸腺中去的细胞数量减少而引发的胸腺萎缩是造成免疫衰老的主要原因。具体表现为:(1) 外周循环中的初始T细胞数量减少;(2)终端分化的记忆性(CD28-)T细胞比例增加;(3) CD4+/CD8+比值降低;(4) T细胞受体(T cell receptor,TCR)的多样性降低,而T细胞库中CMV等慢性病毒的特异性寡克隆大量扩增;(5) 外周血B细胞数量减少;(6) B细胞受体(B cell receptor,BCR)多样性降低等[9,10]。衰老过程中天然免疫系统也发生了诸如黏膜屏障通透性增加、巨噬细胞(Macrophage)和树突状细胞(Dendritic cells,DCs)的吞噬能力减弱、NK细胞(Natural killer cells)细胞毒活性降低以及细胞因子/趋化因子分泌失调等变化,导致持续性的外来抗原暴露和弱化适应性免疫反应,但是天然免疫衰老引起的恶性病变仍然不及适应性免疫[11]。
2 免疫衰老与艾滋病
2.1HIV感染诱发免疫衰老 HIV病毒的直接感染,以及间接引发的黏膜屏障损伤、微生物易位(Microbial translocation)和免疫调控因子功能缺陷等都会引起HIV感染者的慢性免疫活化和炎症,主要表现为活化的T细胞比例增加、病毒特异和非特异性天然免疫细胞激活以及血浆炎症介质水平提高[12-14]。细胞活化是T细胞分化和增殖的主要驱动因素,诱发T细胞的复制型衰老,使T细胞表面失去CD28表达同时增加CD57表达,引起T细胞端粒缩短从而降低T细胞的增殖能力,促使T细胞向Th1型细胞分化以及分泌更多的促炎细胞因子[15,16]。因此,在免疫活化的影响下,HIV感染者常表现出典型的免疫衰老特征,例如CD4+/CD8+T细胞和初始T细胞/记忆性T细胞的比值极低、TCR库多样性减少、疫苗反应能力减弱和CD57+CD28-衰老表型T细胞的比例大量扩张等[17,18]。Kuller等[19]发现HIV感染的年轻人和老年人的一些炎症相关因子(如IL-6、D-dimer)与衰老相关疾病和死亡率风险之间存在显著的正相关性,而在健康年轻人群中却没有表现出此种相关性,表明炎症在HIV感染中起到加速衰老的作用。这种慢性炎症容易引发免疫调节细胞的功能失调以及淋巴组织解剖结构上的不可逆纤维化,加速了感染者的免疫衰老进程(图1)[20,21]。
慢性HIV感染还会引发胸腺组织纤维化,促进胸腺组织的退化和萎缩,损伤感染者的胸腺输出能力[22]。Kalayjian等[23]发现成年HIV感染者的初始CD8+T细胞比例显著降低,犹如比其实际年龄大20~30岁的老年人。此外,HIV感染者的外周CD28-CD8+T细胞比例高达65%,其端粒长度也比健康同龄人的CD28-CD8+T细胞更短,表现出严重的复制型衰老表型[24]。这些研究表明HIV感染加速了CD8+T细胞衰老,过度地消耗免疫资源,极大地损伤了CD8+T细胞所提供的免疫保护能力。
虽然抗病毒疗法能够通过减少CD28-T细胞来恢复T细胞的免疫功能和增殖能力,进而改善AIDS患者的免疫衰老程度[25]。但接受抗病毒治疗的患者仍表现出胸腺功能异常、细胞更新潜能丧失、初始CD4+和CD8+T细胞数量极低和高比例的衰老表型(CD57+) T细胞等诸多T细胞衰老特征,尤其是免疫重建不良和AIDS晚期才开始治疗的患者的免疫衰老更为严重[25,26]。此外,抗逆转录病毒治疗中的一些核苷类似物药物,如司他夫定和齐多夫定会抑制线粒体合成,造成线粒体DNA释放,提高氧化损伤风险而引起代谢异常[27]。一些核苷类似物还会抑制端粒酶,理论上会加重细胞和组织复制性衰老[28]。因此T细胞衰老和功能紊乱也见于免疫重建良好(平均CD4+T细胞数724/mm3)以及病毒受到显著抑制(<80 RNA copies/ml)的抗病毒治疗患者[17]
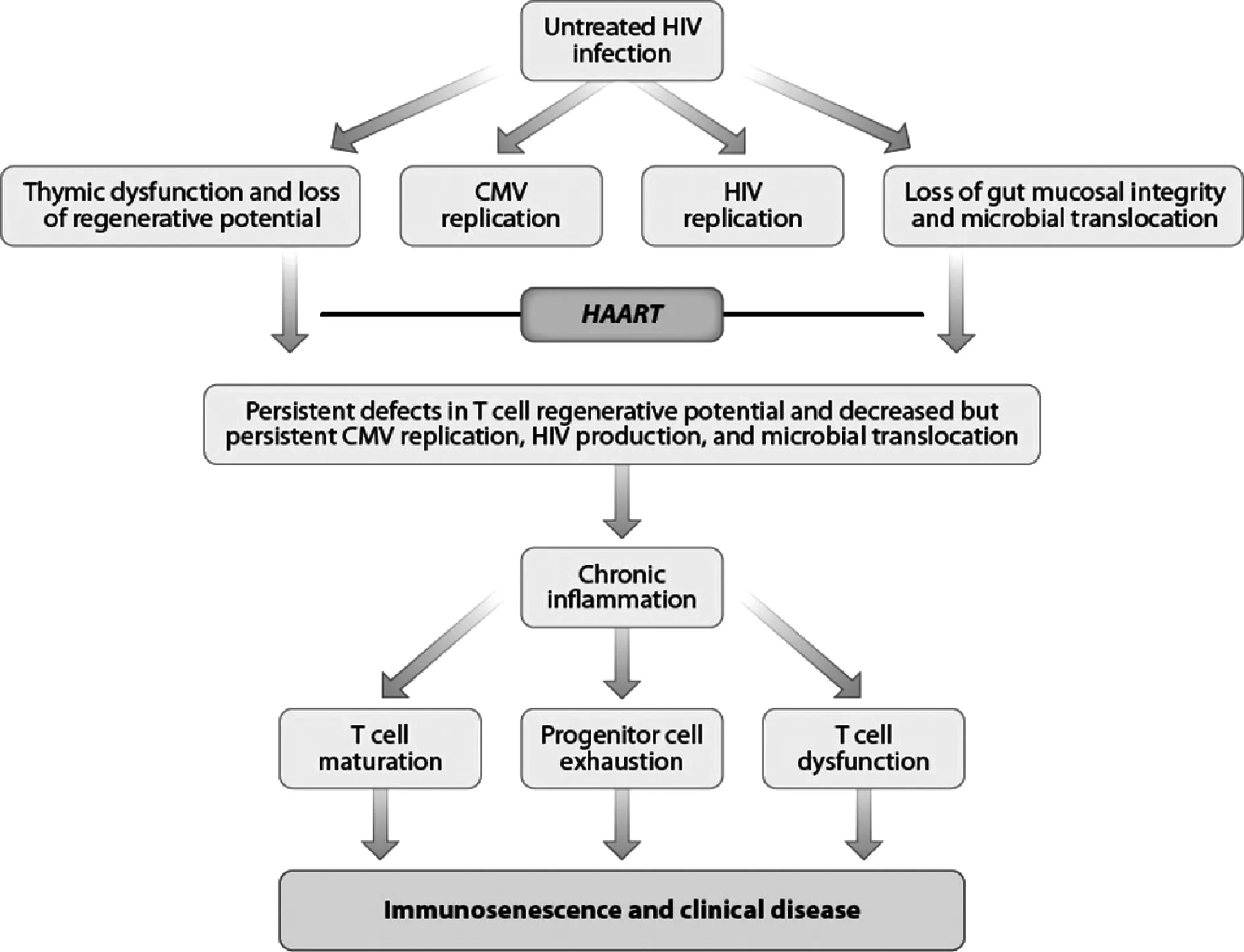
图1 HIV感染诱发免疫衰老过程的示意图[20]Fig.1 Schematic diagram showing procedure of immunosenescence induced by HIV infection[20]
2.2免疫衰老影响艾滋病进展和治疗效果 CD4+T细胞作为辅助性T细胞亚群能够协同作用于CD8+T细胞的抗病毒作用,并在HIV急性感染后对维持CD8+T细胞免疫记忆起到关键作用。CD4+T细胞的衰老会改变信号传导并损伤其对抗原刺激的响应能力、产生IL-2的能力、增殖能力和维持有效抗体反应的能力,最终削弱CD8+T细胞的抗病毒反应能力[29]。相较于5年或5年以上发展为AIDS的慢速进展者,仅在1年内发病的快速进展者的CD31+CD4+初始T细胞显著减少并且增殖活跃,CD31-CD4+初始T细胞数量也显著降低,TCR库多样性水平降低,预示这些患者存在应对新发感染的缺陷。由于CD31-CD4+T细胞对于维持初始CD4+T细胞的稳态至关重要,也是募集到记忆性细胞库的主要细胞亚群,其数量减少和抗原反应能力的丧失将导致机体对HIV和其他病原感染的免疫防卫产生缺陷,从而加速AIDS进展[30,31]。
多项研究发现AIDS患者的免疫衰老程度也影响其抗病毒治疗效果。对1 291例接受长期抗病毒治疗的HIV感染者的研究表明,治疗前免疫衰老的程度可以预示治疗2年后免疫重建的水平,即治疗前CD28-CD8+T细胞比例较低的患者的CD4+T细胞数量在治疗后恢复地更好[25]。Cao 等[32]纵向和横向地对比了AIDS快速进展者和慢速进展者,发现HIV感染造成典型的T细胞衰老特征,如T细胞表面CD28的表达水平降低、记忆性T细胞的比例增加和初始T细胞表面CD31的表达水平降低,并且这些变化预示了进一步的AIDS进展。Krik等[33]发现由于老年人的免疫衰老更为严重,在抗病毒药物控制病毒复制的情况下,老年AIDS患者CD4+T细胞的重建水平仍要差于年轻HIV感染者。
Lange等[34]的研究表明,即使HIV感染者的病毒复制受到成功抑制(病毒载量< 400 copies/ml)以及CD4+T细胞恢复到正常水平(>400 cells/mm3),其接种疫苗后的免疫响应能力与当前的治疗效果无关,反而与治疗前CD4+T细胞的数量相关,并且治疗过程中的CD28-CD4+T细胞比例独立地预示了免疫响应能力。另外HIV感染者的CD28-CD57+T细胞比例预示了颈动脉疾病和动脉粥样硬化发生风险,表明HIV诱导的T细胞衰老促进非AIDS并发症(Non-AIDS comorbidity)的发生[35]。这些研究表明无论是在治疗还是未治疗的情况下,T细胞衰老水平皆能够预示HIV感染过程中的发病率和死亡率且不依赖于其他HIV相关因子,如血浆病毒载量和CD4+T细胞数量。由于免疫衰老、免疫活化和疾病进展之间具有很强的关联性,免疫衰老的指标也常被定义为一种AIDS并发症,因此免疫衰老将会是潜在的非常重要的HIV发病预示因素[36]。
2.3针对免疫衰老的AIDS治疗药物 HAART疗法虽然无法完全恢复HIV感染者的免疫功能,但仍是目前最有效地降低免疫活化水平的治疗方案,能够一定程度上恢复初始T细胞数量。在HAART疗法的基础上配合其他药物的治疗策略旨在减少或完全抑制免疫活化和炎症以促进治疗效果,包括免疫抑制类药物(如环孢素A)、细菌产物介导效应的抑制剂(如TLR-4拮抗剂)、LPS受体或者促炎细胞因子抑制剂(如抗IL-1β抗体,抗IL-6抗体以及抗TNF-α抗体)等[37,38],这实际上与抑制免疫衰老的思路不谋而合。
由于端粒缩短在复制型衰老过程中起到关键作用,一些基于端粒酶的治疗手段正在用于针对衰老和HIV感染的免疫加强治疗研究。Dagarag等[39]将HIV特异性的CD8+T细胞稳定转入人端粒酶(hTERT)基因,加强了其增殖能力和抗病毒功能,延迟了CD28表达丧失,解决了CD8+T细胞在重复的抗原刺激下无法上调端粒酶的问题。Fauce等[40]使用小分子端粒酶激活剂TAT2处理HIV感染者的CD8+T细胞,发现能够一定程度地减缓端粒缩短,提高增殖潜能,加强细胞因子和趋化因子产生以及提高抗病毒活性。
由于初始T细胞对于老年人和HIV感染者的免疫保护起到关键作用,因此大量的临床试验旨在促进胸腺输出和T细胞重建来加强HIV感染者的免疫功能。IL-2是首次运用于AIDS患者临床试验的T细胞生长因子,但是由于毒性大而不得不停止开发[41]。使用胰岛素生长因子1(IGF1)和人生长激素(HGH)仅能够提高儿童感染者的胸腺体积,但是只能轻度地提升T细胞功能[42]。重组人IL-7(rhIL-7)是非常有希望的免疫衰老治疗手段。IL-7是一种功能强大的T细胞细胞因子,能够有效促进胸腺依赖和非依赖的T细胞重建。胸腺中的IL-7对淋巴细胞发生和存活起到关键作用,能够有效促进CD4-CD8-、CD4+和CD8+胸腺细胞的分化增殖[43]。IL-7也是维持外周T细胞免疫稳态的关键调节因子,促进初始和记忆性T细胞的稳态增殖水平[44]。最近使用rhIL-7治疗HIV感染者的Ⅰ/Ⅱa期临床试验表明,rhIL-7治疗可以显著增加患者的外周初始和中央记忆性CD4+和CD8+T细胞,以至于在停药45周后,CD4+T细胞数量仍显著高于治疗前的水平[45]。
3 免疫衰老的猕猴模型研究
由于具有体型大、寿命长和基因背景更接近于人类的特征,猕猴作为一种常用的非人灵长类实验动物,用于免疫衰老研究更有优势,尤其体现在可以进行多种组织器官的纵向和横向研究以及多种人类疾病(AIDS、结核、丙型肝炎等)的疫苗和药物研究[46,47]。
多项研究发现印度猕猴的免疫衰老和人类具有高度相似性,如衰老过程中初始T细胞进行性减少和向记忆性表型转变,尤其是向终端分化的CD28-CD8+T细胞转变[48],同时伴随胸腺退化、稳态增殖水平增加,表现为老年猕猴初始T细胞BrdU插入和Ki67表达水平上调[49]。但是印度猕猴的CD4/CD8比值在5岁以后至老年一直较稳定,这是与人类免疫衰老最为显著的不同[50]。Mascarucci等[51]使用LPS和PHA刺激印度猕猴PBMC,发现上清中IL-6的浓度表现出年龄相关的增长效应,表明老年猕猴也经历炎性衰老的过程。
我们的研究发现中国猕猴外周血T细胞和B细胞随年龄增长数量显著减少,而DCs和单核细胞数量没有表现出明显的年龄相关性[52]。此外老年中国猕猴具有典型的免疫衰老特征,如初始T细胞减少、效应记忆性CD8+T细胞比例扩张、T细胞稳态增殖水平提高、初始B细胞向记忆性表型转化和CD4/CD8比值进行性降低,更类似于人类免疫衰老,尤其是老年雄猴呈现非常严重的免疫危险表型(Immune risk profile)[53]。
虽然免疫衰老在艾滋病发病和治疗中起到重要作用,但至今仍缺乏系统性的研究,主要原因在于没有合适的动物模型。我们首次使用老年中国猕猴感染猴免疫缺陷病毒(Simian immunodeficiency virus,SIV)建立了老年AIDS动物模型,由于老年中国猕猴具有非常显著的免疫衰老特征,为研究免疫衰老和SIV感染的相互作用关系起到了关键作用。我们的研究表明,中国猕猴在SIV感染前的免疫衰老特征会加速其疾病进展,造成CD4+T细胞迅速减少,进而诱导了强烈的T细胞稳态增殖和天然免疫反应以补偿CD4+初始T细胞的耗竭;然而持续的免疫活化和缺乏有效的免疫调节机制又会最终加剧免疫衰老和疾病进展。这表明老年中国猕猴AIDS模型有利于艾滋病的免疫衰老相关研究和治疗(图2)[54]。
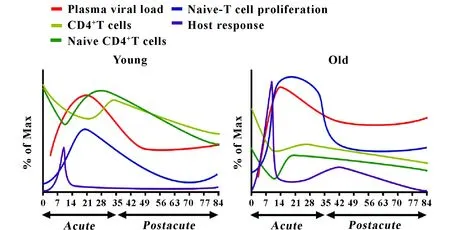
图2 不同年龄组中国猕猴的免疫衰老与SIV疾病进程动态对比[54]Fig.2 Dynamic comparisons of immunosenescence and SIV disease progression between different age groups of Chinese rhesus macaques[54]
4 问题与展望
HAART疗法成功延长了AIDS患者的预期寿命,老年患者的人数正在逐年增加,同时中老年人正在快速成长为新的HIV感染高危人群[55,56]。然而现今的治疗手段虽能够控制病毒复制和一定程度恢复免疫缺陷,HIV感染老年人仍易于快速发病、罹患非AIDS并发症和无法有效重建免疫功能[33,57]。越来越多的证据表明HIV感染者表现出免疫衰老特征,而免疫衰老是重要的长寿预示因子和老年人发病与死亡的独立预示因素[58]。由于HIV感染、非AIDS并发症和免疫衰老之间联系密切,在HIV感染诱导的、抗病毒药物引发的和自然发生的免疫衰老影响下,可以解释为何老年艾滋病患者无论在治疗还是未治疗的情况下都表现出更为严峻的病情。
考虑到我国人口迅速老龄化和中老年人群HIV感染率迅速上升的严重性,开展中老年HIV感染者的发病特征与机制研究,探索更为有效的防治手段,具有重要的现实意义。因此,研究免疫衰老在HIV感染进程中的特征和在发病机制中的作用,探索逆转免疫衰老和重建免疫功能的治疗策略,应用合适的非人灵长类动物模型进行科学研究,最终既可以促进老年艾滋病患者的治愈也有益于衰老相关研究。
[1] Falci C,Gianesin K,Sergi G,etal.Immune senescence and cancer in elderly patients:results from an exploratory study [J].Exp Gerontol,2013,48(12):1436-1442.
[2] Goronzy JJ,Weyand CM.Understanding immunosenescence to improve responses to vaccines [J].Nat Immunol,2013,14(5):428-436.
[3] Cohen J,Torres C.HIV-associated cellular senescence:a contributor to accelerated aging [J].Ageing Res Rev,2016,DOI:10.1016/j.arr.2016.12.004
[4] Walford RL.The immunologic theory of aging [J].Immunol Rev,1969,2(1):171.
[5] Meyer C,Kerns A,Haberthur K,etal.Improving immunity in the elderly:current and future lessons from nonhuman primate models [J].Age (Dordr),2012,34(5):1157-1168.
[6] Sansoni P,Vescovini R,Fagnoni F,etal.The immune system in extreme longevity [J].Exp Gerontol,2008,43(2):61-65.
[7] Tu W,Rao S.Mechanisms underlying T cell immunosenescence:aging and cytomegalovirus infection [J].Front Microbiol,2016,7:2111.
[8] Le Saux S,Weyand CM,Goronzy JJ.Mechanisms of immunos-enescence:lessons from models of accelerated immune aging [J].Ann N Y Acad Sci,2012,1247:69-82.
[9] Czesnikiewicz-Guzik M,Lee WW,Cui D,etal.T cell subset-specific susceptibility to aging [J].Clin Immunol,2008,127(1):107-118.
[10] Pinti M,Appay V,Campisi J,etal.Aging of the immune system:Focus on inflammation and vaccination [J].Eur J Immunol,2016,46(10):2286-2301.
[11] Shaw AC,Joshi S,Greenwood H,etal.Aging of the innate immune system [J].Curr Opin Immunol,2010,22(4):507-513.
[12] Pandrea I,Landay A,Wilson C,etal.Using the pathogenic and nonpathogenic nonhuman primate model for studying Non-AIDS comorbidities [J].Curr HIV/AIDS Rep,2015,12(1):54-67.
[13] Brenchley JM,Douek DC.Microbial translocation across the GI tract [J].Annu Rev Immunol,2012,30:149-173.
[14] Sandler NG,Douek DC.Microbial translocation in HIV infection:causes,consequences and treatment opportunities [J].Nat Rev Microbiol,2012,10(9):655-666.
[15] Lee SA,Sinclair E,Jain V,etal.Low proportions of CD28-CD8+T cells expressing CD57 can be reversed by early ART initiation and predict mortality in treated HIV infection [J].J Infect Dis,2014,210(3):374-382.
[16] Davalos AR,Coppe JP,Campisi J,etal.Senescent cells as a source of inflammatory factors for tumor progression [J].Cancer Metastasis Rev,2010,29(2):273-283.
[17] Desai S,Landay A.Early immune senescence in HIV disease [J].Curr HIV/AIDS Rep,2010,7(1):4-10.
[18] Ferrando-Martinez S,Ruiz-Mateos E,Romero-Sanchez MC,etal.HIV infection-related premature immunosenescence:high rates of immune exhaustion after short time of infection [J].Curr HIV Res,2011,9(5):289-294.
[19] Kuller LH,Tracy R,Belloso W,etal.Inflammatory and coagulation biomarkers and mortality in patients with HIV infection [J].PLoS Med,2008,5(10):e203.
[20] Naeger DM,Martin JN,Sinclair E,etal.Cytomegalovirus-specific T cells persist at very high levels during long-term antiretroviral treatment of HIV disease [J].PLoS One,2010,5(1):e8886.
[21] Deeks SG.HIV infection,inflammation,immunosenescence,and aging [J].Annu Rev Med,2011,62:141-155.
[22] Nunes-Alves C,Nobrega C,Behar SM,etal.Tolerance has its limits:how the thymus copes with infection [J].Trends Immunol,2013,34(10):502-510.
[23] Kalayjian RC,Landay A,Pollard RB,etal.Age-related immune dysfunction in health and in human immunodeficiency virus (HIV) disease:association of age and HIV infection with naive CD8+cell depletion,reduced expression of CD28 on CD8+cells,and reduced thymic volumes [J].J Infect Dis,2003,187(12):1924-1933.
[24] Monteiro J,Batliwalla F,Ostrer H,etal.Shortened telomeres in clonally expanded CD28-CD8+T cells imply a replicative history that is distinct from their CD28+CD8+counterparts [J].J Immunol,1996,156(10):3587-3590.
[25] Tassiopoulos K,Landay A,Collier AC,etal.CD28-negative CD4+and CD8+T cells in antiretroviral therapy-naive HIV-infected adults enrolled in adult clinical trials group studies [J].J Infect Dis,2012,205(11):1730-1738.
[26] Molina-Pinelo S,Vallejo A,Diaz L,etal.Premature immunosenescence in HIV-infected patients on highly active antiretroviral therapy with low-level CD4 T cell repopulation [J].J Antimicrob Chemother,2009,64(3):579-588.
[27] Yu F,Hao Y,Zhao H,etal.Distinct mitochondrial disturbance in CD4+T and CD8+T cells from HIV-infected patients [J].J Acquir Immune Defic Syndr,2017,74(2):206-212.
[28] Ait-Aissa K,Ebben JD,Kadlec AO,etal.Friend or foe? Telomerase as a pharmacological target in cancer and cardiovascular disease [J].Pharmacol Res,2016,111:422-433.
[29] Laidlaw BJ,Craft JE,Kaech SM.The multifaceted role of CD4(+) T cells in CD8(+) T cell memory [J].Nat Rev Immunol,2016,16(2):102-111.
[30] Chattopadhyay PK,Douek DC,Gange SJ,etal.Longitudinal assessment of de novo T cell production in relation to HIV-associated T cell homeostasis failure [J].AIDS Res Hum Retroviruses,2006,22(6):501-507.
[31] Kilpatrick RD,Rickabaugh T,Hultin LE,etal.Homeostasis of the naive CD4+T cell compartment during aging [J].J Immunol,2008,180(3):1499-1507.
[32] Cao W,Jamieson BD,Hultin LE,etal.Premature aging of T cells is associated with faster HIV-1 disease progression [J].J Acquir Immune Defic Syndr,2009,50(2):137-147.
[33] Kirk JB,Goetz MB.Human immunodeficiency virus in an aging population,a complication of success [J].J Am Geriatr Soc,2009,57(11):2129-2138.
[34] Lange CG,Lederman MM,Medvik K,etal.Nadir CD4+T-cell count and numbers of CD28+CD4+T-cells predict functional responses to immunizations in chronic HIV-1 infection [J].AIDS,2003,17(14):2015-2023.
[35] Kaplan RC,Sinclair E,Landay AL,etal.T cell activation and senescence predict subclinical carotid artery disease in HIV-infected women [J].J Infect Dis,2011,203(4):452-463.
[36] Lederman MM,Calabrese L,Funderburg NT,etal.Immunologic failure despite suppressive antiretroviral therapy is related to activation and turnover of memory CD4 cells [J].J Infect Dis,2011,204(8):1217-1226.
[37] Connolly NC,Riddler SA,Rinaldo CR.Proinflammatory cytokines in HIV disease-a review and rationale for new therapeutic approaches [J].AIDS Rev,2005,7(3):168-180.
[38] Klatt NR,Chomont N,Douek DC,etal.Immune activation and HIV persistence:implications for curative approaches to HIV infection [J].Immunol Rev,2013,254(1):326-342.
[39] Dagarag M,Evazyan T,Rao N,etal.Genetic manipulation of telomerase in HIV-specific CD8+T cells:enhanced antiviral functions accompany the increased proliferative potential and telomere length stabilization [J].J Immunol,2004,173(10):6303-6311.
[40] Fauce SR,Jamieson BD,Chin AC,etal.Telomerase-based pharmacologic enhancement of antiviral function of human CD8+T lymphocytes [J].J Immunol,2008,181(10):7400-7406.
[41] Nelson BH.IL-2,regulatory T cells,and tolerance [J].J Immunol,2004,172(7):3983-3988.
[42] Murphy WJ,Longo DL.Growth hormone as an immunomodulating therapeutic agent [J].Immunol Today,2000,21(5):211-213.
[43] Read KA,Powell MD,McDonald PW,etal.IL-2,IL-7,and IL-15:Multistage regulators of CD4(+) T helper cell differentiation [J].Exp Hematol,2016,44(9):799-808.
[44] Silva SL,Sousa AE.Establishment and maintenance of the human naive CD4+T-cell compartment [J].Front Pediatr,2016,4:119.
[45] Levy Y,Sereti I,Tambussi G,etal.Effects of recombinant human interleukin 7 on T-cell recovery and thymic output in HIV-infected patients receiving antiretroviral therapy:results of a phase I/IIa randomized,placebo-controlled,multicenter study [J].Clin Infect Dis,2012,55(2):291-300.
[46] Verdier JM,Acquatella I,Lautier C,etal.Lessons from the analysis of nonhuman primates for understanding human aging and neurodegenerative diseases [J].Front Neurosci,2015,9:64.
[47] Policicchio BB,Pandrea I,Apetrei C.Animal models for HIV cure research [J].Front Immunol,2016,7:12.
[48] Didier ES,Sugimoto C,Bowers LC,etal.Immune correlates of aging in outdoor-housed captive rhesus macaques (Macaca mulatta) [J].Immun Ageing,2012,9(1):25.
[49] Cicin-Sain L,Messaoudi I,Park B,etal.Dramatic increase in naive T cell turnover is linked to loss of naive T cells from old primates [J].Proc Natl Acad Sci U S A,2007,104(50):19960-19965.
[50] Asquith M,Haberthur K,Brown M,etal.Age-dependent changes in innate immune phenotype and function in rhesus macaques (Macaca mulatta) [J].Pathobiol Aging Age Relat Dis,2012,2:18052.
[51] Mascarucci P,Taub D,Saccani S,etal.Cytokine responses in young and old rhesus monkeys:effect of caloric restriction [J].J Interferon Cytokine Res,2002,22(5):565-571.
[52] Xia HJ,Zhang GH,Wang RR,etal.The influence of age and sex on the cell counts of peripheral blood leukocyte subpopulations in Chinese rhesus macaques [J].Cell Mol Immunol,2009,6(6):433-440.
[53] Zheng HY,Zhang MX,Pang W,etal.Aged Chinese rhesus macaques suffer severe phenotypic T-and B-cell aging accompanied with sex differences [J].Exp Gerontol,2014,55:113-119.
[54] Zheng HY,Zhang MX,Chen M,etal.Accelerated disease progression and robust innate host response in aged SIVmac239-infected Chinese rhesus macaques is associated with enhanced immunosenescence [J].Sci Rep,2017,7(1):37.
[55] Nasi M,Pinti M,De Biasi S,etal.Aging with HIV infection:a journey to the center of inflammAIDS,immunosenescence and neuroHIV [J].Immunol Lett,2014,162(1 Pt B):329-333.
[56] 李爱萍,李在村.老年HIV感染者/AIDS患者流行病学特征及诊治进展 [J].医学综述,2016,22(22):4479-4482.
[57] Bakanda C,Birungi J,Mwesigwa R,etal.Association of aging and survival in a large HIV-infected cohort on antiretroviral therapy [J].AIDS,2011,25(5):701-705.
[58] Qin L,Jing X,Qiu Z,etal.Aging of immune system:Immune signature from peripheral blood lymphocyte subsets in 1068 healthy adults [J].Aging (Albany NY),2016,8(5):848-859.
[收稿2017-02-21 修回2017-03-24]
(编辑 张晓舟)
①本文为国家自然科学基金(No.81671627;81471620)资助项目。
R392.9
A
1000-484X(2017)10-1574-05
10.3969/j.issn.1000-484X.2017.10.029
郑宏毅(1988年-),男,博士,主要从事艾滋病灵长类动物模型研究。
及指导教师:郑永唐(1962年-),男,博士,研究员,主要从事艾滋病免疫学及抗艾滋病药物药效学研究,E-mail:zhengyt@mail.kiz.ac.cn。
