miR-210调控Mex3B蛋白对肺癌细胞侵袭和增殖的影响①
2017-10-24王俊钢李聪聪毛广显
王俊钢 李聪聪 毛广显 张 洁 杨 翠
(郑州大学附属医院/南阳市中心医院胸外科,南阳 473000)
miR-210调控Mex3B蛋白对肺癌细胞侵袭和增殖的影响①
王俊钢 李聪聪②毛广显③张 洁 杨 翠
(郑州大学附属医院/南阳市中心医院胸外科,南阳 473000)
目的探讨miR-210和Mex3B蛋白对肺癌细胞侵袭和增殖能力的影响。方法运用qPCR检测miR-210在正常肺组织和癌旁组织中的表达情况;运用qPCR检测Mex3B在肺癌组织、癌旁组织中的表达;qPCR检测miR-210在不同肺癌细胞株中(A549、H1299、H1650和H358)的表达水平;双荧光素酶报告基因系统检测miR-210对Mex3B转录的影响;细胞活性实验检测miR-210的表达对肺癌细胞活性的影响;平板克隆实验检测miR-210的表达对肺癌细胞A549的增殖能力的影响;Transwell侵袭实验检测miR-210的表达对肺癌细胞株A549的侵袭能力的影响。结果和癌旁组织比较,miR-210在肺癌组织中表达明显增高,和癌旁组织比较,Mex3B在肺癌中表达较低,双荧光素酶报告基因系统检测结果显示,miR-210可以直接调控Mex3B的转录活性,抑制miR-210的表达活性后,A549肺癌细胞的细胞活性受到一定的抑制;抑制miR-210后,肺癌细胞株A549的侵袭和增殖能力明显降低。结论miR-210可以靶向调控肺癌细胞的侵袭和增殖能力。
肺癌;miR-210;Mex3B;Transwell
肺癌是全世界呼吸系统发病率最高的恶性肿瘤,也是男性死亡率最高的恶性肿瘤,小细胞肺癌(Small cell lung cancer,SCLC)和非小细胞肺癌(Non-small-cell lung cancer,NSCLC)是其中主要的分类[2]。目前肺癌的主要治疗方式包括手术,化疗、放疗,免疫治疗及生物靶向治疗等,尽管针对少部分肺癌亚型可以通过综合治疗获得一定程度上的缓解,但是大部分类型的肺癌治疗效果不佳或者缓解后容易复发,耐药现象更是层出不穷,对疾病治疗提出很多困难[3]。最近相关研究指出肺癌的复发、耐药等生物学特性与某些分子指标有相关关系[4]。尽管肺癌治疗手段不断进步,但晚期肺癌患者的预后仍然很差,因此研发非侵入性且灵敏可靠的生物分子标志物是目前亟需解决的问题。
微小RNA(miRNA)是由18~22个核苷酸组成的小RNA编码RNA[5]。已知这些小RNA分子在调节细胞增殖、分化和凋亡中起重要作用。通过结合至特异性mRNA的3′-非翻译区(3′-UTR),miRNA诱导降解或抑制靶mRNA的翻译来调节基因表达[6]。以往的研究表明,miRNAs在不同肿瘤中的表达明显不同,在肿瘤相关基因组区中发现了有50%的已知miRNAs类型[7]。研究还表明miRNA和肿瘤细胞与抗癌药物之间存在密切的相关性[8]。
MiR-210在生物体中参与广泛的生理病理过程,包括细胞增殖、迁移、凋亡、分化、DNA修复和细胞代谢等[9,10]。而且miR-210在调节抗肿瘤免疫反应过程中起到主要的调节枢纽作用,尤其miR-210可以抑制线粒体正常代谢从而对许多蛋白电子传递链的活性产生一定影响[11,12]。miR-210对肺癌等肿瘤的代谢也有一定的影响,但具体机制未有报道。
Mex3最初是在早期胚胎发生过程中发现的蛋白,其可以抑制部分蛋白翻译过程,并且在对维持生殖系统的全能性中发挥重要作用[13]。在四种人类Mex3蛋白质中,Mex3A主要在脊椎动物的胚胎发育过程中发挥作用[14]。最近,据相关报道,Mex3B可以协调下游蛋白激活Rap1信号通路,进而诱发小鼠后代的体重和外观发生明显的异常表现[15]。且有研究表明,过表达Mex3蛋白过后,结肠癌的生物学行为得到一定程度的抑制[16]。
本研究拟分析miR-210和Mex3B在肺癌中的表达情况,并进一步探讨miR-210与Mex3B的相互作用以及其在肺癌的迁移增殖过程中的作用。
1 材料与方法
1.1材料
1.1.1细胞株及相关材料 肺癌细胞株A549、H1299、H1650和H358均源自武汉大学典型培养物保藏中心。细胞培养条件:在RPMI1640培养基中加入1%青霉素/链霉素。用5%胎牛血清在5%CO2空气湿润培养箱中37℃恒温培养。兔克隆单抗MEX3B购于Abcam公司(Abcam,FLJ40270)。miR-210-inhibitor慢病毒载体购买于上海吉玛基因有限公司。SsoFast EvaGreen试剂及Lipofecta-mine2000转染试剂购于TaKaRa公司。
1.1.2临床标本采集及处理 收集2015年3月~2016年7月我院收治的80例肺癌患者,其中年龄(54.24±3.61)岁。所有患者术前无化疗或放疗,根据肺癌TNM分期标准,Ⅰ级29例、Ⅱ级26例、Ⅲ级20例、Ⅳ级5例。低分化22例、中分化29例、高分化29例。肿瘤组织离体后分两块,一块迅速投入RNA保存液中,另一块用经焦碳酸二乙酯(DEPC)处理的冷磷酸缓冲液冲洗,去除血迹,迅速投入液氮冻存。标本收集获得医院伦理委员会的批准同意,所有患者均签署知情同意书。
1.2方法
1.2.1细胞转染 取对数生长期的肺癌A549细胞,按照Lipofectamine2000转染试剂盒说明书将miR-210-inhibitor和阴性对照转染细胞。转染后qPCR检测miR-210的表达情况。转染后继续培养,完成后续实验。
1.2.2Western印迹分析 提取A549肺癌细胞蛋白检测Mex3B的表达水平。配置SDS-PAGE电泳胶,取免疫沉淀最后所得的上清,上样,每孔30 μl,电泳。用电转移装置将蛋白转至PVDF或NC膜上。电转移完毕后,使用TBST洗涤1次。将膜放入5%牛奶封闭液于室温封闭1 h,或4℃封闭过夜。用封闭液稀释目标蛋白抗体(Mex3B)1∶2 000,室温下孵育作用2 h。TBST洗膜3次,每次10 min。稀释酶标记二抗1∶500,室温下孵育作用30 min。TBST洗膜3次,每次10 min。 使用Bio-Rad系统,ECL显影剂显影,使用Image Lab 3.0(Bio-Rad)进行分析。实验重复3次。
1.2.3PCR实验步骤 qPCR法检测miR-210表达。将A549肺癌细胞接种于6孔板,接种密度为1×106L-1,培养36 h后按照Trizol说明操作提取组细胞总RNA,使用紫外分光光度计检测核酸的浓度和纯度。用在SsoFast EvaGreen试剂(Bio-Rad)中以1∶10 稀释的cDNA进行qPCR测量。 将表达数据标准化至相应的参照基因。根据ΔΔCT 法计算检测基因反应条件为:37℃ 15 min,98℃ 5min。根据PCR试剂盒说明书进行PCR反应。获得数据以RQ=2-ΔΔCT计算mRNA表达量。
1.2.4细胞活性检测实验 使用细胞计数试剂盒CCK-8(Dojindo Laboratories,Tokyo,Japan)评估细胞活力。将6×103的A549细胞种植于96孔板中,将10 μl的CCK-8溶液加入到各孔中,将细胞在培养箱中孵育2 h(37℃和5%CO2)。 使用微板读数器(Bio-Rad,CA,USA)在450 nm处测量吸光度,参考波长为630 nm。 计算出细胞活性比率。
1.2.5平板克隆形成实验检测肺癌细胞增殖能力 将A549细胞接种于6孔板,加入5 ml的无菌PBS溶液,轻轻吹散洗涤细胞沉淀并再次离心。反复洗涤3次后加入培养基,制备成单细胞悬液。测定细胞浓度并调整为1 000个/ml,将单细胞悬液均匀的种植在无菌的6孔板内,进行平板克隆形成实验。两周后观察平板克隆细胞形成情况,并拍照,计算细胞的增殖率。实验重复3次。
1.2.6细胞侵袭实验测定肺癌细胞侵袭能力 使用Transwell实验进行肺癌细胞侵袭能力测定。将总共5×104个细胞接种在无血清培养基中的上室中。底室含有10%FBS的培养基。 48 h后,棉球擦拭上室细胞,使用结晶紫染色下室细胞。观察并计数穿透Transwell膜的细胞数。实验重复3次。
1.2.7双荧光素酶报告基因实验 从人类基因组DNA产生全长miR-210-3′UTR,并通过退火合成的信号寡核苷酸产生突变体miR-210-3′UTR。将这些DNA片段克隆到ph-TK载体(肾脏荧光素酶)中,Preporter-miR-Mex3B-3′UTR代表野生型质粒载体和miR- Mex3B质粒结合共转染到293U细胞内,Preporter-miR-Mex3B-3′UTRm代表突变型质粒载体和miR-Mex3B质粒结合共转染到293U细胞内,同时使用pGL-3.0(荧光素酶)作为内参照,检测NC组和miR-210-inhibitor组293U细胞中Mex3B的荧光活性相对值。使用Lipofectamine2000TM(Invitrogen)检测转染效率在孢菌素酶活性的基础上正常化。根据制造商的说明书,使用双荧光素酶报告系统试剂盒(Promega)测量萤火虫和海肾荧光素酶活性,通过双荧光素酶检测miR-210对Mex3B 的表达活性的调控能力,明确miR-210对Mex3B荧光活性的调控情况。

2 结果
2.1qPCR检测肺癌组织和不同肺癌细胞中miR-210的表达 通过使用qPCR测定miR-210在肺癌细胞系中的表达水平。qPCR结果显示(图1):在不同肺癌细胞株中,miR-210在A549肺癌细胞株中表达相对较高,后续实验选取A549细胞株作为实验对象。上述结果表明,miR-210在肺癌中可能充当一个促癌分子的角色。
2.2Western blot检测肺癌组织Mex3B的表达及miR-210与临床病理参数间的关系 Western blot检测肺癌组织和癌旁组织中Mex3B蛋白的表达水平。结果显示(图2):相比正常肺组织,肺癌组织中Mex3B表达水平相对较低,差异具有统计学意义。上述结果表明,Mex3B在肺癌中可能扮演一个相对抑癌的作用。
miR-210的表达水平随肺癌病理分期的增加而降低;随分化程度的降低,miR-210的表达水平逐渐降低;miR-210的低表达随着淋巴结受累以及受累数目的增多而降低,差异有统计学意义;miR-210的表达水平与年龄无关。结果表明(表1):miR-210与肺癌病理分期分级以及淋巴结是否存在转移相关,而与年龄等因素无关。

图1 miR-210在不同肺癌细胞株中的表达情况Fig.1 Expression of miR-210 in lung cancer cell

图2 Mex3B在肺癌组织中的表达情况Fig.2 Expression of Mex3B in lung cancerNote: *.P<0.05.
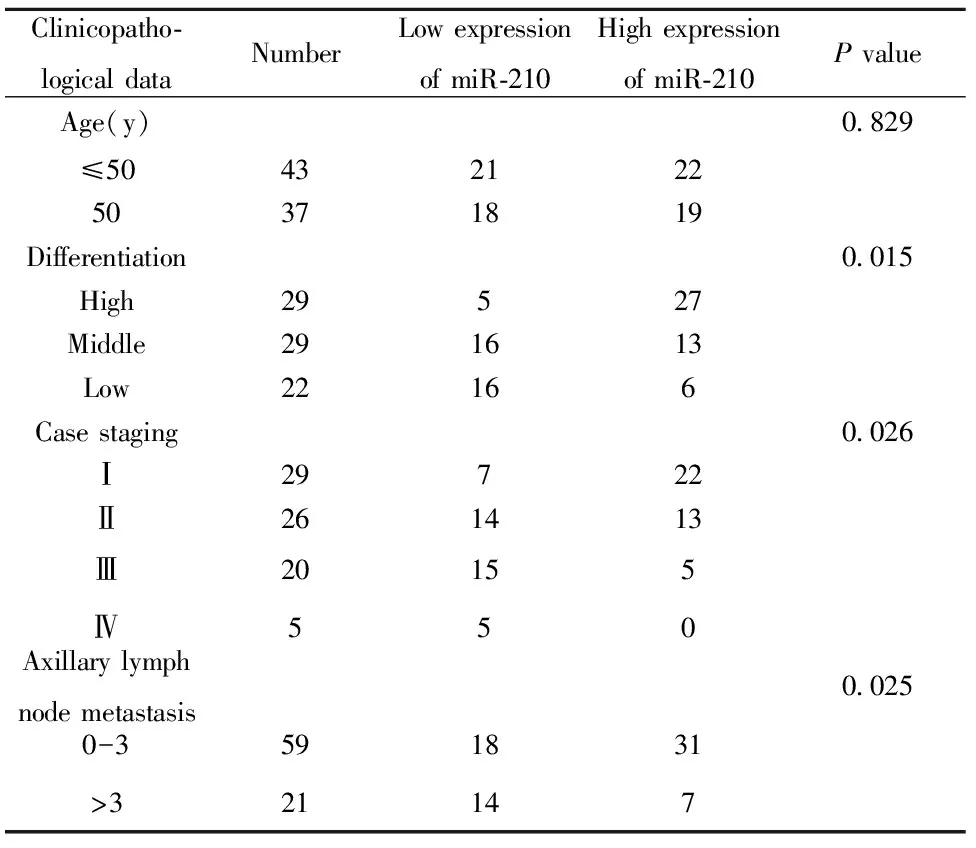
表1 miR-210表达与肺癌临床病理特征的关系

图3 双荧光素酶实验检测miR-210和Mex3B之间的关系Fig.3 Double luciferase assay to detect relationship betw-een miR-210 and Mex3BNote: A.miR-210-inhibitor inhibit the expression of miR-210;B.Double luciferase assay defect the relationship between miR-210 and Mex3B.*.P<0.05.

图4 细胞活性实验检测miR-210对A549细胞的影响Fig.4 Cell activity test were used to detect the effect of miR-210 on A549 cellsNote: *.P<0.05.
2.3双荧光素酶实验检测miR-210和Mex3B之间的关系 双荧光素酶实验检测A549细胞株中miR-210和Mex3B蛋白的表达结果显示(图3):加入miR-210-inhibitor后Mex3B的荧光活性水平出现相应上调。表明miR-210可以调控Mex3B的表达水平。Mex3B是miR-210下游的一个靶点基因,miR-210可能通过干扰Mex3B的表达水平,继而影响后续对肺癌细胞生物学行为的影响。
2.4沉默miR-210表达对肺癌细胞活性的影响 CCK-8检测沉默miR-210对肺癌细胞活性的影响。实验结果显示(图4):加入miR-21-inhibitor后细胞增殖活性受到明显的抑制。
2.5沉默miR-210表达对肺癌细胞增殖的影响Transwell侵袭实验检测miR-210对A549增殖能力的影响。使用miR-210-inhibitor转染细胞,然后将培养好的细胞进行平板克隆形成实验检测增殖能力。结果显示(图5):相比NC组,miR-210-inhibitor组的克隆形成细胞数出现相应的减少[(220.32±18.15)% vs (42.28±8.16)%,P<0.05]。表明沉默miR-210的表达后可以明显地抑制肺癌细胞的增殖能力。

图5 平板克隆形成试验检测沉默miR-210表达后A549细胞增殖能力的变化Fig.5 Proliferation of lung cancer cells were inhibited after inhibitor of miR-210Note: *.P<0.05.
2.6沉默miR-210表达对肺癌细胞侵袭的影响 Transwell侵袭实验检测miR-210的表达对A549侵袭能力的影响。使用miR-210-inhibitor转染细胞,然后将培养好的细胞进行Transwell侵袭测定。结果显示(图6):相比NC组,miR-210-inhibitor组的细胞侵袭数目相应减少[(330.32±25.82)% vs (65.37±11.34)%,P<0.05]。表明沉默miR-210的表达后可以明显抑制肺癌细胞的侵袭能力。
3 讨论
目前临床诊断肺癌的主要依据仍是病理细胞检查,只有在病理细胞学确诊肺癌后才可以临床诊断,但是根据临床症状及影像学早期诊断阳性率较低[17]。因此,寻找一种早期诊断肺癌的方法极为迫切。RNA基因组和蛋白质组指纹图能够整体定量、动态反映疾病发生过程中蛋白质的种类及其数量峰值变化规律,有助于寻找与疾病密切相关的蛋白,可以成为诊断和判断预后的生物标记物及药物治疗的靶点[18]。近年来,RNA图谱和蛋白组指纹图在临床疾病尤其是恶性肿瘤的诊断、预防及治疗方面迅猛发展。所以寻求肺癌肿瘤的早期标志物对于肺癌的临床诊断和治疗是极其重要的。
微小RNA(miRNA)可以调控基因的内源性非编码RNA,并且最近的研究已经证明它们在肿瘤的发病机理中起到关键的作用[19]。miRNA表达谱可以作为诊断、预后、个体化治疗和疾病管理的潜在生物标志物[20]。目前,血清中循环miRNA可以以明显稳定的形式被鉴定出来,许多学者报道肿瘤患者血液中循环miRNA的异常表达。但是据我们所知,目前只有少数研究发现肺癌患者的血清或血浆miRNAs存在明显异常[21]。然而,关于组织和血清血浆之间miRNA表达水平的关系仍有不同的争议,尚未能在临床检测中达成一致[22]。
miR-210是由19~23个核苷酸组成,可以参与细胞内多种功能的调节[23]。最近有研究成功地建立了低温细胞模型,通过调节miRNA的表达参与诱导细胞因子信号[24]。然而,很多研究都是集中在将肿瘤细胞作为研究模型去探讨在缺氧缺血性微环境中如何去避免过多凋亡的分子机制,没有做关于miR-210对肿瘤细胞恶性生物学行为的监测和影响。万菁[25]研究表明,miR-210可以调控因基因缺失而导致的内皮细胞功能缺损对细胞迁移和侵袭的影响,而且抑制miR-210的表达可以增强细胞对缺氧缺血的耐受能力,间接地证明了miR-210的促癌机制。值得注意的是,抑制miR-210的表达与内皮细胞的凋亡能力呈正相关。
而MiR-210也可以作为肿瘤的放射抗性标记,miR-210在许多肿瘤中广泛存在,尤其是肺癌的各个类型中,都存在miR-210的高表达状态[26]。之前研究报道miR-210可以作为小细胞肺癌的不良预后的预测因子[27]。更有学者研究发现,经过术后放射治疗的肺癌患者的miR-210的表达和DNA损伤修复之间有明显的相关性,miR-210的表达可以影响DNA的损伤修复,从而导致肺癌的远处扩散及转移,甚至影响肺癌对化疗药物耐药机制的产生[28]。
微小RNA可以参与细胞转录和基因表达的调控过程,其表达水平的缺失会影响转录平衡的稳定[29]。有研究表明,抑制miR-210的表达可以大幅度降低卵巢癌、肺癌及前列腺癌细胞在裸鼠中的成瘤率,也可以改善荷瘤小鼠的预后[30]。我们实验通过检测肺癌组织和细胞中miR-210和Mex3B表达情况,确定miR-210在肺癌中扮演一个促癌基因的作用,然后查阅相关生物学信息,运用Targetscans/PICTAR预测软件预测miR-210下游可能存在的靶基因位点,筛选出和肺癌有相关关系的靶基因。我们通过生物信息学软件查找,发现miR-210可能与Mex3B的某些保守序列相结合。因此我们推测Mex3B可能是miR-210的潜在下游靶基因,miR-210可能调控Mex3B的表达。为了进一步探讨肺癌细胞中miR-210的改变对Mex3B蛋白的影响,我们通过转染miR-210-inhibitor到肺癌细胞中,发现抑制miR-210能够有效上调Mex3B蛋白的表达。上述结果与其他肿瘤组织中Mex3B受miR-210的调控情况是相似的[31]。
通过双荧光素酶实验证实二者有相同结合位点,且miR-210可以调控Mex3B的表达。后面通过肺癌细胞的增殖和侵袭实验检测沉默miR-210后肺癌细胞的生物学行为的变化,证实miR-210可以调控肺癌细胞的生物学行为。它提供了在功能学方面的miR-210和Mex3B之间的直接作用的证据。
总之,我们的研究表明miR-551和Mex3B在肺癌发生和发展中的作用关系,更好地理解调控肺癌肿瘤发生的分子机制,可以对肺癌的临床诊疗提供一定帮助,为肺癌的临床诊治提供新的分子生物学标志物。
[1] Brahmer J,Reckamp KL,Baas P,etal.Nivolumab versus docetaxel in advanced squamous-cell non-small-cell lung cancer[J].New Eng J Med,2015,373(2):123-135.
[2] Garon EB,Rizvi NA,Hui R,etal.Pembrolizumab for the treatment of non-small-cell lung cancer[J].Eng J Med,2015,372(21):2018-2028.
[3] 陈 衍,韩 晟,刘文超.非小细胞肺癌分子靶向治疗中的循证医学和个体化治疗[J].医学与哲学:临床决策论坛版,2010,11(4):5-6.
[4] Slaby O,Svoboda M,Fabian P,etal.Altered expression of miR-21,miR-210,miR-143 and miR-145 is related to clinicopathologic features of colorectal cancer[J].Oncology,2008,72(5-6):397-402.
[5] Kasinski AL,Kelnar K,Stahlhut C,etal.A combinatorial microRNA therapeutics approach to suppressing non-small cell lung cancer[J].Oncogene,2015,34(27):3547-3555.
[6] 陈 勇,徐兴祥,陈龙邦.靶向 miRNA 的肿瘤干细胞治疗策略[J].肿瘤,2013,33(1):97-102.
[7] Liu ZL,Wang H,Liu J,etal.MicroRNA-21(miR-21)expression promotes growth,metastasis,and chemo- or radioresistance in non-small cell lung cancer cells by targeting PTEN[J].Mol Cell Biochem,2013,372(1-2):35-45.
[8] 李慧慧,宋 宝,王哲海.结直肠癌 miRNA 相关基因单核苷酸多态性与预后相关性研究现状[J].中华肿瘤防治杂志,2014,21(1):77-80.
[9] Chan SY,Loscalzo J.MicroRNA-210:a unique and pleiotropic hypoxamir[J].Cell Cycle,2010,9(6):1072-1083.
[10] Chan YC,Banerjee J,Choi SY,etal.miR-210:the master hypoxamir[J].Microcirculation,2012,19(3):215-223.
[11] Chan SY,Zhang YY,Hemann C,etal.MicroRNA-210 controls mitochondrial metabolism during hypoxia by repressing the iron-sulfur cluster assembly proteins ISCU1/2[J].Cell Metabolism,2009,10(4):273-284.
[12] Bianchi N,Finotti A,Ferracin M,etal.Increase of microRNA-210,decrease of raptor gene expression and alteration of mammalian target of rapamycin regulated proteins following mithramycin treatment of human erythroid cells[J].PLoS One,2015,10(4):e0121567.
[13] Le Borgne M,Chartier N,Buchet-Poyau K,etal.The RNA-binding protein Mex3B regulates the spatial organization of the Rap1 pathway[J].Development,2014,141(10):2096-2107.
[14] 杨玉荣.原位杂交检测 mex-3 mRNA 在 C.elegans 野生型胚胎发育中的分布[J].厦门大学学报:自然科学版,2003,42(5):665-670.
[15] Batlle-Gomez E,Suils ES,Ribera DR,etal.Methods and kits for the prognosis of colorectal cancer:U.S.Patent Application 14/361,111[P].2012-11-12.
[16] Malek E,Jagannathan S,Driscoll JJ.Correlation of long non-coding RNA expression with metastasis,drug resistance and clinical outcome in cancer[J].Oncotarget,2014,5(18):8027-8038.
[17] Montani F,Marzi MJ,Dezi F,etal.miR-Test:a blood test for lung cancer early detection[J].J Nat Cancer Institute,2015,107(6):djv063.
[18] Gregorc V,Novello S,Lazzari C,etal.Predictive value of a proteomic signature in patients with non-small-cell lung cancer treated with second-line erlotinib or chemotherapy(PROSE):a biomarker-stratified,randomised phase 3 trial[J].Lancet Oncol,2014,15(7):713-721.
[19] Fu X,Meng Z,Liang W,etal.miR-26a enhances miRNA biogenesis by targeting Lin28B and Zcchc11 to suppress tumor growth and metastasis[J].Oncogene,2014,33(34):4296-4306.
[20] Yanaihara N,Caplen N,Bowman E,etal.Unique microRNA molecular profiles in lung cancer diagnosis and prognosis[J].Cancer Cell,2006,9(3):189-198.
[21] Gee HE,Camps C,Buffa FM,etal.hsa-miR-210 is a marker of tumor hypoxia and a prognostic factor in head and neck cancer[J].Cancer,2010,116(9):2148-2158.
[22] Greither T,Würl P,Grochola L,etal.Expression of microRNA 210 associates with poor survival and age of tumor onset of soft-tissue sarcoma patients[J].Int J Cancer,2012,130(5):1230-1235.
[23] Rathod SS,Rani SB,Khan M,etal.Tumor suppressive miRNA-34a suppresses cell proliferation and tumor growth of glioma stem cells by targeting Akt and Wnt signaling pathways[J].FEBS Open Bio,2014,4(1):485-495.
[24] Almerdro V,Cheng YK,Rardles A,etal.Inference of tumor evolution during chemotherapy by computational modeling and in situ analysis of genetic and phenotypic cellular diversity[J].Cell Reports,2014,6(3):514-527.
[25] 万 菁.外周血 miRNA 作为肿瘤标志物的研究进展[J].肿瘤,2009,29(6):597-599.
[26] 娄远蕾,刘 芬,高法粱,等.miR-210 对血管内皮细胞 VEGF-Notch 信号通路的调控[J].中国病理生理杂志,2011,27(5):923-927.
[27] Pulkkinen K,Malm T,Turunen M,etal.Hypoxia induces microRNA miR-210 in vitro and in vivo[J].FEBS Letters,2008,582(16):2397-2401.
[28] Raitoharju E,Lyytikäinen LP,Levula M,etal.miR-21,miR-210,miR-34a,and miR-146a/b are up-regulated in human atherosclerotic plaques in the Tampere Vascular Study[J].Atherosclerosis,2011,219(1):211-217
[29] Zhang Z,Sun H,Dai H,etal.MicroRNA miR-210 modulates cellular response to hypoxia through the MYC antagonist MNT[J].Cell Cycle,2009,8(17):2756-2768.
[30] Mizuno Y,Tokuzawa Y,Ninomiya Y,etal.miR-210 promotes osteoblastic differentiation through inhibition of AcvR1b[J].FEBS Letters,2009,583(13):2263-2268.
[31] Ai RT,Wu SY,Wen XY,etal.1,3,4-tri-O-galloyl-6-O-caffeoyl-β-D-glucopyranose,a new anti-proliferative ellagitannin,regulates the expression of microRNAs in HepG(2)cancer cells[J].Nan Fang Yi Ke Da Xue Xue Bao,2011,31(10):1.
[收稿2017-03-24 修回2017-06-26]
(编辑 倪 鹏)
欢迎订阅和投稿《中国免疫学杂志》
EffectsofmiR-210onMex3Bproteinonmigrationandproliferationoflungcancercells
WANGJun-Gang,LICong-Cong,MAOGuang-Xian,ZHANGJie,YANGCui.
DepartmentofThoracicSurgery,theAffiliatedHospitalofZhengzhouUniversityHospital/TheCentralHospitalofNanyangCity,Nanyang473000,China
Objective:To investigate the effect of miR-210 on the migration and proliferation of lung cancer cells.MethodsThe expression of miR-210 in normal lung tissues and lung cancer tissues were detected by qPCR.The expression of Mex3B in lung cancer tissues and adjacent tissues were detected by qPCR.qPCR was used to detect the expression of miR-210 in different lung cancer cell lines(A549,H1299,H1650 and H358).The effect of miR-210 on the transcription of Mex3B was detected by double luciferase reporter gene system.The effect of miR-210 expression on the activity of lung cancer cells was detected by cell viability assay.The effect of miR-210 on the proliferation of A549 cells were detected by plate cloning assay.Transwell invasion assay were used to detect the effect of miR-210 on the invasion ability of lung cancer cell line A549.ResultsCompared with adjacent tissues,the expression of miR-210 were significantly decreased in lung cancer tissues,Mex3B were lower in lung cancer.Double luciferase reporter gene system results showed that miR-210 can directly regulate the transcriptional activity of Mex3B.The invasion and proliferation ability of lung cancer cell line were significantly reduced after inhibition of miR-210.ConclusionmiR-210 can target regulate the expression of Mex3B,and affects the invasion and proliferation of lung cancer cells.
Lung cancer;miR-210;Mex3B;Transwell
①本文为深圳市科技计划项目(JCYJ20140415162338820)和深圳市医疗卫生科研项目(201302068)。
②郑州大学附属医院/南阳市中心医院特需病房一病区,南阳 473000。
③北京大学附属深圳医院胸外科,深圳 518036。
R734.2
A
1000-484X(2017)10-1468-06
10.3969/j.issn.1000-484X.2017.10.006
王俊钢(1978年-),男,主治医师,主要从事胸外科疾病方面研究,E-mail:doctorll22@163.com。
