HIV-1假病毒感染未成熟树突状细胞实验研究①
2017-10-24刘雪丽张洁婷吴诗品李体远金宁一
朱 娜 刘雪丽 仇 妮 张洁婷 吴诗品 李体远 郭 焱 李 昌 金宁一
(青岛市中心医院药学部,青岛 266042)
·基础免疫学·
HIV-1假病毒感染未成熟树突状细胞实验研究①
朱 娜 刘雪丽 仇 妮 张洁婷 吴诗品②李体远②郭 焱③李 昌④金宁一④
(青岛市中心医院药学部,青岛 266042)
目的构建携带增强型绿色荧光蛋白基因(Enhanced green fluorescent protein,EGFP)的HIV-1假病毒;通过HIV-1假病毒感染未成熟树突状细胞(immatural dendritic cell,iDC)实验探讨病毒与细胞的相互作用。方法利用慢病毒包装系统构建携带EGFP基因的HIV-1假病毒,通过RT-PCR扩增HIV-1假病毒中的EGFP基因;HIV-1假病毒感染iDC,对HIV-1假病毒感染iDC后的基因组整合和转录水平进行检测,观察被感染iDC中EGFP基因的表达。结果构建的HIV-1假病毒通过RT-PCR结果显示扩增得到EGFP基因;HIV-1假病毒感染iDC后,在基因组整合和转录水平检测中都扩增得到了EGFP基因,荧光显微镜观察被HIV-1假病毒感染的iDC,观察到iDC表达绿色荧光蛋白。结论成功构建携带EGFP基因的HIV-1假病毒;HIV-1假病毒可以感染iDC,并将其遗传物质整合到iDC基因组中,并经过转录和翻译使iDC表达EGFP。
HIV-1假病毒;未成熟树突状细胞;感染实验
艾滋病(Acquired immunodeficiency syndrome,AIDS)由人免疫缺陷病毒(Human immunodeficiency virus,HIV)引起,HIV-1为主要病原,是循环CD4+T淋巴细胞显著下降、机会感染及恶性疾病为特征的继发性免疫缺陷综合征[1]。树突状细胞(Dendritic cells,DCs)是目前已知功能最强的专职抗原递呈细胞(Antigen presentation cell,APC),主要诱导体内免疫反应,是抗感染免疫的中心环节。一般认为HIV-1侵入人体后,首先感染DC,DC将病毒抗原进行处理,提呈给T淋巴细胞,进而激发一系列抗病毒免疫反应[2,3],DC在HIV感染与免疫中起到重要作用。DC家族的特点之一是成熟过程,在这个过程期间,他们改变形态和功能[4]。iDC有细胞吞噬能力,在受伤或感染部位捕获抗原,DC吞噬过程比其他吞噬细胞更为复杂,并在MHCⅠ、Ⅱ类分子上呈递正确的抗原蛋白[5],加工抗原之后,DC成熟,转移到局部淋巴结,吞噬功能下降和抗原递呈能力提升,并进一步导致T细胞的激活。因此,本文选择抗原吞噬功能较强的iDC作为靶细胞对HIV-1病毒感染机制进行研究,且既往关于HIV-1病毒此类感染的机制研究和相关报道寥寥无几。
由于直接操作HIV-1存在生物安全性问题,需要在生物安全三级以上实验室中进行,所以构建假病毒是当前HIV-1研究的一个重要手段。假病毒核酸分子上编码囊膜蛋白的基因被修饰掉,丧失了病毒的自我复制能力,只进行“一个细胞周期”的侵染,具有单轮感染活性,因此不需要在高级别生物安全实验室操作[6]。我们选用质粒pNL4-3-ΔE-EGFP和pTHRO4156 clone 18(SVPB15)构建HIV-1假病毒,pNL4-3-ΔE-EGFP为骨架质粒,是基于HIV-1原病毒的克隆pNL4-3,但在env开放阅读框中用EGFP基因替代,pTHRO4156 clone 18(SVPB15)为外膜蛋白包装质粒,来自B型病毒,含有全长env和rev基因,这两种质粒经过细胞共转染可以包装出HIV-1假病毒。笔者课题组已经建立4 d获得具有典型形态、表型和功能iDC的优化方法[7]。HIV-1为反转录病毒,感染靶细胞后可以将自身遗传物质整合到靶细胞基因组中,表达相应的蛋白。因此,本研究在前期工作基础上,拟以构建成功的HIV-1假病毒感染iDC,病毒内化后,其RNA经过反转录会整合到iDC基因组中,同时HIV-1假病毒携带的EGFP基因在iDC中经过转录、翻译最后表达EGFP,针对HIV-1假病毒这一生物学特性我们可以对病毒感染及病毒与细胞相互作用进行探讨,对HIV感染DC的研究进行了有益的尝试。
1 材料与方法
1.1材料
1.1.1细胞 人胚胎肾细胞系293T细胞为本实验室保存;iDC为本课题组通过免疫磁珠技术分离与体外诱导培养获得。
1.1.2菌株和质粒 大肠杆菌E.coli STBL 2购自长沙赢润生物技术有限公司;HIV-1假病毒骨架质粒pNL4-3-ΔE-EGFP和外膜蛋白包装质粒pTHRO4156 clone 18(SVPB15)为中国疾病预防控制中心病毒研究所冯霞博士惠赠。
1.1.3工具酶、主要试剂和仪器 限制性内切酶HindⅢ、BamHⅠ、PstⅠ、DL 2000 DNA标志物、λEcoT14 IDNA标志物、rTaq酶、M-MLV反转录酶、随机引物、dNTP和RNasin抑制剂购自TaKaRa公司;TRIzol购自Invitrogen公司;氨苄青霉素购自Invitrogen公司;质粒制备试剂盒购自北京百泰克生物技术有限公司;血液/细胞/组织基因组DNA提取试剂盒购自TIANGEN;0.25%胰蛋白酶(1×)溶液、DMEM培养基、胎牛血清购自Hyclone公司;opti-MEM培养液购自Gibco;FuGEENE HD转染试剂购自Roche公司;TRIzol购自Invitrogen公司;EGFP上下游引物和DEPC水购自上海生工生物工程技术服务有限公司;其他常规生物化学试剂均为分析纯级。高速常温离心机(Sigma);高速低温台式离心机(Eppendorf);-80℃超低温冰箱(三洋公司);荧光显微镜(Olympus);倒置显微镜(XSZ-D2)(重庆光学仪器厂);透射电镜(JEM-1200 EXⅡ)(日本电子公司)。
1.2方法
1.2.1pNL4-3-ΔE-EGFP和pTHRO4156 clone 18(SVPB15)质粒大量制备及浓度测定 制备假病毒包装系统配套大肠杆菌STBL 2感受态细胞参照《分子克隆实验指南》进行的操作[8],将质粒pNL4-3-ΔE-EGFP和pTHRO4156 clone 18(SVPB15)用STBL 2感受态细胞进行转化,利用限制性内切酶PstⅠ酶切反应鉴定pNL4-3-ΔE-EGFP,利用HindⅢ和BamHⅠ双酶酶切反应鉴定pTHRO4156 clone 18(SVPB15),进行扩增培养,提取质粒,用分光光度计NANODROP 2000测定质粒浓度。
1.2.2HIV-1假病毒包装及保存 将对数生长期的293T细胞按照5×106~6×106cells/ml的密度接种于6孔细胞培养板,培养液为正常含有10% FBS的DMEM,37℃、5%CO2条件下培养 24 h;在0.5 ml无抗生素无血清的opti-MEM中加入3 μg质粒pTHRO4156 clone 18(SVPB15)和9 μg质粒pNL4-3-ΔE-EGFP,轻弹混匀,室温放置孵育5 min,加入40 μl Fugene HD轻弹混匀,室温放置孵育20 min制成转染液;将转染液直接加入细胞中,细胞培养48 h后收集上清液,将上清液3 000 r/min(4℃)离心15 min,去除颗粒碎片[9],-80℃保存备用,避免反复冻融导致病毒滴度降低,使用荧光显微镜观察转染后293T细胞荧光蛋白表达情况。
1.2.3HIV-1假病毒的RT-PCR鉴定 取300 μl病毒上清液,采用TRIzol一步法提取上清液中HIV-1假病毒RNA,反转录生成cDNA,进行 RT-PCR,对骨架质粒pNL4-3-ΔE-EGFP中的EGFP进行PCR扩增,引物:上游EP1:ATG GTG AGC AAG GGC GAG GAG;下游EP2:CTT GTA CAG CTC GTC CAT GCC。PCR反应程序如下:95℃预变性5 min,94℃热变性30 s,56℃退火30 s,72℃延伸45 s,扩增30个循环,72℃后延伸10 min,4℃保存,反应结束后琼脂糖凝胶电泳检测PCR产物。
1.2.4HIV-1假病毒感染iDC iDC作为感染靶细胞,用添加10%Gibco胎牛血清和1%青链霉素的1640培养液培养,每1×106cells接种病毒液1 ml[10],吸附1 h后弃去接种液补加10% 1640培养液,继续培养24 h后收集细胞[11],每个实验组设1个空白对照孔。
1.2.5HIV-1假病毒感染iDC后荧光蛋白表达观察 HIV-1假病毒感染iDC后,将iDC继续培养24 h,利用荧光显微镜观察iDC中荧光蛋白表达情况,同时观察正常生长状态下的iDC。
1.2.6HIV-1假病毒感染iDC后电镜观察 用细胞刮将感染HIV-1假病毒3 h后的iDC刮下,得到细胞悬液,5 000 r/min离心20 min,吸弃上清,加500 μl 戊二醛固定,进行透射电镜观察(透射电镜:JEM-1200 EXⅡ,购自日本电子公司)。
1.2.7HIV-1假病毒感染iDC后基因组整合检测 HIV-1假病毒感染iDC后,iDC继续培养24 h,用细胞刮刮取iDC,获得细胞悬液,参照血液/细胞/组织基因组DNA提取试剂盒说明书提取iDC的基因组DNA,然后对其进行PCR扩增EGFP基因,设未感染iDC为对照。
1.2.8HIV-1假病毒感染iDC后的转录水平检测 HIV-1假病毒感染iDC后,iDC继续培养24 h,吸弃细胞培养液,用细胞刮刮取iDC,加约200 μl的PBS重悬,提取细胞总RNA,进行RT-PCR,扩增EGFP基因,设未感染iDC为对照,具体方法同1.2.3。
2 结果
2.1质粒pNL4-3-ΔE-EGFP和pTHRO4156 clone 18(SVPB15)酶切鉴定结果 质粒pNL4-3-ΔE-EGFP的全长为14.7 kb,经PstⅠ单酶切后得到4个条带,片段大小约为8 000、3 000、2 000和 1 300 bp(图1);质粒pTHRO4156 clone 18(SVPB15)全长为8 440 bp,用BamHⅠ和HindⅢ双酶切后得到目的片段env/rev,大小约为3 000 bp,另一个条带约为5 000 bp(图2),得到正确目的片段,证明pNL4-3-ΔE-EGFP和pTHRO4156 clone 18(SVPB15)可以用于HIV-1假病毒构建实验。
2.2pNL4-3-ΔE-EGFP和pTHRO4156 clone 18(SVPB15)大量制备浓度及纯度测定结果 用于转染实验的质粒要求分光光度仪测定其OD260/OD280值在1.6到1.8之间,证明质粒纯度较好,无蛋白和RNA污染。质粒pNL4-3-ΔE-EGFP和pTHRO4156 clone 18(SVPB15)浓度及纯度如表1所示,符合要求,可以用于转染实验。
2.3HIV-1假病毒包装实验 正常培养生长状态良好的293T细胞如图3A所示;pNL4-3-ΔE-EGFP和pTHRO4156 clone 18(SVPB15) 共转染293T细胞,48 h后,观察到293T细胞略微变圆、积聚、颜色稍有加深(图3B),并没有其他病变特征;在荧光显微镜下观察,可以看到细胞中有绿色荧光,证明经转染后pNL4-3-ΔE-EGFP中的EGFP基因在293T细胞中得到表达(图3C、D)。转染48 h后,理论上包装出的HIV-1假病毒存在于细胞培养上清液中,收集细胞培养上清液于-80℃保存备用,并离心处理细胞碎片,用Trizol 法提取细胞总RNA,进行RT-PCR扩增EGFP基因,结果得到约700 bp的目的片段,与pNL4-3-ΔE-EGFP中插入的外源基因EGFP片段大小相同(图4A),设β-actin为内参对照(图4B)。

图1 pNL4-3-ΔE-EGFP的酶切鉴定结果Fig.1 Analysis of pNL4-3-ΔE-EGFP by enzyme digestionNote: M.DNA marker λEcoT14I;1.pNL4-3-ΔE-EGFP;2.pNL4-3-ΔE-EGFP digested by PastⅠ.
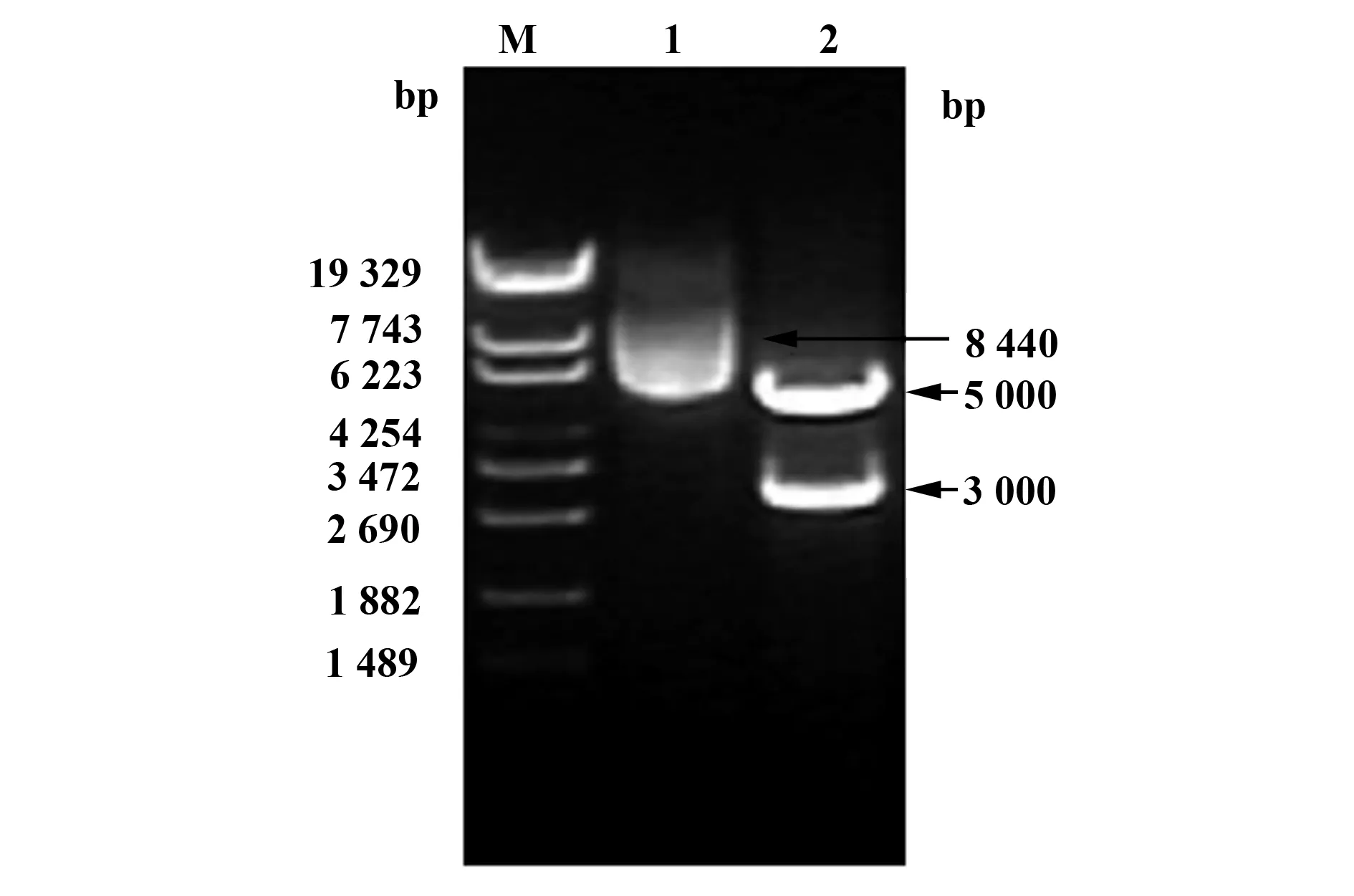
图2 pTHRO4156 clone 18(SVPB15)的酶切鉴定结果Fig.2 Analysis of pTHRO4156 clone 18(SVPB15)by enzyme digestionNote: M.DNA Marker λEcoT14I;1.pTHRO4156 clone 18(SVPB15);2.pTHRO4156 clone 18(SVPB15) digested by BamH Ⅰ/Hind Ⅲ.
2.4HIV-1假病毒感染iDC后iDC中EGFP表达 HIV-1假病毒感染iDC 24 h后细胞未发生病变(图5A),与未感染的iDC形态和生长状态都没有区别,但荧光显微镜观察到被感染的iDC中存在绿色荧光(图5B),证明EGFP在iDC中获得表达,初步提示HIV-1假病毒可以感染iDC。
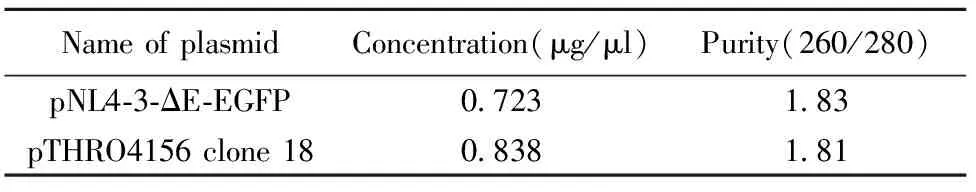
表1 pNL4-3-ΔE-EGFP和pTHRO4156 clone 18(SVPB-15)浓度及纯度
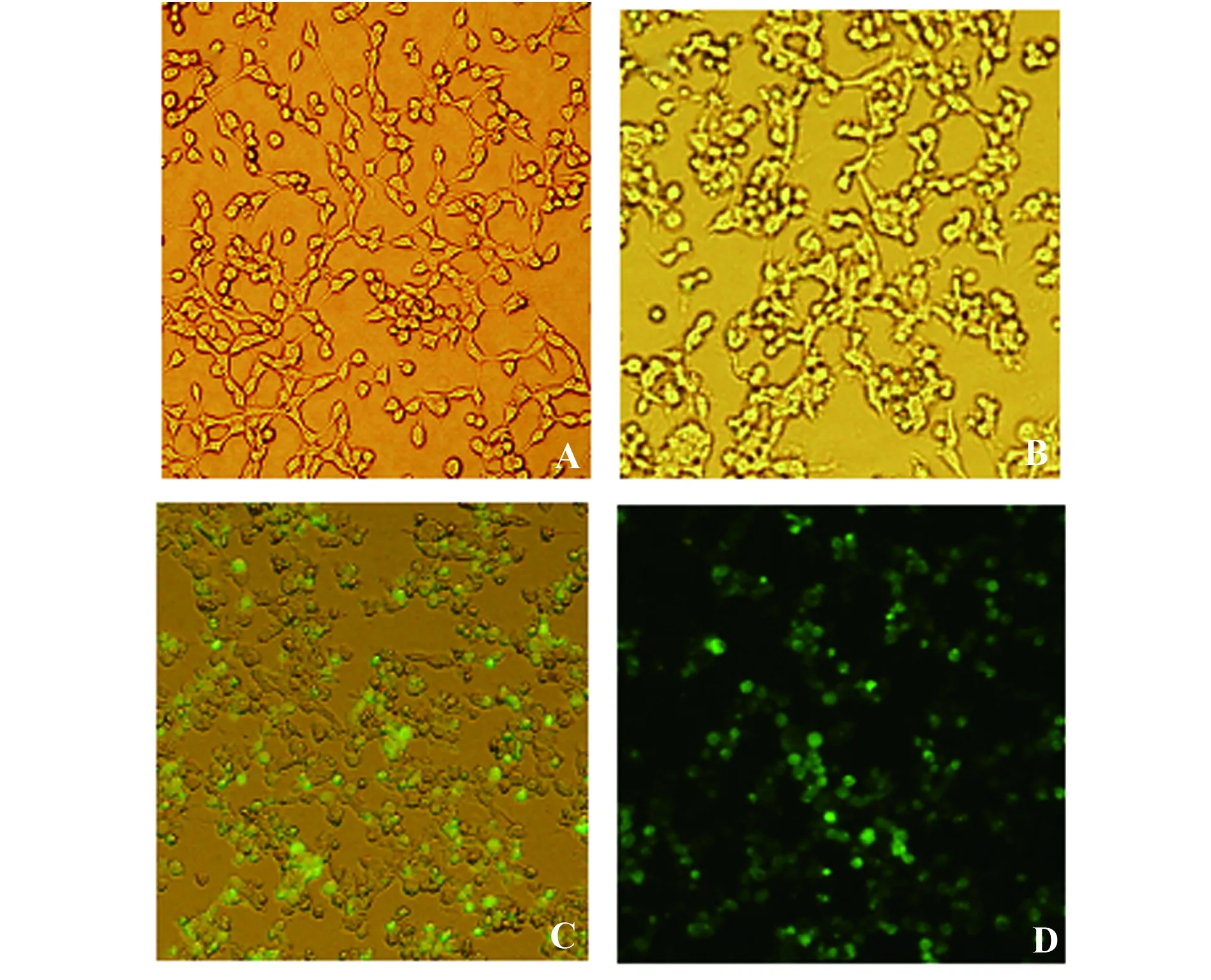
图3 293T细胞观察Fig.3 Observation of 293T cellsNote: A.Normal 293T cell(×200);B.293T cells transfected by plasmid(×200);C/D.EGFP observation of the 293T cells transfected by plasmid(×200).
2.5HIV-1假病毒感染iDC后透射电镜观察 对感染HIV-1假病毒3 h后的iDC进行电镜观察,发现存在疑似病毒粒子,通过电镜拍摄下的病毒形态、病毒粒子大小及存在于两细胞间的位置,表明该病毒粒子可能为结合在iDC表面的病毒粒子(图6)。

图4 β-actin检测Fig.4 β-actin identificationNote: β-actin PCR amplification:M.DL2000 DNA marker;1.H2O control;2.Positive control;3.RT-PCR product of HIV-1 pseudovirus;4.RT-PCR product in control of normal 293T cells supernatant.

图5 iDC观察Fig.5 Observation of iDCNote: A.iDC infected by HIV-1 pseudovirus(×200);B.EGFP observation of the iDC infected by HIV-1 pseudovirus(×200).
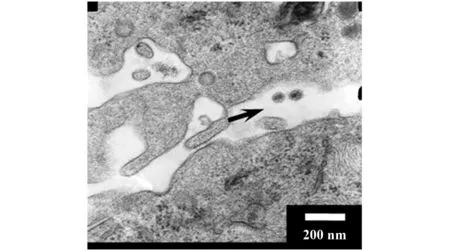
图6 病毒结合与捕获试验(透射电镜,×6 000)Fig.6 Virus binding and capture assay(Observation of transmission electron microscopy,×6 000)
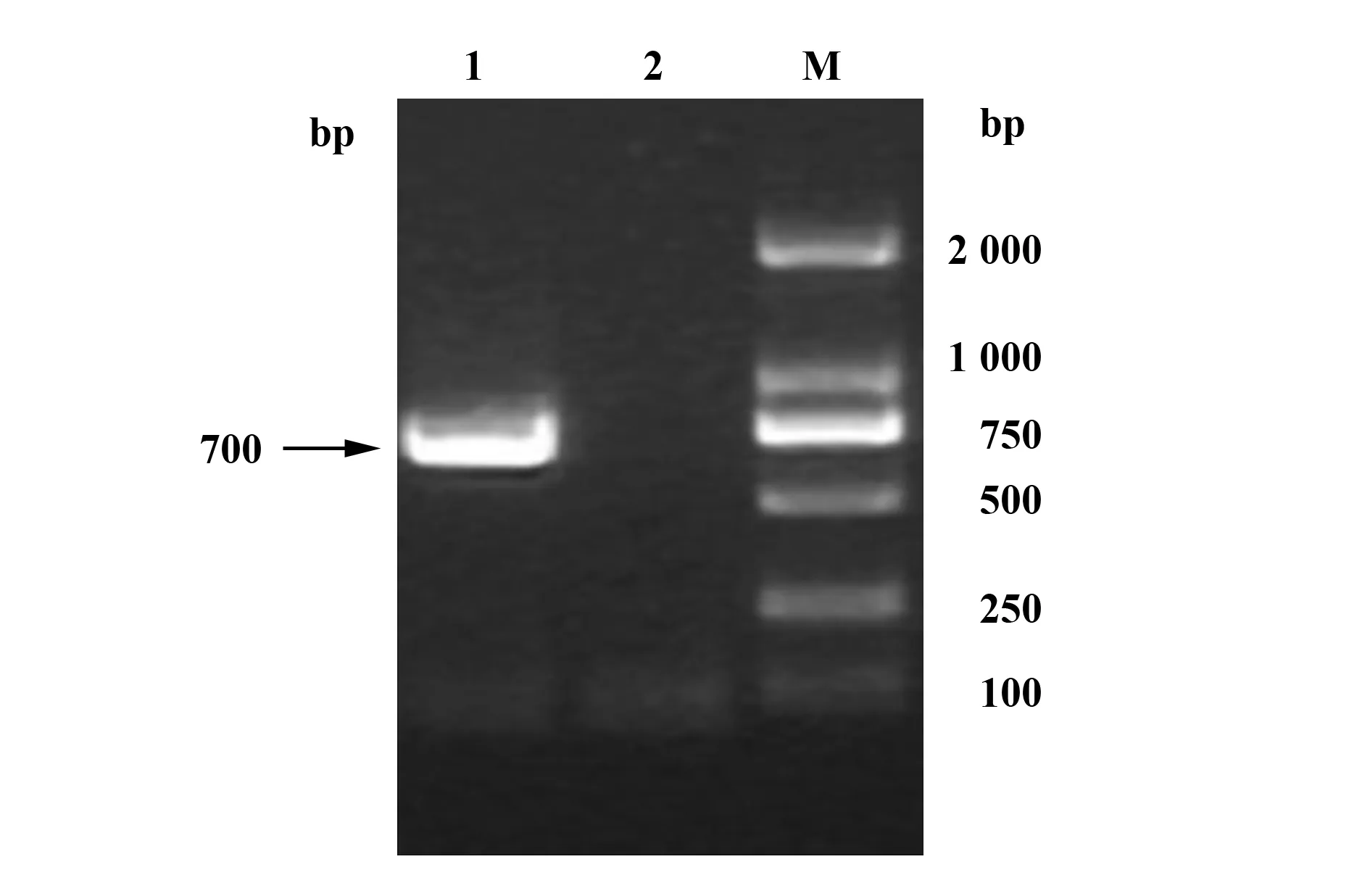
图7 HIV-1假病毒感染iDC基因组整合检测Fig.7 Genome integration level detection of HIV-1 pseudovirusNote: EGFP of genome of iDC PCR amplification:M.DL2000 DNA marker;1.Genome of iDC infected by HIV-1 pseudovirus;2.Genome of normal iDC.

图8 RT-PCR检测HIV-1假病毒感染iDC的mRNAFig.8 RT-PCR identification of mRNA of iDC infected by HIV-1 pseudovirusNote: EGFP of mRNA of iDC PCR amplification:M.DL2000 DNA Marker;1.RT-PCR product in control of mRNA of normal iDC;2.RT-PCR product of mRNA of iDC infected by HIV-1 pseudovirus.
2.6HIV假病毒感染iDC后基因组整合检测结果 HIV-1假病毒感染iDC 24 h后提取iDC的基因组,得到cDNA,利用EGFP特异性引物进行PCR扩增,得到700 bp条带(图7),与EGFP条带的大小一致,证明HIV-1假病毒感染iDC后其RNA经反转录整合到iDC基因组中。
2.7HIV-1假病毒感染iDC后的转录水平检测结果 HIV-1假病毒感染iDC 24 h后提取iDC的RNA,进行RT-PCR,经反转录得到cDNA,利用EGFP特异性引物进行PCR扩增后得到了700 bp条带,与EGFP条带的大小一致(图8),证明HIV-1假病毒感染iDC后在iDC中正常转录,mRNA得到表达。
3 讨论
我们构建HIV-1假病毒,其基因组中的表达膜蛋白的基因失活,需要外源膜蛋白基因共转染才能包装出HIV-1假病毒颗粒,因此,HIV-1感染细胞iDC后,iDC中没有外膜蛋白包装基因,HIV-1不能进一步复制产生新一轮的病毒,降低了生物危险性,同时增加了实验的可重复性。HIV-1假病毒的细胞嗜性和感染过程与真病毒相似,在研究病毒与细胞间相互作用时,直接感染静止培养的iDC,可以模拟病毒感染的早期过程,这样可以更好地理解与阐释病毒与细胞的相互作用,为病毒感染与致病机制提供重要线索,对抗艾滋病DC疫苗与药物的研制奠定理论基础。
实验中HIV-1假病毒骨架质粒为pNL4-3-ΔE-EGFP,它源于HIV-1原病毒克隆的pNL4-3,在env开放阅读框中携带EGFP基因,EGFP是从pEGFP-N1质粒上扩增得到的,通过KpnⅠ和NheⅠ酶切位点插入pNL4-3主链。pNL4-3-ΔE-EGFP表达一种内质网固定的去除顶端的Env-EGFP融合蛋白[12]。外膜蛋白包转质粒pTHRO4156 clone 18(SVPB15)包含全长env和rev基因,源于一个进化枝B型病毒感染的实验者,通过RT-PCR扩增得到。env/rev片段通过HindⅢ和BamHⅠ酶切位点连接到pcDNA3.1(+)表达载体上,克隆表达一个有用的env/rev,可以构建假性感染性病毒[13]。对于B型病毒(SVPB15)来说,pTHRO4156.18 env包含假病毒粒子后属于标准病毒中和模型。pNL4-3-ΔE-EGFP和pTHRO4156 clone 18(SVPB15)构建的HIV-1假病毒是HIV-1报告病毒,可以被用于HIV-1抗药性的表型分析,用于测定针对HIV-1 gag-pol结构域决定的病毒复制能力。
实验中293T细胞系在骨架质粒和外膜蛋白包装质粒共转染后包装HIV-1假病毒。最佳化的293T生产细胞系在人类CMV启动子控制下稳定表达SV40 大T抗原,是病毒产量处于最佳化,同时维持HIV-1假病毒的生存环境[14]。HIV-1假病毒易于浓缩,具有良好的安全性、广泛的宿主范围和更高的转染效率,可以应用于研究病毒与宿主细胞之间相互关系、评价中和抗体效价以及基因治疗方面,是一种新型、安全的实验工具。
体外分离、诱导、培养CD14+单核细胞被认为是获得具有良好细胞活力iDC最普遍的途径[15],我们构建的HIV-1假病毒每一次冻融病毒滴度会降低10%,因此,病毒液储于-80℃保存,感染实验中是将病毒液融化后感染iDC。HIV-1感染iDC实验一方面是对HIV-1假病毒的感染活性作以鉴定,另一面是模拟HIV-1的感染过程,寻找病毒的作用靶标,探索病毒与靶细胞的相互作用。HIV-1假病毒感染进入iDC,病毒RNA反转录后进入细胞核[16],稳定地整合到宿主基因组中[17],EGFP作为报告基因易于检测,因此,通过观察iDC中EGFP的表达、测定iDC的mRNA和基因组cDNA,可以判断HIV假病毒是否感染细胞。本实验结果表明,HIV-1能够成功感染iDC,其RNA经反转录可以整合到iDC基因组中,并得到表达,从而为开展HIV-1与宿主细胞相互作用研究奠定了基础。
HIV感染DC的研究尚处于起步阶段,还有许多问题有待于进一步阐明和证实,比如HIV-1假病毒的功能和单轮感染活性验证实验;iDC摄取HIV-1假病毒后,iDC内部发生了哪些改变,激活了哪些信号通路,从而导致iDC分化为mDC等等。本课题组将开展HIV-1感染DC的差异蛋白组学研究,通过生物信息学分析,进一步了解HIV-1感染过程对iDC造成的影响,相信实验研究的深入和实验技术的发展会为HIV的靶向性抗病毒研发提供新的思路。
[1] 李莉平,康佳丽,夏 薇.HIV致病机制的研究进展[J].细胞与分子免疫学杂志,2007,23(9):886-889.
[2] Kawamura T,Cohen SS,Borris DL,etal.Candidate microbicides block HIV-1 infection of human immature langerhans cells within epithelial tissue explant[J].J Exp Med,2000,192(10):1491-1500.
[3] 闰素仙,于 辉,谢影哲,等.树突状细胞交叉递呈外源抗原的机制研究进展[J].细胞与分子免疫学杂志,2016,32(9):1272-1275.
[4] Mintern JD,Macri C,Wei JC,etal.Differential use of autophagy by primary dendritic cells specialized in cross-presentation[J].Autophagy,2015,11(6):906-917.
[5] Segura E,Amigorena S.Cross-presentation by human dendritic cell subsets[J].Iramunol Lett,2014,158(1-2):73-78.
[6] 王艳海,韩晓旭.HIV-1假病毒的研究进展[J].内蒙古医学杂志,2012,44(7):817-821.
[7] 朱 娜,王海桃,李 昌,等.未成熟树突状细胞快速分离与体外诱导培养及其鉴定研究[J].中国免疫学杂志,2017,33(7):1043-1047.
[8] 萨姆布鲁克 J,拉塞尔 DW.分子克隆实验指南[M].第3版.北京:科学出版社,2002:93-99.
[9] 仇 超,彭 虹,黄相刚,等.携带绿色荧光蛋白基因的单轮感染活性HIV假病毒的建立及其活性检测[J].中华微生物学和免疫学杂志,2006,26(5):394-398.
[10] 朱晓蕾,卢 春,吕志刚,等.HIV-1假病毒的构建及对人原发性渗出性淋巴瘤细胞系的感染研究[J].南京医科大学学报(自然科学版),2008,28(5):565-569.
[11] Zandi F,Eslami N,Soheili M,etal.Proteomics analysis of BHK-21 cells infected with a fixed strain of rabies virus[J].Proteomics,2009,9(9):2399-2407.
[12] Zhang H,Zhou Y,Alock C,etal.Novel single-cell-level phenotypic assay for residual drug susceptibility and reduced replication capacity of drug-resistant human immunodeficiency virus type 1[J].J Virol,2004,78(4):1718-1729.
[13] Li M,Gao F,Mascola JR,etal.Human immunodeficiency virus type 1 env clones from acute and early subtype B infections for standardized assessments of vaccine-elicited neutralizing antibodies[J].J Virol,2005,79(16):10108-10125.
[14] 孙丹丹,李 昌,李太元,等.HIV-1包膜蛋白ENV慢病毒载体的构建及表达[J].中国免疫学杂志,2012,28(5):440-443.
[15] 王茂鹏,杜寿文,李 昌,等.人树突状细胞分离与鉴定最新研究进展[J].中国免疫学杂志,2013,29(10):1093-1097.
[16] Lewis PF,Emerman M.Passage through mitosis is required for oncoretroviruses but not for the human immunodeficiency virus[J].J Virol,1994,68(1):510-516.
[17] Buchschacher GL Jr,Wong-Staal F.Development of lentiviral vectors for gene therapy for human diseases[J].Blood,2000,95(8):2499-2504.
[收稿2017-06-03 修回2017-07-25]
(编辑 张晓舟)
ExperimentalstudyonimmaturaldendriticcellsinfectedbyHIV-1pseudovirus
ZHUNa,LIUXue-Li,QIUNi,ZHANGJie-Ting,WUShi-Pin,LITi-Yuan,GUOYan,LIChang,JINNing-Yi.
PharmacyDepartmentoftheQingdaoCenterHospital,Qingdao266042,China
Objective:To construct HIV-1 pseudovirus containing enhanced green fluorescent protein(EGFP)gene.To understand the interaction between the virus and the cells.MethodsHIV-1 pseudovirus containing EGFP gene was constructed by lentiviral packaging systems,and its EGFP gene was amplified using RT-PCR.The level of genomic integration and transcription of HIV-1 pseudovirus containing EGFP gene were detected on iDCs infected with HIV-1 pseudovirus.At the same time,research on expression of the EGFP gene in iDCs infected with HIV-1 pseudovirus was performed.ResultsThe EGFP gene of HIV-1 pseudovirus was detected through RT-PCR.The EGFP gene was identified in iDCs infected with HIV-1 pseudovirus through PCR and RT-PCR.The EGFP was observed in iDCs infected with HIV-1 pseudovirus under fluorescence microscopy.ConclusionHIV-1 pseudovirus containing EGFP gene has been successfully produced.The HIV-1 pseudovirus that we constructed can infect iDCs,then its RNA can integrate into the genome of iDCs in the way of reverse transcription,and the EGFP gene could express in the iDCs after infected with HIV-1 pseudovirus.
HIV-1 pseudovirus;Immatural dendritic cell;Infection experiment
①本文受国家自然科学基金(31472197)、病原微生物生物安全国家重点实验室开放课题(SKLPBS1435)、北京市自然科学基金(5152023)和吉林省青年科研基金项目(20140520173JH)资助。
②暨南大学第二临床医院,深圳市人民医院,深圳 518000。
③长春中医药大学基础医学院,长春 130117。
④军事医学科学院军事兽医研究所,省部共建吉林省人兽共患病预防与控制重点实验室,长春 130062。
R392
A
1000-484X(2017)10-1441-06
10.3969/j.issn.1000-484X.2017.10.001
朱 娜( 1986年-),女,硕士,主要从事临床药学研究,主要从事微生物与免疫方面的研究,E-mail: merryzhuna@163.com。
及指导教师:郭 焱(1963年-),女,博士,教授,博士生导师,主要从事微生物与免疫方面的研究,E-mail: ccguoyan@163.com。李 昌(1978年-),男,博士,教授,副研究员,主要从事微生物与免疫方面的研究,E-mail: lichang78@163.com。金宁一(1956年-),男,博士,中国工程院院士,博士生导师,主要从事微生物与免疫方面的研究,E-mail: ningyij@hotmail.com。
