BCYRN1调控miR-503通过Notch1信号通路对肺癌迁移和侵袭的影响①
2017-10-24张婧婧姬颖华李伟伟杨庆辉于海川王向鹏
张婧婧 张 轶 姬颖华 张 敏 李伟伟 杨庆辉 王 瑾 于海川 路 平 王向鹏
(河南省新乡医学院医学检验学院和分子诊断与医学检验技术河南省协同创新中心,新乡 453003)
BCYRN1调控miR-503通过Notch1信号通路对肺癌迁移和侵袭的影响①
张婧婧 张 轶 姬颖华②张 敏②李伟伟②杨庆辉②王 瑾②于海川 路 平②王向鹏
(河南省新乡医学院医学检验学院和分子诊断与医学检验技术河南省协同创新中心,新乡 453003)
目的探讨BCYRN1调控miR-503通过Notch1信号通路对肺癌迁移和侵袭的影响机制。方法qPCR检测不同肺癌细胞株中BCYRN1和miR-503的表达情况;免疫荧光和qPCR检测慢病毒BCYRN1+siRNA转染肺癌细胞的转染效率;双荧光素酶报告基因检测BCYRN1与miR-503的相互作用;Transwell侵袭实验和划痕实验检测沉默BCYRN1后肺癌细胞侵袭和迁移能力的变化;Western blot检测沉默BCYRN1后Notch1信号通路蛋白的表达情况;裸鼠皮下成瘤检测沉默BCYRN1后肺癌细胞裸鼠体内成瘤能力的影响。结果在肺癌细胞H1299中BCYRN1表达水平最高,miR-503的表达水平相对较高;免疫荧光及mRNA水平证明BCYRN1+siRNA慢病毒可以有效转染进入H1299细胞内;BCYRN19能与miR-503的3′-UTR特异性结合;沉默BCYRN1可以抑制肺癌H1299细胞的侵袭和迁移能力;沉默BCYRN1后Notch1通路蛋白表达情况相应下调;与NC组相比,BCYRN1-siRNA组荷瘤小鼠肿瘤体积和重量都明显减小。结论BCYRN1可以靶向调节miR-503通过Notch1信号通路影响肺癌H1299细胞的侵袭和迁移能力。
BCYRN1;肺癌;miR-503; Transwell
肺癌是全球呼吸系统肿瘤发病率最高的肿瘤,男性发病率相比女性要明显增高,其中吸烟是重要的因素之一[1]。 肺癌患者的5年整体生存率约为10%~15%,而且晚期失去手术机会,预后效果不佳,导致其死亡率居高不下[2]。非小细胞肺癌(Non-small cell lung cancer,NSCLC),是肺癌最常见的一种类型,容易出现早期转移,所以也是肺癌中最难治疗和防范的一种[3]。寻找有效的早期诊断治疗和分子治疗靶点是目前的亟需解决的问题。
长链非编码RNA(Long-chain non-coding RNA,lncRNA)是指非编码的不小于200nt的一种RNA[4]。 在多种类型的肿瘤发现lncRNA表达参与癌症的增殖和转移等恶性行为[5,6]。例如,被称为MALAT-1的lncRNA被证明是诱导肺癌细胞迁移和转移动力的相关基因[7,8]。 根据文献,BCYRN1是一种由200个核苷酸组成的lncRNA,在乳腺癌、宫颈癌、食道癌、肺癌等的一些恶性肿瘤中高度表达,在正常组织中很少能有效检测其表达[9]。
最近有研究表明BCYRN1在肿瘤进展中通过抑制部分转移抑制因子的转录起到促进其发展的作用[10]。曾有研究指出,miR-503与肺癌细胞的转移密切相关[11]。在肿瘤转移期间,Notch通路的激活可以通过各种方式与肿瘤细胞相互作用,调控肿瘤细胞的转移潜力[12]。
然而,目前关于BCYRN1的作用及其相关性miR-503在肺癌中表达和转移作用机制尚不太了解。本研究通过以下研究初步完成阐明BCYRN1和miR-503的关系以及其在肺癌细胞中的可能调控作用。
1 材料与方法
1.1细胞系和试剂 5种人肺癌细胞系,包括A549、H1299、SPCA-1、H1650及H520,以及人正常支气管上皮细胞株16HBE,均购买于中国上海细胞研究所。细胞培养条件,16HBE和SPCA-1在DMEM培养基(90%)中加入10%胎牛血清(Hyclone,USA),其余细胞在RPMI1640培养基中培养,均放在37℃下,5%CO2的恒温孵箱中培养。
1.2方法
1.2.1BCYRN1+siRNA慢病毒感染 通过慢病毒转染获得过表达BCYRN1+siRNA的细胞,将编码BCYRN1+siRNA或空载体的慢病毒感染到H1299细胞中。并根据制造商的说明书使用Lipofectamine 2000(Invitrogen,Carlsbad,CA)将其转染入细胞48 h,通过GFP表达选择具有稳定的BCYRN1+siRNA表达的克隆细胞株。
1.2.2miRNA的实时PCR分析 使用TRIzol试剂(Invitrogen,Carlsbad,CA,USA)分离肺癌细胞的总RNA,并使用TM miRNA分离试剂盒(Ambion,Austin,TX,USA)进一步纯化miRNA部分。通过光谱测定RNA样品的浓度和纯度。使用实时PCR系统进行实时逆转录PCR(qPCR)。U6管家基因作为对照。使用2-ΔΔCt方法计算肺癌细胞的miRNA相对表达量。实验重复3次。
1.2.3双荧光素酶活性测定 验证BCYRN1和miR-503的相关关系,我们使用双荧光素酶测定,将24孔板中的BCYRN1或NC细胞与0.4 mg萤火虫荧光素酶报告载体和0.1 mg含有海肾萤光素酶(Promega)的pRL-TK对照载体共转染,根据 siPORTneoFX使用方法操作,在转染后48 h制备裂解物。使用双荧光素酶报告基因测定系统(Promega),转染24 h后测定荧光素酶活性。 对于每个转染的萤火虫萤光素酶活性被归一化为海肾萤光素酶活性。实验重复3次。
1.2.4细胞迁移和侵袭测定 对于迁移测定,将5×104个肺癌细胞注入24孔Transwell小室中,每个孔中具有8.0 μm孔的聚碳酸酯滤室。 对于侵袭试验,将5×104个肺癌细胞置于上室,并加入Matrigel基质胶(BD Bioscience,Woburn,MA,USA)。将具有10%FBS和HGF(20 ng/ml)的培养基置于下室中。在37℃下孵育24 h后,小心地去除上膜表面上的细胞。用95%乙醇固定20 min后,用0.5%结晶紫溶液染色10 min,自来水冲洗干净过后,于倒置显微镜下计数。实验重复3次。
1.2.5Western blot蛋白质印迹 用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离总蛋白,并将其转移到硝酸纤维素膜(Bio-Rad,Hercules,CA)。使用5%脱脂牛奶充分封闭膜,并与一抗(浓度1∶1 000),内参GAPDH(浓度1∶2 000),4℃,孵育过夜。次日,TBST充分冲洗过后,使用二抗辣根酶标记物(浓度1∶2 000) 孵育2 h,TBST充分冲洗过后,使用增强的化学发光试剂ECL显影液检测目标蛋白的表达水平。使用GAPDH作对蛋白内参对照。实验重复3次。

2 结果
2.1不同肺癌细胞株中的BCYRN1的表达和miR-503表达 通过检测mRNA水平筛选合适的肺癌细胞株。实验结果表明(图1A),BCYRN1在肺癌细胞中表达水平,在A549、H1299、SPCA-1、H1650及H520细胞中均呈现呈高表达水平,在H1299中表达水平明显最高。同样,miR-503在不同肺癌细胞株中的表达如图1B所示。BCYRN1和miR-503的表达水平在肺癌细胞株中均比人支气管细胞株(16HBE)表达升高,表明可能扮演一定的促癌作用。后续试验我们选取H1299细胞株。
2.2检测慢病毒BCYRN1+siRNA的转染效率检测 图2A显示,使用慢病毒BCYRN1+siRNA1和BCYRN1+siRNA2转染H1299细胞,免疫荧光显示二者转染效率均高于80%,mRNA水平检测同样显示慢病毒转染后BCYRN1的表达明显下调,差异具有统计学意义。
2.3双荧光素酶检测BCYRN1和miR-503之间的关系 为明确与BCYRN1和下游miR-503相关的miRNA的情况,我们使用生物信息学预测工具明确,BCYRN1可能与miR-503直接相互作用,相关结合位点如图3A所示。为了验证BCYRN1能否与miR-503 3′UTR结合,我们将BCYRN1-siRNA与miR-503共转染到肺癌H1299细胞株中。荧光素酶报告基因结果显示(图3B):BCYRN1+siRNA可以明显抑制miR-503的荧光素酶活性。表明BCYRN1-siRNA能与miR-503的3′UTR特异性结合,并可以调控miR-503的表达。

图1 BCYRN1和miR-503在肺癌组织和细胞株中的表达水平 Fig.1 Expression levels of BCYRN1 and miR-503 in lung cancer tissues and cell linesNote: A.Expression of BCYRN1 levels in different lung cancer cell lines;B.Expression of miR-503 in different lung cancer cell lines.

图2 慢病毒在肺癌细胞株中的转染效率 Fig.2 Transfection efficiency of lentivirus in lung cancer cell linesNote: A.Immunofluorescence was used to detect transfection efficiency of BCYRN1;B.qPCR was used to detect the expression of BCYRN1 in H1299 lung cancer cells.**.P<0.001.
2.4肺癌细胞的迁移和侵袭能力受到BCYRN1的调节 如图4A所示,Transwell迁移试验检测BCYRN1对肺癌H1299细胞迁移能力的影响,BCYRN1+siRNA1和BCYRN1+siRNA1组的H1299细胞迁移数目明显少于NC组的数目[(25.3±2.2)% vs(85.6±6.3)%,P=0.018],表明BCYRN1的表达下调可以抑制H1299细胞的迁移能力。同理,如图4B所示,Transwell侵袭试验也显示,BCYRN1的表达下调对基质胶的溶解能力下降,导致H1299细胞的侵袭能力相应减弱[(21.7±1.9)% vs (68.2±5.9)%,P=0.009]。差异均具有统计学意义。 所有上述结果提示H1299细胞迁移和侵袭能力可由BCYRN1进行相应调节。
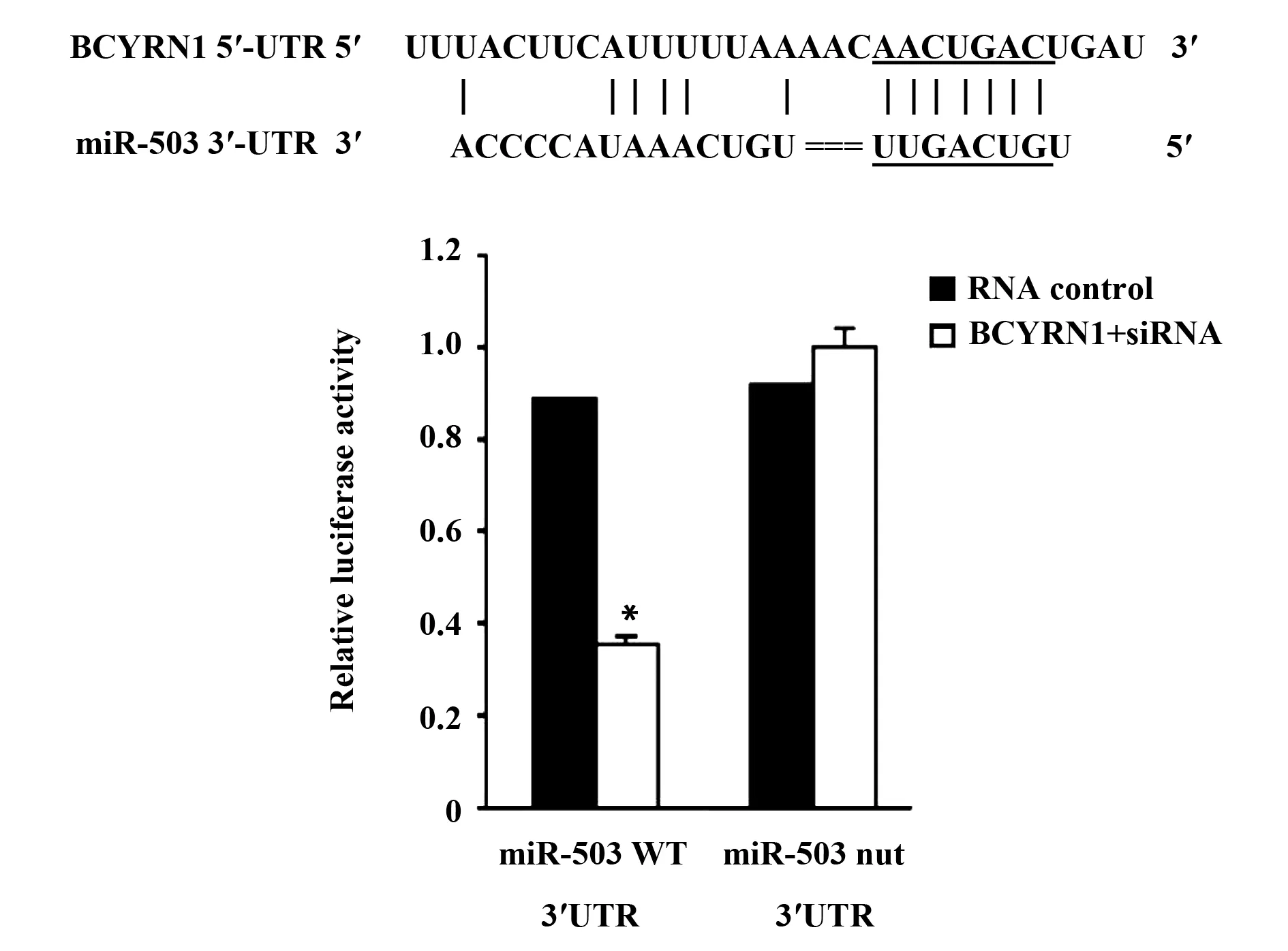
图3 双荧光素酶实验检测BCYRN1和miR-503之间的关系Fig.3 Double luciferase assay to detect relationship between BCYRN1 and miR-503Note: A.Binding site of BCYRN1 to miR-503;B.Double luciferase to detect the relationship between BCYRN1 and miR-503.*.P<0.05.
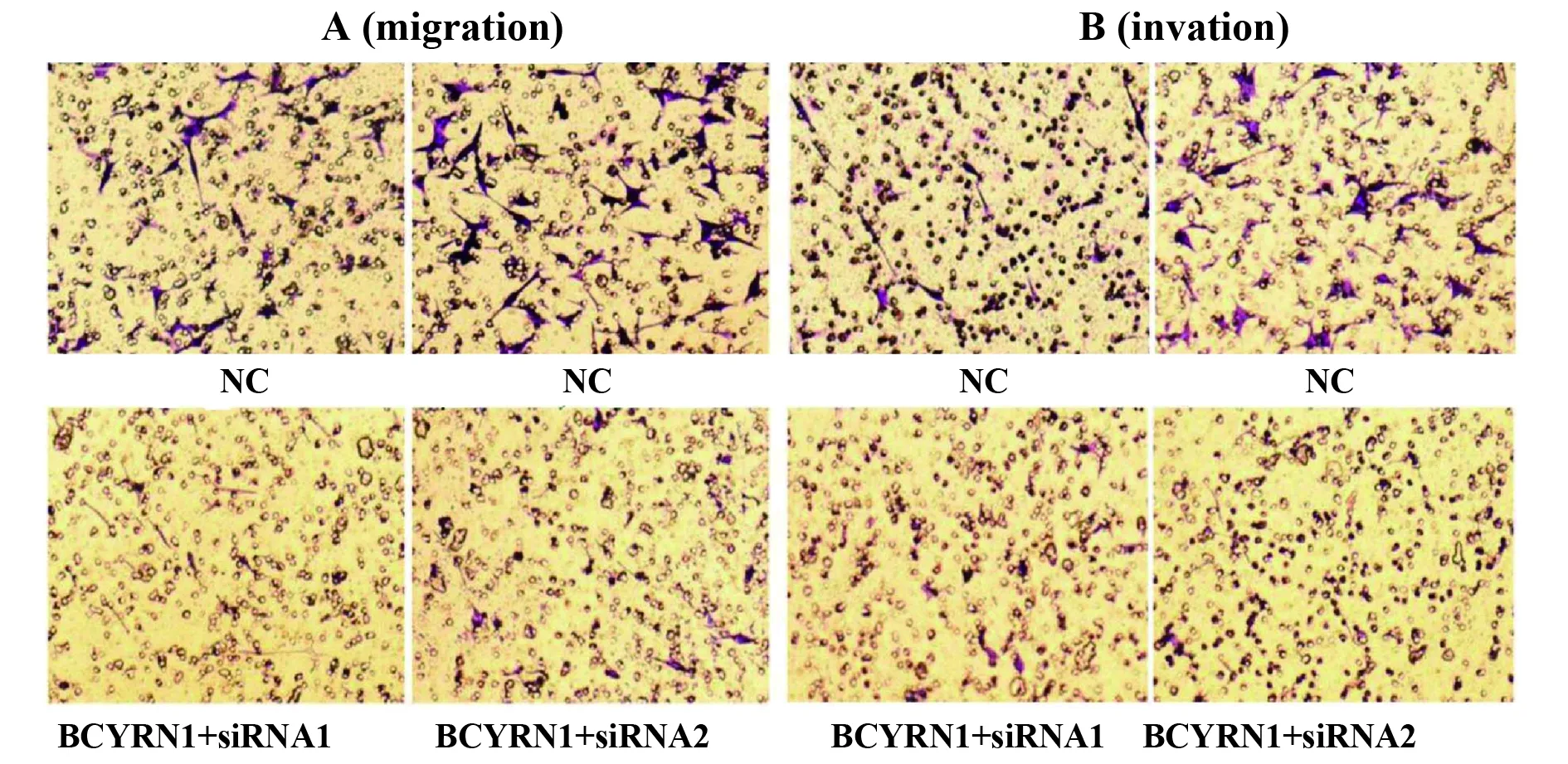
图4 迁移和侵袭实验检测BCYRN1对肺癌细胞的影响Fig.4 Migration and invasion experiments to detect effect of BCYRN1 on lung cancer cellsNote: A.Migration experiments to detect the effect of BCYRN1 on H1299 migration capacity;B.Invasion assay to detect the effect of BCYRN1 on H1299 invasion.

图5 Notch1蛋白通路的表达水平Fig.5 Expression level of Notch1 protein pathwayNote: A.Western blot to detect Notch1 pathway protein expression;B.Notch1 pathway protein corresponding expression.**.P<0.001.

图6 裸鼠成瘤实验检测BCYRN1对肺癌细胞的影响Fig.6 Effect of BCYRN1 on lung cancer cells in nude mice by tumorigenesisNote: A.Nude mice tumor formation test to detect BCYRN1 on lung cancer H1299 cells in vivo tumorigenic ability;B.Comparison between BCYRN1-siRNA group and NC group nude mice tumor weight.**.P<0.001.
2.5BCYRN1的表达对North1信号通路的影响情况 为了研究BCYRN1调控H1299细胞的生物学行为是否和Notch1信号通路相关。Western blot实验结果显示,抑制BCYRN1之后Notch1信号通路中的Notch1和hes1蛋白表达相应下调[(108.3±10.34)% vs (30.2±3.26)% vs (28.1±4.56)%,P=0.019],差异有统计学意义。说明抑制BCYRN1后肺癌H1299细胞的生物学行为的改变可能是通过Notch1信号通路进行调控的。
2.6BCYRN1的表达对肺癌细胞裸鼠体内成瘤能力的影响 裸鼠成瘤实验结果显示,肿瘤生长情况如图所示(图6A):与NC组裸鼠肿瘤大小相比,BCYRN1-siRNA组的肿瘤体积明显减小[体积(2.89±0.35)cm3vs (0.27±0.11)cm3,P=0.029]。处死裸鼠后,剥除肿瘤重量对比(图6B):与NC组相比,BCYRN1-siRNA组裸鼠肿瘤重量明显减小[(3.06±0.44)g vs (1.05±0.17)g,P=0.016]。表明抑制BCYRN1的表达后可以抑制肺H1299癌细胞的体外成瘤能力。
3 讨论
肺癌是全球发病率和死亡最高的呼吸系统恶性肿瘤,由于其诱因繁多,早期诊断率低,误诊情况出现较多,在我国的发病率远远高于部分发达国家,对人类的健康威胁巨大[13,14]。然而肺癌的具体病因和发病机制未完全研究清楚,鉴于其高危因素众多,对于有效预防和早期诊断存在很大难度,一般认为是多种混合高危因素互相影响的结果[15,16]。关于肺癌的治疗目前进展仍然缓慢,尽管针对少部分肺癌亚型可以通过综合治疗获得一定程度上的缓解,但是大部分类型的肺癌治疗效果不佳或者缓解后容易复发[17]。所以对肺癌分子发病机制的研究,可以为临床早期诊断和治疗提供有效的作用靶点和标志物,具有重要的科研和临床意义,也是目前多学科研究的重点方向。
长链非编码BCYRN1,也被称为BC200,一般在正常组织中表达很低,在多种类型的肿瘤组织中异常表达[18]。在研究中,在不同的肺癌细胞株中都观察到BCYRN1高表达水平,相比正常支气管上皮细胞,BCYRN1可能扮演一个促进肿瘤进展的因子。有研究表明,lncRNA对肿瘤的影响一般都是通过下游相关miRNA或蛋白靶点的激活发挥作用,lncRNA的异常表达通过调节肿瘤抑制或激活因子来诱导肿瘤发生[19]。
miR-503是常见的一种具有促癌作用的mRNA,其可以调控下游c-myc、Meg3等因子,可以调控数十种人类恶性肿瘤的进展,与患者诊断和预后都有一定关联[20]。有研究表明,miR-503通常在肿瘤抑制途径中被抑制,在致癌物中有相当活跃的状态,从而间接说明了其可以促进肿瘤的发生发展过程[21]。生物基因学者研究表明,miR-503的靶向因子基因多达3 000个人类基因,证明其存在的广泛性[22]。根据我们的实验结果发现,miR-503与BCYRN1的表达也存在一定的反馈关联,表明BCYRN1与对miR-503有一定的调控能力,尤其在肺癌H1299细胞中。miR-503是BCYRN1下游的一个作用靶标。还有学者研究发现其具体的机制可能是通过影响细胞的黏附能力进而影响肿瘤细胞的迁移和侵袭。
我们研究表明,BCYRN1的表达增高,可以导致肺癌H1299细胞的侵袭和迁移能力增强。Xu等[23]研究表明,BCYRN1的表达水平与肺癌的分期有关,并且BCYRN1与肺癌浸润深度和转移范围呈一定相关关系。本研究通过沉默BCYRN1的表达,发现肺癌细胞的侵袭和迁移能力变弱,结合前面实验结果表明BCYRN1在肺癌的发生、发展过程中起重要作用。然后继续探讨BCYRN1肺癌细胞可能的作用机制,通过关于lncRNA的包括生物信息学预测结合实验验证发现BCYRN1与miR-503有相似的结合位点,通过双荧光素酶检测BCYRN1和miR-503有直接的相互作用,表明BCYRN1可能是通过调控miR-503的表达对肺癌细胞进行干扰影响的。有学者研究报道,由于BCYRN1在不同类型的肿瘤中差异表达,表明BCYRN1的表达是具有组织特异性的[24]。在本研究中,我们发现BCYRN1在H1299肺癌细胞中表达水平显著上调。以前的研究表明,可能是因为表观遗传学的改变混合影响下游miRNA的失调表达。所以,需要进一步的研究来阐明潜在的可能机制。根据以往的研究显示,BCYRN1在口腔癌细胞和肝细胞癌细胞中表达下调,而在甲状旁腺癌,视网膜母细胞瘤和肾上腺皮质癌中表达上调[25]。
尽管在不同肿瘤中的调控水平存在不一致的情况,可以考虑是由于其作用机制不同所致。此外,BCYRN1也被报道可以直接通过蛋白质和mRNA水平抑制内源性CCND1来增加增殖期间的细胞群的生长速度来调控细胞生长,这表明BCYRN1是明确的促癌因子[26]。
为了进一步明确BCYRN1下游的调控肿瘤细胞转移的机制,我们通过检测细胞转移相关通路Notch1的激活情况,发现Notch1通路的的激活与BCYRN1的表达有一定的关系,表明BCYRN1诱导肿瘤细胞的转移和Notch1通路有密切关系。Notch1通路中的Notch1和hes1蛋白的表达是可以调节肿瘤细胞的转移行为的[27]。在本研究,通过Western blot分析发现Notch1蛋白质水平随着BCYRN1的降低水平而相应下降,间接证明BCYRN1可以激活Notch1通路的活性。所以,我们可以得出结论,BCYRN1的表达以某种方式影响了下游miR-503的表达从而激活Notch1信号通路对肺癌细胞的生物学行为进行调控。
我们针对BCYRN1在肺癌中的作用和具体机制进行了上述实验探讨,并通过靶向作用于BCAR4下游miR-503靶点,从而激活Notch1信号通路,验证H1299肺癌细胞的侵袭和迁移能力受到相应的调控。本研究结果不但丰富了BCYRN1在肺癌中的作用机制,而且还为以肺癌的早期诊断和分子靶标的治疗提供有力的理论支持。
[1] Cella DF,Bonomi AE,Lloyd SR,etal.Reliability and validity of the functional assessment of cancer therapy-lung(FACT-L)quality of life instrument[J].Lung Cancer,1995,12(3):199-220.
[2] Brodowicz T,Krzakowski M,Zwitter M,etal.Cisplatin and gemcitabine first-line chemotherapy followed by maintenance gemcitabine or best supportive care in advanced non-small cell lung cancer:a phase III trial[J].Lung Cancer,2006,52(2):155-163.
[3] 吴一龙,王长利,廖美琳,等.明智选择:常见的肺癌治疗决策[J].循证医学,2014,14(3):129-135.
[4] Gupta RA,Shah N,Wang KC,etal.Long non-coding RNA HOTAIR reprograms chromatin state to promote cancer metastasis[J].Nature,2010,464(7291):1071-1076.
[5] Wang P,Ren Z,Sun P.Overexpression of the long non-coding RNA MEG3 impairs in vitro glioma cell proliferation[J].J Cell Biochem,2012,113(6):1868-1874.
[6] Liu X,Sun M,Nie F,etal.Lnc RNA HOTAIR functions as a competing endogenous RNA to regulate HER2 expression by sponging miR-331-3p in gastric cancer[J].Mol Cancer,2014,13(1):92.
[7] Arun G,Diermeier S,Akerman M,etal.Differentiation of mammary tumors and reduction in metastasis upon Malat1 lncRNA loss[J].Genes Dev,2016,30(1):34-51.
[8] 张军旗,祝 德.长链非编码 RNA MALAT1 与非小细胞肺癌患者肿瘤复发和预后的相关性研究[J].广西医科大学学报,2016,33(3):459-463.
[9] Booy EP,McRae EKS,Howard R,etal.RNA helicase associated with AU-rich element(RHAU/DHX36)interacts with the 3′-tail of the long non-coding RNA BC200(BCYRN1)[J].J Biol Chem,2016,291(10):5355-5372.
[10] Zhang XY,Zhang LX,Tian CJ,etal.LncRNAs BCYRN1 promoted the proliferation and migration of rat airway smooth muscle cells in asthma via upregulating the expression of transient receptor potential 1[J].Am J Transl Res,2016,8(8):3409.
[11] Kim J,Kang Y,Kojima Y,etal.An endothelial apelin-FGF link mediated by miR-424 and miR-503 is disrupted in pulmonary arterial hypertension[J].Nature Med,2013,19(1):74-82.
[12] Sonoshita M,Itatani Y,Kakizaki F,etal.Promotion of colorectal cancer invasion and metastasis through activation of NOTCH-DAB1-ABL-RHOGEF protein TRIO[J].Cancer Discovery,2015,5(2):198-211.
[13] 姚晓军,刘伦旭.肺癌的流行病学及治疗现状[J].现代肿瘤医学,2014,22(8):1982-1986.
[14] 支修益,石远凯,于金明.中国原发性肺癌诊疗规范(2015 年版)[J].中华肿瘤杂志,2015,37(1):67-78.
[15] Solomon B J,Mok T,Kim D W,etal.First-line crizotinib versus chemotherapy in ALK-positive lung cancer[J].New England J Med,2014,371(23):2167-2177.
[16] Janne PA,Yang JCH,Kim DW,etal.AZD9291 in EGFR inhibitor-resistant non-small-cell lung cancer[J].New England J Med,2015,372(18):1689-1699.
[17] Rizvi NA,Mazières J,Planchard D,etal.Activity and safety of nivolumab,an anti-PD-1 immune checkpoint inhibitor,for patients with advanced,refractory squamous non-small-cell lung cancer(CheckMate 063):a phase 2,single-arm trial[J].Lancet Oncol,2015,16(3):257-265.
[18] Wang J,Roy B.Single-cell RNA-seq reveals lincRNA expression differences in Hela-S3 cells[J].Biotechnol Letters,2017,39(3):359-366.
[19] 朱彩华,曹新广,曹 巍,等.BCYRN1 表达上调与食管鳞癌患者预后差相关[J].医药论坛杂志,2016,37(2):4-8.
[20] Hu T,Lu YR.BCYRN1,a c-MYC-activated long non-coding RNA,regulates cell metastasis of non-small-cell lung cancer[J].Cancer cell international,2015,15(1):36.
[21] Qiu T,Zhou L,Wang T,etal.miR-503 regulates the resistance of non-small cell lung cancer cells to cisplatin by targeting Bcl-2[J].Int J Mol Med,2013,32(3):593-598.
[22] Li L,Sarver AL,Khatri R,etal.Sequential expression of miR-182 and miR-503 cooperatively targets FBXW7,contributing to the malignant transformation of colon adenoma to adenocarcinoma[J].J Pathol,2014,234(4):488-501.
[23] Xu YJ,Du Y,Fan Y.Long noncoding RNAs in lung cancer:what we know in 2015[J].Clin Translational Oncol,2016,18(7):660-665.
[24] Zhang XY,Ma LJ,Guo YL,etal.Effect of BCYRN1 on proliferation and migration of airway smooth muscle cells in rat model of asthma[J].Zhonghua Yi Xue Za Zhi,2016,96(46):3751-3756.
[25] Zhang XY,Zhang LX,Tian CJ,etal.LncRNAs BCYRN1 promoted the proliferation and migration of rat airway smooth muscle cells in asthma via upregulating the expression of transient receptor potential 1[J].Am J Translational Res,2016,8(8):3409.
[26] Biswas AK,Kang M,Kim DC,etal.Inferring disease associations of the long non-coding RNAs through non-negative matrix factorization[J].Network Modeling Analysis in Health Informatics and Bioinformatics,2015,4(1):9.
[27] Yu L,Liang H,Lu Z,etal.Membrane receptor-dependent Notch1/Hes1 activation by melatonin protects against myocardial ischemia-reperfusion injury:in vivo and in vitro studies[J].J Pineal Res,2015,59(4):420-433.
[收稿2017-05-25 修回2017-06-29]
(编辑 张晓舟)
EffectsofBCYRN1onmiR-503onmigrationandinvasionoflungcancerbyNotch1pathway
ZHANGJing-Jing,ZHANGYi,JIYing-Hua,ZHANGMin,LIWei-Wei,YANGQing-Hui,WANGJin,YUHai-Chuan,LUPing,WANGXiang-Peng.
CollaborativeInnovationCenterofHenanProvince,InstituteofMedicalLaboratoryScienceandMolecularDiognosticsandMedicalLaboratoryTechnology,Xinxiang453003,China
Objective:To investigate the mechanism of BCYRN1 regulating miR-503 through Notch1 signaling pathway in the migration and invasion of lung cancer.MethodsThe expression of BCYRN1 and miR-503 in different lung cancer cell lines were detected by qPCR.Immunofluorescence and qPCR were used to detect the transfection efficiency of lentivirus BCYRN1 + siRNA transfected lung cancer cells.Double luciferase reporter gene was used to detect the interaction between BCYRN1 and miR-503.Transwell invasion test and scratch test were used to detect the invasion and migration of lung cancer cells after silencing BCYRN1.Western blot was used to detect the expression of Notch1 signaling pathway silence BCYRN1.The effect of silencing BCYRN1 on lung cancer cells in nude mice was measured by subcutaneous tumor formation in nude mice.ResultsThe expression level of BCYRN1 was the highest in lung cancer cell H1299,and the expression level of miR-503 was relatively high.Immunofluorescence and mRNA levels demonstrated that BCYRN1 + siRNA lentivirus could be effectively transfected into H1299 cells;BCYRN19 binds specifically to the 3′-UTR of miR-503;silencing BCYRN1 could inhibit the invasion and migration of lung cancer H1299 cells;the expression of Notch1 pathway protein was down-regulated after silencing BCYRN1.Compared with NC group,tumor volume and weight of BCYRN1-siRNA group were significantly decreased.ConclusionBCYRN1 can target the regulation of miR-503 through Notch1 signaling pathway in the invasion and migration of lung cancer H1299 cells.
BCYRN1;Lung cancer;miR-503;Transwell
①本文为国家自然科学基金(No.31301135)、河南省自然科学基金(No.162300410211)和河南省科技攻关计划项目(No.201203068)。
②河南省新乡医学院第一附属医院肿瘤科,卫辉 453100。
R734.2
A
1000-484X(2017)10-1453-06
10.3969/j.issn.1000-484X.2017.10.003
张婧婧(1982年-),女,硕士,实验师,主要从事分子免疫学方面研究。
及指导教师:王向鹏(1985年-),男,副教授,主要从事长链非编码RNA在肿瘤发生发展中的机制研究,E-mail:15225991758@163.com。
