调节性B细胞在肿瘤免疫中的作用①
2017-10-24吴华国陈冠璇
吴华国 陈冠璇 张 慧
(山东省肿瘤防治研究院肿瘤化疗科,济南 250117)
调节性B细胞在肿瘤免疫中的作用①
吴华国 陈冠璇 张 慧
(山东省肿瘤防治研究院肿瘤化疗科,济南 250117)
早在20世纪50年代就有学者开始关注B细胞及其分泌的抗体在肿瘤进展过程中的作用[1]。这些早期研究指出,在移植性肿瘤模型和化学诱导性肿瘤模型中,肿瘤特异性抗体的传递可以促进肿瘤的生长[1,2],而B细胞缺失则会限制肿瘤的形成[3]。1996年Wolf等发现,在小鼠实验性自身免疫性脊髓炎(experimental autoimmune encephalomyelitis,EAE)模型中,B细胞缺陷小鼠的急性EAE情况要比野生型小鼠严重得多,因此推测有一群B细胞在其中起免疫调节功能[4]。1997年,Mizoguchi等[5]首次提出了“调节性B细胞”(B regulatory cells,Bregs)这一概念。他们在小鼠炎症性肠病(Inflammatory bowel disease,IBD)模型中发现,B细胞和自身抗体在抑制肠炎过程中发挥重要的调节作用,并猜想其作用机制可能是影响了凋亡细胞的正常清除。到了2002年,Fillatreau等[6]和Mizoguchi等[7]几乎同时证实,在慢性炎症环境下,有一群B细胞亚群可分泌IL-10,可以抑制由上调IL-1和激活STAT3引起的炎性级联反应。
2006年,Inoue等[8]研究发现,B细胞缺失可以促进小鼠CD8+T细胞和NK细胞的抗肿瘤活性。将肿瘤细胞与B淋巴细胞缺陷小鼠的脾细胞共同培养后,CD8+T细胞和NK细胞可分泌γ干扰素(Interferon-γ,IFN-γ),但如果在共培养时加入纯化的正常小鼠B淋巴细胞或IL-10,IFN-γ的分泌会明显减少,由此证明,B细胞或其产生的IL-10可抑制淋巴细胞对肿瘤细胞的杀伤作用。这也提示,B细胞耗竭可能通过其IL-10产生的减少而增强抗肿瘤免疫治疗的作用。2008年,Yanada等[9]和Matsushita等[10]发现了一类专职分泌IL-10的具有独特表型(CD5+CD1d+)的Bregs,这群Bregs分泌的IL-10几乎占B细胞来源的IL-10的全部,为了将这类专职分泌IL-10的B细胞和其他Bregs亚群相区别,这群细胞也被称为B10。到了2011年,Horikawa等[11]证实,内生性的B10细胞是固有免疫中强有效的负性调节分子,仅少量的B10细胞即可抑制CD20mAbs介导的对淋巴瘤的杀伤作用。因此猜测,清除B10细胞,在治疗恶性B细胞非霍奇金淋巴瘤患者方面,可能具有良好的效果。2012年,一项纳入了36位肝细胞性肝癌(Hepatocellular carcinoma,HCC)患者的临床研究表明,与健康人群相比,施行手术后的肝癌病人其外周血中的调节性T细胞(T regulatory cells,Tregs)和Bregs均显著增加,提示针对Tregs和Bregs的治疗可能有利于肝癌病人的手术预后[12]。以上这些有关Bregs在肿瘤免疫方面的深入研究,也为在临床上开展肿瘤免疫治疗提供了新的思路和方向。
1 调节性B细胞的来源和表型
关于Bregs的来源众说纷纭,迄今为止仍未有统一的定论。根据学者们的探索结果,目前可能的来源有以下五个:过渡2型边缘带前体B细胞(Transitional 2 marginal zone precursor B cells,T2-MZP)、边缘带B细胞(Marginal zone B cells,MZB)、滤泡区B细胞(Follicular B cells,FOB)、B1a细胞与Breg祖细胞。Lampropoulou等[13]的研究发现,幼稚的滤泡区B细胞(naive FOB)可通过Toll样受体(Toll-like receptor,TLR)接受刺激并通过CD40与BCR放大后可以表现出免疫抑制作用。但同时也有证据表明,FOB是所有B细胞亚群中分泌IL-10最少的,而且并不具有免疫抑制作用[14]。由相似的表型推测,Breg细胞可能来源于T2-MZP、MZB与B1a细胞[15]。Mauri等[16]认为其可能来源于过渡2型边缘带前体B细胞(T2-MZP)。Dalwadi等[17]的研究显示,缺少T2-MZP与MZB但FOB功能与数量不变的Gαi2基因缺陷的小鼠发生了自发的结肠炎。Li等[18]发现,在转人TNF基因的小鼠慢性关节炎模型中,关节腔和淋巴结中均出现了大量T2样B细胞的。这两项研究均支持了这一观点。还有学者认为,对于小鼠来说,在脾中存在一种独特的Breg祖细胞,可以分化为产生IL-10的Breg[19]。另一种Breg的分化模型表明,Breg存在多个亚型,并且每个亚型需接受各自不同的刺激分化产生。“获得性”抗原特异性Breg接受CD40与BCR的刺激产生,“不成熟的”Breg有一系列不成熟的B细胞接受CD40刺激信号产生,而“固有的”Breg则由B1细胞和MZB接受TLR刺激信号产生[20]。
关于调节性B细胞的表型,现在还没有一种用来区分Breg细胞的成熟方法,而使用IL-10来检测Breg细胞需要进行固定与破膜,因此找到一种或一类Breg特有的细胞表面分子表型就显得十分重要。由于人脾组织获取十分困难,目前对于人Breg细胞的研究多集中在外周血中。除上述的T2-MZP、MZB与B1a细胞外,目前研究最多的鼠Breg表型是B10亚群(CD19+CD5+CD1d+)[21]。这一亚群占鼠的脾B细胞1%~2%,其可以抑制多种自身免疫病的进展[15]。同时,与CD4+效应T细胞分化有关的T细胞免疫球蛋白1(T cell immune globulin 1,TIM-1)也在大多数鼠类的Breg细胞上表达[22],提示TIM-1或许可以成为一个Breg细胞的表面标志。另外,一项研究表明,体外LPS刺激B细胞上调了IL-10的表达,但是其中表达最大量IL-10的细胞是CD19+CD138+的浆细胞,其分泌的IL-10多于CD1dhiCD5+的Breg细胞。另一项研究观察到了类似表型的具有调节作用的浆细胞在沙门氏菌感染后出现[23],两项研究共同提示CD138+的B细胞亚群可能在免疫调节中发挥作用。
对于人外周血Breg细胞表型,各项研究的结果也不尽相同。CD19+CD24hiCD38hi的B细胞可以分泌大量IL-10并且在SLE模型中功能降低[24]。也有研究表明,CD19+CD24+CD27+B细胞也具有类似B10细胞的功能[25]。而CD19+IgD+CD24hiCD38hiCD5hi的B细胞也被发现具有抑制作用与在体外诱导Tregs细胞分化的能力[26](表1)。

表1 调节性B细胞的来源和表型
2 调节性B细胞在肿瘤免疫中的作用机制
迄今为止,人们发现的调节性B细胞在肿瘤免疫中的作用机制主要包括以下几个方面:一方面,Bregs可以通过分泌IL-10,减少Th1细胞和Th17等T细胞的分化,减少肿瘤抑制性细胞因子的表达;另一方面,Bregs可以通过分泌TGF-β、协同共刺激分子和IL-10一同诱导Tregs的产生,从而通过Tregs抑制免疫效应细胞的功能,是肿瘤免疫逃逸的关键因素(图1)。
2.1Bregs通过分泌IL-10减少肿瘤抑制性细胞因子的产生 Yang等[27]研究表明,Bregs可以通过分泌IL-10,下调STAT3的磷酸化,减少Th17细胞的分化,从而减少转录因子维A酸相关孤独受体γt(Retinoic acid receptor-related orphan receptor gammat,RORγt)的表达。在小鼠实验模型中,也有多项研究证实,调节性B细胞可以在体内和体外通过抑制Th1细胞下调IFN-γ和TNF的表达[28,29],而RORγt、IFNγ、TNF、肿瘤的形成和进展均密切相关[30-33]。Schioppa等[33]的研究揭示了Bregs在皮肤鳞状细胞癌的形成和进展中发挥关键性作用,TNF-α在其中起着重要的角色,B细胞可以通过产生TNF-α而促进Bregs的增殖,从而使皮肤鳞状细胞癌进一步恶化。也有研究显示,将肿瘤细胞与B淋巴细胞缺陷小鼠的脾细胞共同培养,CD8+T细胞和NK细胞能分泌IFN-γ,但是如果在共同培养时加入纯化的正常小鼠B淋巴细胞或IL-10,则IFN-γ的分泌就会明显减少。这说明B细胞或其产生的IL-10可抑制淋巴细胞对肿瘤细胞的杀伤作用。Olkhanud等[34]利用EL4模型表明,调节性B细胞产生的IL-10可能和体外IFN-γ反应性降低有关,调节性B细胞的存在可能是肿瘤转移的关键因素。这种可能诱发肿瘤转移的调节性B细胞也被称为肿瘤诱发调节性B细胞(tumor-evoked Bregs,tBregs)[34]。
2.2Bregs通过分泌TGF-β/共刺激分子/IL-10等诱导Tregs的产生 Parekh等[35]发现,活化的调节性B细胞除了可以表达Fas配体,还可以表达TGF-β1。Bregs可以通过TGF-β控制CD4+T细胞向Tregs分化,这也是除了IL-10外,Bregs的免疫抑制机制中被研究得最多的机制之一。Blair等[36]的研究表明,表型为CD19+CD24hiCD38hi调节性B细胞也可以抑制T细胞的功能,诱导Tregs的产生,且这种抑制作用可以是依赖于CD80/CD86共刺激分子存在,阻断CD80/CD86可以大大降低Bregs对T细胞的抑制作用。由此可知,Bregs可依赖于CD80/CD86等共刺激分子信号发挥对T细胞的抑制功能。另外,他们发现,CD40/CD40L、CTLA4同样起类似作用[37]。说明Bregs除了可以通过分泌IL-10和TGF-β以外,还可以依赖CTLA4、CD80/CD86、CD40/CD40L等共刺激分子信号,抑制T细胞的功能,诱导Tregs的产生,从而使肿瘤发生免疫逃逸。相关的机制图如图1所示。
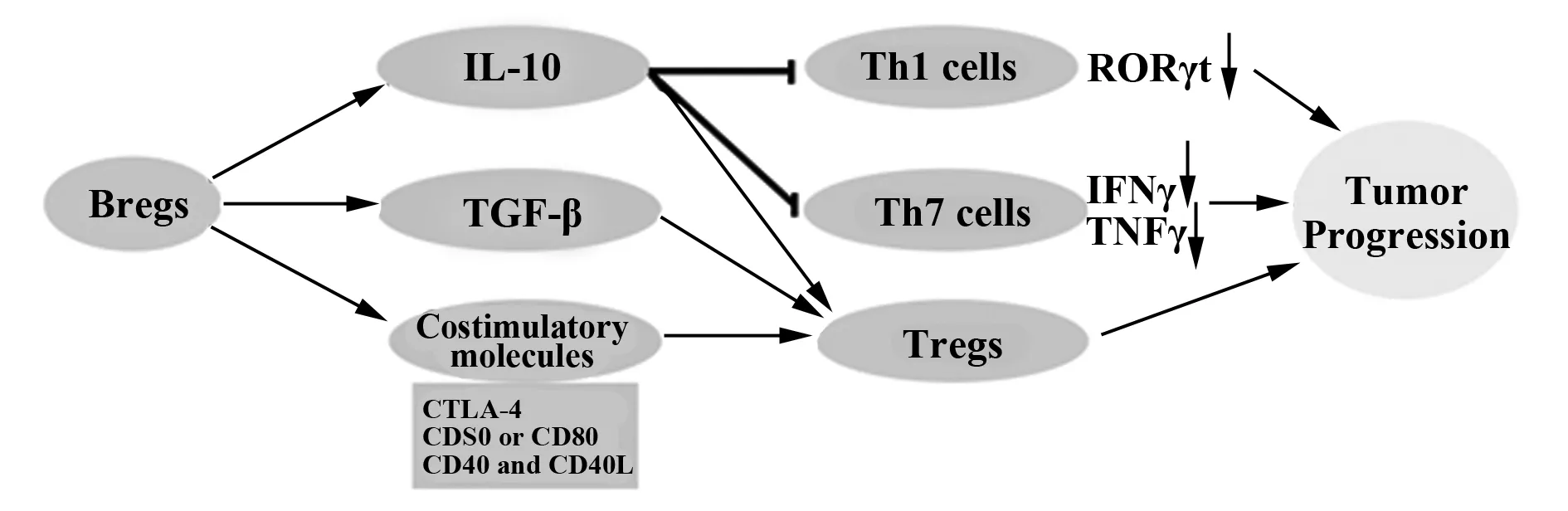
图1 Bregs在肿瘤免疫中的作用机制图Fig.1 Role of Bregs in tumor immune mechanism
3 Bregs与肿瘤耐药
非霍奇金淋巴瘤用CD20mAb治疗可以取得非常好的效果,但很容易复发。Horikawa等[11]发现,分泌IL-10的Bregs参与肿瘤的形成,并在淋巴瘤抗CD20治疗耐药性的形成过程中发挥重要作用。他们在小鼠模型中发现,即使仅有少量的B10细胞,也可以显著地抑制CD20mAb对淋巴瘤的杀伤作用。因此,关于Bregs细胞的特异性清除能否降低肿瘤的耐药性有待证明。另外,Ammirante等[38]发现,一群B细胞产生的淋巴毒素等细胞因子,在雄激素抵抗性前列腺癌中,可以不依赖雄激素激活肿瘤细胞中的κB抑制蛋白激酶α(Inhibitor of κB α-kinase,IKKα)和STAT3,从而容易使肿瘤复发,使雄激素抵抗性前列腺癌进一步恶化。这群可以调控IKKα和STAT3的B细胞是否和肿瘤的耐药性有关系,靶向Bregs能否逆转肿瘤多药耐药,值得进一步证明。
4 针对调节性B细胞的治疗策略
Bodogai等[39]发现,对于某些肿瘤,单纯运用CD20mAb耗竭B细胞的策略并不能起到良效,反而会加速癌症的进展和转移,这是由于人类和鼠类tBregs表达的CD20维持在非常低的水平,因此抗CD20抗体会聚集在这些细胞周围,从而对这群细胞起到保护作用。当他们用一种名为趋化因子CXCL13偶联寡核苷酸CpG(非甲基化胞嘧啶鸟嘌呤二核苷酸)抑制住低表达CD20的tBregs时,肿瘤的转移则被非常显著抑制。该研究提示,在进行靶向Bregs等免疫治疗时,分析tBregs等的特征性表型也同样重要。另外一项研究发现,在实体肿瘤微环境中,IL-21诱导型的Tregs附件有一群表型为CD19+CD38+CD1d+IgM+CD147+Bregs。这群Bregs与Tregs有类似的功能,同样可以表达颗粒酶B(granzyme B,GrB or GZMB)和吲哚胺-2,3-双加氧酶(indoleamine-2,3-dioxygenase)[40]。
Lee-Chang等[41]研究证实,tBregs可通过诱导Foxp3+Tregs的产生促进乳腺癌的肺部转移。他们还发现,在小鼠模型中,运用一种叫白藜芦醇(Resveratrol,RSV)的植物多酚,可以有效地逆转乳腺癌的肺部转移。其机理是这种药物可以抑制STAT3的激活,减少tBregs的增殖并使其表达TGF-β等功能受抑制,从而发挥抗肿瘤效果。
5 结语
总而言之,调节性B细胞可以依赖于CD40/CD40L、CD80/CD86等多种共刺激信号,以及分泌IL-10、TGF-β等多种细胞因子,抑制Th1、Th17等细胞的增殖和功能,诱导调节性T细胞的产生,从而使肿瘤发生免疫逃逸,甚至加重肿瘤的复发和转移,对调节性B细胞的深入研究可以为肿瘤免疫治疗提供新的方向和思路。但目前,关于调节性B细胞的来源不是十分清楚,各种来源相关的假说仍有待证实;同时,由于对人体研究的局限性,调节性B细胞的表型研究大多局限在鼠科动物,人类的调节性B细胞表型和功能研究仍有待开展。另外,关于调节性B细胞的作用机制,Bregs活化的信号通路,Bregs与调节性T细胞、树突状细胞和调节性树突状细胞等其他免疫细胞的相互作用方式,特异性靶向清除调节性B细胞抗肿瘤的方法和效果等,仍有待于深入研究。
[1] Kaliss N.Immunological enhancement of tumor homografts in mice:a review[J].Cancer Res,1958,18(9):992-1003.
[2] Ran M,Witz IP.Tumor-associated immunoglobulins.Enhancement of syngeneic tumors by IgG2-containing tumor eluates[J].Int J Cancer,1972,9(1):242-247.
[3] Brodt P,Gordon J.Natural resistance mechanisms may play a role in protection against chemical carcinogenesis[J].Cancer Immunol Immunother,1982,13(2):125-127.
[4] Wolf SD,Dittel BN,Hardardottir F,etal.Experimental autoimmune encephalomyelitis induction in genetically B cell-deficient mice[J].J Exp Med,1996,184(6):2271-2278.
[5] Mizoguchi A,Mizoguchi E,Smith RN,etal.Suppressive role of B cells in chronic colitis of T cell receptor alpha mutant mice[J].J Exp Med,1997,186(10):1749-1756.
[6] Fillatreau S,Sweenie CH,Mcgeachy MJ,etal.B cells regulate autoimmunity by provision of IL-10[J].Nat Immunol,2002,3(10):944-950.
[7] Mizoguchi A,Mizoguchi E,Takedatsu H,etal.Chronic intestinal inflammatory condition generates IL-10-producing regulatory B cell subset characterized by CD1d upregulation[J].Immunity,2002,16(2):219-230.
[8] Inoue S,Leitner WW,Golding B,etal.Inhibitory effects of B cells on antitumor immunity[J].Cancer Res,2006,66(15):7741-7747.
[9] Yanaba K,Bouaziz JD,Haas KM,etal.A regulatory B cell subset with a unique CD1dhiCD5+phenotype controls T cell-dependent inflammatory responses[J].Immunity,2008,28(5):639-650.
[10] Matsushita T,Horikawa M,Iwata Y,etal.Regulatory B cells (B10 cells) and regulatory T cells have independent roles in controlling experimental autoimmune encephalomyelitis initiation and late-phase immunopathogenesis[J].J Immunol,2010,185(4):2240-2252.
[11] Horikawa M,Minard-Colin V,Matsushita T,etal.Regulatory B cell production of IL-10 inhibits lymphoma depletion during CD20 immunotherapy in mice[J].J Clin Invest,2011,121(11):4268-4280.
[12] Chen T,Song D,Min Z,etal.Perioperative dynamic alterations in peripheral regulatory T and B cells in patients with hepatocellular carcinoma[J].J Transl Med,2012,10:14.
[13] Lampropoulou V,Calderon-Gomez E,Roch T,etal.Suppressive functions of activated B cells in autoimmune diseases reveal the dual roles of Toll-like receptors in immunity[J].Immunol Rev,2010,233(1):146-161.
[14] Evans JG,Chavez-Rueda KA,Eddaoudi A,etal.Novel suppressive function of transitional 2 B cells in experimental arthritis[J].J Immunol,2007,178(12):7868-7878.
[15] Kalampokis I,Yoshizaki A,Tedder TF.IL-10-producing regulatory B cells (B10 cells) in autoimmune disease[J].Arthritis Res Ther,2013,15(Suppl 1):S1.
[16] Mauri C,Bosma A.Immune regulatory function of B cells[J].Annu Rev Immunol,2012,30:221-241.
[17] Dalwadi H,Wei B,Schrage M,etal.B cell developmental requirement for the G alpha i2 gene[J].J Immunol,2003,170(4):1707-1715.
[18] Li J,Kuzin I,Moshkani S,etal.Expanded CD23(+)/CD21(hi) B cells in inflamed lymph nodes are associated with the onset of inflammatory-erosive arthritis in TNF-transgenic mice and are targets of anti-CD20 therapy[J].J Immunol,2010,184(11):6142-6150.
[19] Yanaba K,Bouaziz JD,Matsushita T,etal.The development and function of regulatory B cells expressing IL-10 (B10 cells) requires antigen receptor diversity and TLR signals[J].J Immunol,2009,182(12):7459-7472.
[20] Zhang X.Regulatory functions of innate-like B cells[J].Cell Mol Immunol,2013,10(2):113-121.
[21] Stolp J,Turka LA,Wood KJ.B cells with immune-regulating function in transplantation[J].Nat Rev Nephrol,2014,10(7):389-397.
[22] Ding Q,Yeung M,Camirand G,etal.Regulatory B cells are identified by expression of TIM-1 and can be induced through TIM-1 ligation to promote tolerance in mice[J].J Clin Invest,2011,121(9):3645-3656.
[23] Neves P,Lampropoulou V,Calderon-Gomez E,etal.Signaling via the MyD88 adaptor protein in B cells suppresses protective immunity during Salmonella typhimurium infection[J].Immunity,2010,33(5):777-790.
[24] Blair PA,Norena LY,Flores-Borja F,etal.CD19(+)CD24(hi)CD38(hi) B cells exhibit regulatory capacity in healthy individuals but are functionally impaired in systemic Lupus Erythematosus patients[J].Immunity,2010,32(1):129-140.
[25] Iwata Y,Matsushita T,Horikawa M,etal.Characterization of a rare IL-10-competent B-cell subset in humans that parallels mouse regulatory B10 cells[J].Blood,2011,117(2):530-541.
[26] Lemoine S,Morva A,Youinou P,etal.Human T cells induce their own regulation through activation of B cells[J].J Autoimmun,2011,36(3-4):228-238.
[27] Yang M,Deng J,Liu Y,etal.IL-10-producing regulatory B10 cells ameliorate collagen-induced arthritis via suppressing Th17 cell generation[J].Am J Pathol,2012,180(6):2375-2385.
[28] Evans JG,Chavez-Rueda KA,Eddaoudi A,etal.Novel suppressive function of transitional 2 B cells in experimental arthritis[J].J Immunol,2007,178(12):7868-7878.
[29] Yang M,Sun L,Wang S,etal.Novel function of B cell-activating factor in the induction of IL-10-producing regulatory B cells[J].J Immunol,2010,184(7):3321-3325.
[30] Sinha P,Parker KH,Horn L,etal.Tumor-induced myeloid-derived suppressor cell function is independent of IFN-gamma and IL-4Ralpha[J].Eur J Immunol,2012,42(8):2052-2059.
[31] Di Minin G,Bellazzo A,Dal Ferro M,etal.Mutant p53 reprograms tnf signaling in cancer cells through interaction with the tumor suppressor DAB2IP[J].Mol Cell,2014,56(5):617-629.
[32] Zhang Y,Luo X,Wu D,etal.ROR nuclear receptors:structures,related diseases,and drug discovery[J].Acta Pharmacol Sin,2015,36(1):71-87.
[33] Schioppa T,Moore R,Thompson RG,etal.B regulatory cells and the tumor-promoting actions of TNF-alpha during squamous carcinogenesis[J].Proc Natl Acad Sci U S A,2011,108(26):10662-10667.
[34] Olkhanud PB,Damdinsuren B,Bodogai M,etal.Tumor-evoked regulatory B cells promote breast cancer metastasis by converting resting CD4(+) T cells to T-regulatory cells[J].Cancer Res,2011,71(10):3505-3515.
[35] Parekh VV,Prasad DV,Banerjee PP,etal.B cells activated by lipopolysaccharide,but not by anti-Ig and anti-CD40 antibody,induce anergy in CD8+T cells:role of TGF-beta 1[J].J Immunol,2003,170(12):5897-5911.
[36] Blair PA,Norena LY,Flores-Borja F,etal.CD19(+)CD24(hi)CD38(hi) B cells exhibit regulatory capacity in healthy individuals but are functionally impaired in systemic Lupus Erythematosus patients[J].Immunity,2010,32(1):129-140.
[37] Blair PA,Chavez-Rueda KA,Evans JG,etal.Selective targeting of B cells with agonistic anti-CD40 is an efficacious strategy for the generation of induced regulatory T2-like B cells and for the suppression of lupus in MRL/lpr mice[J].J Immunol,2009,182(6):3492-3502.
[38] Ammirante M,Luo JL,Grivennikov S,etal.B-cell-derived lymphotoxin promotes castration-resistant prostate cancer[J].Nature,2010,464(7286):302-305.
[39] Bodogai M,Lee CC,Wejksza K,etal.Anti-CD20 antibody promotes cancer escape via enrichment of tumor-evoked regulatory B cells expressing low levels of CD20 and CD137L[J].Cancer Res,2013,73(7):2127-2138.
[40] Lindner S,Dahlke K,Sontheimer K,etal.Interleukin 21-induced granzyme B-expressing B cells infiltrate tumors and regulate T cells[J].Cancer Res,2013,73(8):2468-2479.
[41] Lee-Chang C,Bodogai M,Martin-Montalvo A,etal.Inhibition of breast cancer metastasis by resveratrol-mediated inactivation of tumor-evoked regulatory B cells[J].J Immunol,2013,191(8):4141-4151.
[收稿2017-02-16 修回2017-03-20]
(编辑 许四平 刘格格)
①本文为国家自然基金青年项目(8150111724)、山东省博士基金(2015BSC03007)和山东省医科院基金(No.2014-49)。
R730.3R392.12
A
1000-484X(2017)10-1584-05
10.3969/j.issn.1000-484X.2017.10.031
吴华国(1990年-),男,硕士,住院医师,主要从事肿瘤药理学方面的研究,就职于山东省肿瘤防治研究院头颈外科,E-mail:whg2007@aliyun.com。
及指导教师:张 慧(1986年-),女,博士,主治医师,硕士生导师,主要从事肿瘤个体化治疗方面的研究,E-mail:hui8942615@163.com。
