呼吸道合胞病毒融合蛋白(F蛋白)结构及中和表位的研究进展①
2017-10-24曹健力夏宁邵郑子峥
曹健力 张 伟 夏宁邵 郑子峥
(厦门大学国家传染病诊断试剂与疫苗工程技术研究中心,厦门大学分子疫苗学与分子诊断学国家重点实验室,厦门 361102)
呼吸道合胞病毒融合蛋白(F蛋白)结构及中和表位的研究进展①
曹健力 张 伟 夏宁邵 郑子峥
(厦门大学国家传染病诊断试剂与疫苗工程技术研究中心,厦门大学分子疫苗学与分子诊断学国家重点实验室,厦门 361102)
呼吸道合胞病毒(Respiratory syncytial virus,RSV),是造成全世界范围内婴幼儿下呼吸道感染的主要原因之一,2岁前的幼儿几乎全部感染过RSV[1],造成肺炎及毛细支气管炎等呼吸道疾病[2]。 0~2个月的婴儿在感染RSV后易出现严重的病症[3]。而在最新的全球疾病死亡率分析中,1月到1周岁的儿童死亡中约有6.7%是由RSV感染造成的[4]。青壮年人群感染后病症较轻,但在老年人群中会出现严重病症及死亡病例[5]。人体被RSV感染后会激发出中和抗体并引发T细胞应答,但免疫能力会随着时间衰退,进而造成终身的反复感染[6]。至今没有安全有效的疫苗上市,唯一获准上市的RSV特异性药物是中和单抗Palivizumab(Synagis®),但由于其价格高昂,中和效价不足致免疫剂量大等原因,目前仅用于降低免疫缺陷和先心病等高危新生儿的患病风险。结构生物学解析显示Palivizumab能够与一种稳定构象的F蛋白结合,提示F蛋白作为中和抗体靶向蛋白的重要性。
呼吸道合胞病毒属于副黏病毒科(Paramyxov-iridae)成员,根据表面抗原的差异可分为RSV-A和RSV-B两个亚型[7,8]。包含10个基因,编码11种蛋白[9]。其中G蛋白和F蛋白是病毒表面的主要保护性抗原,能激起机体产生中和抗体[10]。G蛋白在亚型间差异性较大,故针对G蛋白的抗体大多是型特异性抗体[11,12],而F蛋白在亚型间高度保守,由F蛋白诱导产生的抗体可同时抑制A/B型RSV病毒的感染,而且F蛋白也是激发机体产生保护性抗体的主要靶向蛋白[13,14]。因此,目前疫苗研究的重要目的是激起靶向RSV F的高中和抗体。
近期,研究者在RSV F蛋白的蛋白结构,表位及其免疫原性等方面均取得了显著进展,其中包括通过抗原抗体复合物晶体解析出融合前构象(Prefusion)和融合后构象(Postfusion)的结构,并发现了新的中和抗体表位。本文旨在总结近年来RSV F蛋白的研究进展,包括Post/Prefusion结构的解析、代表性表位及其抗体的发现,以期对疫苗发展做出贡献。
1 呼吸道合胞病毒融合蛋白的结构研究
呼吸道合胞病毒F蛋白(Fusion glycoprotein,融合蛋白)是N-糖基化的Ⅰ型跨膜蛋白,全长为574个氨基酸,包含信号肽(aa 2-20)、信号肽切割位点(aa 21-25)、F2区(aa 26-109)、多肽裂解区(aa 110-136)以及F1区(aa 137-574)[15]。RSV感染细胞后,会先合成一个70 kD的非活性F0前体,组装成同源三聚体,之后转移到高尔基体,109和136位点经弗林蛋白酶切割后,F1和F2通过二硫共价键连接成具有活性的F蛋白[16,17]。F2亚单位含有2个N连接糖基化位点,决定RSV感染的宿主特异性[18]。F1亚单位则包含了膜融合的重要因素:F1-N端融合膜肽段(FP,aa 137-155),引发细胞膜融合,以及F1-C端穿膜肽段(TM,aa 488-516)。F1核心包括HR1(aa 149-206)和HR2(aa 474-523),两者都是亮氨酸基序形成的卷曲螺旋结构,其中HR1可以介导融合肽段插入靶细胞膜。在F结构并未明确解析的早期,研究者猜测RSV F蛋白与其他副黏病毒科病毒类似,在病毒粒子表面存在亚稳定态的融合前构象(Prefusion F)[19]。
随着冰冻电镜技术的发展,研究者在病毒粒子表面同时观测到Prefusion和Postfusion结构[20],该发现也同时证明了Prefusion是亚稳定状态,最终会转变为稳定态的Postfusion形态。研究也证明了高温以及低渗透压会引发Prefusion的变构[21,22]。但是目前对自然环境下变构的触发机制仍不明确。有研究者提出是宿主细胞表面的受体与F蛋白结合而触发了融合机制,比如最近发现的核仁素[23,24]。
由于Postfusion结构的稳定性,通过重组表达系统获得的F蛋白可以稳定保持在Postfusion状态。Melero团队在2011年首次通过重组痘病毒载体表达系统在HEp2细胞上表达出可溶性的Postfusion蛋白[25],通过电镜及蔗糖密度梯度分析,该蛋白能聚集呈玫瑰花状。同年,McLellan团队利用哺乳动物细胞悬浮表达纯化,得到了缺失融合膜肽段(FP)前10个疏水性氨基酸及穿膜(TM)区的F蛋白,随后通过X射线晶体学衍射对其结构进行解析[26,27]。该蛋白的结构(图1B)揭示Postfusion是1个类似锥形的三聚体分子,头部类似球状,尾部呈柄状,头部包含F1和F2亚单位且两者紧密地结合在一起,形成了数个α螺旋和β折叠。尾部包含6HB结构,几乎全由α螺旋构成,与其他Ⅰ型融合蛋白的Post结构类似。
由于Prefusion蛋白结构的不稳定,存在多种中间体,在前期实验中,McLellan团队利用已知结构的HPIV5 prefusion蛋白对RSV prefusion蛋白的结构进行模拟和预测[28],提出RSV F蛋白极可能存在类似的Prefusion结构。接下来,为了解析Prefusion的准确结构,McLellan团队在F蛋白基因上分别进行一系列的基因突变以稳固Prefusion状态,选取其中的优势突变质粒(敲除C端的穿膜区肽段,C端引入了三聚体结构稳定肽,凝血酶切割位点,6个His标签以及Streptag标签)与针对Prefusion的单克隆抗体质粒共转[29]。该复合物制备并纯化后进行晶体结构解析,从结构上看,Prefusion是一个致密的椭圆形三聚体结构,其中部有一个空腔(图1A)。RSV F蛋白胞外域部分约有470个氨基酸,其中约300个在Prefusion和Postfusion间是相对保守的,差异部分基本都位于F1的C端和N端(图1C、D)。pre-F蛋白的近膜端包含F2-N端和F1-C端,其由1个三层β折叠及3个螺旋(α8、α9和α10)组成的,其中α10螺旋延伸到病毒膜中。而远膜端包含F1-N端和F2-C端,由7个螺旋(α1-α7)形成的三股反向平行折叠组和β折叠发夹(β3+β4)组成(图1C)。3个原聚体(Protomer)相互接触从而稳固三聚体的结构(图1A)。在Prefusion转变为Postfusion的过程中,F1 N端的变化最为明显,有5个二级结构会重排为更延展的α螺旋,这5个二级结构分别是α2、α3、α4、β3和β4(图1C、D)。大部分特异性靶向Prefusion的抗体结合在F1的C端或者N端,而与Prefusion和Postfusion均有反应的抗体,它们的结合位点基本位于变构前后的保守性区域。
2 融合蛋白的表位研究
随着呼吸道合胞病毒融合蛋白结构的解析,新的中和表位也被逐步发现,目前确认的代表性表位及其对应抗体有:SiteⅠ:131-2a[30];SiteⅡ:1129[31]、Palivizumab[32]、Motavizumab[33];SiteⅢ:MPE8[34];SiteⅣ:101F[35];SiteⅤ:7.936;SiteⅥ:7.916和9.432[36];SiteⅦ:hRSV90[37];Site Ø: D25、5C4、AM22[29](表1、图2)。此外,还发现一株特异性结合Prefusion三聚体表位的抗体AM14[38]。由于F蛋白存在变构现象,部分表位会由于结构的扭曲或延展而消失。其中,SiteⅠ、SiteⅡ、SiteⅣ~Ⅵ在Prefusion及Postfusion结构均存在,而其中代表性的中和表位是SiteⅡ和SiteⅣ。针对这两个表位的抗体虽不能阻断病毒吸附,但是可以通过阻断病毒粒子与宿主细胞膜的融合来中和感染[39]。
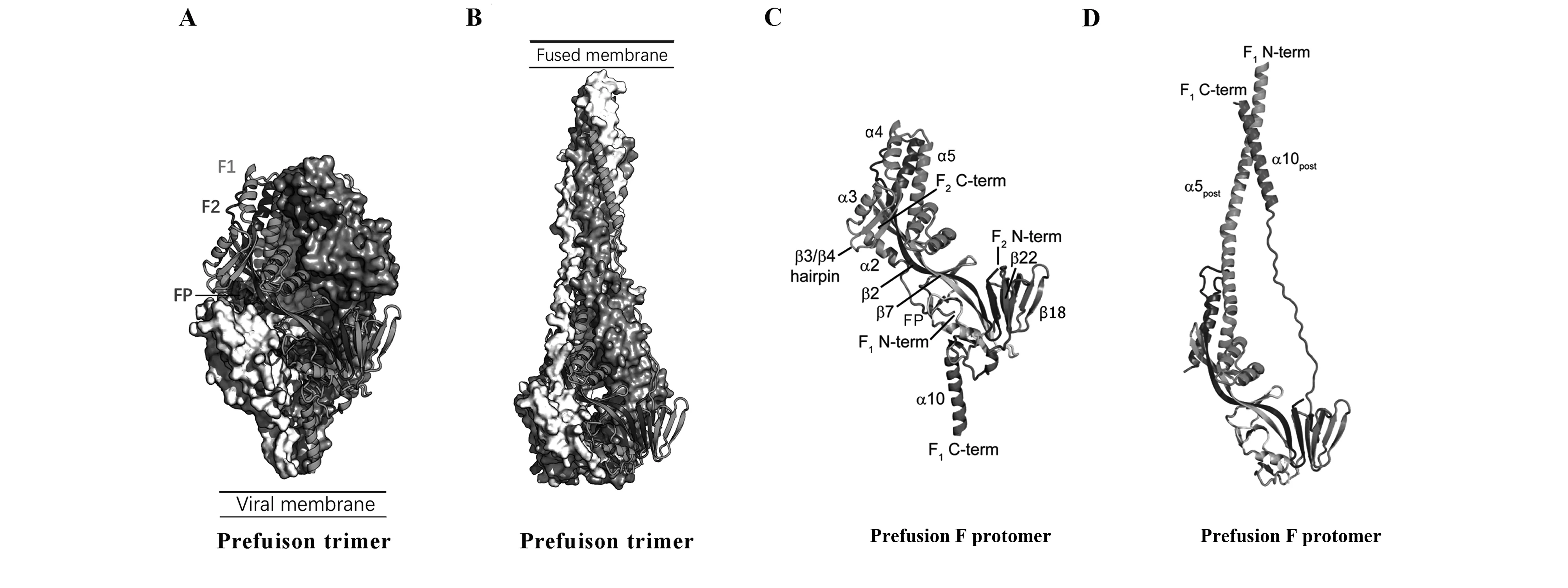
图1 RSV Prefusion蛋白及Postfusion蛋白的二级结构比较[29]Fig.1 Comparision of Pre- and Postfusion secondary structure[29]
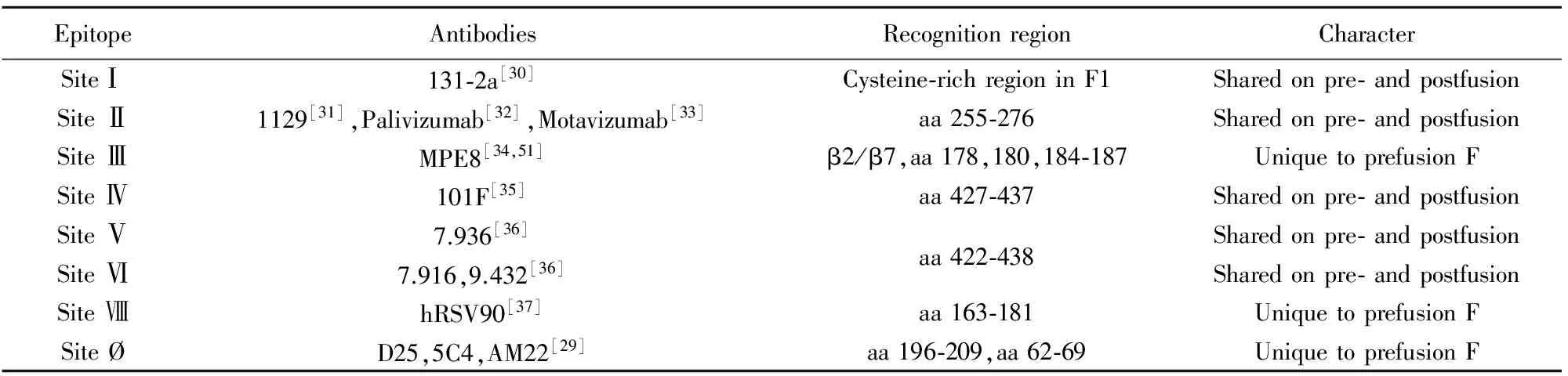
表1 RSV F蛋白表位情况
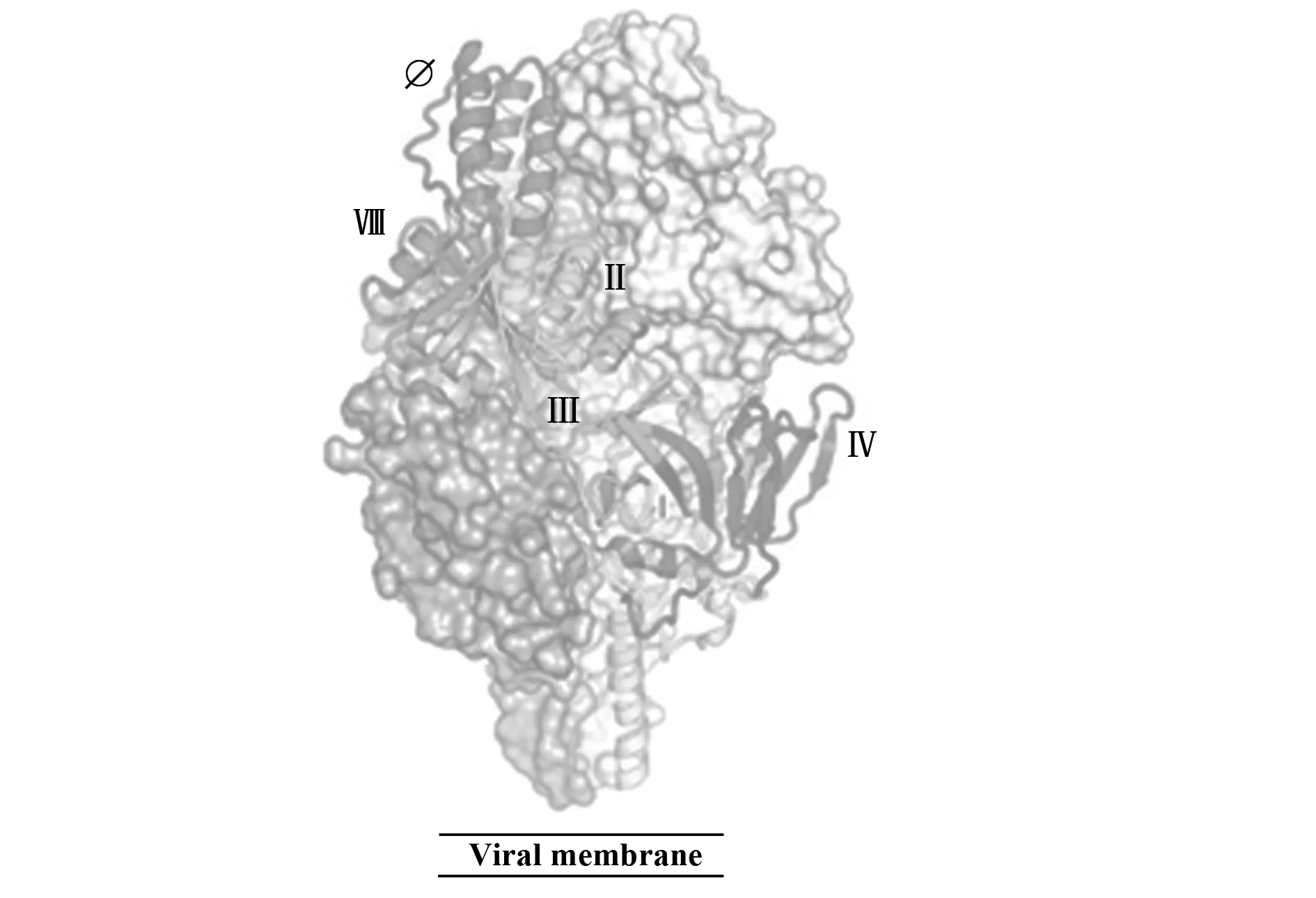
图2 RSV Prefusion现有的中和表位情况[54]Fig.2 Current neutralizing epitopes on RSV prefusion[54]
2.1SiteⅡ SiteⅡ的代表性抗体是鼠源抗体1129[31]、人源化的Palivizumab[40]与其二代抗体Motavizumab[33]。F蛋白对这些抗体的逃逸突变位于F1的Asn262、Asn268和Lys272,结合表位横跨了aa 255-276。从Motavizumab与RSV-F复合物的晶体结构可以看到,该表位形成了一个螺旋-环-螺旋(Helix-loop-helix)结构,Motavizumab识别的是这两个螺旋[41]。虽然这个表位是由不连续的残基组成,但仍然聚合成一个20氨基酸的线性肽段,使SiteⅡ可以成为免疫及疫苗发展的潜力靶标。
Lopez团队曾用该表位的肽段免疫,但并没有激起中和抗体[31],其实从结构上可以发现,保持螺旋-环-螺旋结构对抗体识别是至关重要的,所以一旦破坏了该空间结构,就无法有效激起抗体。McLellan团队为了稳固该结构,曾尝试将表位放置于一个含有逆平行α螺旋的支架蛋白上,但该重组蛋白免疫后并不能显著提高小鼠体内的中和抗体滴度[42]。Schief团队则通过计算机设计和纳米粒子展示的方法,生产出了Motavizumab表位支架,该蛋白能在恒河猴体内激起类似Motavizumab的中和抗体[43]。虽然激起的体内抗体滴度较低,但这个设计理念提出了一个精确研究免疫反应的方法。
2.2Site Ⅳ 另一个在Prefusion和Postfusion均存在的重要表位是SiteⅣ,该表位的代表性抗体是101F,该抗体的逃逸突变是F1的Arg429、Ile432、Lys433和Val447。101F和RSV-F复合物的晶体结构可见,结合位置横跨了aa 422-438,这是一段线性结构[28]。在RSV的Prefusion和Postfusion结构上,这段肽段位于半胱氨酸富集区的7*beta链中最外侧的β18上。对101F与RSV F胞外结合区域建模,发现Site Ⅳ区域在空间结构上比这段线性肽段更大且更复杂,还包括了额外的beta折叠。这个发现也解释了101F与线性肽段的反应性比与RSV F的反应性弱10 000倍的原因[28]。最近,Schuster团队从人体内分离出了一株可中和包含RSV在内的四种副黏病毒的抗体,研究者预测该抗体识别RSV F上的Site Ⅳ位点[44]。综上可知,SiteⅣ是广谱中和抗体的靶标,有望用于被动性预防免疫。
2.3Site Ø Melero团队在人血清中发现大部分的中和活性并不是由Postfusion引起的,从而确定了特异性靶向Prefusion结构抗体的存在[13],Graham团队同样也发现人血清中的中和活性大部分来源于Prefusion特异性抗体[45]。RSV F上的其余表位SiteⅢ、SiteⅧ、Site Ø就是Prefusion的特异性表位。D25、5C4、AM22是第一批被发现的Prefusion特异性的抗体,其中和效价比Palivizumab高5倍以上,其中D25和AM22是通过将志愿者提供的B细胞进行永生化后使用AIMM疗法后分离得到的[46],5C4是厦门大学夏宁邵团队用质粒免疫小鼠后通过杂交瘤腹水纯化获得的鼠源抗体[29]。这三株抗体均有高中和活性且检测不到与Postfusion RSV F的反应性。综合X射线晶体学和电子显微镜的结果,发现三株抗体均特异性结合在Prefusion RSV F三聚体的远膜端顶部,该位点被命名为Site Ø。该表位包括了F1的α4螺旋(aa 196-209)和F2的部分区域(aa 62-69)。这两个区域在由Prefusion变构为Postfusion的过程中均发生了巨大的变化,α4螺旋甚至翻转了180°。这些结构间的巨大变化正好印证了抗体的Prefusion特异性,也间接说明了Fusion抑制剂的机理。其中Prefusion特异性抗体D25可以与单体F(Monomeric F)结合[47],说明单体与三聚体Prefusion构象有类似结构域。
2.4SiteⅧ 近期,Crowe团队从一位8岁儿童外周血单核细胞分离得到能与Prefusion(SC-TM)[48]特异性反应的B细胞,处理为杂交瘤细胞株[49]后进行表达鉴定,发现hRSV90这株抗体对A/B亚型均有很好的中和活性,且有Prefusion特异性。为了确定新抗体的结合位置情况,研究者将各表位的代表性抗体与hRSV90进行竞争实验,发现hRSV90能完全阻断SiteⅡ和Site Ø,就此将hRSV90的结合区域定义为表位SiteⅧ。为了进一步了解新表位的情况,研究者将RSV A2 SC-TM与hRSV90-Fab复合物进行了X射线晶体结构建模分析,观察到Fab位于SiteⅡ和Site Ø间的界面,每个Fab仅结合一个原聚体(Protomer)。分析hRSV90的结合界面可知,SiteⅧ主要区域是靠近螺旋-环-螺旋的aa 163-181并部分覆盖SiteⅡ和Site Ø。该表位的抗体易受周边表位抗体的空间位阻影响,当hRSV90与D25,Motavizumab、AM14共结合时,会发生近90°的偏转,转移到RSV F的垂线。Site Ⅷ覆盖了部分SiteⅡ和Site Ø表位且能激发出高效中和抗体,其特殊位置可以为未来的疫苗设计提供新思路。
2.5SiteⅢ 其他的Prefusion特异性抗体,比如MPE8,同样是分离自捐赠者的IgG+记忆B细胞,可以交叉中和四种副黏病毒。在MPE8发现初期,研究者预测其表位位于β2/β7附近,结合位点有Thr50、Asp305、Gly307、Ile309、Asp310,在结构上位于SiteⅡ螺旋-环-螺旋的下方并包含了部分F2的区域[34],研究者将其定义为SiteⅢ表位。近期Jardetzky团队解析了MPE8与Prefusion RSV F(Ds-Cav1)[50]的晶体结构,发现MPE8横跨了Prefusion三聚体相邻的两个亚基,是仅在Prefusion结构存在的亚基间表位;MPE8结合七肽重复序列A(Heptad reaped A,HRA)上的β(aa 178,180,184-187)[51],该区域在Postfusion状态时会重排为一段长螺旋并远离MPE8原结合位置[29,52],使该表位在Postfusion状态时丧失;该区域在HRSV、BRSV、hMPV(人类偏肺病毒)、PMV(鼠肺炎病毒)间高度保守,基于此结构MPE8才具有交叉中和活性。
类似的三聚体识别抗体AM14则是识别另一个聚体表位,并同样横跨两个原聚体(Protomer F),包括在Pre/Post转变后显著变化的区域。对AM14的逃逸突变位点Leu160、Asn183、Asn426、Arg429,从晶体结构解析可知,该三聚体表位位于α2/α3、β3/β4的Loop环和另一个Protomer的β17/β18 Loop环。通过反应性分析发现AM14是特异性结合弗林蛋白酶切割后的Prefusion F三聚体,这是存在于病毒粒子表面的F成熟形态[38]。这些结果说明Prefusion F三聚体包含有单体F不具备的高中和表位,这更有助于设计RSV F疫苗抗原。
Prefusion新表位的发现对有效预防RSV感染的研究有着深远影响。这些表位激发的抗体中和效价比Palivizumab强10倍以上,促进了针对F蛋白三聚体和Prefusion的抗体药物的研发[13]。此外,由于Prefusion特异性抗体可以稳固F蛋白的Pre结构,有研究者便参考抗原抗体复合物结构对F蛋白进行改造,其中,Graham团队利用D25与Site Ø的结合界面对F进行突变来稳固Prefusion结构[50],其中最好的突变体DS-Cav1,能在小鼠和恒河猴的体内免疫出高滴度中和抗体。而且Prefusion上有所有已知的中和表位[47],这个特性更易于在体内激起高效价抗体。目前,以Prefusion为研究基础的亚单位疫苗作为RSV候选疫苗也正在研发中[53]。
3 结语
综上所述,近期关于RSV融合蛋白F结构、表位的研究,包括分离出新的F特异性抗体并由此发现新的高中和表位,都对RSV疫苗的发展起到了推动作用。目前对RSV F的Prefusion和Postfusion的结构以及中和表位结构的解析,让研究者意识到特定的结构即可激起高效价的中和抗体,尤其是Prefusion构象上的表位。那么如何维持融合蛋白的Prefusion状态或者设计出与高中和抗体表位类似结构就成为疫苗设计的关键。此外,疫苗可以通过这些抗体的结合表位结构为依托进行优化。在疫苗免疫后如何才能在体内激起高中和抗体且避免产生无用抗体则是目前研究者的主要探究方向。
[1] Glezen WP,Taber LH,Frank AL,etal.Risk of primary infection and reinfection with respiratory syncytial virus[J].Am J Dis Child,1986,140(6):543-546.
[2] Hall CB,Simoes EA,Anderson LJ.Clinical and epidemiologic features of respiratory syncytial virus[J].Curr Top Microbiol Immunol,2013,372:39-57.
[3] Hall CB.The burgeoning burden of respiratory syncytial virus among children[J].Infect Disord Drug Targets,2012,12(2):92-97.
[4] Lozano R,Naghavi M,Foreman K,etal.Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010:a systematic analysis for the Global Burden of Disease Study 2010[J].Lancet,2012,380(9859):2095-2128.
[5] Walsh EE,Falsey AR.Respiratory syncytial virus infection in adult populations[J].Infect Disord Drug Targets,2012,12(2):98-102.
[6] Varga SM,Braciale TJ.The adaptive immune response to respiratory syncytial virus[J].Curr Top Microbiol Immunol,2013,372:155-171.
[7] Pringle CR.The order Mononegavirales-current status[J].Arch Virol,1997,142(11):2321-2326.
[8] Mufson MA,Orvell C,Rafnar B,etal.Two distinct subtypes of human respiratory syncytial virus[J].J Gen Virol,1985,66 ( Pt 10):2111-2124.
[9] Collins PL,Dickens LE,Buckler-White A,etal.Nucleotide sequences for the gene junctions of human respiratory syncytial virus reveal distinctive features of intergenic structure and gene order[J].Proc Natl Acad Sci U S A,1986,83(13):4594-4598.
[10] Collins PL,Graham BS.Viral and host factors in human respiratory syncytial virus pathogenesis[J].J Virol,2008,82(5):2040-2055.
[11] Johnson PR,Jr Olmsted RA,Prince GA,etal.Antigenic relatedness between glycoproteins of human respiratory syncytial virus subgroups A and B:evaluation of the contributions of F and G glycoproteins to immunity[J].J Virol,1987,61(10):3163-3166.
[12] Stott EJ,Taylor G,Ball LA,etal.Immune and histopathological responses in animals vaccinated with recombinant vaccinia viruses that express individual genes of human respiratory syncytial virus[J].J Virol,1987,61(12):3855-3861.
[13] Magro M,Mas V,Chappell K,etal.Neutralizing antibodies against the preactive form of respiratory syncytial virus fusion protein offer unique possibilities for clinical intervention[J].Proc Natl Acad Sci U S A,2012,109(8):3089-3094.
[14] Collins PL,Melero JA.Progress in understanding and controlling respiratory syncytial virus:still crazy after all these years[J].Virus Res,2011,162(1-2):80-99.
[15] Collins PL,Huang YT,Wertz GW.Nucleotide sequence of the gene encoding the fusion (F) glycoprotein of human respiratory syncytial virus[J].Proc Natl Acad Sci U S A,1984,81(24):7683-7687.
[16] Collins PL,Mottet G.Post-translational processing and oligomerization of the fusion glycoprotein of human respiratory syncytial virus[J].J Gen Virol,1991,72 ( Pt 12):3095-3101.
[17] Bolt G,Pedersen LO,Birkeslund HH.Cleavage of the respiratory syncytial virus fusion protein is required for its surface expression:role of furin[J].Virus Res,2000,68(1):25-33.
[18] Schlender J,Zimmer G,Herrler G,etal.Respiratory syncytial virus (RSV) fusion protein subunit F2,not attachment protein G,determines the specificity of RSV infection[J].J Virol,2003,77(8):4609-4616.
[19] Lamb RA.Paramyxovirus fusion:a hypothesis for changes[J].Virology,1993,197(1):1-11.
[20] Liljeroos L,Krzyzaniak MA,Helenius A,etal.Architecture of respiratory syncytial virus revealed by electron cryotomography[J].Proc Natl Acad Sci U S A,2013,110(27):11133-11138.
[21] Yunus AS,Jackson TP,Crisafi K,etal.Elevated temperature triggers human respiratory syncytial virus F protein six-helix bundle formation[J].Virology,2010,396(2):226-237.
[22] Chaiwatpongsakorn S,Epand RF,Collins PL,etal.Soluble respiratory syncytial virus fusion protein in the fully cleaved,pretriggered state is triggered by exposure to low-molarity buffer[J].J Virol,2011,85(8):3968-3977.
[23] Tayyari F,Marchant D,Moraes TJ,etal.Identification of nucleolin as a cellular receptor for human respiratory syncytial virus[J].Nat Med,2011,17(9):1132-1135.
[24] Mastrangelo P,Hegele RG.RSV fusion:time for a new model[J].Viruses,2013,5(3):873-885.
[25] Gonzalez-Reyes L,Ruiz-Arguello MB,Garcia-Barreno B,etal.Cleavage of the human respiratory syncytial virus fusion protein at two distinct sites is required for activation of membrane fusion[J].Proc Natl Acad Sci U S A,2001,98(17):9859-9864.
[26] Ruiz-Arguello MB,Martin D,Wharton SA,etal.Thermostability of the human respiratory syncytial virus fusion protein before and after activation:implications for the membrane-fusion mechanism[J].J Gen Virol,2004,85(Pt 12):3677-3687.
[27] McLellan JS,Yang Y,Graham BS,etal.Structure of respiratory syncytial virus fusion glycoprotein in the postfusion conformation reveals preservation of neutralizing epitopes[J].J Virol,2011,85(15):7788-7796.
[28] McLellan JS,Chen M,Chang JS,etal.Structure of a major antigenic site on the respiratory syncytial virus fusion glycoprotein in complex with neutralizing antibody 101F[J].J Virol,2010,84(23):12236-12244.
[29] McLellan JS,Chen M,Leung S,etal.Structure of RSV fusion glycoprotein trimer bound to a prefusion-specific neutralizing antibody[J].Science,2013,340(6136):1113-1117.
[30] Anderson LJ,Hierholzer JC,Tsou C,etal.Antigenic characterization of respiratory syncytial virus strains with monoclonal antibodies[J].J Infect Dis,1985,151(4):626-633.
[31] Lopez JA,Andreu D,Carreno C,etal.Conformational constraints of conserved neutralizing epitopes from a major antigenic area of human respiratory syncytial virus fusion glycoprotein[J].J Gen Virol,1993,74 ( Pt 12):2567-2577.
[32] Palivizumab,a humanized respiratory syncytial virus monoclonal antibody,reduces hospitalization from respiratory syncytial virus infection in high-risk infants.The IMpact-RSV Study Group[J].Pediatrics,1998,102(3 Pt 1):531-537.
[33] Wu H,Pfarr DS,Johnson S,etal.Development of motavizumab,an ultra-potent antibody for the prevention of respiratory syncytial virus infection in the upper and lower respiratory tract[J].J Mol Biol,2007,368(3):652-665.
[34] Corti D,Bianchi S,Vanzetta F,etal.Cross-neutralization of four paramyxoviruses by a human monoclonal antibody[J].Nature,2013,501(7467):439-443.
[35] Wu SJ,Schmidt A,Beil EJ,etal.Characterization of the epitope for anti-human respiratory syncytial virus F protein monoclonal antibody 101F using synthetic peptides and genetic approaches[J].J Gen Virol,2007,88(Pt 10):2719-2723.
[36] Lopez JA,Bustos R,Orvell C,etal.Antigenic structure of human respiratory syncytial virus fusion glycoprotein[J].J Virol,1998,72(8):6922-6928.
[37] Mousa JJ,Kose N,Matta P,etal.A novel pre-fusion conformation-specific neutralizing epitope on the respiratory syncytial virus fusion protein[J].Nat Microbiol,2017,2:16271.
[38] Gilman MS,Moin SM,Mas V,etal.Characterization of a prefusion-specific antibody that recognizes a quaternary,cleavage-dependent epitope on the RSV fusion glycoprotein[J].PLoS Pathog,2015,11(7):e1005035.
[39] Magro M,Andreu D,Gomez-Puertas P,etal.Neutralization of human respiratory syncytial virus infectivity by antibodies and low-molecular-weight compounds targeted against the fusion glycoprotein[J].J Virol,2010,84(16):7970-7982.
[40] Johnson S,Oliver C,Prince GA,etal.Development of a humanized monoclonal antibody (MEDI-493) with potent in vitro and in vivo activity against respiratory syncytial virus[J].J Infect Dis,1997,176(5):1215-1224.
[41] McLellan JS,Chen M,Kim A,etal.Structural basis of respiratory syncytial virus neutralization by motavizumab[J].Nat Struct Mol Biol,2010,17(2):248-250.
[42] McLellan JS,Correia BE,Chen M,etal.Design and characterization of epitope-scaffold immunogens that present the motavizumab epitope from respiratory syncytial virus[J].J Mol Biol,2011,409(5):853-866.
[43] Correia BE,Bates JT,Loomis RJ,etal.Proof of principle for epitope-focused vaccine design[J].Nature,2014,507(7491):201-206.
[44] Schuster JE,Cox RG,Hastings AK,etal.A broadly neutralizing human monoclonal antibody exhibits in vivo efficacy against both human metapneumovirus and respiratory syncytial virus[J].J Infect Dis,2015,211(2):216-225.
[45] Ngwuta JO,Chen M,Modjarrad K,etal.Prefusion F-specific antibodies determine the magnitude of RSV neutralizing activity in human sera[J].Sci Transl Med,2015,7(309):309ra162.
[46] Kwakkenbos MJ,Diehl SA,Yasuda E,etal.Generation of stable monoclonal antibody-producing B cell receptor-positive human memory B cells by genetic programming[J].Nat Med,2010,16(1):123-128.
[47] Swanson KA,Balabanis K,Xie Y,etal.A monomeric uncleaved respiratory syncytial virus F antigen retains prefusion-specific neutralizing epitopes[J].J Virol,2014,88(20):11802-11810.
[48] Krarup A,Truan D,Furmanova-Hollenstein P,etal.A highly stable prefusion RSV F vaccine derived from structural analysis of the fusion mechanism[J].Nat Commun,2015,6:8143.
[49] Smith SA,Crowe JE Jr.Use of human hybridoma technology to isolate human monoclonal antibodies[J].Microbiol Spectr,2015,3(1):AID-0027-2014.
[50] McLellan JS,Chen M,Joyce MG,etal.Structure-based design of a fusion glycoprotein vaccine for respiratory syncytial virus[J].Science,2013,342(6158):592-598.
[51] Wen X,Mousa JJ,Bates JT,etal.Structural basis for antibody cross-neutralization of respiratory syncytial virus and human metapneumovirus[J].Nat Microbiol,2017,2:16272.
[52] Yin HS,Wen X,Paterson RG,etal.Structure of the parainfluenza virus 5 F protein in its metastable,prefusion conformation[J].Nature,2006,439(7072):38-44.
[53] Graham BS,Anderson LJ.Challenges and opportunities for respiratory syncytial virus vaccines[J].Curr Top Microbiol Immunol,2013,372:391-404.
[收稿2017-03-17 修回2017-04-03]
(编辑 倪 鹏)
①本文为国家自然科学基金(No.81401668、No.81361120408)项目和国家自然科学基金委员会(NSFC)与美国国立卫生研究院(NIH)合作研究项目(No.81161120419)。
R373.1
A
1000-484X(2017)10-1568-06
10.3969/j.issn.1000-484X.2017.10.028
曹健力(1992年-),女,在读硕士,主要从事呼吸道合胞病毒抗体改造及真核表达系统方面的研究,E-mail:jenny_cao422@163.com。
及指导教师:郑子峥(1982年-),男,博士,副教授,主要从事戊型肝炎病毒及呼吸道合胞病毒感染机制方面研究,E-mail:zhengzizheng@xmu.edu.cn。
