百令胶囊对病毒性心肌炎小鼠心肌纤维化及TGF-β1-MAPK/ERK通路的影响①
2017-10-24吕欣桐张春艳孙景辉王朝霞
吴 岚 吕欣桐 张春艳 孙景辉 王朝霞
(吉林大学第一医院儿科,长春 130021)
百令胶囊对病毒性心肌炎小鼠心肌纤维化及TGF-β1-MAPK/ERK通路的影响①
吴 岚 吕欣桐 张春艳 孙景辉 王朝霞②
(吉林大学第一医院儿科,长春 130021)
目的探讨百令胶囊(BL)对病毒性心肌炎(VMC)小鼠心肌纤维化及TGF-β1-MAPK/ERK通路的影响。方法200只健康雄性BALB/c小鼠中的180只采用间断多次腹腔注射组织培养半数感染量(TCID50)100 TCID50 /0.1 ml的柯萨奇病毒B3(CVB3)病毒稀释液,建立VMC心肌纤维化模型,另外20只注射不含病毒的Eagle′s液作为正常对照组。两个月后模型制作成功。存活的小鼠随机分为4组,模型组、BL高、中、低剂量组。分别给予不同剂量BL进行治疗,每日灌胃给药一次,60 d后结束。心脏超声检测左室舒张末期内径(LVEDd)和左室收缩末期内径(LVEDs),并计算左室射血分数缩短率(FS);采用免疫组化法检测心肌组织Ⅰ型胶原、Ⅲ型胶原;Masson染色计算心肌胶原容积分数(CVF);测定采用半定量Western blot法检测心肌TGFβ1及p-ERK1/2蛋白的表达。结果①与对照组比较,模型组小鼠心肌CVF、Ⅰ型、Ⅲ型胶原明显增高,心脏LVEDd,LVEDs升高,FS下降,差异有统计学意义(P<0.05)。②与对照组比较,模型组心肌TGF-β1及p-ERK1/2蛋白表达升高,差异有统计学意义(P<0.05)。③与模型组比较,BL大、中剂量组CVF、Ⅰ型、Ⅲ型胶原下降,心脏LVEDd,LVEDs下降,FS升高,差异有统计学意义(P<0.05)。④与模型组比较,BL大剂量组心肌TGF-β1及p-ERK1/2蛋白表达下降,差异有统计学意义(P<0.05)结论①百令胶囊可以改善病毒性心肌炎小鼠减轻心肌纤维化,改善心功能。②在病毒性心肌炎中,TGF-β1-MAPK/ERK通路激活可能起促心肌纤维化作用。③百令胶囊抗心肌纤维化作用机制可能是通过抑制TGF-β1-MAPK/ERK通路的活化实现的。
病毒性心肌炎;心肌纤维化;信号通路;百令胶囊
心肌纤维化贯穿着病毒性心肌炎(Viral myocarditis,VMC)病程始终,是心脏扩大、心功能恶化的重要原因,细胞因子介导的相关信号转导通路在此过程中发挥着重要作用[1]。丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)是一组能被不同的细胞外刺激,如细胞因子、神经递质、激素、细胞应激及细胞黏附等激活的丝氨酸-苏氨酸蛋白激酶,而MAPK通路是转化生长因子-β1(Transforming growth factor-beta 1,TGF-β1)下游重要的细胞内信号转导通路。众多文献报道,MAPK/ERK通路在多个脏器纤维化中起着重要的作用[2-4]。百令胶囊(BL)成分是人工虫草菌丝干粉,在病毒性心肌炎的治疗中研究尚少。本研究旨在探讨百令胶囊对病毒性心肌炎治疗作用及TGF-β1-MAPK/ERK通路的影响。
1 材料与方法
1.1材料 200只雄性纯种近系4周龄BALB/c小鼠,体质量(18±1)g,吉林大学实验动物中心提供,实验动物许可证号:SCXK(吉)2014-0033。CVB3(Nancy株)由吉林大学白求恩医学部免疫学教研室惠赠。病毒液组织培养半数感染量为100 TCID50/0.1 ml。ELISA试剂盒(北京博奥森生物技术有限公司);免疫组化及Western blot抗体(美国Abcam公司);百令胶囊(BL),0.2 g/粒,杭州中美华东制药有限公司;美国GE公司Vidid7超声仪,I13L型号小动物超声探头(14 mHz)。
1.2方法
1.2.1分组 200只小鼠随机分为对照组20只,VMC模型组180只。VMC模型组小鼠首次腹腔无菌接种100 TCID50/0.1 ml的CVB3病毒稀释液0.1 ml,以后每个月1次,每次病毒量递增0.05 ml,共3次[6],第3个月末死亡63只小鼠。随机抽取7只存活的小鼠,进行心肌组织HE染色:可见弥漫性胶原增多,炎性细胞数减少,心肌细胞部分由纤维组织代替,符合VMC心肌纤维化小鼠的特点,与相关报道一致[7]。对照组同期腹腔注射等量Eagle′s液,第3个月末无小鼠死亡。
将存活的VMC模型小鼠随机选取60只再次分组为模型组、BL小剂量组、BL中剂量组、BL大剂量组,每组n=15(剩余50只小鼠用于其他实验)。模型组每日1 ml生理盐水灌胃;BL大剂量组,每日BL 15 g/(kg·d),1 ml生理盐水稀释灌胃;BL中剂量组,每日BL 7.5 g/(kg·d),1 ml生理盐水稀释灌胃;BL小剂量组,每日BL 2.5 g/(kg·d),1 ml生理盐水稀释灌胃,对照组(n=20)小鼠每日1 ml生理盐水灌胃,共60 d[6]。小鼠用药量根据人和动物间按体表面积折算的等效剂量比值表计算[7]。除对照组外各组小鼠均有死亡情况,至观察结束模型组(n=9),BL大剂量组(n=10),BL中剂量组(n=8),BL小剂量组(n=8),对照组(n=20)。
1.2.2心脏超声 待观察时间到达终点用8%硫化钠脱毛,3%水合氯醛腹腔注射用以镇静(0.01 ml/g)后由专业心脏超声科医生操作。检测左室舒张末期内径(LVEDd)、左室收缩期内径(LVEDs),计算左室内径缩短率(FS)。
1.2.3标本采集 拉颈处死小鼠,迅速开胸分离心脏,预冷PBS冲洗后分为2部分,分别于10%中性甲醛PBS溶液固定以及液氮冻存后转入-70℃冰箱。
1.2.4免疫组化检测心肌组织Ⅰ型胶原和Ⅲ型胶原 心肌组织石蜡切片脱蜡至水化,抗原修复,PBS 振荡洗涤。加一抗,37℃孵育3 h。PBS 振荡洗涤,滴加生物素标记的二抗,37℃孵育30 min,PBS 振荡洗涤,加入辣根过氧化物酶标记的链霉菌抗生物素蛋白工作液,37℃孵育30 min;滴加显色剂,中性树胶加盖玻片封固。医学图像分析软件Image-pro Plus 6.0 半定量分析方法,每张切片选择5 个视野,测量各指标的阳性表达面积,并计算平均值[6]。
1.2.5心肌胶原纤维Masson染色及胶原容积分数(CVF)测定 心肌组织石蜡切片脱蜡至水化;苏木素染色2 min,水洗后丽春红酸性复红液5 min;1%磷钼酸水溶液分化3 min,1%苯胺蓝液后烘干,二甲苯中性树胶封片。医学图像分析软件Image-pro plus 6.0,每张切片选5个视野,测量胶原纤维染色阳性面积,CVF=胶原面积/全视野面积×100%,计算平均值[6]。
1.2.6Western blot法分析测定心肌组织TGF-β1、ERK1/2蛋白 取小鼠心肌组织100 mg,提取总蛋白,BCA法测定蛋白浓度,蛋白样品与等体积上样缓冲液混合,100℃煮沸5 min,完全冷却后,10%的SDS-PAGE凝胶电泳。将凝胶中的蛋白质转移至NC膜,5%的脱脂奶粉在37℃封闭1 h。加一抗4℃孵育过夜,次日洗膜后加二抗常温孵育1 h,水浴摇床,洗膜。暗室ECL发光,凝胶成像仪成像并检测。采用所测目的蛋白条带与内参β-actin条带的光密度比值来表示目的蛋白的表达水平。

2 结果
2.1各组小鼠死亡率 至观察结束模型组15只小鼠死亡6只(死亡率40.0%),BL大剂量组15只小鼠死亡5只(死亡率为33.3%),BL中剂量组15只小鼠死亡7只(死亡率为46.7%),BL小剂量组15只小鼠死亡7只(死亡率为46.7%),组间死亡率比较差异无统计学意义(χ2=1.912,P=0.752)。
2.2各组小鼠心脏超声 与对照组比较,各组小鼠均存在LVEDd及LVEDs数值增大,Fs下降,差异有统计学意义(P<0.05)。与模型组比较,BL大剂量治疗组、中剂量组小鼠LVEDd及LVEDs均下降,Fs值升高,差异有统计学意义(P<0.05),BL小剂量组各指标未见明显改善,差异无统计学意义(P>0.05),见图1、表1。
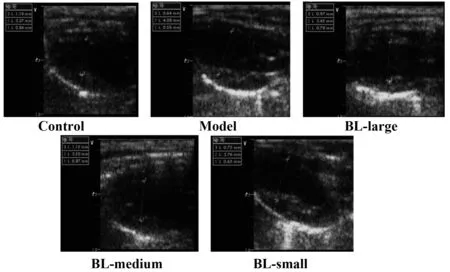
图1 各组小鼠心脏超声Fig.1 Heart function changes in different groups
2.3各组小鼠心肌胶原容积分数(CVF)测定 与对照组相比,模型组及各治疗组小鼠心肌CVF明显升高,差异有统计学意义(P<0.01)。与模型组比较,BL大、中剂量治疗组CVF下降,差异有统计学意义(P<0.05)。与模型组比较,BL小剂量组CVF下降,但差异无统计学意义(P>0.05)。见表1。
2.4各组小鼠心肌组织中Ⅰ型胶原和Ⅲ型胶原的表达 与对照组相比较,模型组Ⅰ型胶原和Ⅲ型胶原的表达均明显增高,差异有统计学意义(P<0.01)。与模型组相比较,BL大、中剂量组Ⅰ型胶原和Ⅲ型胶原表达明显降低(P<0.05)。见表2。
2.5各组小鼠心肌组织中TGF-β1和p-ERK1/2 的表达 与对照组比较,模型组小鼠TGF-β1的表达增多(P<0.01);各治疗组TGF-β1的表达量均有下降,BL中、小剂量组与模型组相比较差异无统计学意义(P>0.05)。BL大剂量组的表达量明显低于模型组,差异有统计学意义(P<0.01),与正常对照组比较,模型组小鼠p-ERK1/2的表达量明显增多,差异有统计学意义(P<0.01); BL大、中剂量组的表达量明显低于模型组,差异有统计学意义(P<0.01),见表2、图2。
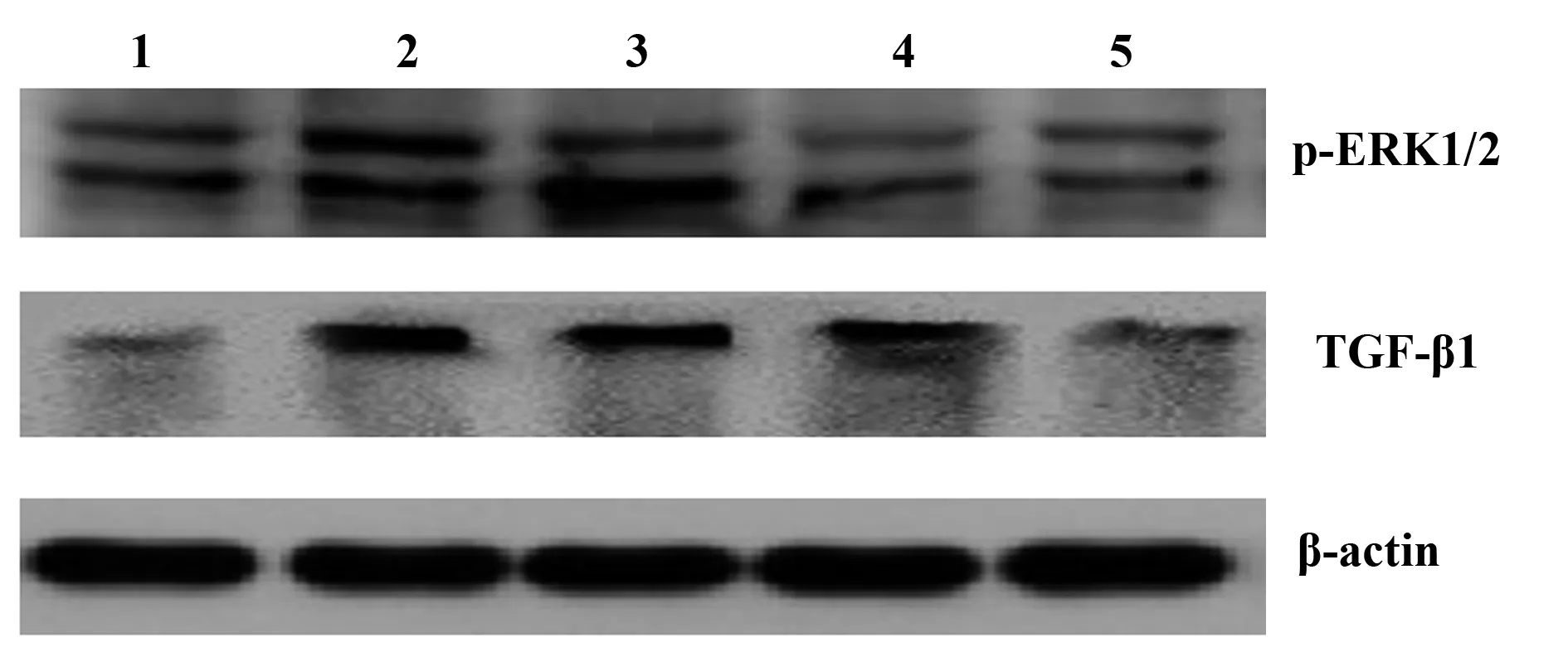
图2 各组小鼠心肌TGF-β1及 p-ERK1/2表达Fig.2 TGF-β1 and p-ERK1/2 in mice myocardial tissue of various groupsNote:1.Control;2.Model;3.BL-small;4.BL-medium;5 BL-large.
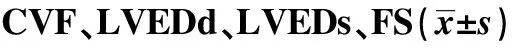
表1 各组小鼠心肌
Note:Compared with control group,1)P<0.01;compared with model group,2)P<0.05.
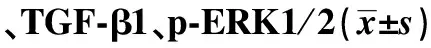
表2 各组小鼠心肌Ⅰ型胶原、Ⅲ型胶原
Note:Compared with control group,1)P<0.01;compared with model group,2)P<0.05.
3 讨论
病毒性心肌炎是由嗜心性病毒感染所致的心肌及其间质的局灶性或弥漫性炎症,是临床常见的心血管系统疾病之一,近年来在儿童和青少年中的发病率呈逐年上升趋势。部分患者病情迁延,遗留顽固性心律失常、慢性心功能不全甚至进展为扩张性心肌病[8],严重危害患儿身体健康。本研究中,病毒感染后各组小鼠死亡率均处于较高水平(26.7%~46.7%),药物干预后死亡率有下降,但差异无统计学意义(P>0.05)。病毒模型组小鼠LVEDd及LVEDs明显增大,Fs下降,提示心脏扩大,心功能不全,与相关报道结果一致[9]。
心肌纤维化是心肌间质中胶原过度沉积,贯穿VMC病程始终,是引起心律失常、心功能减退甚至心脏性猝死等并发症的重要原因[10]。有研究表明在VMC病程早期即发现心肌组织TGF-β1表达增加,Ⅰ、Ⅲ型胶原合成增加及Ⅰ、Ⅲ型胶原比例失调[11]。本研究结果表明模型组小鼠心肌CVF明显高于对照组(P<0.01),心肌Ⅰ型胶原和Ⅲ型胶原相对表达量明显高于对照组(P<0.01),提示模型组小鼠存在明显心肌纤维化,其心脏扩大和心功能不全与之相关。改善心肌纤维化是病毒性心肌炎治疗的重要环节,寻求一种有效药物已成临床需要。
冬虫夏草是一种名贵中药材,具有多重药理作用,但因其产量有限而且价格昂贵,尚未能广泛应用。百令胶囊(BL)为人工培养发酵的冬虫夏草无性型中华束丝孢,与天然虫草成分基本一致,具有抗纤维化、抗氧化、抗炎、免疫调节等药理作用,临床广泛应用于肾脏疾病、肿瘤性疾病、心脏疾病等的治疗中,疗效确切[12-16]。但目前BL对病毒性心肌炎的治疗少见报道,本研究发现BL大剂量治疗组、中剂量组小鼠LVEDd及LVEDs均下降,Fs值升高,CVF、Ⅰ、Ⅲ型胶原表达下降(P<0.05),表明BL可改善VMC小鼠心功能及心肌纤维化,为BL的临床应用提供实验依据。
MAPK通路是介导细胞反应的重要信号系统,广泛存在于多种生物细胞中,参与细胞生长、增殖、分化、凋亡等一系列细胞生理活动,同时也参与组织纤维化、肿瘤、炎性反应等多种生理病理过程[15]。目前已发现MAPK主要信号通路有4条,分别为细胞外调解蛋白激酶(Extra cellular regulated protein kinases,ERK)信号通路、C-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)信号通路、p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase)信号通路和ERK5/大丝裂原活化蛋白激酶(Big mitogen-activated protein kinase 1,BMK1)信号通路,其中ERK主要作为细胞促有丝分裂增殖/分化的活化因子[15]。MAPK/ERK通路是TGF-β1信号传入细胞核内,进而调控胶原基因表达的主要信号通路之一,ERK1/2主要被一些因素如过氧化氢、离子射线、生长因子等磷酸化后激活,激活的p-ERK1/2可促进一些基因的转录和表达,参与细胞生长、分化、增殖、凋亡以及细胞功能的调节,ERK通路在多个脏器的纤维化过程中起着重要的促进作用[17]。有报道对肝纤维化与MAPK/ERK信号通路相关密切,肝纤维化大鼠肝组织MAPK/ERK信号通路中的多个激酶表达水平均显著升高,并表现出顺序激活的时序关系[18]。也有学者对糖尿病大鼠进行研究,发现模型大鼠心肌组织ERK1/2、p-ERK1/2的表达显著上调,而且心肌组织Ⅰ型胶原和Ⅲ型胶原表达明显升高,二者有正相关性,提示ERK通路的激活起到促进糖尿病大鼠心肌纤维化的作用[4]。
本研究显示病毒性心肌炎小鼠模型组中,心肌胶原容积分数显著增高,心肌组织Ⅰ、Ⅲ型胶原表达明显增加,同时心肌组织TGF-β1和ERK的表达均增加(P<0.05),提示TGF-β1-MAPK/ERK通路在病毒性心肌炎中起促心肌纤维化作用。TGF-β-MAPK/ERK通路可能作为抗病毒性心肌炎心肌纤维化的治疗新靶点。同时本研究结果表明BL大剂量组心肌组织TGF-β1和ERK的表达量明显低于模型组,提示BL可能通过抑制TGF-β1-MAPK/ERK通路的活化,进而抑制心肌胶原蛋白增生,达到抑制心肌纤维化,改善心功能的目的。
综上所述,本研究发现百令胶囊对病毒性心肌炎小鼠有改善心功能,抗心肌纤维化的作用,其作用机制可能是通过抑制TGF-β-MAPK/ERK通路的活化实现的,是否存在其他作用机制及其长期用药的安全性有待于进一步研究。
[1] 戴 娜,卜丽梅,付 军.病毒性心肌炎的研究进展[J].中国老年学杂志,2014,9(34):5318-5321.
[2] 杨雅茹,黄 艳,李 俊.TGF-β1 介导的Smads 与ERK 通路在肺纤维化中的作用及相互关系[J].中国药理学通报,2010,26(5):561-563.
[3] 刘 萍,王 密,陆 小,等.内源性大麻素对血吸虫肝纤维化小鼠原代肝星状细胞增殖和磷酸化-Erk表达的影响[J].中华肝脏病杂志,2013,21(1):42-46.
[4] 张冠军,张蔚屏,王 开,等.厄贝沙坦对抗糖尿病大鼠心肌纤维化作用及机制[J].中国应用生理学杂志,2016,32(3):221-224.
[5] 张召才,李双杰,杨英珍,等.黄芪甲甙对慢性心肌炎心肌纤维化的影响[J].中国中西医结合杂志,2007,27(8):728-731.
[6] 吴 岚,王朝霞,高 曼,等.百令胶囊对病毒性心肌炎心肌纤维化小鼠骨膜蛋白表达的干预作用[J].中国实用儿科临床杂志,2015,30(1):64-67.
[7] 施新猷.现代医学实验动物学[M].北京:人民军医出版社,2000:421.
[8] Rose NR.Viral myocarditis [J].Curr Opin Rheumatol,2016,28(4):383-389.
[9] Wen C,Xie G,Zeng P,etal.Tranilast inhibits myocardial fibrosis in mice with viral myocarditis[J].Zhongguo Dang Dai Er Ke Za Zhi,2016,18(5):446-454.
[10] 孙景辉,翟淑波.病毒性心肌炎发病机制的研究进展[J].临床儿科杂志,2012,30(7):607-612.
[11] Li J,Schwimmbeck.Collagen degradation in a murine myocarditis model:relevance of matrix metalloproteinase in association with inflammatory induction[J].Cardiovasc Res,2002,56(2):235-247.
[12] 许惠娟,李时悦.百令胶囊的药理作用及其在肺部疾病的研究进展[J].中国中药杂志,2010,35(20):2777-2781.
[13] 胡姬婷.百令胶囊联合应用低分子肝素治疗儿童原发性肾病综合征的临床疗效分析[J].中国实用医药,2016,11(27):172-173.
[14] 张 红,张 琼,刘茂鸿.百令胶囊治疗慢性阻塞性肺疾病的临床疗效[J].临床合理用药,2016,9(4C):129-130.
[15] Zhang Y,Nallaparaju KC,Liu X,etal.MAPK phosphatase 7 regulates t cell differentiation via inhibiting ERK-mediated IL-2 expression[J].J Immunol,2015,194(7):3088-3095.
[16] Dong J,Ramachandiran S,Tikoo K,etal.EGFR-independent activation of p38 MAPK and EGFR-dependent activation of ERK1/2 are required for ROS-induced renal cell death[J].Am J Physiol Renal Physiol,2004,287(5):1049-1058.
[17] Lake D,Correa SA,Muller J.Negative feedback regulation of the ERK1/2 MAPK pathway[J].Cell Mol Life Sci,2016,73(23):4397-4413.
[18] 潘 勤,谢渭芬,张忠兵,等.肝纤维化逆转中MAPK/ERK信号转导通路的活化及其特征[J].中国现代医学杂志,2006,16(15):2253-2260.
[收稿2017-06-01]
(编辑 张晓舟)
EffectofBailingcapsuleonmyocardialfibrosisandTGF-β1-MAPK/ERKpathwayofviralmyocarditisrats
WULan,LÜXin-Tong,ZHANGChun-Yan,SUNJing-Hui,WANGZhao-Xia.
DepartmentofPediatrics,theFirstHospitalofJilinUniversity,Changchun130021,China
Objective:To investigate the effect of Bailing capsule on myocardial fibrosis in mice with viral myocarditis(VMC)and TGF-β1-MAPK/ERK pathway.MethodsMale BALB/c mice(n=200)were randomly divided into model group(n=180)and control group(n=20).The model group mice were infected with Coxsackie virus B3 to prepare VMC myocardial fibrosis.The control group mice were injected with Eagle′s MEM without virus.The model was successful after two months.The survival mice were randomly divided into model group and high,middle and low dose of Bailing capsule was administered consecutively for sixty days,once a day,Cardiac ultrasound was used to test LVEDd,LVEDs,then calculate FS.The expression of type Ⅰ collagen and type Ⅲ collagen in all the mice myocardial tissue was detected by immunohistochemical methods.Masson staining for myocardial fibrosis was used to calculate the collagen volume fraction(CVF).Western blot was used to detect the protein expression of TGF-β1 and p-ERK1/2.Results①Compared with the control group,the CVF,type Ⅰ collagen and type Ⅲ collagen obviously increased,LVEDd,LVEDs increased,FS decreased,which had statistically significance(P<0.05).②Compared with the control group,the model group of mice had a statistically significantly higher expression of TGF-β1 and p-ERK1/2(P<0.05).③Compared with the model group,the expression of CVF,type Ⅰ collagen and type Ⅲ collagen of high and middle dose of Bailing capsule was significantly lower,LVEDd,LVEDs decreased,while FS increased(P<0.05).④Compared with the model group,the high dose of Bailing capsule group of mice had a statistically significantly lower expression of TGF-β1 and p-ERK1/2(P<0.05).Conclusion①Bailing capsule can prevent myocardial fibrosis of mice with VMC.②The activation of TGF-β1-MAPK/ERK pathway may can promote myocardial fibrosis in VMC.③Bailing capsule could prevent myocardial fibrosis,which may be related to prevention of TGF-β1-MAPK/ERK pathway.
Viral myocarditis;Myocardial fibrosis;Signaling pathway;Bailing capsule
①本文为吉林省科技厅重点项目资助课题(20140204041)。
②通讯作者,深圳市儿童医院,深圳 518038,E-mail:wangzhaoxia1969 @163.com。
R72
A
1000-484X(2017)10-1493-05
10.3969/j.issn.1000-484X.2017.10.011
吴 岚(1979年-),女,博士,副主任医师,主要从事病毒性心肌炎的研究。
