SAMHD1 对HBV DNA形成的抑制作用及其机制研究
2017-10-24王青青
程 璐 王青青
(浙江大学基础医学院免疫学研究所,杭州 310058)
SAMHD1对HBVDNA形成的抑制作用及其机制研究
程 璐 王青青
(浙江大学基础医学院免疫学研究所,杭州 310058)
目的研究不同肝细胞SAMHD1表达水平及其对HBV DNA形成的抑制作用和相关机制。方法通过实时荧光定量PCR和Western blot法检测Jurkat、THP-1、HepG2、HepG2.2.15和Huh7细胞等细胞SAMHD1 mRNA和蛋白表达水平;通过对HepG2.2.15细胞转染过表达质粒和shRNA,升高或者降低SAMHD1的表达水平,观察不同SAMHD1表达水平对HBV DNA水平的影响;补充不同浓度的dNTP,比较不同dNTP浓度对HBV DNA水平的影响。结果肝癌细胞系有较高的SAMHD1表达水平;降低SAMHD1可以使HBV DNA水平升高2.3~2.8倍,升高SAMHD1可以使HBV DNA降低至33%左右(P<0.01);升高dNTP浓度可以促进HBV DNA的合成水平,抵消SAMHD1的抑制作用。结论SAMHD1可以抑制肝癌细胞内HBV DNA的生成,可能是通过降低细胞内dNTP浓度实现的。
SAMHD1; HBV; 肝癌细胞;dNTP; DNA; 宿主限制因子
宿主进化出不同的机制来对抗和防御病毒的感染。通过不断表达宿主限制因子来介导固有免疫反应是近期来发现的一种独断病毒感染的有效方式,与传统的天然免疫机制有一定的差别[1]。SAMHD1(Sterile alpha motif and HD-domain containing protein 1)是一种新发现的细胞内抗病毒宿主限制因子,并且可以调控机体固有免疫应答[2-4],它的主要功能是将胞内的dNTP水解成脱氧核苷和无机的三磷酸,从而降低核内dNTPs的浓度,是参与细胞核酸代谢的重要酶[4,5]。包括HIV-1在内的逆转录病毒在感染时首先要通过逆转录酶将自身RNA逆转录成DNA,这个过程需要高浓度的dNTP供应,而SAMHD1则通过水解dNTP降低逆转录所需要的“原料”浓度,进而限制了这些逆转录病毒的复制水平。最近的研究进一步发现,SAMHD1可以通过限制DNA复制来抑制未分裂的髓系细胞内的DNA病毒感染[6]。
乙型肝炎病毒(Hepatitis B virus,HBV)是一种DNA病毒,可导致肝硬化、肝衰竭和肝细胞肝癌等,并且每年造成约100万人死亡[7]。HBV虽然不是逆转录病毒,但在其生命周期中存在一个从RNA转录到DNA的逆转录的过程,类似于慢病毒的逆转录过程。研究发现,人类的肝脏中可以表达SAMHD1分子[8],但目前对于HBV的复制是否能够被肝细胞中表达的SAMHD1所阻断仍然不清楚。有研究报道,SAMHD1的dNTP水解酶活性对HBV复制有抑制作用[8-10]。本文中,我们研究了SAMHD1对肝癌细胞中HBV复制的影响,发现SAMHD1能够显著抑制细胞外HBV DNA和细胞内逆转录产物水平,但对HBV RNA和cccDNA水平无影响,外源性dNTP能够解除SAMHD1的抑制作用。
1 材料与方法
1.1细胞系、试剂及仪器 Jurkat、THP-1、HepG2、HepG2.2.15和Huh7细胞等细胞系购自美国模式培养物保藏所(ATCC),鼠抗人SAMHD1和GAPDH单克隆抗体购自美国R&D公司,dNTP混合液购自Sigma-Aldrich公司,Jurkat和THP-1细胞用含有10%胎牛血清(美国Gibco公司)和1%青链霉素的RPIM1640(美国HyClone公司)完全培养基培养;HepG2、HepG2.2.15和Huh7细胞用含有2%胎牛血清和1%青链霉素的DMEM(美国HyClone公司)培养基培养,细胞培养瓶至于5% CO2的37℃恒温孵箱中。
1.2方法
1.2.1Western blot 收集大约1×106个细胞,用200 μl 细胞裂解液(美国Cell Signaling Technology公司)于冰上30充分裂解细胞,用8 000×g离心10 min,取上清液,用BCA protein assay kit试剂盒检测总蛋白浓度(美国Pierce公司),用牛血清白蛋白作为标准品。将收取的细胞裂解液按照每孔相同蛋白量上样,进行SDS-聚丙烯酰胺凝胶电泳,将分离后的蛋白质转移到硝化纤维素膜上,用50 g/L的脱脂牛奶封闭后,加入1~2 μg/ml的鼠抗人SAMHD1一抗温育4℃过夜,用HRP标记的羊抗鼠二抗温育2 h后进行显色曝光。提取的胞浆蛋白和核蛋白同法检测,同时检测GAPDH作为参照。
1.2.2荧光定量PCR反应 用Trizol试剂(美国Invitrogen公司)或者miRNeasy Mini Kit试剂盒(德国Qiagen公司)提取样本中的总RNA,实验步骤按照说明书进行。总RNA用大连宝生物公司逆转录试剂盒逆转录为cDNA,反应体系为20 μl。用罗氏公司的SYBR Green kit试剂盒进行实时荧光定量PCR反应,使用DNA Engine Chromo 4 Real-time quantitative PCR system(美国Bio-Rad公司)PCR仪,所用反应体系为:模板1 μl,10 mmol/L引物各2 μl,2×PCR混合液25 μl,加去离子水至50 μl,反应条件均为:94℃ 3 min,94℃ 30 s,55℃ 1 min,72℃ 1 min,30 个循环,72℃延伸10 min。引物如表1所示。
1.2.3细胞外HBV DNA水平检测 用Qiagen公司总DNA提取试剂盒提取细胞上清总DNA,采用实时荧光定量PCR法检测HepG2.2.15 HBV DNA水平,分别采用0、10、100、1 000、10 000、100 000和1 000 000拷贝/ml的pAAV/1.2HBV质粒作为标准品,计算细胞外HBV DNA的相对拷贝数。所用引物序列如表1所示,所用试剂盒、反应体系如SAMHD1 mRNA中所述。反应条件为:95℃ 3 min,95℃ 10 s,60℃ 30 s,72℃ 30 s,35个循环后72℃延伸10 min。
1.2.4SAMHD1 RNAi和过表达质粒转染 通过PCR法扩增SAMHD1全长片段,所用引物如表1中所示,将扩增好的SAMHD1全长片段用Sal I和EcoR V双酶切后克隆入pCDNA3.1质粒的相应多克隆位点,构建SAMHD1过表达质粒。SAMHD1 shRNA和Control Scr shRNA片段序列根据文献报道[10]由上海吉玛公司合成。将构建好的SAMHD1过表达质粒和SAMHD1 shRNA或Control Scr shRNA片段分别转染HepG2.2.15细胞。转染前将细胞接种于96孔板中,每孔细胞数为10 000,至细胞生长至80%孔面积时,用Lipofectamine 2000转染试剂(美国Life Technologies公司)转染,按照说明书操作。每孔质粒或片段用量为0.3 μg,脂质体用量为1 μl,同时设空白对照和阳性对照,每种设6个重复孔。48 h后采用表1中的引物,按照步骤3所述荧光定量PCR法检测SAMHD1 mRNA和HBV DNA水平。
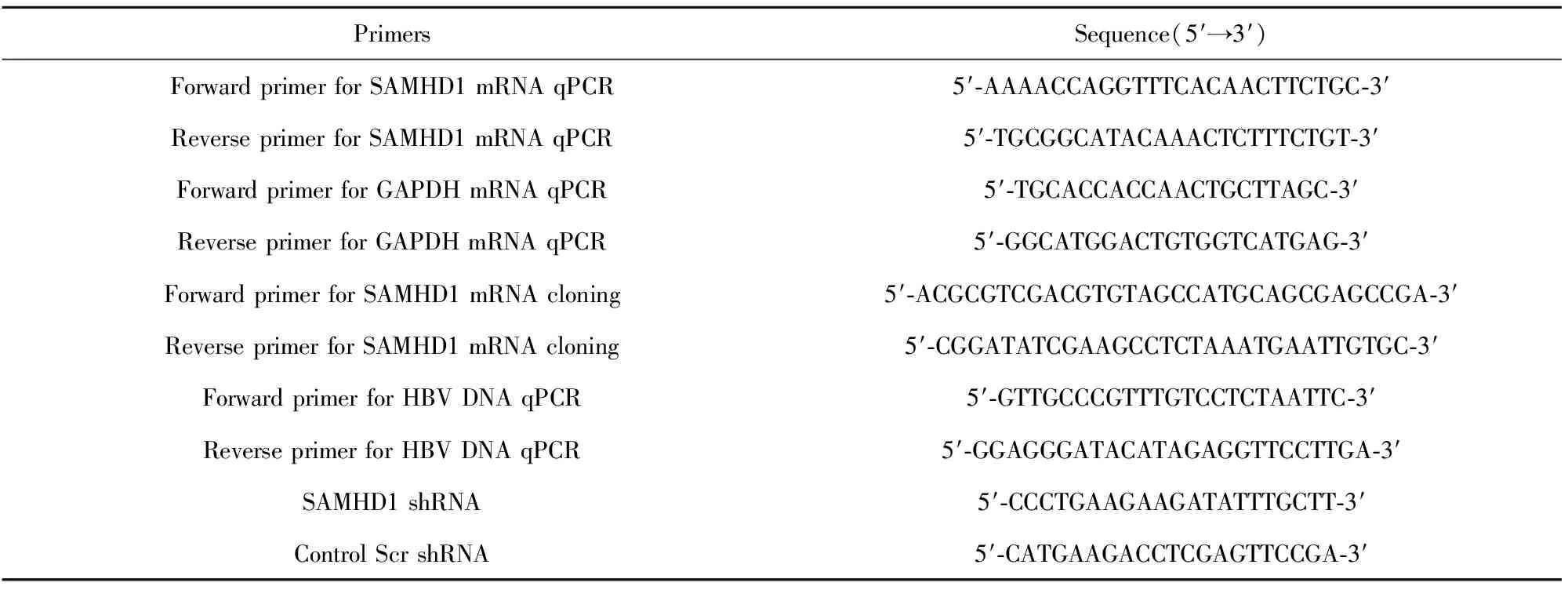
表1 引物及片段序列

2 结果
2.1SAMHD1在不同肝癌细胞系中的表达 在蛋白质水平和mRNA水平,SAMHD1在Jurkat细胞中低表达,THP-1细胞中高表达,与先前研究结果一致;三种肝癌细胞系HepG2、HepG2.2.15和Huh7中SAMHD1表达水平均较高,其中蛋白质水平与THP-1细胞未见显著差异,mRNA水平略低于THP-1细胞(P<0.05,图1)。
2.2SAMHD1表达水平对肝癌细胞内HBV复制的影响 通过RNAi敲低SAMHD1的表达,或者转染SAMHD1过表达质粒升高SAMHD1表达,检测不同SAMHD1表达水平对HepG2.2.15细胞中HBV复制的影响。结果显示,RNAi可以显著降低SAMHD1的表达水平至25%~33%,过表达质粒可以升高SAMHD1表达水平至4~5倍(P<0.01,图2A);SAMHD1表达降低后细胞外HBV DNA水平升高2.3~2.8倍,SAMHD1过表达后细胞外HBV DNA水平降低至1/3左右(P<0.01,图2B)。
2.3不同dNTP浓度对肝癌细胞内HBV复制的影响 我们进一步检测改变dNTP浓度是否会影响SAMHD1对HBV复制的抑制效果。分别用0、1、2、3 mmol/L的dNTP处理HepG2.2.15细胞和转染过表达质粒的HepG2.2.15细胞24 h,结果显示,升高培养基中dNTP浓度可以显著提高HBV的复制,2~3 mmol/L的dNTP可以将细胞外HBV DNA水平升高2倍左右(P<0.01,图3);高浓度的dNTP可以对抗SAMHD1对HBV复制的抑制效果,2~3 mmol/L 的dNTP 可以完全抵消SAMHD1的抑制效果,3 mmol/L的dNTP可以将转染了SAMHD1过表达质粒的肝癌细胞外HBV DNA水平升高至1.5~1.9倍(P<0.01,图3)。

图1 不同细胞系中SAMHD1的蛋白和mRNA表达水平Fig.1 Levels of SAMHD1 protein and mRNA in different cell linesNote:*.P<0.05,**.P<0.01.
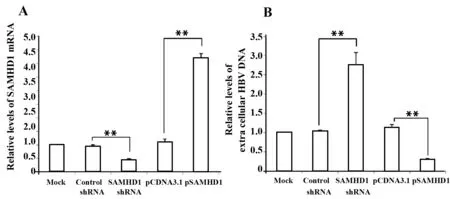
图2 不同SAMHD1表达水平对细胞外HBV DNA的影响Fig.2 Effect of different SAMHD1 expression on extra-cellular HBV DNA levelsNote:SAMHD1 expression in HepG2.2.15 was knocked down by shRNA,or increased by over-expression vectors.Fluorescence quantitative PCR was used to detect(A) relative SAMHD1 mRNA levels and(B) extracellular HBV DNA levels.Levels of HBV DNA in Mock group were defined as 1.**.P<0.01.
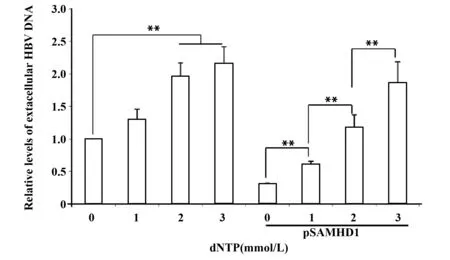
图3 不同dNTP浓度对肝癌细胞内HBV复制的影响Fig.3 Effect of different dNTP concentration on HBV replication in liver cancer cellsNote:HepG2.2.15 cells with and without over-expressed SAMHD1 were treated with 0,1,2 and 3 mmol/L dNTP for 24 h.Fluorescence quantitative PCR was used to detect extracellular HBV DNA levels.Levels of HBV DNA in untreated HepG2.2.15 cells were defined as 1.**.P<0.01.
3 讨论
SAMHD1是最新发现的一种HIV-1宿主限制因子,如同核苷类似物一类的逆转录酶抑制剂一样,都是限制病毒的逆转录过程[2-6]。SAMHD1可以被来自HIV-2和部分SIV来源的辅助蛋白Vpx降解,因此对于这些病毒,SAMHD1不具有限制性[5]。但HIV-1在进化过程中丢失了Vpx蛋白,虽然有报道发现,与Vpx功能相近的Vpr蛋白也有部分抗SAMHD1的作用,但仅限于某些SIV,HIV-1的Vpr蛋白不具有此功能[11]。因此,不同于其他HIV-1宿主限制因子,SAMHD1是目前已知的HIV-1唯一无法对抗的宿主限制因子[12]。HBV虽然是DNA病毒,但在其生命周期中存在从RNA到DNA的复制过程,类似于HIV-1的逆转录过程。SAMHD1是否对HBV的复制过程有抑制作用目前尚不清楚。
本研究首先检测了SAMHD1在不同肝癌细胞中的表达情况,我们的研究结果显示,SAMHD1可以高表达于三种肝癌细胞系HepG2、HepG2.2.15和Huh7中,其表达水平略低于单核细胞系THP-1细胞,但显著高于CD4+T细胞系Jurkat细胞。最近研究发现,HIV-1难以感染单核细胞的主要原因是在单核细胞中存在着高水平的SAMHD1表达,进而导致dNTP低于HIV-1逆转录所需的水平,而低表达SAMHD1的CD4+T细胞则对HIV-1易感[13]。我们的研究表明,肝癌细胞系中高表达的SAMHD1可能对HBV复制起抑制作用。进一步通过过表达和敲低HepG2.2.15细胞中SAMHD1的表达水平,观察不同SAMHD1表达水平对HBV DNA水平的影响。结果发现,表达高水平的SAMHD1可以显著抑制HBV DNA的水平,而敲低SAMHD1表达后HBV DNA水平明显升高,这些结果表明,SAMHD1对HBV DNA的生成有显著的抑制作用,可能进一步抑制HBV的感染。
SAMHD1的主要生物学功能是水解dNTP,降低细胞内的dNTP水平,SAMHD是否通过降低dNTP水平抑制HBV DNA的生成尚不清楚。我们进一步研究了不同dNTP浓度对SAMHD1抑制HBV DNA生成作用,结果显示高浓度的dNTP可以显著促进HBV DNA的生成,甚至可以完全对抗SAMHD1的抑制作用。因此,我们的结果表明SAMHD1是通过水解dNTP来抑制HBV DNA的生成的,另有研究报道,SAMHD1还可以促进干扰素的生成来抑制HBV DNA的生成[9,10],详细的机制还有待于进一步的研究。
[1] Yan N,Chen ZJ.Intrinsic antiviral immunity[J].Nat Immunol,2012,13(3):214-222.
[2] St Gelais C,Wu L.SAMHD1:a new insight into HIV-1 restriction in myeloid cells[J].Retrovirology,2011,8:55.
[3] Jermy A.Viral infection:SAMHD1 cuts the power to HIV-1[J].Nat Rev Microbiol,2012,10(4):237.
[4] Zhang C,de Silva S,Wang JH,etal.Co-evolution of primate SAMHD1 and lentivirus Vpx leads to the loss of the vpx gene in HIV-1 ancestor[J].PLoS One,2012,7(5):e37477.
[5] Laguette N,Rahm N,Sobhian B,etal.Evolutionary and functional analyses of the interaction between the myeloid restriction factor SAMHD1 and the lentiviral Vpx protein[J].Cell Host Microbe,2012,11(2):205-217.
[6] Hollenbaugh JA,Gee P,Baker J,etal.Host factor SAMHD1 restricts DNA viruses in non-dividing myeloid cells[J].PLoS Pathog,2013,9(6):e1003481.
[7] Grimm D,Heeg M,Thimme R.Hepatitis B virus:from immunobiology to immunotherapy[J].Clin Sci,2013,124(2):77-85.
[8] Chen Z,Zhu M,Pan X,etal.Inhibition of hepatitis B virus replication by SAMHD1[J].Biochem Biophys Res Commun,2014,450(4):1462-1468.
[9] Jeong GU,Park IH,Ahn K,etal.Inhibition of hepatitis B virus replication by a dNTPase-dependent function of the host restriction factor SAMHD1[J].Virology,2016,495:71-78.
[10] Sommer AF,Rivière L,Qu B,etal.Restrictive influence of SAMHD1 on hepatitis B virus life cycle[J].Sci Rep,2016,6:26616.
[11] Brandariz-Nuez A,Valle-Casuso JC,White TE,etal.Role of SAMHD1 nuclear localization in restriction of HIV-1 and SIVmac[J].Retrovirology,2012,9:49.
[12] Mosier DE.Virus and target cell evolution in human immunodeficiency virus type 1 infection[J].Immunol Res,2000,21(2-3):253-258.
[13] Berger A,Sommer AF,Zwarg J,etal.SAMHD1-deficient CD14+cells from individuals with Aicardi-Goutieres syndrome are highly susceptible to HIV-1 infection[J].PLoS Pathog,2011,7(12):e1002425.
[收稿2017-03-17 修回2017-06-06]
(编辑 张晓舟)
InhibitoryeffectofSAMHD1onproductionofHBVDNA
CHENGLu,WANGQing-Qing.
InstituteofImmunology,SchoolofBasicMedicalScience,ZhejiangUniversity,Hangzhou310058,China
Objective:To study the expression levels of SAMHD1 in different liver cancer cells and the inhibition of HBV DNA production by SAMHD1.MethodsSAMHD1 mRNA and protein levels in Jurkat,THP-1,HepG2,HepG2.2.15 and Huh7 were detected by Real-time quantitative PCR and Western blot.SAMHD1 expression in HepG2.2.15 was increased by transfecting SAMHD1 over expression vectors or was inhibited by transfecting SAMHD1 specific shRNA,and then HBV DNA levels were detected.The effect of different dNTP concentration on HBV DNA production was detected also.ResultsSAMHD1 were highly expressed in liver cancer cells.Decreased SAMHD1 expression could enhance HBV DNA production by 2.3-2.8 times,and increased SAMHD1 expression could inhibit HBV DNA levels by 3 times(P<0.01).Increased dNTP concentration could enhance HBV DNA production and counteract the inhibitory effect of SAMHD1.ConclusionSAMHD1 can inhibit the production of HBV DNA in liver cancer cells by decreasing dNTP concentration.
SAMHD1;HBV;Liver cancer cells;dNTP;DNA;Host restriction factors
R392.11
A
1000-484X(2017)10-1474-04
10.3969/j.issn.1000-484X.2017.10.007
程 璐(1984年-),女,主管技师,主要从事临床检验医学研究,现工作于浙江医院。
及指导教师:王青青(1971年-),女,博士,教授,系主任,主要从事免疫医学研究,E-mail:wqq@zju.edu.cn。
