广西稻瘟病菌生理小种鉴定及遗传多样性分析
2017-10-23陈小林李瑞芳李焜华韦善富黄凤宽韦丽丽
陈小林,颜 群*,李瑞芳,李焜华,韦善富,黄凤宽,韦丽丽
(1.广西农业科学院植物保护研究所,广西 南宁 530007;2.广西作物病虫害生物学重点实验室,广西 南宁 530007)
广西稻瘟病菌生理小种鉴定及遗传多样性分析
陈小林1,2,颜 群1,2*,李瑞芳1,2,李焜华1,2,韦善富1,2,黄凤宽1,2,韦丽丽1
(1.广西农业科学院植物保护研究所,广西 南宁 530007;2.广西作物病虫害生物学重点实验室,广西 南宁 530007)
【目的】明确广西稻瘟病菌生理小种组成及遗传结构,为今后水稻抗病品种的选育和布局提供依据。【方法】利用我国7个稻瘟病菌鉴别品种和SSR对广西2012~2014年分离获得的稻瘟病菌单孢菌株分别进行生理小种鉴定和遗传多样性分析。【结果】2012-2014年分离获得的142株稻瘟病菌菌株分成ZA、ZB、ZC、ZD、ZE、ZF、ZG 7群24个生理小种,其中优势种群为ZB,出现频率67.61 %,优势生理小种为ZB9和ZB13,出现频率均为19.01 %。运用UPGMA法对其中107个菌株进行遗传多样性分析,在0.88的相似水平上划分为14个遗传宗谱。其中,宗谱L01为优势宗谱,占供试菌株比例为44.86 %;其次为宗谱L03、L06和L11,占供试菌株比例分别为19.63 %、13.08 %和10.28 %。对每个遗传宗谱所包含的菌株及对应生理小种进行统计,发现稻瘟病菌遗传宗谱与生理小种之间未存在相关性。【结论】2012-2014年广西稻瘟病菌优势种群为ZB,优势生理小种为ZB9和ZB13,其遗传宗谱与生理小种之间未存在相关性。
水稻;稻瘟病菌;生理小种;遗传多样性;SSR

1 材料与方法
1.1 供试品种
我国7个水稻稻瘟病菌鉴别品种分别为:特特普、珍龙13、四丰43、东农363、关东51、合江18及丽江新团黑谷。
1.2 稻瘟病标样采集及病菌分离
于2012-2014年在广西桂中、桂南、桂北和高寒山区等稻作区随机采集的水稻穗颈瘟标样46份,采用孢子振落法[13]分离获得单孢菌株142个,接种到灭菌后约0.5 cm长的稻节中培养,产孢后于干燥处保存。
1.3 培养基
PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂20 g,加水定容至1000 mL,自然pH,121 ℃湿热灭菌20 min;不加琼脂为PDB液体培养基。
稻瘟病菌产孢培养基[21]:新鲜紫鸭跖草剪成约1 cm长片段,放入三角瓶中,每瓶15~20 g,121 ℃湿热灭菌20 min。
1.4 SSR引物
参照刘二明等[22]筛选的13对SSR引物:A5、D4、D5、G5、KMS02、KMS20、SMS17、FG01、FG02、 FG03、MS355、MS363、MS677,引物由上海Invitrogen公司合成。

表1 菌株来源Table 1 The origin of strains
1.5 孢子悬浮液的制备
将保存的菌株转移到PDA培养基上,28 ℃恒温培养约7 d,待菌丝长满培养基表面,挑取适量菌丝体,接种于产孢培养基,28 ℃恒温培养7~10 d后,每个三角瓶加无菌水50 mL,用纱布滤掉菌丝及培养基,配制成孢子浓度为1×105~3×105CFU/mL用于人工接种。
1.6 苗期人工接种
将7个鉴别品种种子浸种48 h,置于28 ℃恒温催芽24 h,按顺序播于同一瓷盘中,每个品种播10~15粒种子,常规管理,接种前3~5 d追施尿素1次,每盘4 g。待秧苗长至3~4叶时,均匀喷雾孢子液,接种量以所有叶片布满孢子液为标准,接种后置于28 ℃黑暗条件下保湿24 h,而后光暗交替,高保湿条件下诱导发病。每菌株接种2盆(2次重复)。接种6~8 d后,参照全国稻瘟病菌生理小种联合试验组调查标准记载及划分生理小种[23]。
1.7 DNA提取
从稻瘟病菌PDA平板上挑取适量菌丝接种到装有PDB培养基的三角瓶中,置于28 ℃、180 r/min摇床,振荡培养5~7 d,收集菌丝,采用SDS法[24]提取基因组DNA,并用Nano Drop的Spectrophotometer检测DNA浓度,调节浓度至100 ng/μl备用。
1.8 PCR扩增
PCR反应体系含有正、反向引物(10 μM/L)各1 μl,10 μl 2×TaqPCR MasterMix,1 μl模板DNA,加ddH2O补足至20 μl。PCR扩增程序为:95 ℃预变性5 min;95 ℃变性30 s,55~57 ℃(根据具体引物设定[22])退火1 min,72 ℃延伸1~2 min,共35个循环;72 ℃延伸10 min后4 ℃保存。PCR扩增产物在2 %琼脂糖凝胶上电泳检测,电压80 V,1 h,电泳后在凝胶成像仪下观察、拍照并记录。

表2 广西稻瘟病菌生理小种组成Table 2 Composition of physiological races of M.oryzae in Guangxi
1.9 数据处理
根据PCR扩增结果,建立SSR的0-1数据库,每个样品的电泳条带,有则赋值为1,无则赋值为0,应用NTSYSpc2.1软件,UPGMA方法(unweighted pair group method with arithmetic means)进行聚类分析[25],构建树状聚类图。
2 结果与分析
2.1 广西稻瘟病菌生理小种鉴定
对2012-2014年广西不同稻作区采集分离的142个稻瘟病单孢菌株,采用7个中国鉴别品种进行接种鉴定,结果显示,142个稻瘟病单孢分离菌株分为7群24个生理小种(表2),包括ZA、ZB、ZC、ZD、ZE、ZF和ZG群,出现频率分别为13.38 %、67.61 %、4.93 %、7.04 %、1.41 %、3.52 %和2.11 %。鉴定的结果表明,优势种群为ZB,其次为ZA和ZD;优势生理小种为ZB9和ZB13,出现频率均为19.01 %。与颜群[17]等检测的2006年广西稻瘟病菌生理小种相比,优势种群未变,优势生理小种由原来出现频率分别为25.1 %、19.42 %的ZB1和ZB9变成出现频率为均19.01 %的ZB9和ZB13。
2.2 稻瘟病菌遗传多样性分析
2.2.1 供试菌株的PCR扩增 13对SSR引物对107个分离菌株进行了有效扩增,不同引物扩增的菌株呈现不同的多态性。KMS02、KMS20、SMS17、A5、D4、D5、G5、FG01、FG02、FG03、MS355、MS363和MS677分别扩增出181、121、109、105、281、116、201、148、186、115、130和153条亮带,表明107个稻瘟病菌株遗传具有多样性、复杂性。部分代表性扩增结果如图1。

M:DNA ladder;1~12:供试菌株 图1 引物KMS20、A5、KMS02对部分公司菌株的扩增产物Fig.1 Products of part of M.oryzae isolates by primer KMS20,A5 and KMS02,respectively
2.2.2 稻瘟病菌群体的遗传组成 从107个供试菌株进行聚类的结果(表3)可见,107个菌株在0.88的相似水平下被分成14个宗谱,其中L01为优势宗谱,包含48个菌株,占供试菌株比例为44.86 %;其次为宗谱L03、L06和L11,分别包含21、14和11个菌株,占供试菌株比例分别为19.63 %、13.08 %、10.28 %;其余10个宗谱分别包含菌株为1~3个,占供试菌株总比例为12.15 %。
2.3 稻瘟病菌遗传宗谱与生理小种的关系
对每个遗传宗谱所包含的菌株及对应生理小种进行统计(表3),结果表明稻瘟病菌遗传宗谱与生理小种之间未存在相关性。同一宗谱内有多个不同生理小种,如宗谱L01就包括ZA1、ZA9、ZB1、ZB3、ZB5、ZB9、ZB13、ZB29、ZC1、ZC13、ZD1、ZE3、ZF1和ZG1共14种生理小种共48个菌株。而同一种生理小种又聚在不同宗谱上,如ZA1的10个菌株分别聚在宗谱L01、L03和L06上,ZB1的12个菌株分别聚在宗谱L01、L03、L06和L11上,说明用传统的7个鉴别品种鉴定出的生理小种本身在遗传组成上存在差异。
3 讨 论
本研究对2012-2014年广西26县市稻区的稻瘟病菌142个单孢分离菌株进行生理小种鉴定,菌株分成ZA、ZB、ZC、ZD、ZE、ZF、ZG共7群24个生理小种,ZB为优势种群,出现频率67.61 %,ZB9和ZB13为优势生理小种,出现频率均为19.01 %,与2006年广西稻瘟病菌生理小种的组成[13]相比,优势种群未变,优势生理小种由原来出现频率分别为25.1 %、19.42 %的ZB1和ZB9变成出现频率为均19.01 %的ZB9和ZB13。本研究所用菌株均采自田间自然发病的穗颈瘟标样,采集地点多、寄主品种多样,能够很好的反映广西田间稻瘟病菌的菌体结构,而肖丹凤等[15]研究结果表明,广西局部稻区2011-2012年优势生理小种为ZA11、ZA7和ZA15,因其仅对广西南宁地区分离的菌株进行测定,标样采集地点分布偏窄、测定菌株数量偏少,故难以全面反映广西稻瘟病菌优势生理小种;近10多年来ZB一直是广西稻瘟病菌的优势种群,表明该地区水稻主栽品种与ZB群具有很好的亲和性,利于其田间发生和流行。目前,含有不同稻瘟病抗性基因的单基因系IRBLK-KA(Pi-k)、IRBLKm-TS(Pi-km)、IRBL1-CL(Pi-1)、IRBLTA-RE(Pi-ta)和IRBL9-W(Pi-9)对广西142个分离株的抗谱均大于70.00 %,说明这些抗性基因仍具有较高的应用价值,可作为优良的抗源在该地区水稻抗病育种中使用,或通过聚合不同抗性基因从而达到提高品种抗性的目的。
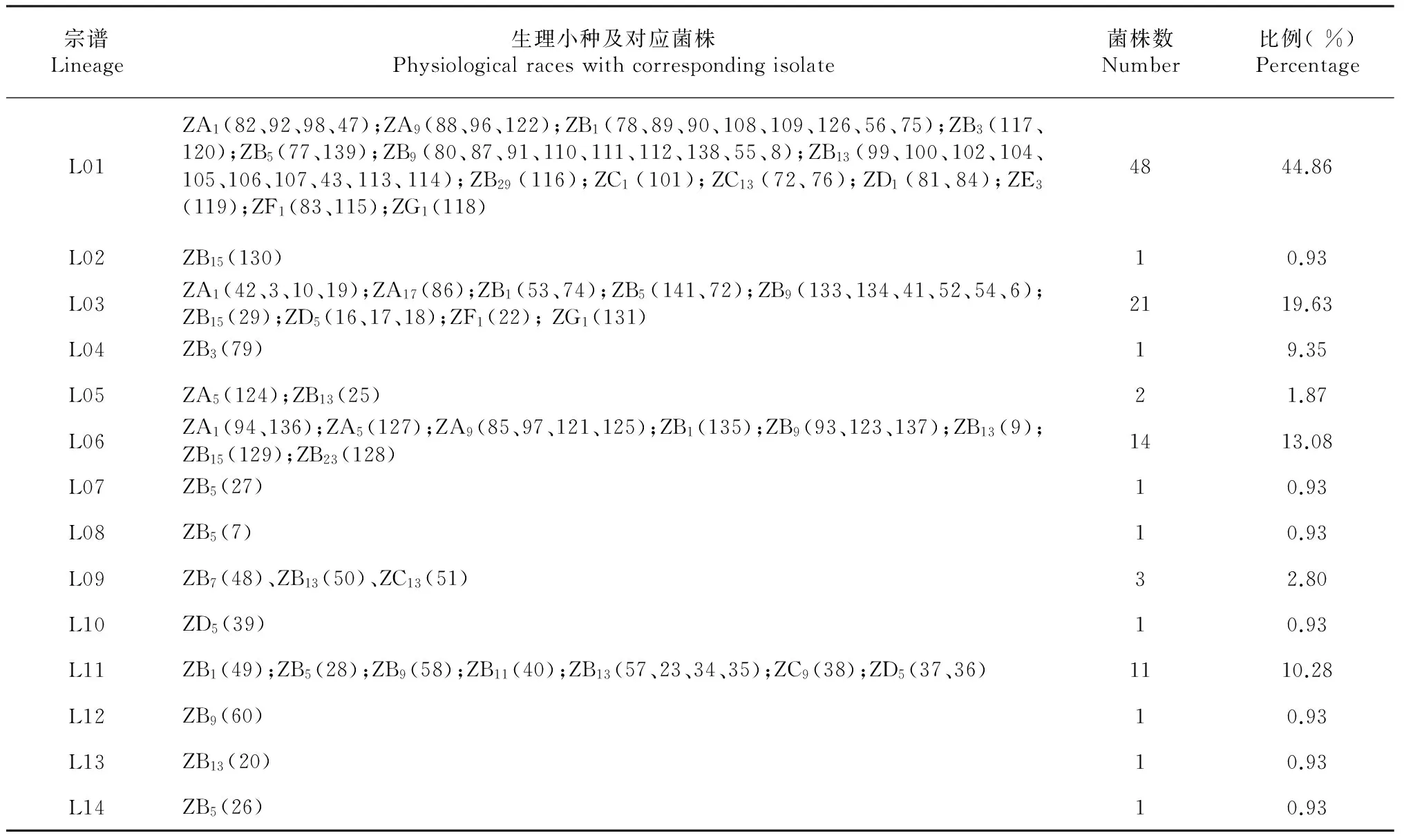
表3 稻瘟病菌菌株的遗传宗谱Table 3 Genetic lineages of M.oryzae isolates
本研究利用13对SSR引物对107个单孢分离菌株进行了有效扩增,运用UPGMA法对其进行遗传多样性分析,在0.88的相似水平上将其划分为14个遗传宗谱,表明这些菌株在遗传组成上的复杂性。而对每个遗传宗谱所包含的菌株及对应生理小种进行统计,发现稻瘟病菌遗传宗谱与生理小种之间未存在明显相关性,这与前人的研究结果较为一致[15,26]。由于大多数SSR引物都是中性的分子标记,其多态性在一定程度上反映了病原菌基因组遗传组成的差异,但不能很好地反映病原菌致病相关基因差异,而生理小种是根据水稻品种对菌株的抗、感反应型划分,反映病原菌无毒基因(AVR)和寄主(R)抗性基因的互作,因此可以考虑利用与病原菌无毒基因连锁或无毒基因内特异性分子标记来分析其群体的遗传多样性。邓其明[27]等分析了基于毒性相关基因序列的稻瘟病菌群体遗传多样性,揭示了9个区域稻瘟病菌群体遗传规律及其与地理分布之间的关系,具有一定的参考意义。
4 结 论
2012-2014年广西稻瘟病菌优势种群为ZB,优势生理小种为ZB9和ZB13;其遗传宗谱与生理小种之间未存在相关性。
[1]Liu W,Liu J,Ning Y,et al.Recent progress in understanding PAMP- and effector-triggered immunity against the rice blast fungusMagnaportheoryzae[J].Molecular Plant,2013,6(3): 605-620.
[2]颜 群,高汉亮.广西水稻区试品种(组合)对稻瘟病的抗性评价[J].中国种业, 2007(8): 40-41.
[3]穆慧敏,姜 华,王艳丽,等.研究稻瘟病菌群体遗传多态性的分子标记方法[J].中国水稻科学, 2013,27(5): 545-552.
[4]Karaoglu H,Lee CMY,Meyer W.Survey of Simple Sequence Repeats in Completed Fungal Genomes[J].Molecular Biology and Evolution,2005,22(3): 639-649.
[5]颜学海,邓元宝,韩 冬,等.西南地区稻瘟病菌群体遗传多样性分析[J].植物保护学报,2016,43(4): 537-543.
[6]刘 翔,任佐华,陈娟芳,等.利用SSR分析湖南桃江病圃丽江新团黑谷上稻瘟病菌的遗传多样性[J].西南农业学报,2015,28(6): 2496-2500.
[7]谢晶晶,姜 华,毛雪琴,等.利用SSR技术研究浙江省稻瘟病菌群体的遗传多样性[J].浙江农业学报,2015,27(10): 1781-1788.
[8]程兆榜,史明乐,刘志恒,等.苏辽粳稻区稻瘟病菌遗传多样性研究[Z].青岛,2013:351.
[9]张崎峰,靳学慧,蔡鑫鑫,等.用SSR标记法对黑龙江省稻瘟菌无毒基因的检测[J].中国农学通报,2010,26(10): 250-254.
[10]李 亚.湖南稻瘟病菌遗传多样性的SSR分析与病菌致病型比较研究[D].湖南农业大学硕士论文,2006: 10.
[11]魏松红,王海宁,刘志恒,等.辽宁省稻瘟病菌遗传宗谱与致病型的关系[J].沈阳农业大学学报,2016,47(4): 412-417.
[12]苏代群,孙 健,杨春福,等.黑龙江省部分稻区稻瘟病菌生理小种鉴定[J].种子世界,2016(10): 40-41.
[13]徐建第,张全芳,姜明松,等.2013年山东省部分稻区稻瘟病菌生理小种的鉴定及分析[J].山东农业科学,2015,47(4): 110-111.
[14]赵正洪,周 政,吴伟怀,等.湖南稻瘟病菌生理小种的组成及其致病性[J].湖南农业大学学报(自然科学版),2014,40(2): 173-177.
[15]肖丹凤,王 玲,刘连盟,等.黑浙桂稻瘟病菌生理小种鉴定与遗传多样性分析[J].西南农业学报,2014,27(1): 121-126.
[16]刘晓梅,李 莉,姜兆远,等.2002-2012年吉林省稻瘟病菌生理小种的变化动态[J].吉林农业科学,2014,39(2): 68-70,77.
[17]颜 群,高汉亮,张 晋.2006年广西稻瘟病菌生理小种的组成与分布研究[J].广西农业科学,2009,40(8): 1004-1006.
[18]霍秀娟,李朝生,陆荣生,等.广西稻瘟病菌生理分化及对4个水稻品种的毒性测定[J].南方农业学报,2012,43(6): 771-775.
[19]颜 群,韦鸿若,罗志勇,等.广西岑溪田间自然诱发稻瘟病圃的建立及水稻品系的抗瘟性评价[J].中国农学通报,2011,27(27): 255-259.
[20]颜 群,罗志勇,张 晋,等.广西部分水稻主导品种对稻瘟病的抗性评价[J].西南农业学报,2014,27(5): 1924-1928.
[21]霍秀娟,李朝生,韩美丽,等.灰梨孢菌产孢培养基筛选[J].南方农业学报,2012,43(5): 605-608.
[22]虞选杰,任佐华,管玲莉,等.湖南桃江病圃丽江新团黑谷上稻瘟病菌遗传多样性分析[J].杂交水稻,2014,29(3): 70-73.
[23]我国稻瘟病菌生理小种研究[J].植物病理学报,1980,10(2): 71-82.
[24]刘少华,陆金萍,朱瑞良,等.一种快速简便的植物病原真菌基因组DNA提取方法[J].植物病理学报,2005,35(4): 362-365.
[25]Bertin P,Grégoire D,Massart S,et al.High level of genetic diversity among spelt germplasm revealed by microsatellite markers[J].Genome,2004,47(6): 1043-1052.
[26]李 亚,刘二明,戴良英,等.湖南稻瘟病菌群体遗传多样性与病菌致病型的关系[J].中国水稻科学,2007,21(3): 304-308.
[27]邓其明,颜学海,何建美,等.基于毒性相关基因序列的稻瘟病菌群体遗传多样性分析[J].植物病理学报,2016,46(1): 91-102.
PhysiologicalRacesIdentificationandGeneticDiversityAnalysisofMagnaportheoryzaeinGuangxiProvince
CHEN Xiao-lin1,2,YAN Qun1,2*,LI Rui-fang1,2,LI Kun-hua1,2,WEI Shan-fu1,2,HUANG Feng-kuan1,2,WEI Li-li1
(1.Institute of Plant Protection,Guangxi Academy of Agricultural Sciences,Guangxi Nanning 530007,China; 2.Guangxi Key Laboratory of Biology for Crop Diseases and Insect Pests,Guangxi Nanning 530007,China)
【Objective】The present paper aims to figure out physiological races variation and genetic structure ofMagnaportheoryzaein Guangxi and providea basis for breeding and distribution of rice resistant varieties in the future.【Method】Physiological races identification with seven differential varieties and genetic diversity analysis with SSR ofM.oryzaefrom 2012 to 2014 in Guangxi were conducted in the present work.【Result】24 physiological races belonging to 7 groups which included ZA,ZB,ZC,ZD,ZE,ZF and ZG were identified from 142 isolates collected from 2012 to 2014.Among them,the predominant group was ZB with an occurrence frequency of 67.61 %,and the predominant races were ZB9and ZB13with an occurrence frequency of 19.01 %,respectively.The UPGMA method was used to analyze the genetic diversity of 107 isolates and 14 lineages at similarity coefficient of 0.88 were obtained.Among them,lineage L01 was the dominant lineage accounting for 44.86 % of the isolates,lineage L03,L06 and L11 were subordinate lineages accounting for 19.63 %,13.08 % and 10.28 % of the isolates,respectively.In addition,the number of isolates and their corresponding physiological race of every lineage was counted and the result showed that there was no correlation between genetic lineages and races.【Conclusion】Between the year of 2012 and 2014 in Guangxi,the predominant group ofM.oryzaewas ZB while the predominant races were ZB9and ZB13,and there was no correlation between genetic lineages and races.
Rice;Magnaportheoryzae; Physiological race; Genetic diversity; SSR
1001-4829(2017)4-0767-06
10.16213/j.cnki.scjas.2017.4.010
2016-12-19
国家现代农业产业技术体系广西创新团队(水稻)项目(nycytxgxcxtd-01-04);广西自然科学基金项目(2015GX NSFBA139106);广西农业科学院基本科研业务专项及科技发展基金项目(2015YT36,2015YM24,桂农科2016JM11);广西作物病虫害生物学重点实验室基金项目(2016-ST-2)
陈小林(1982-),女,广西博白人,博士,助理研究员,主要从事水稻病害研究,E-mail:cxl19830807@163.com,*为通讯作者,颜 群,E-mail:56297244@qq.com。
S435.111.4+1
A
(责任编辑 陈 格)
