茚三酮显色分光光度法测定食品中α-氨基酸含量的方法探讨
2017-10-20丁永霞
丁永霞
(菏泽市疾病预防控制中心,山东菏泽 274010)
茚三酮显色分光光度法测定食品中α-氨基酸含量的方法探讨
丁永霞*
(菏泽市疾病预防控制中心,山东菏泽 274010)
1 材料与方法
1.1 仪器
UV—2550紫外可见分光光度计,日本岛津公司;FA2004N电子分析天平,上海精密科学仪器公司;石英比色皿(1cm);玻璃比色皿;容量瓶;移液管;吸管;蒸馏烧瓶;加热套;pH试纸。
1.2 试剂
盐酸溶液,浓度6 mol/L,分析纯;甘氨酸,优级纯;茚三酮试剂,分析纯;乙酸,分析纯;乙酸钠,分析纯;NaOH溶液,浓度1 mol/L,分析纯;酚酞指示剂。
乙酸-乙酸钠缓冲溶液(pH=5.5):精确称取50 g乙酸钠 (CH3COONa·3H20) 于烧杯中,加入150mL蒸馏水,用移液管移取2.50mL冰醋酸,加热溶解,冷却后转移到250mL容量瓶中,用馏水定容至刻度。
茚三酮乙二醇溶液(质量浓度3%):精确称取3 g水合茚三酮,加入50mL乙二醇,低温加热溶解后,转移至100mL容量瓶中,用乙二醇定容至刻度,转移到试剂瓶后置于0℃~5℃冰箱中保存备用(临用时配)。
甘氨酸标准储备液:准确称取0.1000 g甘氨酸标准品,加馏水溶解定容到100mL容量瓶中,摇匀,转移到玻璃试剂瓶后置于0℃~5℃冰箱中备用,此溶液质量浓度为1000 μg/mL。
1.3 样品处理与测定方法
1.3.1 样品处理
精确称取5 g样品于蒸馏烧瓶中,加入30mL 6 mol/L的盐酸溶液,在100℃的沸水浴中加热水解10 h。冷却后过滤,并用少量的水冲洗过滤漏斗中的残渣,将溶液定容至100mL容量瓶中。取1.00mL样品溶液于烧杯中,加入20mL蒸馏水、2滴酚酞试剂,用1 mol/L的NaOH溶液滴定,使其pH值在5~7之间,记录所需NaOH溶液的体积。取出1.00mL样品溶液于50mL容量瓶中,加入所需体积的NaOH溶液,配置pH值在5~7之间的样品稀释溶液,备测。
1.3.2 测定方法
分别吸取样品稀释液 2.00mL和0.0 μg/mL、10.0 μg/mL、25.0 μg/mL、50.0 μg/mL、75.0 μg/mL 的甘氨酸系列标准溶液2.0mL置于20mL比色管中,加入乙酸-乙酸钠缓冲溶液(pH=5.5) 5.0mL,充分摇匀后,加2.0mL质量浓度3%的茚三酮乙二醇溶液,摇匀,于沸水浴中加热,颜色变化后计时20min,计时结束后取出试管,冷却至室温,倒入比色皿中,以0.0 μg/mL的甘氨酸溶液为参比,在566nm波长处测定吸光度,并绘制标准曲线,计算出样品含量,同时做试剂空白。样品及标准溶液的吸光度值见表1。
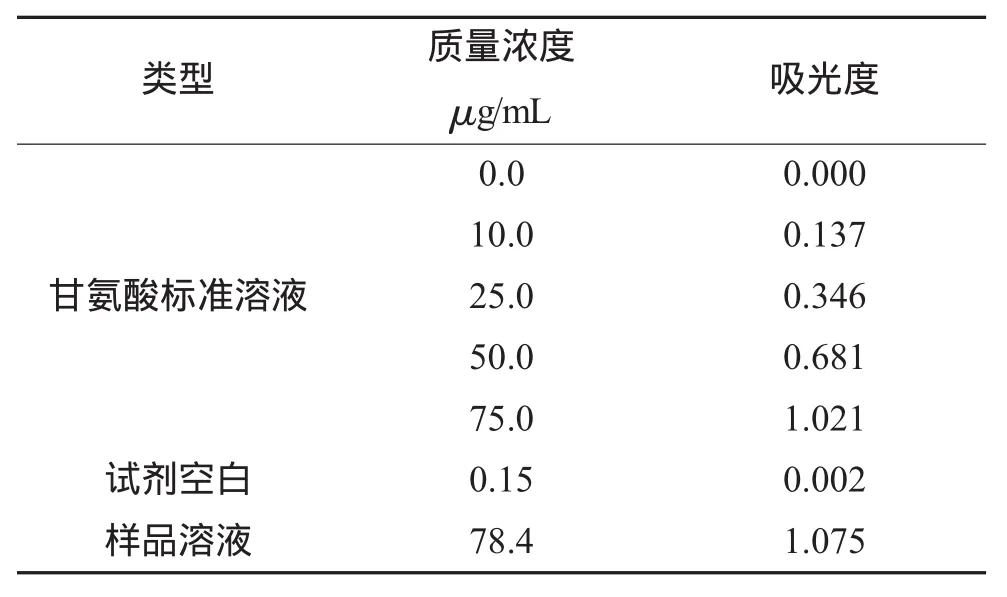
表1 样品及标准溶液的吸光度
根据测定结果求得其回归方程为y=0.0137x+0.0035,相关系数R2=0.9996。结果表明,标准溶液的浓度在 0 μg/mL~100 μg/mL 范围内有良好的线性关系。
2 结果与讨论
2.1 最大吸收波长的选择
用紫外分光光度计(1cm石英比色皿)对样品显色溶液进行比色(范围190nm~700nm),发现最高峰值在可见区566nm处,换玻璃比色皿对溶液进行验证(范围400nm~700nm),最高峰值仍在566nm处,故选取566nm为最大吸收波长。吸收光谱见图1和图2。

图1 样品显色液紫外可见区光谱图

图2 样品显色液可见区光谱图
2.2 加热时间的影响
取6.0mL质量浓度为100 μg/mL的甘氨酸标准工作液于50mL比色管中,加入15.0mL乙酸-乙酸钠缓冲液(pH=5.5) 和6.0mL质量浓度3%的茚三酮乙二醇溶液,摇匀,于沸水浴中加热,当溶液有颜色变化时开始计时,每过5min取出约5mL溶液,冷却,测定其吸光度,结果见表2、图3。由图3可知,加热20min时吸光度数值基本稳定,因此选择20min时为最佳加热时间。

表2 不同反应时间测得吸光度

图3 不同显色时间对吸光度的影响
2.3 显色剂用量的影响
取2.0mL质量浓度为100 μg/mL的甘氨酸标准工作液于试管中,各加入5.0mL乙酸-乙酸钠缓冲液 (pH=5.5),分别加入 1.0mL、2.0mL、3.0mL、4.0mL质量浓度3%茚三酮乙二醇溶液,在沸水中水浴加热,待显色20min时取出测吸光度。测定的各显色体系的吸光度见表3、图4。

表3 不同显色剂用量测得吸光度
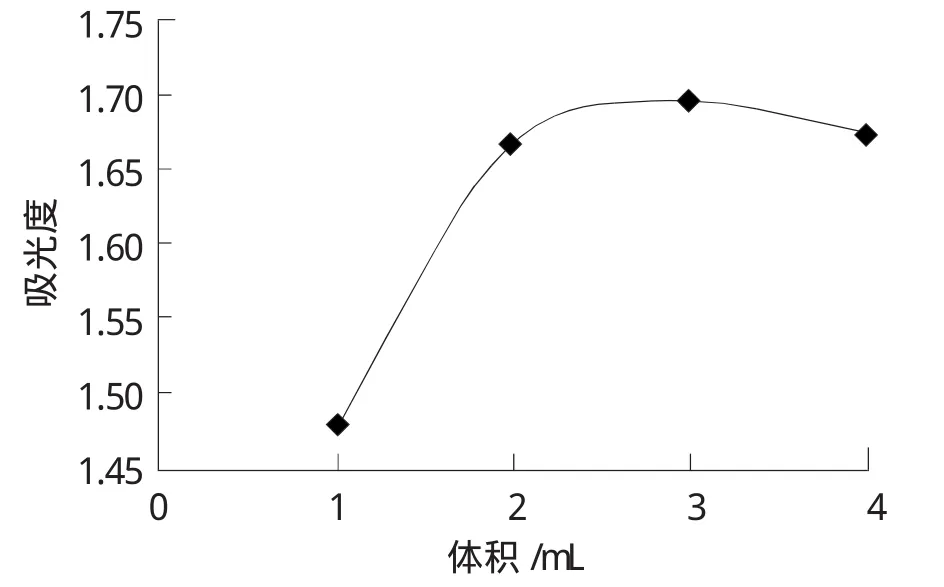
图4 不同显色剂用量对吸光度的影响
由图4可知,随着显色剂用量的增加,吸光度不断增大,当显色剂用量超过3.0mL时吸光度开始下降,显色剂用量为2.0mL时的显色稳定度好、显色速度较快,因此选择显色剂用量为2.0mL。
2.4 精密度测定
取2.00mL样品稀释液进行多次测定(n=5),计算其α-氨基酸总含量,结果见表4。
由表4可以看出,样品稀释液的α-氨基酸含量为78.53 μg/mL,标准偏差为0.33,相对标准偏差为0.42%。

表4 样品液中α-氨基酸含量测定的重复性
2.5 回收率测定
为了确定测量的准确度,取一定量的样品液,测定其α-氨基酸总量作为本底量,以5 μg/mL、10 μg/mL的甘氨酸分别作为加标量,测定回收率,结果见表5。

表5 回收率试验结果
由表5数据可知,回收率在97.4%~103.4%范围内,表明该方法测定结果准确可靠。
3 结论
本研究采用茚三酮显色分光光度法测定食品中的α-氨基酸总含量,该方法具有操作简单、快速和重现性较好等优点,通过试验得出最佳试验条件为:pH值5.5,沸水浴加热20min,最佳吸收波长566nm。此试验条件下,该方法的变异系数0.42%,平均加标回收率为100.02%。
[1]钟秋珍,玮玲,林武,等.5个杨桃品种果实氨基酸含量及组成分析[J].福建果树,2011,5(3):5-8.
[2]史修周,陈昌生,谢潮添,等.坛紫菜氨基酸提取工艺影响条件的优化与分析[J].台湾海峡,2011,30(1):132-138.
[3]刘慧燕,德力格尔桑,方海田.茚三酮比色法测定牛肉中游离氨基酸的试验研究[J].加工工艺,2005,6(2):23-25.
[4]王昂,王丽丽,仪宏,等.茚三酮比色法测定谷氨酸含量的研究[J].中国调味品,2005,8(8):50-52.
[5]张振华.α-氨基酸与茚三酮显色反应影响因素的探讨[J].邵阳高等专科学校学报,2000,13(1):42-44.
Determination of alpha amino acid in food by ninhydrin color spectrophotometry
DING Yongxia*
(Heze citycenter for disease control and prevention,ShandongHeze 274010,China)
采用茚三酮显色分光光度法测定食品中α-氨基酸的总含量,通过试验摸索,确定了以甘氨酸为标准品、茚三酮为显色剂的测定方法。试验结果表明,该方法的最佳反应条件为:pH值5.5,在沸水浴中加热显色20min,常温条件下的最大吸收波长566nm。用甘氨酸配制系列标准溶液,通过标准曲线法对待测溶液进行定量分析,其相关系数为0.9995,回收率在95.5%~104.3%范围内,表明该方法具有操作简便、结果准确、重现性良好的特点。
茚三酮;分光光度法;α-氨基酸;甘氨酸
The method ofdeterminate alpha aminoacid in food on the basis ofglycine,ninhydrin as chromogenic agent was established.The results show that the optimum reaction conditions were pH 5.5,in a boiling water bath heating chromogenic 20min,under the condition ofroomtemperature the maximumabsorption wavelength of566nm.Prepared with glycine series of standard solution,standard curve method for quantitative analysis of the test solution,the correlation coefficient is 0.9995,the recovery rate from 95.5%to 104.3%range.The method is with simple operation,accurate results and good reproducibility.
ninhydrin;spectrophotometry;alpha aminoacid;glycine
TS207.4
A
1673-6044(2017)01-0055-03
10.3969/j.issn.1673-6044.2017.01.016
*丁永霞,女,1963年出生,1996年毕业于曲阜师范大学化学系化学专业,副主任技师。
2016-12-10
