原电池法探究金属铝在浓硝酸中的钝化行为
2017-10-19诸佳丹丁伟
诸佳丹+丁伟
摘要:以浓硝酸为电解质溶液,以铜、铝为电极,通过导线连接灵敏电流计构成原电池。通过观察灵敏电流计指针偏转方向的变化即电流反转现象,来表征铝的钝化行为。利用该装置考察金属铝在不同浓度硝酸中的钝化情况,探寻引起金属铝发生钝化的硝酸浓度的临界值。此外,本实验装置采用塞有棉花的具支U形管作为原电池载体,能够有效处理实验产生的有害气体,具有绿色环保、操作简单等特点,可用于课堂演示。
关键词:原电池法;金属铝;浓硝酸;钝化;实验探究
文章编号:1005–6629(2017)9–0059–04 中图分类号:G633.8 文献标识码:B
1 问题的提出
金属的防腐蚀处理十分重要。金属防腐的方法多种多样,金属表面钝化处理是其中重要的一种。所谓钝化即金属表面经阳极氧化或化学方法处理,由活泼态转变成不活泼态(钝化态)的过程[1]。
高中化学教材中有提到“金属铝在浓硝酸中会发生钝化”的内容,但是仅仅作为一则信息穿插在介绍铝的性质与硝酸的性质中,而且相关的实验也不多。仅在苏教版高中必修教材《化学1》“铝土矿到铝合金”一节中安排了“活动与探究”:“将几小块用砂纸打磨过的铝条分别放入浓硝酸、浓硫酸、6mol/L盐酸、6mol/L氢氧化钠溶液,观察现象”。在教材实验的基础上,有研究者对金属铝的钝化行为进行了拓展性探究。例如,用钝化后的铝片探究钝化膜的性质;探究钝化后的鋁是否仍具有活泼金属的性质,从溶液(如硫酸铜溶液)中置换相对不活泼金属的能力[2]。已有的研究较少关注金属铝钝化反应的发生过程及其反应速率。
是否可以通过实验现象让学生直观感知钝化反应的过程以及钝化反应的速率?本研究设计了“铜铝-浓硝酸原电池”,巧妙地利用灵敏电流计指针偏转方向的变化,即正负极反转,以表现金属铝的钝化。并利用灵敏电流计指针偏转速度反映钝化反应的快慢。通过不断降低硝酸的浓度来探查不同硝酸浓度对金属铝的钝化反应速率的影响,并探寻能引起金属铝发生钝化的硝酸浓度的临界值。
2 实验设计
2.1 仪器与药品
实验仪器:J0409灵敏电流计(300μA)、导线(鳄鱼夹-U型叉型)、具支U形管、橡胶塞、塑料滴管、脱脂棉
实验药品:铝棒、铜棒、浓硝酸(质量分数为65%)、6mol/L氢氧化钠溶液、2mol/L稀硫酸
2.2 装置设计
设计以铝棒和铜棒为电极的电解池。以盛有浓硝酸作为电解液的具支U形管作为电解槽,左侧插入铝棒,连接灵敏电流计的负极;右侧插入铜棒,连接灵敏电流计的正极。U形管的两侧具支口接有尾气吸收装置。尾气吸收装置制作如下:将塑料滴管的头部和尾部剪去一部分,并在头部一侧塞入浸泡过6mol/L氢氧化钠溶液的脱脂棉,用于吸收反应中产生的二氧化氮气体(见图1)。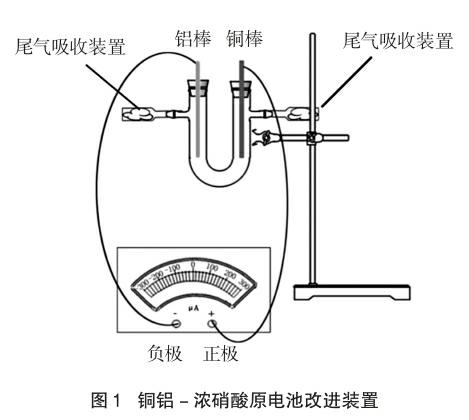
将两电极分别置于电解槽U形管的两个管口,有利于同时观察两极气泡产生情况及溶液颜色变化。改进后装置有较好的密闭性,通过设置二氧化氮尾气吸收装置,避免二氧化氮尾气污染环境。通过上下抽动电极棒可实现反应随时开始或停止。实验操作简单,可控性高。
3 实验过程
3.1 铜铝-浓硝酸原电池的电流反转现象
常温下(以下实验各溶液起始温度及室温均在15℃),以冷的浓硝酸为电解质溶液,铝棒接灵敏电流计的负极,铜棒接灵敏电流计的正极,构成原电池,观察灵敏电流计指针偏转。记录指针偏转情况于表1。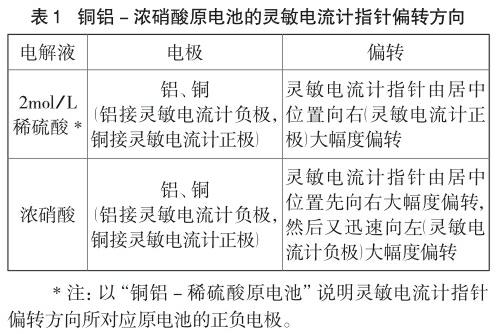
铜铝-浓硝酸原电池中,灵敏电流计指针首先向右大幅度偏转,说明此时铝棒做负极;然后灵敏电流计指针迅速反转,指针又向左大幅度偏转,说明此时铜棒做负极。
上述两次偏转体现了在此原电池中的电流反转现象,第一次灵敏电流计指针偏转时,金属铝发生化学钝化。化学反应初始时刻,灵敏电流计指针由零刻度向右大幅度偏转,且偏转时间极短(小于1s),说明钝化过程非常迅速。然后灵敏电流计指针又迅速向左大幅度偏转,完成第二次灵敏电流计指针偏转。上述两次偏转体现了在此原电池中的电流反转现象,因此可以通过此现象表征金属铝的钝化行为。
3.2 探究硝酸浓度对金属铝钝化行为的影响
首先,配制不同体积比的浓硝酸与水的混合溶液,用作原电池电解质溶液进行初步实验,从而探究使铝发生钝化的硝酸浓度的临界值范围;然后将初步实验中的临界值浓度范围进一步细化。具体实验步骤如下:
(1)将65%的浓硝酸与水以体积比4:1、3:1、2:1、1:1混合配制溶液。
(2)分别将上述四种混合溶液作为铜铝原电池的电解质溶液,观察灵敏电流计指针偏转。
(3)由(1)、(2)两步可知,浓硝酸与水体积比为2:1(10mol/L)时仍发生电流反转现象,而浓硝酸与水体积比为1:1(7.5mol/L)时,不发生电流反转现象。因此将临界浓度范围缩小至7.5~10mol/L。
(4)分别配制8mol/L与9mol/L硝酸溶液,将其作为原电池的电解质溶液,观察灵敏电流计指针偏转,记录实验现象和电流反转时间(见表2)。
从表中数据可以看出,使铝发生钝化的硝酸浓度临界值在7.5~8mol/L。超过临界浓度时,铝在铜铝-浓硫酸原电池中的电极角色会发生转变,在反应一开始做负极,至钝化完成后变为正极。随着硝酸浓度的增加,铝钝化所需要的时间越来越短,说明硝酸浓度越高,铝发生钝化速度越快。

4 实验现象分析
4.1 铝的电极角色转变
图2为具有钝化特性的金属的典型阳极极化曲线[3],阳极极化是在外加电流的作用下,在阳极上形成一层氧化膜的过程。当极化曲线沿AB线变化时,此时金属处于活化区。当电势到达B点时,表面开始钝化。随着钝化膜的增厚,进入稳定钝化区。当电势到达C点时,金属处于稳定钝态。金属变成钝态之后,其电极电势不断升高,甚至可以升高到接近贵金属(如Au:Au3++3e-=Au,Eθ=1.55V)的电极电势。可见,金属发生钝化后,其电极电势向正方向移动。
铝是比较活泼的金属,其标准电极电位为-1.66V。本实验中金属铝发生化学钝化,由活泼态转变成不活泼态(钝化态)。因此随着钝化膜的增长(钝化膜的生长速率比较快),铝棒电势升高,从而超过铜的标准电极电势(Cu2++2e-=Cu,Eθ=0.34V)。所以,金属铝发生钝化后,铜棒做负极,钝化的铝棒做正极,铝棒与铜棒的电极角色发生转变。
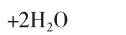
4.2 电极附近溶液颜色变化及气体产生情况
在浓硝酸环境中,铜棒电极产生大量红棕色气体,气体为二氧化氮。铜棒附近的溶液为绿色,是由于二氧化氮气体溶于水与硝酸铜溶液混合所致。随着硝酸浓度不断降低,铜棒一侧产生的气体颜色变浅,其附近溶液逐渐转为蓝色。
而铝表面形成钝化膜,电势升高,不利于电子传递给外界电解液,从而不利于NO3-在铝极一侧得电子。因此铝棒电极产生的气泡减少,表现为在铝棒表面附着有一层气泡。
5 结论与启示
利用“铜铝-浓硝酸原电池”,让学生在灵敏电流计指针的一偏一转中直观感受钝化反应的发生,通过灵敏电流计指针反转的速度表征钝化反应的速率。与以往实验的不同之处在于本研究以原电池实验为媒介将钝化反应的动态过程直观呈现出来,并得到金属铝钝化行为发生的硝酸浓度临界值在7.5~8mol/L。此外,本研究设计了携带尾气吸收的单液原电池装置,装置绿色环保、简单易行,可用于课堂操作。
通过研究设计该实验,可为实际课堂教学提供一些建议。
(1)对原电池工具与铝的钝化行为做了较好的内容整合,利用原电池作为研究工具,易于表征无法直观可视的实验现象。对此,在实际教学中遇到无法直观显示现象的化学反应,可以利用辅助工具或试剂来间接呈现实验过程与现象。充分利用感知规律在学生化学学习中的有效作用,同时有助于培养学生知识迁移的习惯与能力。
(2)通过探究铝钝化行为发生的速度与影响因素实验,可在教学中培养学生的探究、思考和观察能力。
(3)通过实验中原电池正负极的转变,巩固原电池原理,有利于学生理解原电池与氧化还原反应的实质关系。
(4)设计了携带尾气吸收的单液原电池装置,可巩固学生有关原电池装置设计的相关知识,增强实验绿色化的意识。
(5)本实验采用定性的方法来描述铝的钝化过程,仪器装置简单,普通教学环境下即可实现,但还无法精确描述钝化的发生过程。如果在实际课堂上能实现原电池反应过程中电流的曲线表征,將更加直观呈现整个钝化反应的过程。
参考文献:
[1]密家德.钝化及钝化层的防腐蚀和装饰性[J].山东化工,1997,(4):39-41.
[2]潘秀侠.铝钝化实验的设计[J].化学教学,1999,(6):17.
[3]傅献彩.物理化学(第五版)(下册)[M].北京:高等教育出版社,2006:138~139.
