基质分散固相萃取-高效液相色谱/串联质谱法检测红薯中氯吡脲
2017-10-19万慧慧
张 婧, 万慧慧, 张 华
(大连理工大学化工与环境生命学部化学分析测试中心,辽宁大连 116024)
植物生长调节剂(Plant Growth Regulators,PGRs)是一种人工合成的、具有与天然植物激素同等效能,甚至更为有效、更为优越效能的活性物质[1]。氯吡脲属于植物生长促进剂。它的主要作用是促进细胞分裂、分化和扩大。然而近些年来,由于植物生长调节剂使用不当引起的食品安全问题逐渐增多,植物生长调节剂在农作物中的残留可通过食物链进入人体,轻者造成腹泻等疾病,重者使人体免疫力下降,骨骼疏松,甚至有致畸、致癌现象[2]。氯吡脲可能会对人体带来潜在的危害,因此,欧盟、美国、日本等国对其残留量作出了严格限定[3]。目前,已报道的氯吡脲的检测方法主要有气相色谱法[4]、液相色谱法[5]以及液-质联用法[3,6 - 8]。黄何何等人[6]以QuEChERS法为前样品处理方法,结合液-质联用技术对水果中的植物生长调节剂进行了定量检测。张燕等人[8]利用Florisil分散固相萃取-液相色谱/串联质谱法测定了水果中的氯吡脲含量。徐永等人[9]采用固相萃取结合液-质联用方法测定了水果中的多效唑、氯吡脲以及咪鲜胺的残留量。
基质分散固相萃取(MSPD)通过混匀并研磨分散剂材料和果蔬样品,使果蔬细胞破碎而达到均质的效果,待测样品通过很好地分散到固相萃取材料表面,从而达到良好的分散提取效果[14]。而且整个过程中有机试剂的用量很少,经济环保。MSPD已经被用于水果、蔬菜的农药残留检测[15]。本实验通过红薯样品与C18HC分散剂材料研磨进行分散提取,建立了MSPD-高效液相色谱/串联质谱(HPLC-MS/MS)测定红薯中的氯吡脲含量的分析方法。
1 实验部分
1.1 仪器与试剂
TSQ QUANTUM ULTRA液-质联用仪(美国,Thermo scientific公司),配有电喷雾电离源(ESI源)以及Xcalibur数据处理系统;真空抽滤器(河南省予华仪器有限公司);超声波清洗仪(江苏省昆山市超声仪器有限公司);漩涡混合器(江苏省海门市其林贝尔仪器制造有限公司);医用离心机(湖南湘仪实验室仪器开发有限公司);氮吹仪(天津市恒奥科技发展有限公司);Milli-Q超纯水系统(美国,Millipore公司)。
C18HC、硅胶(北京华谱新创科技有限公司);氯吡脲(TCI,98%);甲醇(德国默克公司);尼龙注射器滤器(北京华谱新创科技有限公司);SPE筛板(北京华谱新创科技有限公司);水膜(0.22 μm,13 mm,天津博纳艾杰尔科技有限公司);甲酸铵(美国西格玛奥德里奇公司);甲酸(北京迪马科技有限公司),溶剂均为色谱纯。
1.2 溶液的配制
准确称取0.0108 g氯吡脲于100 mL容量瓶中,用甲醇溶解并稀释至刻线,配制成浓度108 μg/mL的氯吡脲标准贮备液。避光保存于4 ℃冰箱。标准工作溶液现用现配。
1.3 样品前处理
准确称取切碎后的红薯样品0.50 g,置于玛瑙研钵中研碎以达到均质的目的,然后加入10 μL 40 μg/mL的氯吡脲标准溶液后,再加入2.00 g的C18HC吸附材料,研磨均匀后装入固相萃取小柱,用10 mL的甲醇进行洗脱。洗脱液于40 ℃水浴条件下氮气吹干,然后用1 mL的甲醇进行超声重溶,过0.22 μm水膜,4 000 r/min离心15 min,取上清液,进行液/质检测。
1.4 色谱条件
色谱柱:Thermo Hypersil Gold C18柱(150×2.1 mm,5 μm),保护柱:Thermo HYPERSIL GOLD C18柱(10× 2.1 mm,5 μm)。流动相:甲醇(A)/ 0.1%甲酸-5 mmol/L甲酸铵(B)。线性梯度洗脱程序:0~5.0 min,10%A;5.01~7 min,10%~90%A;7.01~13.0 min,90%A;13.01~14 min,90%~10%A;14.01~25.0 min,10%A。流速:200 μL/min;柱温:25 ℃;进样量:20 μL。
1.5 质谱条件
质谱条件:离子源:电喷雾离子源(ESI);扫描方式:选择反应监测(SRM)模式;离子扫描模式:正离子模式;电喷雾电压:3 kV;鞘气(N2)压力:35;辅助气(N2)压力:10;碰撞气:Ar;碰撞能量:30 eV;离子源温度:250 ℃;毛细管温度:350 ℃;扫描时间:0.15 s。
2 结果与讨论
2.1 色谱及质谱条件的优化
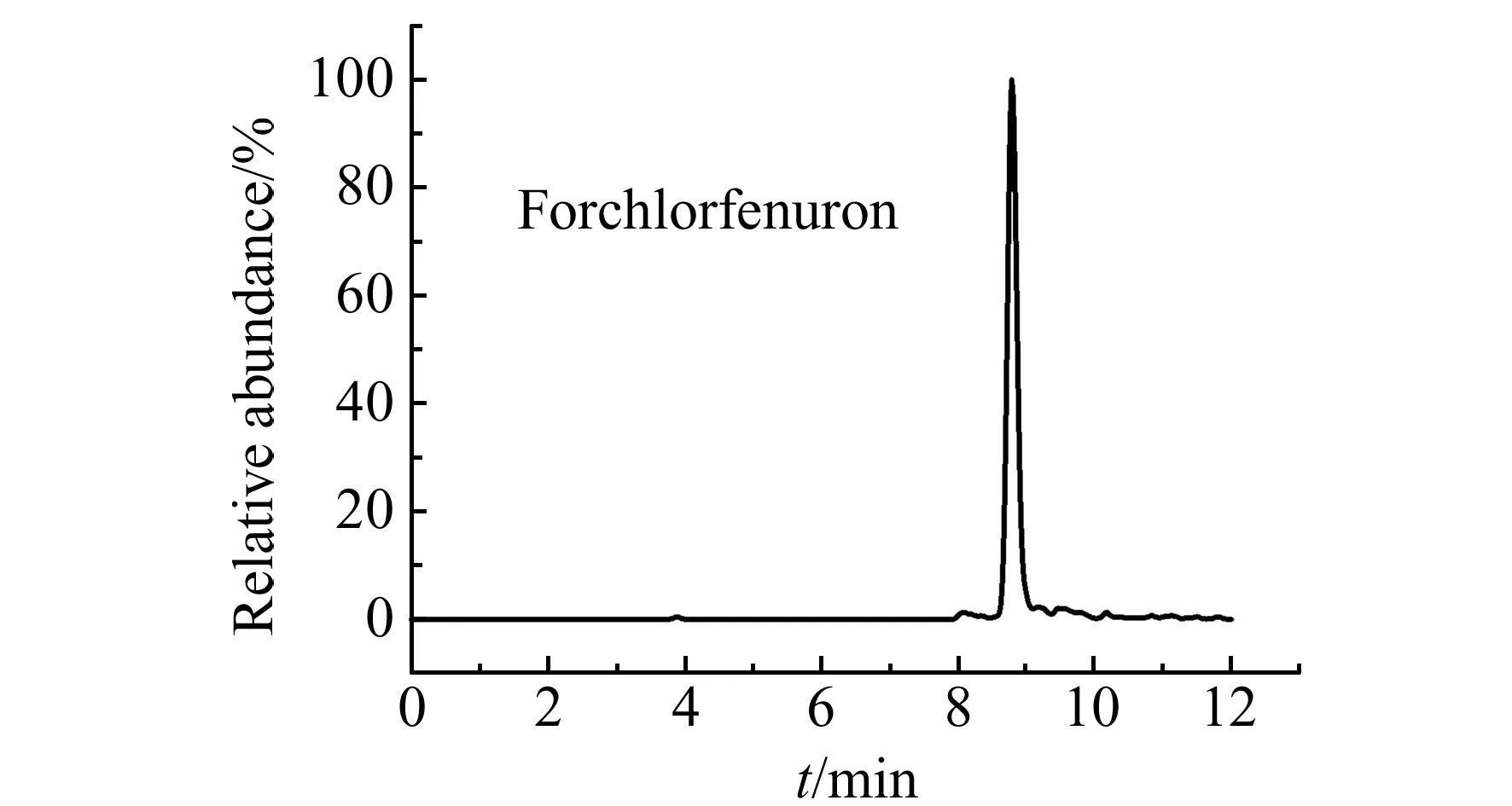
图1 氯吡脲的LC-MS/MS色谱图Fig.1 The LC-MS/MS chromatogram of forchlorfenuron
将配好的质量浓度为108 μg/mL的氯吡脲标准储备溶液,在电喷雾离子源下分别进行正离子模式全扫描,优化质谱参数使其母离子的响应最大化。然后通过优化碰撞能量(CE)使得子离子的响应最大化,最终选择两对离子对及相应的优化参数作为最终的质谱采集参数。定量离子对为248.0/129.0,相应的碰撞能量为14 eV,定性离子对为248.0/93.2,相应的碰撞能量为30 eV。
采用串联质谱在正离子扫描方式下通过选择反应模式定量分析,以质谱优化参数为采集参数,采用Thermo Hypersil Gold C18色谱柱(150×2.1 mm,5 μm)对氯吡脲进行分离,以甲醇(A)/ 0.1%甲酸-5 mmol/L甲酸铵(B)作为流动相,色谱图见图1。从图中可以看出C18柱对氯吡脲的保留较好,且峰形对称。
2.2 基质效应
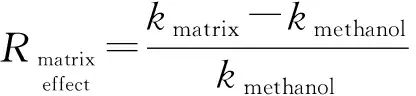
2.3 稳定性实验
用水和甲醇稀释108 μg/mL的氯吡脲标准贮备溶液,配制成溶剂分别为5%、50%和100%甲醇氯吡脲贮备溶液,连续测定5 d,结果表明室温条件下,5%、50%和100%甲醇不同溶剂条件下氯吡脲贮备液随着放置时间的增长,其含量都在不断减少,总体趋势氯吡脲都不稳定。氯吡脲置于溶剂为100%甲醇中的稳定性较好,5%甲醇作为溶剂次之,50%甲醇中稳定性最差。同时将溶剂为100%甲醇的氯吡脲贮备液置于4 ℃冰箱的稳定性好。为了实验的准确性,实验过程中所用的贮备溶液均置于4 ℃冰箱中保存,标准溶液现用现制。
2.4 吸附剂材料与分散比例优化
分别考察了C18HC和硅胶两种分散剂材料,按照1.3样品前处理方法进行操作, 与硅胶分散剂材料相比C18HC作为分散剂材料洗脱得到的氯吡脲含量更高,结果如图2所示。所以本实验最终选择C18HC为分散吸附材料。
比较测试了样品与分散剂质量的比例对实验的影响,按照1.3样品前处理方法进行操作。检测后以样品与分散剂的不同比例为横坐标,以峰面积为纵坐标绘制成条形统计图,如图3所示,当比例为1∶4时,洗脱得到的氯吡脲的量最多,选择分散剂比例为1∶4。
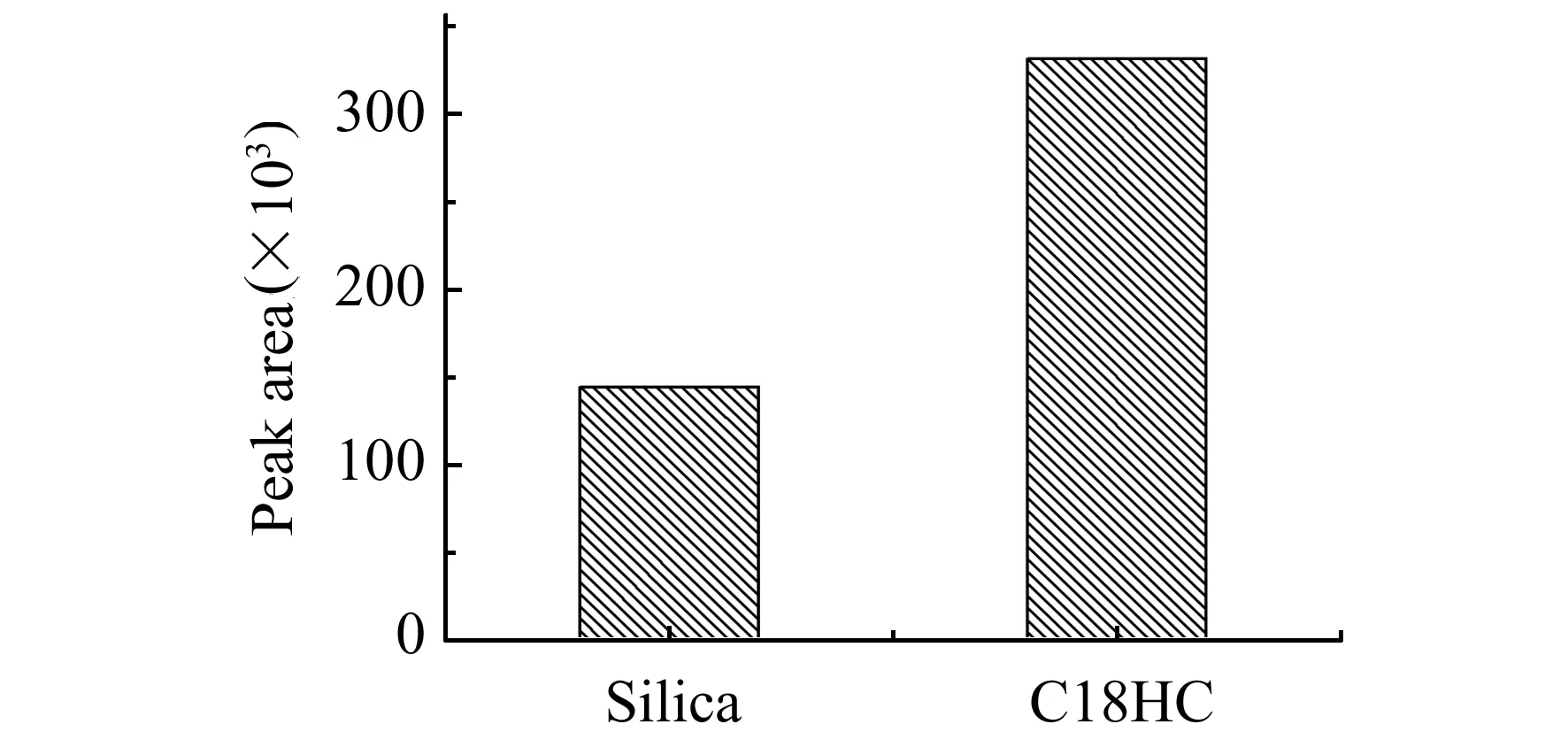
图2 同吸附剂材料的选择Fig.2 The choice of different dispersant materials
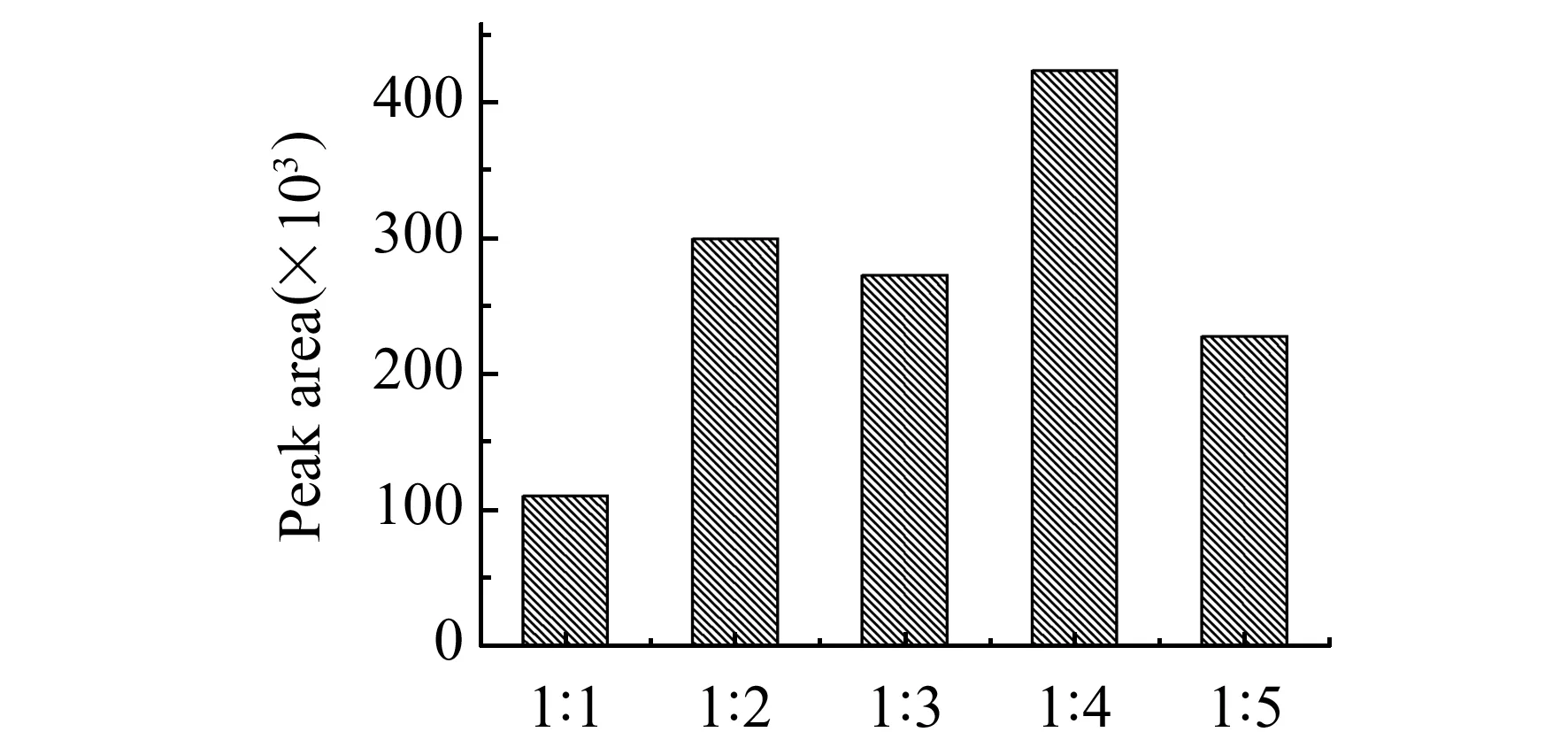
图3 红薯与分散剂比例优化Fig.3 The optimization of the ratio between batatas and dispersant material
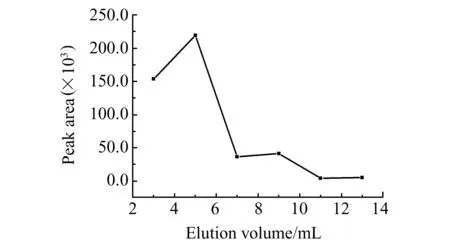
图4 洗脱体积优化Fig.4 The optimization of elution volume
2.5 最佳洗脱体积的选择
准确称取切碎后的红薯样品约0.50 g,置于玛瑙研钵中捣碎,加入10 μL的混标,再加入2.00 g的吸附材料研磨均匀后,装入固相萃取小柱,依次用3、2、2、2、2、2 mL甲醇进行洗脱。收集洗脱液,于40 ℃水浴条件下氮气吹干,依次用500 μL的甲醇进行超声重溶,过0.22 μm水膜,膜滤后4 000 r/min离心15 min,取20 μL上清液进液/质检测。结果如图4。实验选择13 mL甲醇进行洗脱。
2.6 线性关系与检测限
采用红薯空白基质配制2.63~675.00 ng/mL范围内7个浓度的氯吡脲标准溶液,测定后绘制标准曲线进行线性回归分析。结果表明在2.63~675.00 ng/mL内氯吡脲线性关系良好,线性方程为:y=10 844.9+375.14x,相关系数(R2)为0.9995。以信噪比(S/N)≥10确定定量限,定量检测限为0.66 ng/mL。
2.7 回收率
按照1.3样品前处理操作,在氯吡脲的线性范围内进行10、25、50 ng/g三个浓度添加水平回收实验,每个水平重复3次。结果表明,氯吡脲的回收率在74.2%~131.8%之间,RSD小于13%。
3 结论
本文将MSPD前处理技术与HPLC-MS/MS技术结合,建立了检测红薯中的氯吡脲的分析方法。实验证明MSPD技术可以很好地提取红薯中氯吡脲,同时HPLC-MS/MS对痕量植物生长调节剂表现出较高的灵敏度和重复性。该方法简便、可操作性强、回收率高,适用于红薯中痕量氯吡脲的检测。
