双层固相萃取-液相色谱/串联质谱法测定水稻中独脚金内酯
2017-10-19叶儿翠冯钰锜
叶儿翠, 丁 俊, 冯钰锜
(生物医学分析化学教育部重点实验室,武汉大学化学与分子科学学院,湖北武汉 430072)
独脚金内酯(Strigolactone,SLs)是一类具有倍半萜内酯结构特征的植物信号分子,已被确定为一种新型的植物激素[1]。研究发现,SLs具有调控植物种子萌发[2]、光形态发生[3]、叶片衰老[4 - 5]以及根枝构型[6 - 7]等生理功能。SLs的生物合成、信号传导和代谢路径也成了近年来生物学家的关注热点。然而,由于SLs在植物体内含量很低且植物基质非常复杂,制约了SLs研究的深入。此外,SLs的性质不稳定,对外界条件敏感,因此建立灵敏稳定的SLs定量分析方法,对于研究SLs分子作用机制是十分重要的。目前,SLs的检测平台包括气相色谱-质谱(GC-MS)和液相色谱-串联质谱(LC-MS/MS)联用技术。由于SLs的沸点较高,需要化学衍生后才可进入GC-MS进行分析,但SLs的化学稳定性差,在化学衍生过程中部分SLs可能会发生分解[8]。相比GC-MS法,LC-MS/MS法不需要对分析物衍生化即可直接分析检测,高效快速[9 - 11]。
植物组织基质复杂且SLs的含量极低,因此样品前处理步骤不可或缺。目前,液-液萃取[12]、固相萃取[13 - 14]、高效液相色谱(HPLC)纯化[15]已经被用于植物根、茎样品的前处理过程。这些方法虽然可行,但大多数存在过程耗时、消耗大量有机溶剂、萃取回收率较低等缺点。因此,新型的SLs样品前处理方法仍有待开发。考虑到SLs是一类中性内酯,并缺少易离子化的官能团,通过LC-MS/MS检测时,其离子化效率容易受共存的易电离基质抑制,造成质谱检测灵敏度下降,因而SLs的富集纯化十分关键。串联混合模式阴离子交换(MAX)和混合模式阳离子交换(MCX)固相萃取(SPE)方法已被证明能够较好地消除植物提取液极性基质的干扰[16 - 17]。石墨化炭黑(GCB)是一类能够与含π电子化合物建立π-π相互作用的疏水性材料[18 - 19]。植物组织中的色素如叶绿素是具有大π键的极性分子,可以利用GCB将色素从植物提取液中除去。基于此,本文提出了双层固相萃取(GCB/MAX+MCX),LC-MS/MS法分析检测水稻中SLs。该方法简便、快速,可有效去除植物提取液中的色素以及极性基质,适用于1 g水稻根样品中SLs的准确定量分析。
1 实验部分
1.1 仪器与试剂
液相色谱-质谱联用系统由LC-30AD和Shimadzu 8040型三重四极杆串联质谱仪(日本,岛津公司)组成;LE204E型电子分析天平(瑞士,Mettler Toledo公司);Neofuge 23R型低温高速离心机(香港力康公司);Milli-Q型超纯水仪(美国,Millipore公司);固相萃取仪(上海安谱公司);TTL-DC型多功能氮吹仪(聚创伟业仪器)。
SLs标准品:包括独脚金醇(Strigol)、列当醇(Orobanchol)、2′-Epi-5-脱氧独脚金醇(2′-Epi-5-deoxystrigol)、独脚金内酯人工合成类似物(GR24),均购自Olchemim(捷克Olomouc公司)。标准储备溶液:分别称取适量标准品,用乙腈溶解,配制成1 mg/mL的标准储备溶液,于-18 ℃保存。混合标准溶液:分别取适量各标准储备溶液,用乙腈稀释成所需浓度的混合标准溶液。乙腈、甲醇为色谱纯(德国Merk公司)。甲酸为分析纯(上海国药集团)。
固相萃取吸附剂:石墨化炭黑(GCB)、HiCapt-MAX、HiCapt-MCX和HiCapt-PSA 硅胶,均购自维泰克科技(武汉)有限公司。固相萃取小柱(6 mL)上层装填GCB,下层装填MAX和MCX,两层之间以聚乙烯垫片间隔,两端用两块垫片压紧后,待用。
1.2 植物材料
将野生型水稻(OryzasativaL)水培种植于环境温度为25 ℃,光照周期为16 h的恒温培养箱中。水培营养液参照国际水稻研究所,营养液每3 d更换一次。收获生长21 d的水稻根,称重并用液氮冷冻,储藏于-80 ℃的超低温冰箱内。
1.3 实验方法
1.3.1样品处理将1 g鲜重的水稻根样品在液氮冷冻下研磨成粉末后,转移至离心管中并加入提取液(乙腈,1 g/5mL)和内标GR24(0.1 ng/g鲜重),然后置于-4 ℃过夜提取(12 h)。经冷冻离心(8 000 r/min,10 min,4 ℃),将上清液经过GCB/MAX+MCX(100 mg/250 mg+250 mg) 双层固相萃取柱(预先以2 mL 乙腈活化),收集上样流出液;再用2 mL乙腈解吸液洗脱固相萃取小柱上吸附的SLs。将上样流出液与解吸液合并,于40 ℃下的恒定氮气流吹干,溶解于100 μL甲醇/水(3/7,V/V)溶液中,待上机分析。水稻提取液经双层固相萃取除杂后,再经过吹干、复溶,实现了对SLs的纯化和富集。
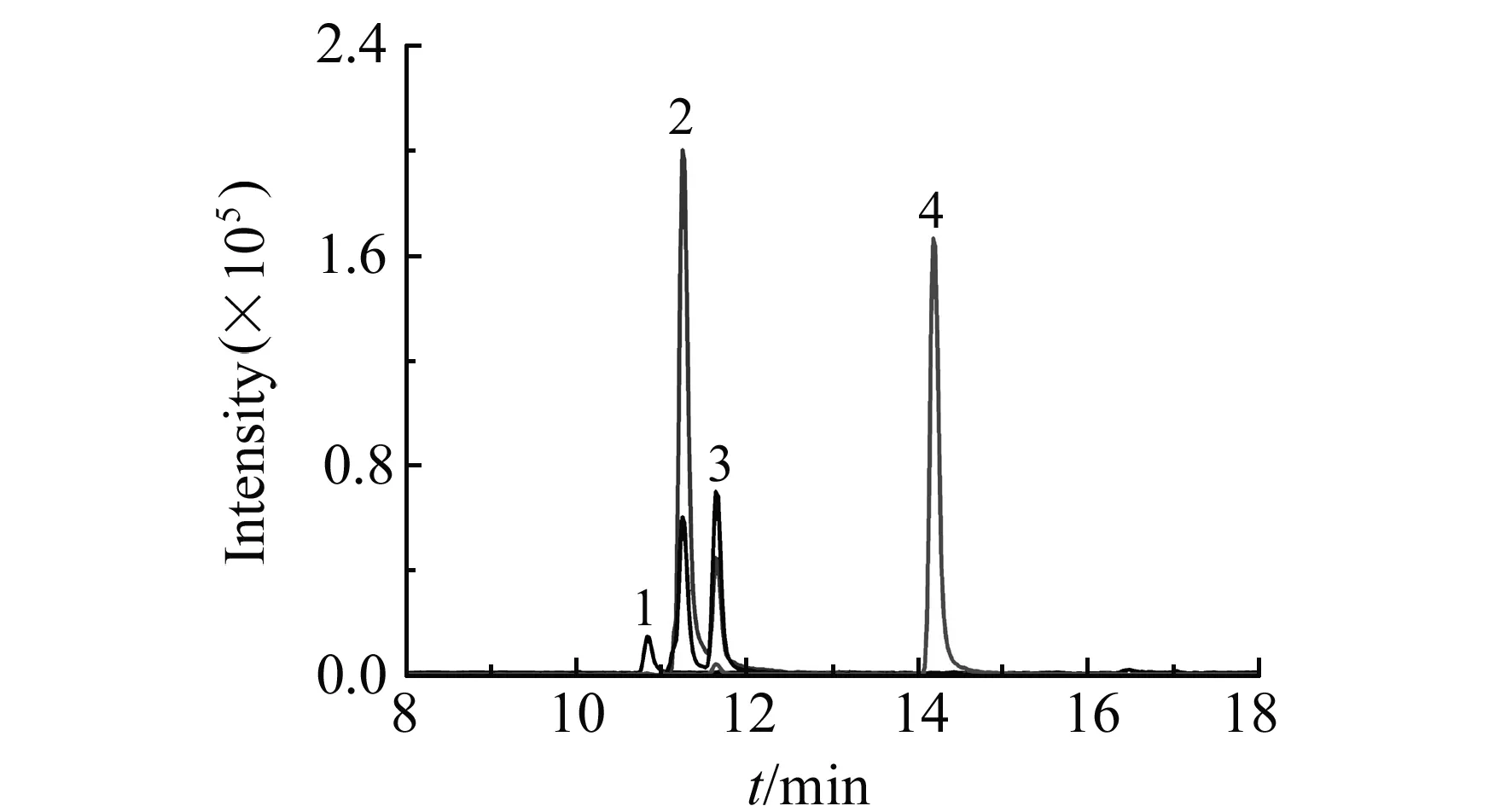
图1 1 ng/mL SLs标准溶液的MRM色谱图Fig.1 MRM chromatogram of SLs standard solution at the concentration of 1 ng/mLPeaks:1.GR24;2.Orobanchol;3.Strigol;4.2′-Epi-5-deoxystrigol.
1.3.2色谱-质谱条件色谱条件:Waters BEH C18色谱柱(100×2.0 mm,1.7 μm);流动相:A为0.1%甲酸水溶液;B为0.1%甲酸甲醇溶液。梯度洗脱程序:0~3 min,30%B;3~10 min,30%~70%B;10~18 min,70%~95%B;18~22 min,95%B;22.01~30 min,30%B。流动相流速:0.3 mL/min。柱温:40 ℃;进样体积:30 μL。质谱条件:电喷雾电离源(ESI),正离子多反应监测(MRM)模式;脱溶剂管温度:250 ℃,加热模块温度:400 ℃,雾化气流速:3 L/min,干燥器的流速为15 L/min。MRM模式下SLs的色谱图见图1,优化得到的SLs的碰撞能量以及相关质谱参数列于表1。

表1 3种SLs和人工合成类似物GR24的相关质谱参数
* The product ions in bold were used for quantification.
2 结果与讨论
2.1 样品前处理条件优化
2.1.1提取溶剂的优化考察了甲醇、丙酮、乙腈、乙腈/水(4/1,V/V)四种溶剂的提取效率。如图2(A)所示,采用乙腈和丙酮作为提取溶剂时回收率较高,考虑到丙酮极性更弱,提取SLs的同时也会提取出更多的色素和脂类。综合考虑,选择乙腈作为提取溶剂。
2.1.2固相萃取吸附剂的选择比较了乙二胺-N-丙基键合硅胶(PSA)、GCB、MAX+MCX以及两两组合(GCB/PSA、GCB/MAX+MCX)作为吸附剂填料的除杂效果。由图2(B)所示,水稻根提取液经GCB/MAX+MCX双层固相萃取柱处理后,各分析物信噪比最高,表明其除杂效果最佳。
2.1.3吸附剂用量的优化GCB用量对SLs的萃取有重要影响。GCB用量过少,会导致除杂能力不够;GCB用量过多,则可能对部分SLs产生不可逆吸附,造成萃取回收率下降。因此,固定MAX和MCX用量分别为250 mg,装填了GCB用量分别为20、50、100、200、300 mg的萃取柱对SLs进行萃取。由图2(C)所示,100 mg GCB用量条件下,SLs的回收率最高。因为SLs是一类中性内酯,没有易电离的基团,因此在乙腈的上样条件下MAX+MCX不会对SLs存在吸附,因而MAX+MCX的用量对SLs的萃取回收率影响较小。因此后续实验GCB用量选用100 mg,MAX和MCX用量则参照文献报道[17 - 20],分别选用250 mg 装填双层固相萃取柱。
2.1.4解吸液体积的优化解吸液体积会直接影响目标分析物的解吸效果。通过用4 mL乙腈依次解吸四次(每次1 mL),考察解吸体积。如图2(D)所示,2 mL解吸液足以解吸95%以上的SLs,继续增加乙腈用量,3种SLs回收率没有明显变化,但会延长氮气吹干时间。因此采用2 mL乙腈解吸SLs。

图2 (A)不同萃取溶剂对SLs回收率的影响;(B) 植物提取液经不同吸附剂填料除杂后SLs的信噪比;(C) GCB用量对SLs萃取效率的影响;(D)解吸液体积对SLs回收率的影响Fig.2 (A) Effect of different extraction solvents on SLs recoveries;(B) Effect of different sorbents on the S/N levels of SLs in plant extracts;(C) Effect of GCB amount on the extraction efficiencies of SLs;(D) Effect of desorption volume on the recoveries of SLs
2.2 植物用量的考察
由于植物样品基质复杂,植物用量的增加可能会对分析物的萃取以及质谱信号存在抑制作用,造成检测灵敏度的下降。为获得最佳的植物用量,通过在0.1、0.2、0.5、1、2 g水稻根样品中均加入1 ng/mL SLs标准品,分别考察不同植物用量对萃取效率和基质效应的影响。如表2所示,SLs萃取回收率随着植物用量的增加没有明显变化,表明植物样品基质对SLs的萃取效率影响较小。通过向空白基质中加标得到的分析物峰面积与标样中分析物峰面积之比来计算基质效应。由表3可得,植物用量在1 g以下时基质效应在84.6%~94.3%之间,且随着植物用量的增加,基质效应变化不大,表明该范围内基质对SLs离子化效率的抑制不明显;当植物用量超过1 g,基质效应对质谱响应的抑制明显增加。因此,最终选用1 g作为实际样品检测用量。
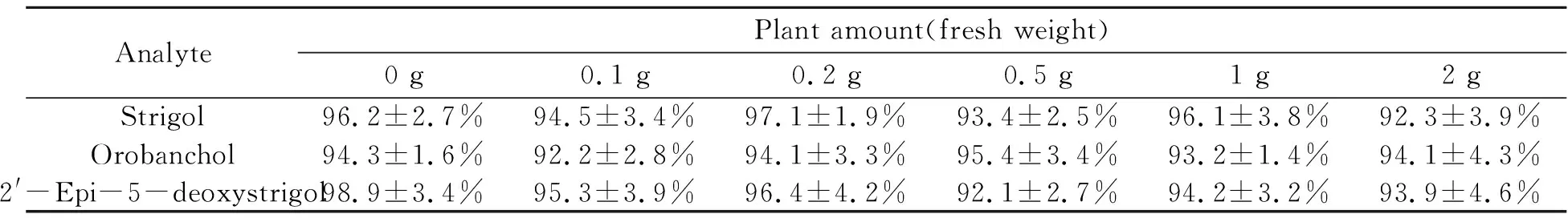
表2 不同植物用量下的SLs萃取回收率
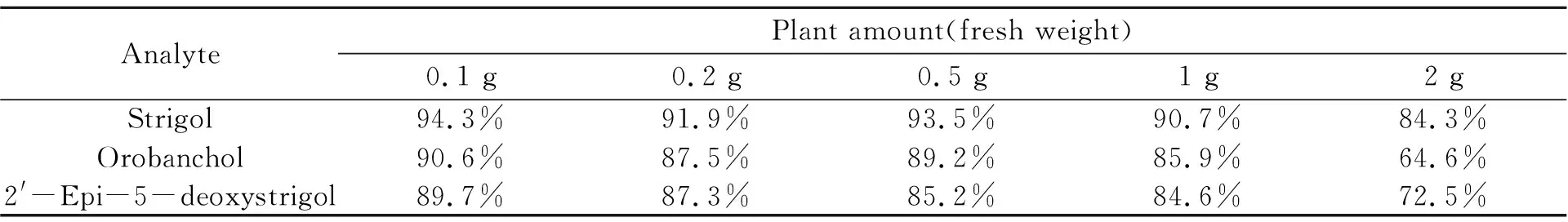
表3 不同植物用量下的基质效应
2.3 方法学考察
通过向1 g水稻根提取液里加入一系列浓度的混合标准溶液(独脚金醇:0.05~50 ng/g;列当醇、2′-5-脱氧独脚金醇:0.01~10 ng/g)以及0.1 ng/g GR24作为内标,按照1.3所述的步骤处理,以每种目标物定量离子与内标GR24定量离子的峰面积比值(Y)对SLs质量浓度(X)作图得到标准曲线回归方程。由表4可以看出,在对应范围内,3种SLs的线性关系良好,相关系数均大于0.9972。以信噪比(S/N)的3倍计算检出限,3种SLs的检出限为0.007~0.028 ng/g。将添加了3个浓度SLs标准品的水稻根样品经过处理后,考察方法的日内、日间精密度(RSD,n=6)及回收率数据。结果表明,方法的RSD在1.9%~14.1%之间,回收率在82.1%~115.8%之间,说明该方法准确性和灵敏度较高,重现性好,适用于水稻样品中多种SLs的准确定量。

表4 水稻根样品中添加SLs的回收率、相对标准偏差、相关系数和检出限

图3 加标水稻样品的MRM色谱图Fig.3 MRM chromatogram of spiked rice samplesPeaks:1.Orobanchol;2.Strigol;3.2′-Epi-5-deoxystrigol.
2.4 样品测定
将水稻根样品根据1.3所述的步骤处理,同时做加标回收实验(列当醇、2′-Epi-5-脱氧独脚金醇:50 pg/g;独脚金醇:250 pg/g),平行测定3次。根据SLs的保留时间和MRM模式下的定性和定量离子通道的色谱峰进行定性分析。结果显示,未在水稻样品中检测到内源性SLs,而加标样品中均检测到SLs(图3),说明该水稻样品中3种SLs的含量均低于检出限。
3 结论
本文采用双层固相萃取,结合LC-MS/MS技术,建立了测定水稻中内源性SLs的分析方法。双层GCB/MAX+MCX固相萃取能有效除去植物提取液中的色素和极性基质,具有简单、快速、高通量的优点。方法的线性范围及分析结果的精密度、准确度和回收率均能满足水稻根样品中SLs定性和定量分析的要求,适合用于水稻中内源性SLs的检测。
