生物/化学同步聚合法制备纤维蛋白纳米复合物及传感研究
2017-10-19徐霞红韩芳芳傅迎春王新全王祥云姚守拙
徐霞红, 韩芳芳, 傅迎春*2,, 王新全, 王祥云, 姚守拙
(1.浙江省农业科学院农产品质量标准研究所,浙江杭州 310021;2.浙江大学生物系统工程与食品科学学院,浙江杭州 310058;3.湖南师范大学化学化工学院,湖南长沙 410081)
开发能有效应用于生物大分子高效固定的新型多功能纳米复合物,是当前生物传感技术研究的热点之一。作为新型复合材料,聚合物基纳米复合物(PNCs)结合纳米粒子、聚合物和其它组分的性质于一体[1 - 4],已在生物传感应用中显现出重要的科学价值和应用潜力[2,5]。PNCs主要具有以下优点:(1)纳米粒子具有高的比表面积和生物相容性,使得聚合物具有很强的包埋能力[2,6 - 9];(2)纳米粒子的催化[2,10]、光/电[11 - 12]及磁[6,13]等各种特性,便于制备多种功能的生物器件;(3)聚合物可通过物理、化学方法进行修饰,能有效包埋或吸附分析物,易实现功能化再修饰[2,9,14]。因此,PNCs已成为基于酶[4,15 - 19]、蛋白质[4,8,14]和DNA[20]等生物传感器领域的热点材料。
已有多篇文献报道基于PNCs的生物传感研究[6,9,14 - 15,17,20 - 22],但多采用多步合成法即分步合成PNCs及纳米粒子,再固定酶或抗体,结果可能导致纳米粒子组装不均匀、酶或抗体的固定量受限等缺点。本研究组报道了一系列结合聚合物生成、金属纳米粒子生长和生物分子包埋三个过程的一锅制备PNCs的简便方法,所制得的生物传感器性能居同类传感器前列[2,7,23]。此外,在凝血过程中,分散性好的纤维蛋白原链被凝血酶切断后生成难分散的纤维蛋白(Fibrin),纤维蛋白聚集成团并形成疏松网状结构包埋其它分子。通过凝血仿生过程制备的三维疏松网络结构的纤维复合物,可望结合一锅法制备新型PNCs,用于高负载量、高活性固定生物分子,从而进一步提升生物传感器的各项性能。
本文提出了凝血仿生凝结/一锅法化学氧化聚合的新型同步聚合法,在凝血酶触发纤维蛋白仿生聚合的同时,加入NaAuCl4作为化学氧化剂,引发多巴胺(DA)化学氧化聚合生成聚多巴胺(PDA),NaAuCl4被还原为纳米金(AuNPs)沉积在纤维蛋白骨架上,同时,共存的大量葡萄糖氧化酶(GOx)原位被包埋在复合物基底中。所制备的Fibrin-PDA-GOx-AuNPs改善了酶的包埋量,基于此PNCs研制了高灵敏的生物传感器。
1 实验部分
1.1 仪器和试剂
采用CHI660C电化学工作站(上海辰华)及常规三电极电解池进行电化学测试。工作电极为金棒电极(面积0.031 cm2),对电极为碳棒,参比电极为饱和KCl甘汞电极(SCE),所有电位均相对于SCE(vs.SCE)。PNCs的微观形貌表征选用JEM-2100F透射电子显微镜(TEM)(日本,JEOL)。
凝血酶(Thrombin,来自人血清)、纤维蛋白原(Fibrinogen,来自牛血清)、GOx(EC 1.1.3.4;黑曲霉来源,Ⅱ型,活性150 kU/g)、HAuCl4、DA、葡萄糖、牛血清白蛋白(BSA),均购于Sigma公司。所用化学试剂均为分析纯或更高纯度。化学和电化学实验中均使用0.10 mol/L KH2PO4-K2HPO4+0.10 mol/L K2SO4(PBS 1,pH=7.0),其它实验使用0.010 mol/L NaH2PO4-Na2HPO4+0.15 mol/L NaCl(PBS 2,pH=7.0)。实验用水为Millipore超纯水(≥18 MΩ·cm)。
1.2 实验方法
1.2.1电极处理将金电极依次在0.5、0.05 μm的Al2O3粉末悬浊液中抛光打磨,然后分别在超纯水、丙酮、超纯水中各超声1 min,最后将金电极置于稀H2SO4中,采用循环伏安法(CV)扫描至氧化还原峰重现为止(扫速100 mV/s,电位范围-0.1~1.5 V)。
1.2.2复合物制备及电极修饰将纤维蛋白原(2.0 mg/mL)、GOx(8.0 mg/mL)和DA(60 mmol/L)溶解在PBS 2中,在金电极表面小心滴涂1.5 μL该混合溶液,再依次滴加1 μL凝血酶(0.4 μmol/L)、1 μL NaAuCl4(2 mmol/L),经化学氧化聚合1 h后生成Fibrin-PDA-GOx-AuNPs。在室温下干燥成膜后制得酶修饰电极。电极不用时保存在PBS 1中(4 ℃)。各组分浓度、电极表面滴涂量及pH值优化测试范围见表1。
1.2.3各种复合物对GOx的包埋率测定采用上述参数,分别制备了Fibrin-GOx、Fibrin-PDA-GOx和Fibrin-PDA-AuNPs-GOx复合物,离心后收集上清液。将裸金电极浸入到10 mL含0.05 mol/L葡萄糖的PBS 1中(pH=7.0,磁力匀速搅拌),并将电位恒定在-0.05 V。当电流输出稳定后,在PBS 1中加入各种含酶复合物的离心上层清液(参照为加入最终浓度为2 μg/mL的GOx原液),记录电化学电流响应。
1.2.4电化学检测采用三电极系统和计时电流法(恒定0.7 V电位)测定。将各种PNCs修饰电极置于PBS 1中,加入目标物前的初始背景电流与加入目标物后的稳态电流之差为PNCs修饰电极对目标物的电流响应值。
2 结果与讨论
2.1 复合物的表征

图1 同步聚合法制备Fibrin-PDA-AuNPs-GOx的生物纳米复合物示意图Fig.1 Scheme for the preparation of the fibrin-PDA-AuNPs-GOx nanocomposites
图1为Fibrin-PDA-AuNPs-GOx的同步聚合过程,结合了凝血酶诱导的纤维蛋白凝聚、NaAuCl4诱导AuNPs生长及化学聚合PDA包埋GOx三个过程。采用最佳条件下的各组分浓度制备出包埋GOx的复合物。如表1所示。图2分别给出了各种复合物材料:Fibrin-GOx(A)、PDA-GOx(B)、Fibrin-PDA-GOx(C)和Fibrin-PDA-AuNPs-GOx(D)的透射电镜(TEM)图。我们可以观察到(A)Fibrin-GOx具有三维网状结构,而(B)PDA-GOx、(C)Fibrin-PDA-GOx和(D)Fibrin-PDA-AuNPs-GOx的复合物呈粗糙多孔状态。从(C)Fibrin-PDA-GOx和(D)Fibrin-PDA-AuNPs-GOx看出PDA已在纤维蛋白骨架上沉积。另外,可以观察到在(D)Fibrin-PDA-AuNPs-GOx表面存在AuNPs。
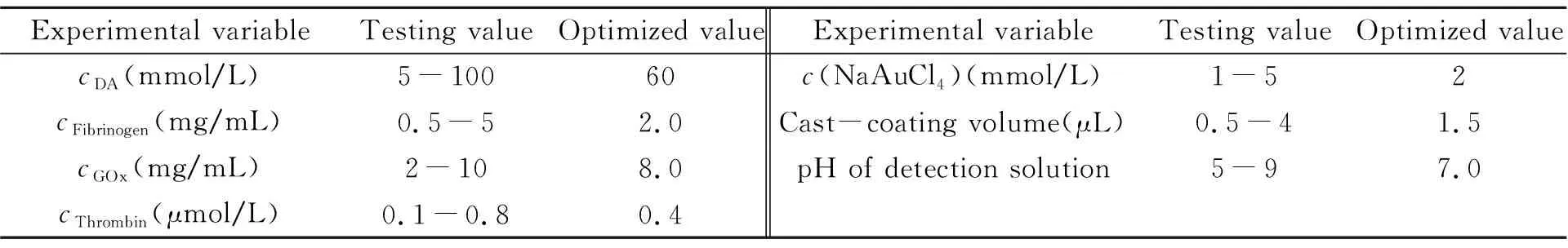
表1 实验参数优化

图2 (A)Fibrin-GOx、(B)PDA-GOx、(C)Fibrin-PDA-GOx和(D)Fibrin-PDA-AuNPs-GOx的透射电镜(TEM)图Fig.2 TEM images of(A)Fibrin-GOx,(B)PDA-GOx,(C)Fibrin-PDA-GOx,and(D)Fibrin-PDA-AuNPs-GOx

图3 裸金电极在-0.05 V时加入10 μL 8 mg/mL GOx(1)、Fibrin-GOx(2)、Fibrin-PDA-GOx(3)和Fibrin-PDA-AuNPs-GOx(4)上清液时电流响应图(溶液为10 mL含有0.05 mol/L葡萄糖的PBS 1)Fig.3 The current responses of a bare Au electrode at -0.05 V to the addition of 10 μL(1)8 mg/mL GOx,and the supernatants of(2)Fibrin-GOx,(3)Fibrin-PDA-GOx,(4)Fibrin-PDA-AuNPs-GOx into stirred PBS 1containing 0.05 mol/L glucose(pH=7.0)
2.2 复合物的酶包埋效率
基于电化学方法可以测定GOx的催化产物H2O2,通过测量各种复合物上清液中残留GOx的量以间接测定复合物中GOx的包埋率。如图3所示,在加入各种PNCs的离心上清液(对照为加入酶原液)后,由于酶催化产物H2O2的持续生成,电极还原电流出现持续下降。通过计算加入含酶溶液150 s内的电流变化值,可以间接估算酶分子的负载率,如表2所示。以(1)酶原液作为对照,计算出Fibrin-GOx、Fibrin-PDA-GOx和Fibrin-PDA-AuNPs-GOx对GOx的负载率分别为12%、38%和51%。上述实验结果表明,由同步聚合法得到的Fibrin-PDA-AuNPs-GOx对GOx的包埋效率高于纤维蛋白直接包埋法(Fibrin-PDA-GOx),这可能是由于AuNPs增加了复合物的结合位点,从而提升了酶包埋量。

表2 各种纳米复合物的GOx包埋率估算
2.3 修饰电极的催化性能
图4给出了(1)Fibrin-PDA-AuNPs-GOx/Au、(2)Fibrin-PDA-GOx/Au和(3)Fibrin-GOx/Au三种PNCs修饰金电极对葡萄糖的催化电流响应(A)及校准曲线(B),表3总结了这三种修饰电极的生物传感性能数据。结果表明Fibrin-PDA-AuNPs-GOx/Au电极的灵敏度为117 μA/(cm2·mmol/L),检测限为57 nmol/L。Fibrin-PDA-GOx/Au电极的灵敏度为83 μA/(cm2·mmol/L),Fibrin-GOx/Au电极的灵敏度为35 μA/(cm2·mmol/L)。Fibrin-PDA-AuNPs-GOx/Au电极的灵敏度分别是Fibrin-PDA-GOx/Au电极和Fibrin-GOx/Au电极的1.4和3.4倍。同时,该传感器性能要优于传统聚合物修饰酶电极[24 - 26]。我们推测Fibrin-PDA-AuNPs-GOx/Au电极催化性能明显改善的原因可能为:(1)原位化学氧化生成的AuNPs提供了大量结合位点,有效提高了生物分子的固定量;(2)天然纤维蛋白原和多巴胺均来源于生物体,提高了PNCs的生物相容性,保持了酶的活性。
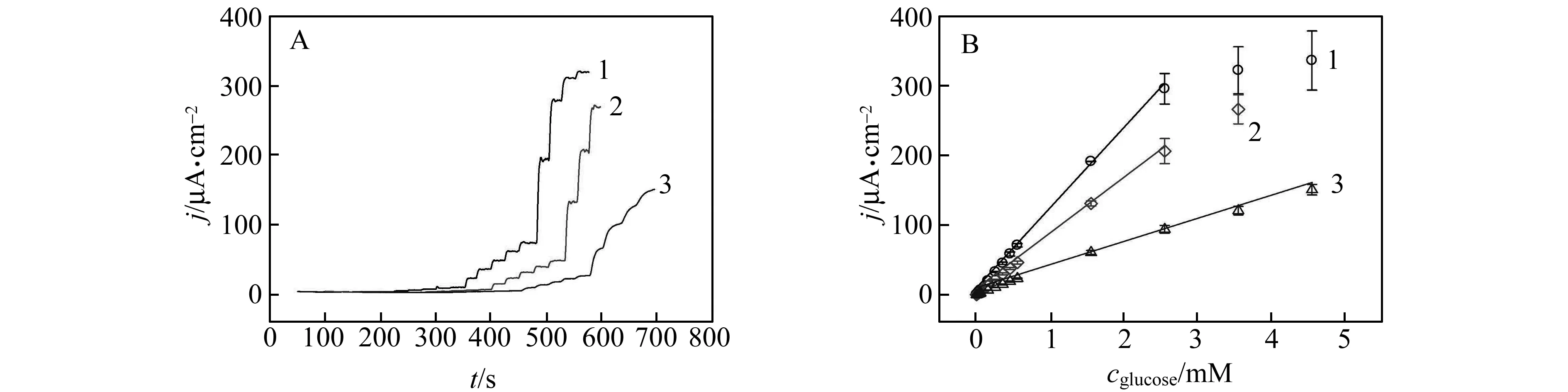
图4 Fibrin-PDA-AuNPs-GOx/Au(1)、Fibrin-PDA-GOx/Au(2)和Fibrin-GOx/Au(3)电极对不同浓度葡萄糖的电流响应(A)及校准曲线(B)Fig.4 The chronoamperometric responses (A) and the calibration curves (B) to successive additions of glucose for Fibrin-PDA-AuNPs-GOx/Au(1),Fibrin-PDA-GOx/Au(2),and Fibrin-GOx/Au(3) electrodes obtained in PBS 1 at 0.7 V
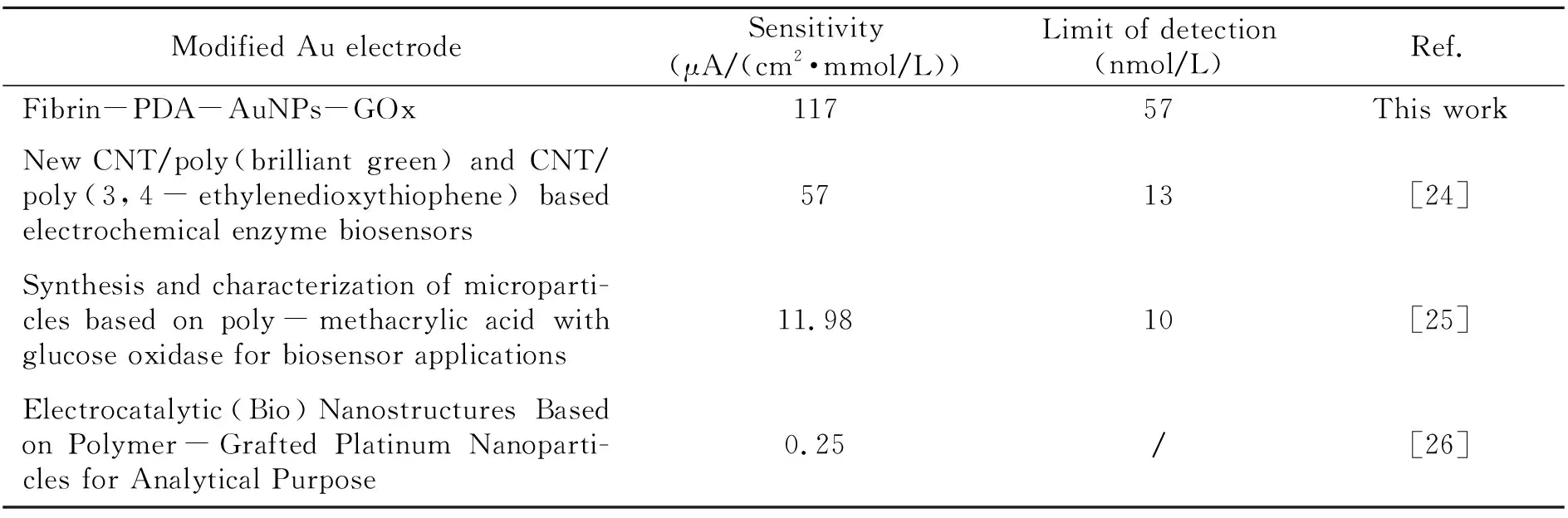
Modified Au electrodeSensitivity(μA/(cm2·mmol/L))Limit of detection(nmol/L)Ref.Fibrin-PDA-AuNPs-GOx11757This workNew CNT/poly(brilliant green) and CNT/poly(3,4-ethylenedioxythiophene) based electrochemical enzyme biosensors5713[24]Synthesis and characterization of microparti-cles based on poly-methacrylic acid with glucose oxidase for biosensor applications11.9810[25]Electrocatalytic(Bio)Nanostructures Based on Polymer-Grafted Platinum Nanoparti-cles for Analytical Purpose0.25/[26]
3 结论
本文提出了基于凝血仿生和一锅法化学聚合的新型同步聚合法,成功制备了Fibrin-PDA-AuNPs-GOx复合物,有效提升酶的固定化效率。基于该PNCs材料研制的生物传感器具有优异性能,对葡萄糖的检测灵敏度高达117 μA/(cm2·mmol/L),检测限为57 nmol/L。基于凝血仿生纤维骨架开发新型聚合物纳米材料,为生物分子的高效固定提供了新思路和新平台,可望为生物传感、生物催化和生物纳米器件等领域提供方法参考。
