基于CdS量子点构建的“signal-off”型电致化学发光免疫传感器用于心肌肌钙蛋白I的高灵敏检测
2017-10-19汪子力
高 敏,张 璞,汪子力,袁 若
(西南大学化学化工学院,发光与实时分析重点实验室,重庆400715)
基于CdS量子点构建的“signal-off”型电致化学发光免疫传感器用于心肌肌钙蛋白I的高灵敏检测
高 敏,张 璞,汪子力,袁 若*
(西南大学化学化工学院,发光与实时分析重点实验室,重庆400715)
该实验制备了CdS量子点,以过硫酸根作为共反应试剂,能有效增强CdS量子点的ECL发光信号,合成的Hemin二抗偶合物对其ECL信号具有猝灭效果。将电致化学发光免疫传感器的高灵敏度与CdS量子点纳米材料的表面效应、量子效应特性相结合,所构建的夹心型免疫传感器在检测急性心肌梗死标志物心肌肌钙蛋白I(cTnI)的方面具有检出限低、灵敏度高的优势。 实验结果表明,cTnI的检测范围为0.25 pg/mL~0.11 ng/mL,检出限为0.083 pg/mL(S/N=3)。基于该量子点构建的免疫传感器能很好地用于急性心肌梗死标志物cTnI的早期检测,有望实现对急性心肌梗死的早期诊断和治疗检测。
电致化学发光;免疫传感器;心肌肌钙蛋白-I;CdS量子点
Abstract:In this study,CdS quantum dots were prepared successfully and the S2O82-was used as co-reagents to enhance the ECL signal of CdS quantum dots.The synthesized complex of Hemin and antibody had a quenching effect on the signal of CdS quantum dots.Combining the advantages of high sensitivity of the ECL immunosensor with the surface effect and quantum effect of CdS quantum dots,the sandwich mode immunosensor was constructed to detect acute myocardial infarction marker cardiac troponin I(cTnI),which has the advantages of low detection limit and high sensitivity.The results showed that the detection range of cTnI was 0.25 pg/mL to 0.11 ng/mL,and the detection limit was 0.083 pg/mL(S/N=3).Based on the high luminescence emission of quantum dot,the proposed immunosensor can be used for detecting acute myocardial infarction markers cTnI,which is expected to applied in early diagnosis and treatment of acute myocardial infarction.
Key words:electrochemiluminescence(ECL);immunosensor;cardiac troponin I;CdS quantum dots
0 引言
心血管疾病是当今世界威胁人类健康的头号杀手,而其中的急性心肌梗死具有发病快,致残率高,死亡率高等特点[1],已逐渐成为中老年人常见疾病之一[2],故而针对急性心肌梗死的研究逐渐成为热点。而心肌肌钙蛋白是国际上公认的诊断急性心肌梗死的灵敏性和特异性最好的标志物[3-5]。它是心肌细胞中特有的结构蛋白,由三种不同基因的亚基因组成:心肌肌钙蛋白T(cTnT)、心肌肌钙蛋白 I(cTnI)、心肌肌钙蛋白 C(cTnC)。标志物cTnT和cTnI在诊断急性心肌梗死的疾病中应用的最为广泛。其中,cTnT的浓度在急性心肌梗死患者的血清中的上升幅度明显,利于观察,但是,其在大多数抗原的刺激下,会出现一定的免疫反应,引起浓度的变化,特异性较差,而cTnI对于诊断心肌梗死则表现出良好的特异性[6],但是由于其含量低,实现cTnI的高灵敏检测成为了一种挑战。
目前,检测cTnI的生物分析方法主要有酶联免疫吸附测定[7]、光磁生物传感器[8]、电化学免疫检测法[9]等。但是,由于这些方法有步骤复杂、耗费时间、破坏环境等缺点,所以依旧要求提高检测技术水平。电致化学发光(Electrochemiluminescence,ECL) 是一种由电化学方法触发的化学发光现象。与化学发光类似,ECL无需使用任何额外光源,而将化学发光与分析技术的超灵敏性和电化学计数的高可控性巧妙的结合赋予了其独特的优势,如具有操作简便,成本低,可控性强等优点,因此被广泛应用于蛋白质的检测[10-12]。在众多的ECL发光试剂中,CdS量子点(CdS)具有优异的光稳定性,良好的成膜性,抗干扰能力强,可以通过调节尺寸实现对其发射光谱的可控调节,具有宽的激发谱和窄的发射谱,荧光寿命长,且易于固定在电极表面而被广泛应用,制备简易,因而有望发展为一种操作简单,易行成本低的免疫传感器[13-15]。这对研究量子点的制备方法、基本性质和实际应用具有重大意义。为了提高免疫传感器的可控性,降低背景值,具有低背景信号、高可控性的ECL猝灭法一直备受青睐。在众多的猝灭试剂中,Hemin因其猝灭效果好,生物兼容性强等优点而被广泛的应用于ECL“signal off”型传感器的构建。因此,该实验利用CdS良好的成膜性,将其固定在电极表面,通过Hemin中的羧基和二抗蛋白大分子的氨基之间的酰胺化反应制备二抗偶合物(Hemin-Ab2),形成了“一抗-抗原-二抗偶合物”的夹心结构,构建了一种新型的免疫传感器。该免疫传感器不仅可以应用于急性心肌梗死的早期检测,也可在治疗时期进行相关监测。
1 实验部分
1.1 实验仪器及试剂
实验仪器:CHI660D型电化学工作站 (上海辰华仪器有限公司);MPI-E型ECL分析系统多功能化学发光检测仪(西安瑞迈分析仪器有限公司);WH-986静音搅拌器(海门市其林贝尔仪器制造有限公司);UV-2450紫外分光光度计(日本岛津仪器有限公司);三电极体系:玻碳电极(GCE,Φ=4 mm)及其修饰电极为工作电极,饱和甘汞电极或Ag/AgCl电极为参比电极,铂丝为对电极(上海辰华仪器有限公司)。
实验试剂:人心肌肌钙蛋白I(cTnI)及cTnI鼠单克隆抗体 (anti-cTnI)(上海华裔公司),Hemin、牛血清白蛋白(BSA)、EDC/NHS(Sigma 公司), Cd(NO3)2·4H2O、 Na2S、 K2S2O8、 K2HPO4、NaH2PO4、 KCl、 (成都市科龙化工试剂厂),Er2O3(子美国际贸易有限公司),不同pH和不同浓度的磷酸盐缓冲液 (PBS)通过混合 0.10 mol/L K2HPO4,0.10 mol/L NaH2PO4,0.10 mol/L KCl 制备且用0.10 mol/L H3PO4和NaOH调节pH,然后用二次蒸馏水稀释至所需浓度,所有溶液使用前均保存在4℃下,其他试剂均为分析纯试剂,实验用水均为二次蒸馏水。
1.2 CdS量子点的制备
先将 0.1683 g Cd(NO3)2·4H2O 溶于 30 mL 水中,然后现配0.085 mmol/L Na2S溶液30 mL,将Cd(NO3)2·4H2O、Na2S 两种溶液同时加入 250 mL圆底烧瓶中搅拌加热至70℃,回流3 h,反应混合物经离心分离后,用无水乙醇洗涤一次,二次蒸馏水洗涤两次,以除去吸附在其表面的杂质离子,将制备的CdS分散于二次蒸馏水中,于4℃下保存待用。
1.3 二抗偶合物的制备
在Hemin溶液中加入EDC/NHS活化20 min,然后加入二抗,反应2 h后,将所得反应混合物离心分离,并依次用无水乙醇,二次蒸馏水洗涤,将制备的Hemin-Ab2分散于二次蒸馏水中,于4℃下保存待用。
1.4 免疫传感器的构建
免疫传感器的构建过程如图1所示。首先,将玻碳电极(GCE)依次用 0.30、0.05 μm 的 Al2O3抛光,再依次用二次蒸馏水,无水乙醇超声清洗。清洗后的电极置于室温下自然晾干备用。随后,将10 μL CdS孵育在电极表面,在避光条件下自然晾干,得到CdS修饰的玻碳电极(CdS/GCE)。稍后,在电极表面滴加anti-cTnI 16 μL,低温孵育12 h后(anti-cTnI/CdS/GCE),用 1%的 BSA 封闭纳米粒子上多余的结合位点得到(BSA/anti-cTnI/CdS/GCE)。随后往电极表面滴加16 μL目标物cTnI,在避光条件下反应 2 h(cTnI/BSA/anti-cTnI/CdS/GCE),最后滴加二抗偶合物(Hemin-Ab2)16 μL反应30 min,构建成传感器(Hemin-Ab2/cTnI/BSA/anti-cTnI/CdS/GCE)。
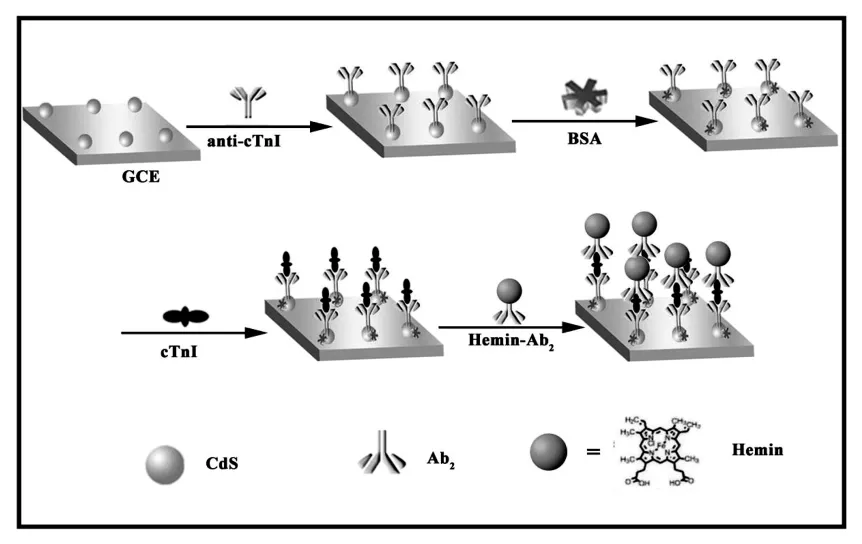
图1 ECL传感器的构建过程图Fig.1 Schematic diagram of the preparation process of ECL sensor
1.5 检测方法
该工作测量电极采用三电极体系:修饰电极为工作电极,铂丝电极作为对电极,Ag/AgCl电极为参比电极。在磷酸缓冲溶液(PBS,pH=7.0,含有0.10 mol/L S2O82-)中,进行电化学扫描来考察传感器的电化学发光特性。电位扫描范围为-1.6~0.2 V,电位扫描速度为0.1 V/s,光电倍增管高压设置为800 V。
2 结果与讨论
2.1 电致化学发光免疫传感器修饰过程的循环伏安表征
该工作以5.0 mmol/L铁氰化钾溶液作为氧化还原标记物,采用循环伏安法(CV)来表征ECL免疫传感器每一步构建过程。如图2所示,裸电极GCE(曲线a)呈现出一对可逆的氧化还原峰。当CdS孵育到GCE表面上后峰电流变小 (曲线b),这是由于CdS是半导体,传递电子能力很弱;当电极进一步孵育anti-cTnI后,由于抗体蛋白大分子阻碍电子的传递使得氧化还原峰有所下降 (曲线c),依次用BSA封闭特异性结合位点(曲线d)、孵育cTnI抗原(曲线e)和滴加Hemin-Ab2(曲线f)后,由于BSA和抗原抗体免疫复合物对电子传递的阻碍作用,CV曲线的峰电流也依次降低。
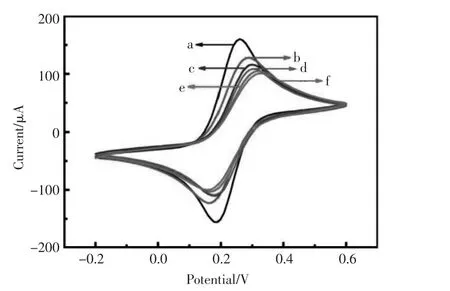
图2 免疫传感器修饰过程的循环伏安表征Fig.2 The CVs of(a)bare GCE;(b)CdS/GCE;(c)anti-cTnI/CdS/GCE;(d)BSA/anti-cTnI/CdS/GCE;(e)cTnI/BSA/anticTnI/CdS/GCE;(f)Hemin-Ab2/cTnI/BSA/anti-cTnI/CdS/GCE in 5.0 mmol/L K3[Fe(CN)6]at scan rate of 100 mV/s
2.2 免疫传感器对cTnI的ECL响应
Hemin的固载量与cTnI的浓度线性相关,因此在0.10 mol/L的S2O82-共反应试剂的缓冲溶液中可通过改变cTnI的浓度使传感器上孵育不同浓度的Hemin。又因为Hemin对过硫酸根的ECL信号具有较好的猝灭作用,从而使ECL信号下降。如图3所示,ECL信号强度随着cTnI浓度的增加而减小,ECL强度与cTnI的浓度在0.25 pg/mL~0.11 ng/mL范围内呈良好的线性关系,检出限为0.083 pg/mL(S/N=3),其线性回归方程为I=-103.173 c+12626.412,线性回归率为r2=0.996,式中I为发光强度,c为cTnI的浓度。

图3 免疫传感器在含有0.10 mol/L共反应试剂的PBS(pH=7.0)中对cTnI不同浓度的ECL响应,cTnI浓度从上往下依次为:(a)0.25 pg/mL;(b)30.25 pg/mL;(c)45.25 pg/mL;(d)60.25 pg/mL;(e)90.25 pg/mL;(f)105.25 pg/mLFig.3 ECL response of the sensor in presence of various concentrations of cTnI in PBS(pH=7.0)containing 0.10 mol/LThe concentration of cTnI:(a)0.25 pg/mL;(b)30.25 pg/mL;(c)45.25 pg/mL;(d)60.25 pg/mL;(e)90.25 pg/mL;(f)105.25 pg/mL
2.3 传感器稳定性的测定
在最优条件下即CdS浓度为1.2 mmoL/L,将已制备好的传感器连续扫描10圈(如图4),得到的ECL信号的相对标准偏差(RSD)为0.33%,表明传感器的稳定性良好,可以保证测量的精确度,有望用于实际样品的检测。

图4 免疫传感器的稳定性Fig.4 The stability of the biosensor with ECL intensitytime curve in the optimal conditions under consecutivecyclic potential scans for 10 circles
2.4 传感器重现性的测定
在同一批电极中,取三根电极构建相同的传感器并测量其ECL信号,对比信号值得到批内重现性。再取同一根电极,连续三天构建相同的传感器,并测其ECL信号,对比信号值得到批间重现性。实验结果得到批内、批间的相对标准偏差(RSD)均小于5%,说明构建的传感器重现性良好。
3 结论
综上所述,基于CdS量子点构建的“signaloff”型电致化学发光免疫传感器实现了心肌肌钙蛋白I的高灵敏检测。结合量子点的相关性质,通过电致化学发光表征,得到稳定高效的CdS量子点制备方法。探究Hemin对S2O82-的ECL的猝灭作用,进一步制备Hemin-Ab2。此传感器修饰方法简单、快捷,并且具有良好的重现性、稳定性,不仅有望于应用在急性心肌梗死的早期检测,也可在治疗时期进行相关监测。
[1]Hu S,Kong L,Gao R,et al.Ourline of the report on cardiovascular disease in China[J].Biomed Environ Science,2012,25:251-256.
[2]Mukamal K,Nesto R,Cohen M,et al.Impact of diabetes on long-term survival after acute myocardial infarction:Comparability of risk with priormyocardial infarction[J].Diabetes Care,2001,24:1422-1427.
[3]Fuehs S,Gruberg S,Kornowski R,et al.Prognostic value of cardiac troponin I re-elevation following percutaneous coronary intervention in high-risk patients with acute coronary syndromes[J].Am.J.Cardiol.,2001,88:129-133.
[4]Wu A H,Feng Y,Moore R,et al.Characterization of cardiac troponin subunit release into serum after acute myocardial infarction and comparison of assays for troponin T and I[J].Clin.Chem.,1998,44:1198-1208.
[5]Mair J,Morandell D,Genser N,et al.Equivalent early sensitivities of myoglobin,creatine-kinase mb mass,creatine-kinase isoform ratios,and cardiac troponin-I and troponin-T for acute myocardial-infarction[J].Clin.Chem.,1995,41:1266-1272.
[6]Adams J,Bodor G,Davila-Roman V,et al.Myocardial injury/infarction:cardiac troponin I:a marker with high specificity for cardiac injury[J].Circulation,1993,88:101-106.
[7]Cho I,Paek E,Kim Y,et al.Chemiluminometric enzymelinked immunosorbent assays (ELISA)-on-a-chip biosensor based on cross-flow chromatography[J].Anal.Chim.Acta.,2009,632:247-255.
[8]Bejhed R,Donolato M,Hansen M,et al.Turn-on optomagnetic bacterial DNA sequence detection using volume-amplified magnetic nanobeads[J].Biosens Bioelectron,2015,66:405-411.
[9]Guo H,He N,Ge S,et al.MCM-41 mesoporous material modified carbon paste electrode for the determination of cardiac troponin I by anodic stripping voltammetry[J].Talanta,2005,68:61-66.
[10]McCreery R.National Institute for Nanotechnology,Department of Chemistry,University of Alberta,Edmonton,Alberta T6G 2M9,Canada[J].Chem.Rev.,2008,108:2646-2687.
[11]Irkham,Watanabe T,Fiorani A,et al.Co-reactant-on-Demand ECL:Electrogenerated Chemiluminescence by the in Situ Production of S2O82–at Boron-Doped Diamond Electrodes[J].Am.Chem.Soc.,2016,138:15636-15641.
[12]Richter M.Department of Chemistry,Southwest Missouri State University,Springfield,Missouri 65804-0089[J].Chem.Rev.,2004,104:3003-3036.
[13]Chan W,Nie S.Quantum dot bioconjugates for ultrasensitive nonisotopic detection[J].Science,1998,281:2016-2018.
[14]Jamieson T,Bakhshi R,Petrova D,et al.Biological applications of quantum dots[J].Biomaterials,2007,28:4717-4732.
[15]Gao X,Yang L,Petros J A,et al.In vivo molecular and cellular imaging with quantum dots[J].Current Opinion in Biotechnology,2005,16:63-72.
A “Signal-off” electrochemiluminescence immunosensor based on CdS quantum dots for highly sensitive detection of cardiac troponin I
Gao Min,Zhang Pu,Wang Zi-li,Yuan Ruo*
(College of Chemistry and Chemical Engineering,Southwest University,Chongqing 400715,China)
*通信联系人
