豌豆蛋白的提取及利用次豌豆浆发酵乙醇的研究
2017-10-19邓永东吕西军吴学凤李兴江
邓永东,吕西军,吴学凤,李兴江
(合肥工业大学农产品精深加工安徽省重点实验室,安徽合肥 230009)
加工教研
豌豆蛋白的提取及利用次豌豆浆发酵乙醇的研究
邓永东,吕西军,吴学凤,*李兴江
(合肥工业大学农产品精深加工安徽省重点实验室,安徽合肥 230009)
目前,国内利用豌豆提取豌豆蛋白会产生大量废弃液体,这些液体称为次豌豆浆,其中含有大量的豌豆淀粉。一些企业将这部分液体直接排放或者用于生产饲料,造成了资源浪费和环境污染。为了解决这一问题,对豌豆蛋白的提取工艺及其余下的次豌豆浆发酵乙醇展开研究,采用酸沉法对豌豆蛋白进行提取,然后通过试验探究次豌豆浆发酵乙醇的最适条件。结果表明,50 g碗豆中蛋白含量10.84 g,淀粉含量20.34 g,淀粉水解率达到理论值的83.7%;最佳发酵条件为发酵温度30℃,菌液接种量10%,发酵液pH值4,摇床转速200 r/min。在该条件下,乙醇产量达到28.36 g/L,糖利用率达到98%,乙醇产量达到理论值的88%。对次豌豆浆发酵乙醇工艺展开研究将为豌豆综合利用率的提高奠定一定基础。
次豌豆浆;豌豆蛋白;葡萄糖;乙醇;发酵
Abstract:At present,the domestic use of peas to extract pea protein left a large number of abandoned liquid,these liquids are called sub-pea pulp,which contain a lot of pea starch.Some companies will directly discharge this part of the liquid or for the production of feed,resulting in waste of resources and environmental pollution.In order to solve this problem,this paper studies the extraction process of pea protein and the fermentation of fermented ethanol from the other pea pulp.The pea protein is extracted by acid precipitation method,and then the optimum conditions of ethanol fermentation are studied.The results show that 50 g peanut protein content of 10.84 g,starch content of 20.34 g,and the hydrolysis rate of starch reaches 83.7%of the theoretical value.The optimum fermentation conditions are as follows:fermentation temperature 30℃,inoculation amount 10%,initial pH 4,shaking speed 200 r/min.Under the optimum conditions,the ethanol yield reaches 28.36 g/L,sugar utilization rate of 98%.Ethanol production reaches 88%of the theoretical value.The research on the fermentation technology of pea pulp is carried out,which las a foundation for the improvement of the comprehensive utilization rate of pea.
Key words:secondary pea pulp;pea protein;glucose;ethanol;fermentation
豌豆是世界第二大豆类作物,目前生产干豌豆的国家有60多个。豌豆蛋白具有较高的溶解度、吸水性和乳化性,其中氨基酸组成符合人体需要,富含维生素、矿物质元素、蛋白质和碳水化合物等物质,营养全面且均衡,在食品工业中用途广泛。豌豆中含有膳食纤维,有助于消化、防止包括阑尾炎、心脏病和结肠癌等在内的多种疾病。淀粉和蛋白是豌豆中的重要组分。
干豌豆不仅含有大量的淀粉,而且还含有丰富的蛋白质;其成熟籽粒中分别含有蛋白质21%~28%,淀粉48%~52%。目前,国内许多企业利用豌豆提取豌豆蛋白,但未对其剩下的次豌豆浆进行有效利用,通常一些企业将这部分液体直接排放或者用于生产饲料,既造成了资源的浪费,又会对环境造成污染。为了解决这一问题,对豌豆蛋白提取及余下的次豌豆浆利用展开研究,利用次碗豆浆中的淀粉发酵生产乙醇,不仅可以提高豌豆的利用率,也能达到改善环境的目的。
1 材料与方法
1.1 酵母菌
热带假丝酵母CICC1779。
1.2 培养基
YPD葡萄糖液体培养基(100 mL):酵母膏1 g,葡萄糖2 g,蛋白胨2 g。
YPD固体培养基(100 mL):酵母膏1 g,葡萄糖2 g,蛋白胨2 g,琼脂1.5 g。
种子培养基、扩大培养基,均用YPD培养基。
1.3 主要仪器
LY-B0.025型压力蒸汽灭菌器,武汉市鸿雁医疗器械制造有限公司产品;AR1140/C型电子分析天平,奥豪斯(上海)公司产品;SWO-CJ-IP型超净工作台,苏静集团安泰公司产品;756MC型紫外分光光度计,上海第三分析仪器厂产品;ZHP-Y2102L型智能恒温摇床培养箱,上海三发科学仪器有限公司产品;FE20型实验室pH计,梅特勒-托利多仪器(上海)有限公司产品;MC型酒精计,上海长城仪器厂产品;WYT-4型手持糖量计,泉州中友光学仪器有限公司产品;温度计,郑州泽铭科技有限公司产品;RE-85Z型旋转蒸发仪,上海五相仪器仪表有限公司产品。
1.4 主要试剂
葡萄糖、牛血清蛋白、重铬酸钾溶液、DNS溶液、蛋白胨、酵母膏、琼脂(BR)、考马斯亮蓝试剂、95%乙醇、HCl和NaOH,以上试剂均为分析纯。
1.5 试验方法
1.5.1 菌种的活化与扩培
(1) 菌种活化。配置YPD葡萄糖固体培养基;将冷藏的酵母菌活化,使菌种从冷藏状态恢复到室温状态。将冷藏的酵母菌用糖水活化后,接种到固体培养基中,置于恒温培养箱中培养24 h,培养温度30℃。挑选培养基茁壮的菌落接种到新的YPD固体培养基中培养,重复此步骤2~3次,从而得到生长良好的菌落。
(2)菌种保存。挑选茁壮的单个菌落接种到试管中,置于4℃冰箱中保存。
(3)菌种扩培。将保存的菌种接种到YPD液体培养基中,培养12 h(温度30℃,转速150 r/min),实现扩培[1]。
1.5.2 豌豆中蛋白的提取
将50 g豌豆与300 mL水混合,清洗后浸泡24 h(浸泡使纤维吸水膨胀增大,使之破碎后,与蛋白、淀粉易于分离,从而使蛋白和淀粉从中提取出来)。去除豌豆皮后,用豆浆机磨浆(磨浆是通过机械作用破坏豌豆内部纤维与蛋白的结构网,从而使淀粉和蛋白溶于磨浆液中)[2],使用100目滤网过滤,滤渣部分主要为淀粉、纤维素等不溶成分,上层清液中主要为蛋白等[3]。
取上清液,调节pH值至4.6后,使用离心机以转速10 000 r/min离心10 min,下层沉淀部分为豌豆蛋白。通过考马斯亮蓝法,标定出标准蛋白曲线[4]。
1.5.3 豌豆中淀粉含量的测定
将50 g豌豆与300 mL水混合,浸泡24 h后打浆,调pH值至4.6等电点去除蛋白后,取余下淀粉乳→烘干→称量→蒸煮糖化→烘干→称量,减少的质量即为淀粉糊化糖化减少的质量[5]。取最后的烘干产物,用一定水溶解后加入碘液,有轻微淡蓝色出现,则淀粉分解较为完全[6]。
1.5.4 次豌豆浆的制备及糖化率的测定
次豌豆浆是指提取豌豆蛋白后所余下的部分,在这里通过制备得到次豌豆浆。将上一步分离蛋白之后的液体与之前的滤渣混合,得到的浆液即为次豌豆浆[7]。
调节次豌豆浆pH值至5.6(α-高温淀粉酶最适pH值),加入α-高温淀粉酶,于60℃条件下水浴30 min,随后于100℃条件下水浴60 min;待浆液冷却至60℃,加入糖化酶于60℃条件下水浴60 min,得到糖化后用于发酵的次豌豆浆。
取少量糖化后的次豌豆浆置于试管中,滴加2滴碘液,有轻微淡蓝色出现,则淀粉水解较为完全[8]。
1.5.5 乙醇产量测定
重铬酸钾标准曲线的标定:①取8支10 mL比色管,分别加入2 mL重铬酸钾溶液和适量乙醇标准溶液,用蒸馏水定容至10 mL,沸水浴10 min后流水冷却至室温,于波长600 nm处测定吸光度,以吸光度为横坐标、乙醇含量为纵坐标绘制标准曲线[8];②取发酵液10 mL,以转速12 000 r/min离心10 min,取上清液作为待测液;③取10 mL比色管加入2 mL重铬酸钾溶液,1 mL待测液,用蒸馏水定容至10 mL,沸水浴10 min后流水冷却至室温,于波长600 nm处测定吸光度,根据重铬酸钾标准曲线回归方程计算出乙醇粗测质量分数[9]。
1.5.6残糖量测定
(1)DNS试剂。量取750 mL去离子水,加热至微热后顺序加入3,5-二硝基水杨酸10 g,NaOH 16 g,苯酚5 g,亚硫酸钠5 g和酒石酸钾钠300 g,溶解后定容至1 000 mL,棕色瓶中室温下暗处放置1周后使用。
(2)DNS标准曲线的标定。①取10 mL比色管,分别加入1.5 mL DNS试剂和适量葡萄糖标准溶液,用蒸馏水定容至10 mL,沸水浴5 min后冷却至室温,于波长540 nm处测定吸光度[10];②取发酵液10 mL,以转速12 000 r/min离心10 min,取上清液作为待测液;③取10 mL比色管,加入1.5 mL DNS溶液,50 μL待测液,用蒸馏水定容至10 mL,沸水浴5 min后流水冷却至室温,于波长540 nm处测定吸光度,根据DNS标准曲线回归方程计算出残糖量[10]。
1.5.7 次豌豆浆发酵乙醇的单因素试验
由以往发酵试验得知,影响发酵的因素 包括发酵时间、菌液接种量、发酵温度、发酵液 pH值、转速以及通气量等。试验主要研究发酵液pH值、菌液接种量、发酵温度,摇床转速这4个因素对乙醇发酵的影响[7]。
发酵时间72 h,每个500 mL锥形瓶中装入次豌豆浆300 mL,发酵液pH值分别取3,4,5,6,7共5个水平;菌液接种量分别取6%,8%,10%,12%,14%共 5个水平;发酵温度分别取26,28,30,32,34℃共5个水平;摇床转速分别取100,150,200,250, 300 r/min共5个水平。
1.5.8 次豌豆浆发酵乙醇的正交试验在单因素试验的基础上,进行正交试验。正交试验因素与水平设计见表1。

表1 正交试验因素与水平设计
2 结果与讨论
2.1 豌豆成分含量测定
根据方法1.5.2测出蛋白溶液于波长595 nm处的吸光度,根据标准曲线计算出50 g豌豆中蛋白含量为10.84 g;根据方法1.5.3测得50 g豌豆中淀粉含量为20.34 g,其他含量为18.82 g。
2.2 糖化率
根据方法1.5.4利用淀粉酶和糖化酶对次豌豆浆进行水解,然后通过DNS法测得葡萄糖质量浓度为62.97 g/L,达到淀粉水解理论值的83.7%(理论值为1 g淀粉完全水解得到1.11 g葡萄糖)。
2.3 最适单因素试验研究
2.3.1 最佳发酵温度的确定
发酵温度对乙醇产量的影响见图1。
发酵温度是影响乙醇发酵的主要因素之一。温度会影响微生物细胞内的生物大分子活性,进而影响到微生物的生命活动。随着温度升高,细胞内的酶反应速度会加快;可是温度过高或过低,生物活性物质(蛋白质、核酸等)会发生变性,细胞功能下降,甚至死亡。由图1可知,随着发酵温度的升高,酵母菌利用次豌豆浆发酵乙醇的产量有明显提高。在30℃时乙醇产量达到最高值26.58 g/L,残糖量仅为5.2 g/L;随着发酵温度的继续升高,乙醇产量明显降低。当发酵温度低于30℃时,发酵温度越高越有利于发酵;而发酵温度高于30℃时,由于发酵温度过高,会影响乙醇产量[11]。
2.3.2 最佳摇床转速的确定
摇床转速对乙醇产量的影响见图2。
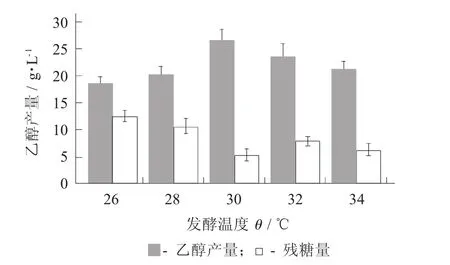
图1 发酵温度对乙醇产量的影响
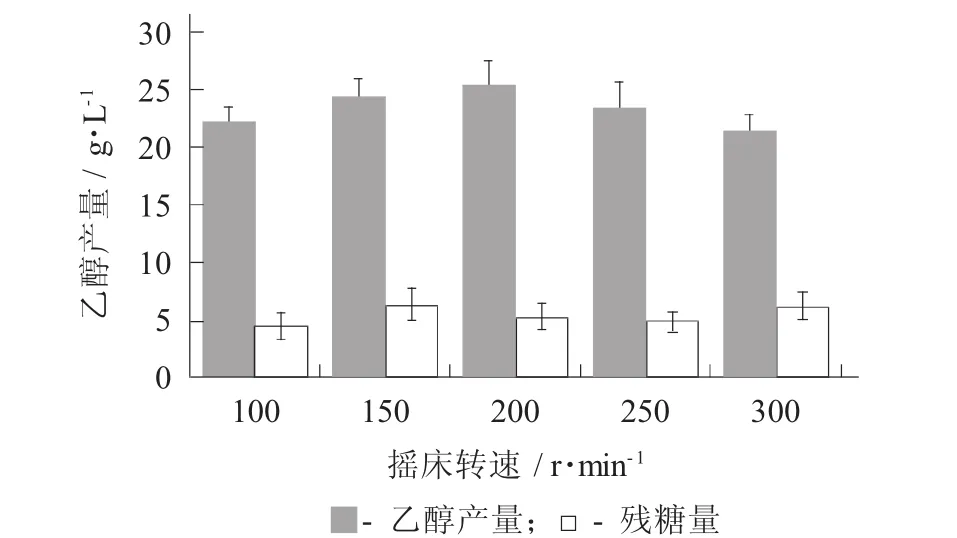
图2 摇床转速对乙醇产量的影响
摇床可以排出发酵液中生成的CO2,CO2会通过影响酵母细胞内外的pH值、细胞膜及酶来抑制酵母的生长代谢[2]。而摇床转速对酿酒酵母的生长与发酵状况也有一定影响,摇床能够加速发酵过程中产生CO2的排出,并使酵母悬浮在培养液中,在一定程度上增加菌液浓度。由图2可知,随着摇床转速的提高,乙醇产量有明显的提高[12]。在摇床转速200 r/min时,乙醇产量达到最高达到25.63 g/L;随着发酵转速继续升高,乙醇产量有略微的降低。当摇床转速为100~200 r/min时,摇床转速越高,乙醇产量越高;当摇床转速为200~300 r/min时,摇床转速越高越不利于酵母菌的生长,乙醇产量越低。
2.3.3 最佳发酵液pH值的确定
发酵液pH值对乙醇产量的影响见图3。
培养基或环境中的pH值与微生物的生命运动有着密切的联系。培养基或环境中的pH值不光影响细胞对营养物质的吸收、促进或抑制微生物的生长,还可影响环境中有害物质对微生物的毒性;影响培养基中某些营养物质的分解或中间代谢产物的解离,从而影响微生物对这些物质的利用;并且酵母对酸度耐受性的高低是评价乙醇酵母优劣的重要指标[13]。由图3可知,随着发酵液pH值的提高,乙醇产量有明显提高。在发酵液pH值4时,乙醇产量达到最高值26.98 g/L,残糖量为3.69 g/L;发酵液pH值继续升高,乙醇产量有明显降低。因此,发酵液pH值为5是最适发酵液pH值。
2.3.4 最佳菌液接种量的确定
菌液接种量对乙醇产量的影响见图4。
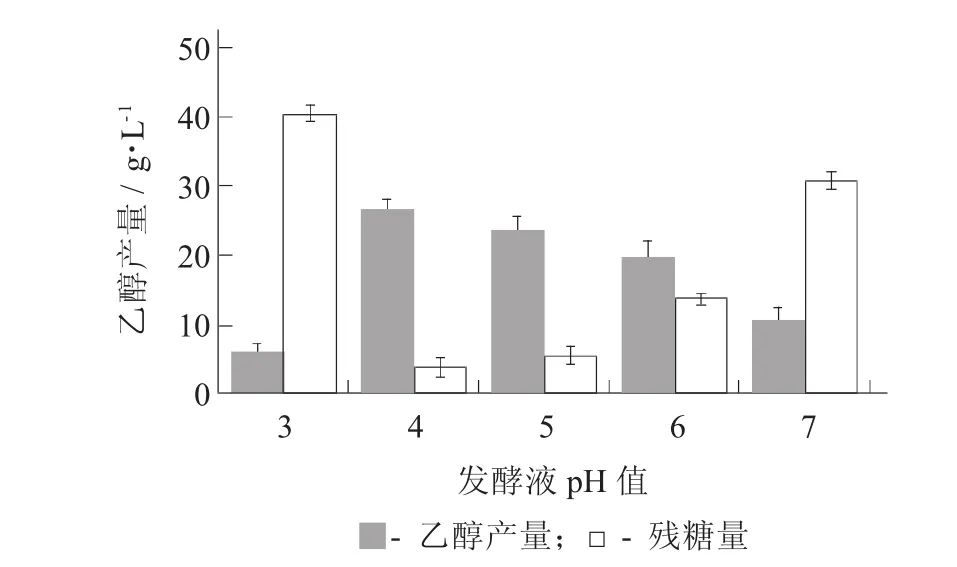
图3 发酵液pH值对乙醇产量的影响

图4 菌液接种量对乙醇产量的影响
酵母菌菌液接种量不同,其中酵母菌的含量也不同。菌液接种量过多,培养基成分会对发酵造成一定影响;这里接种量较少,不考虑培养基成分的影响,仅观察酵母菌量对发酵的影响。菌液量过少会使得发酵速率大大降低,菌液量过多酵母菌之间会相互抑制。由图4可知,随着菌液接种量的提高,乙醇产量有明显提高。在菌液接种量为10%时,乙醇产量达到最高值27.52 g/L,残糖量为2.36 g/L;随着菌液接种量继续增高,乙醇产量又有明显降低。因此,菌液接种量为10%是最佳菌液接种量。
2.4 正交试验
正交试验结果见表2。
由表2可知,4个因素中对乙醇产量影响的主次顺序为发酵液pH值>摇床转速>菌液接种量>发酵温度,其中发酵液pH值对乙醇产量影响最为显著,摇床转速次之。发酵液pH值不仅影响细胞对营养物质的吸收、促进或抑制微生物的生长,还可影响环境中有害物质对微生物的毒性;影响培养基中某些营养物质的分解或中间代谢产物的解离,从而影响微生物对这些物质的利用。摇床转速影响了培养基中CO2的含量,影响较强;发酵温度影响最小。
由正交试验分析可知,最佳乙醇发酵条件为发酵液pH值4,摇床转速200 r/min,发酵温度30℃,菌液接种量10%。
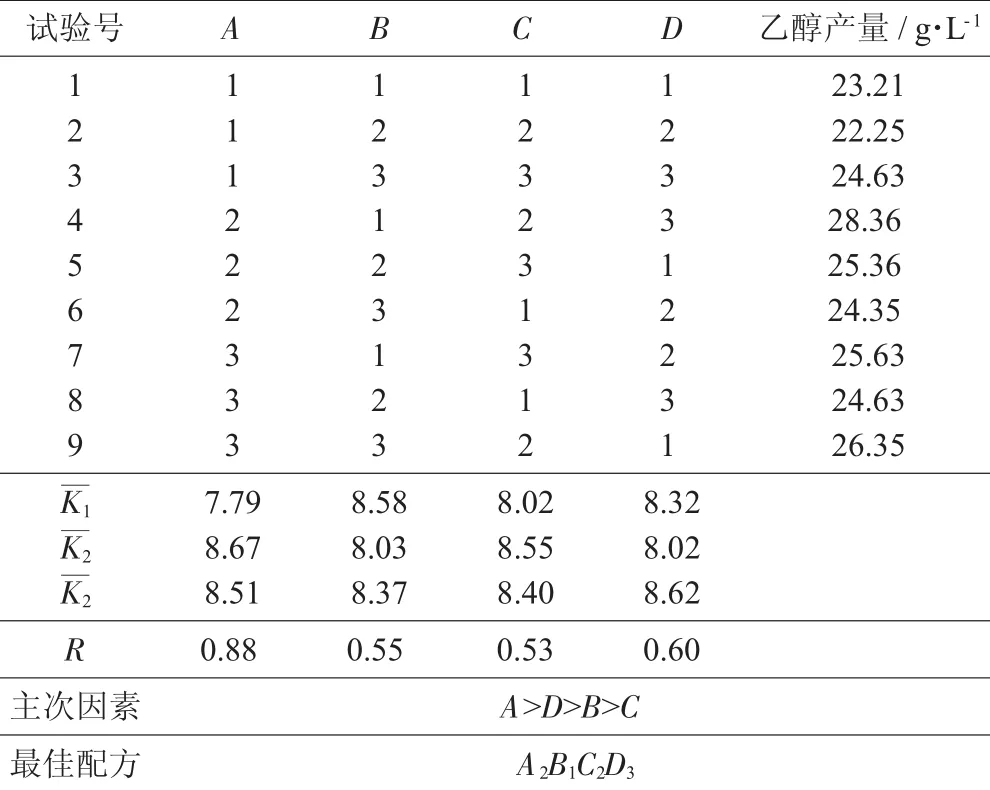
表2 正交试验结果
3 结论
通过对豌豆蛋白的提取工艺及对其余下的次豌豆浆发酵制备乙醇进行研究,采用酸沉法对豌豆蛋白进行提取,分析得到蛋白含量为21.68%,淀粉含量为40.68%。然后,对次豌豆浆发酵制备乙醇进行单因素试验及在此基础上进行正交试验优化,最终得到最佳的发酵条件为发酵温度30℃,菌液接种量10%,发酵液pH值4,摇床转速200 r/min;最终乙醇产量达到28.36 g/L,糖利用率达到98%。
[1]岳力.发酵木糖产乙醇菌株的筛选与鉴定 [D].长沙:湖南农业大学,2014.
[2]Chiotelli E,Le Meste M.Effect of small and large wheatstarch granules on thermomechanical behavior of starch[J].Cereal Chemistry,2002 (2):286-293
[3]周稳,付烈,王俊卿,等.重组运动发酵单胞菌发酵木糖产乙醇的研究 [J].化学与生物工程,2011(5):23-27.
[4]曲春香.用考马斯亮蓝测定植物粗提液中可溶性蛋白质含量方法的研究 [J].苏州大学学报(自然科学版),2006 (2):82-85.
[5]叶明.微生物学实验技术 [M].合肥:合肥工业大学出版社,2009:135-150.
[6]叶明.微生物学 [M].北京:化学工业出版社,2010:101-120.
[7]张军合,饶平凡,张利真,等.小麦B淀粉乙醇发酵工艺研究 [J].食品科技,2015(7):33-37.
[8]何川.重铬酸钾-DNS比色法测定发酵液中乙醇含量 [J].生命科学研究,2013(1):1-4.
[9]唐冰,夏秋瑜,李从发,等.NAG含量测定中常见的3种DNS试剂使用效果比较研究 [J].热带农业科学,2006,26(2):33-35.
[10]王俊丽,聂国兴,李素贞,等.DNS测定还原糖含量时最适波长的确定 [J].河南农业科学,2010(4):115-118.
[11]陆雁,秦艳,李明松,等.木薯淀粉高温浓醪发酵乙醇工艺的研究 [J].酿酒科技,2009(9):22-25.
[12]莫重文.豌豆蛋白及淀粉的制取研究 [J].郑州粮食学院学报,1999(4):84-88.
[13]李海明.木薯淀粉生产乙醇的发酵工艺研究 [J].福建农业学报,2013(6):593-596.◇
Studyon the Extraction ofPea Protein and the Fermentation of Ethanol fromSub-pea Pulp
DENG Yongdong,LV Xijun,WU Xuefeng,*LI Xingjiang
(Key Laboratory of Intensive Processing of Agricultural Products in Anhui Province,Hefei University of Technology,Hefei,Anhui 230009,China)
TS201.1
A
10.16693/j.cnki.1671-9646(X).2017.09.026
1671-9646(2017) 09b-0001-04
2017-06-26
安徽省重大科技专项“利用次淀粉浆废液发酵酒精资源综合利用的关键技术研究及产业化”(15CZZ03100)。
邓永东(1992— ),男,硕士,研究方向为发酵工程。
*通讯作者:李兴江(1978— ),男,博士,副教授,研究方向为发酵工程。
