脑缺血再灌注损伤大鼠Beclin-1与Bcl-xL、Caspase-2的表达及Cystatin C干预作用的影响
2017-10-17梁秀军王爱乐常晓栋杨嘉磊
陈 萌, 梁秀军, 王爱乐, 常晓栋, 杨嘉磊
脑缺血再灌注损伤大鼠Beclin-1与Bcl-xL、Caspase-2的表达及Cystatin C干预作用的影响
陈 萌1, 梁秀军2, 王爱乐3, 常晓栋4, 杨嘉磊4
目的探讨大鼠脑缺血再灌注后自噬蛋白Beclin-1与凋亡蛋白Bcl-xL、Caspase-2表达的变化以及Cystatin C对其的干预作用。方法Sprague-Dawley大鼠雄性60只随机分成假手术组(sham)、模型组(model)、Cystatin C低(low)、中(middle)、高(high)浓度组,每组12只。用线栓法制备大鼠右侧局灶性脑缺血2 h再灌注24 h模型。各组大鼠进行神经损伤严重程度评分(mNSS),Western Blot检测损伤区脑皮质组织中凋亡相关蛋白Bcl-xL、Caspase-2的表达;免疫荧光法检测Beclin-1蛋白表达的平均荧光强度;TUNEL法观察神经细胞的凋亡指数(AI)。结果与模型组相比,Cystatin C低、中浓度组中Bcl-xL的表达较模型组明显升高(P<0.05),Caspase-2的表达降低(P<0.05);而Cystatin C高浓度组Bcl-xL表达明显降低,Caspase-2的表达则显著上升(P<0.05);Cystatin C低、中、高浓度组Beclin-1的表达逐渐升高(P<0.05)。结论应用低、中浓度的Cystatin C干预脑缺血再灌注损伤大鼠后,自噬的增强能够促进Bcl-xL的表达,抑制Caspase-2的表达;而高浓度的Cystatin C使Caspase-2的表达增强,Bcl-xL的表达降低。
脑缺血再灌注; 自噬; Caspase-2; Bcl-xL; Beclin-1
Abstract:ObjectiveTo investigate the expressions of autophagy related proteins Beclin-1 and apoptosis related proteins Bcl-xL、Caspase-2 after focal cerebral ischemia-reperfusion with Cystatin C pretreatment in rats.Methods60 male SD rats were randomly divided into sham operation group,the model group and Cystatin C pretreatment group(Cystatin C 2 mg/l,5 mg/l,10 mg/l,respectively),12 rats in each group. The model of right middle cerebral artery occlusion(MCAO) was established by thread embolism. After ischemia for 2 h and reperfusion 24 h,the Modified neurological severity scores (mNSS) were tested. All rats were killed at 24 h after MCAO. The brains were removed and using Western Blot method to detect apoptosis related proteins Bcl-xL and Caspase-2,located in the center area of the cerebral cortex tissue injury;Beclin-1 protein expression was detected by immunofluorescence method,and TUNEL method was used to evaluate the apoptosis of neuron.ResultsCompared with model group,the expression of Bcl-xL had different degree of increase in the Cys low and Cys middle group(P<0.05),the expression of Caspase-2 decreased(P<0.05);While the expression of Caspase-2 in the Cys high group was higher than the Cys low and Cys middle group(P<0.05),the Bcl-xL was obviously lesser(P<0.05);the expression of Beclin-1 protein in the each concentration Cystatin C group increased gradually(P<0.05).ConclusionLow and middle concentration of Cystatin C intervention ischemia reperfusion injury in rats,the activity of autophagy increased could promote the pression of Bcl-xL,inhibit the expression of Caspase-2.While high concentration of Cystatin C (reach a certain degree of autophagy flow) could inhibit the expression of Bcl-xL,promote the expression of Caspase-2.
Keywords: Cerebral ischemia reperfusion; Autophagy; Beclin-1; Bcl-xL; Caspase-2
脑卒中(Stroke)又叫脑血管意外,是一种突然起病的脑血液循环障碍性疾病,临床上分为缺血性脑卒中和出血性脑卒中。在国内的脑血管疾病患者中,缺血性脑卒中患者可达66.4%[1]。脑缺血后继发性脑损伤将严重影响患者预后并导致病情加重,其主要参与原因包括炎症反应、细胞凋亡、兴奋性氨基酸毒性、自噬及钙超载等等。自噬在缺血再灌注损伤时是一把双刃剑,当细胞启动适度的自噬来清除受损细胞器时,对细胞主要起保护作用,但当不完全或过度自噬发生时可能导致细胞死亡[2]。半胱氨酸蛋白酶抑制剂C(Cystatin C,Cys C)已证实可以诱导细胞自噬,从而保护小鼠皮质神经元[3]。本实验预先给予大鼠不同浓度的Cystatin C进行处理,然后建立局灶性脑缺血再灌注损伤模型,研究其对大鼠脑缺血再灌注损伤后神经细胞自噬蛋白Beclin-1和凋亡蛋白Bcl-xL、Caspase-2表达的影响。
1 材料与方法
1.1 动物分组及处理 清洁级SD雄性大鼠60只,体质量260~280 g。购自北京维通利华生物技术有限公司。大鼠随机分为5组:假手术组、模型组、Cystatin C低、中、高浓度组,每组12只。Cystatin C各组分别于术前1h经鼠尾静脉给予Cystatin C 2 mg/L,5 mg/L,10 mg/L,假手术组和模型组给予等量的生理盐水。
1.2 实验药品及试剂 半胱氨酸蛋白酶抑制剂C (Cystatin C,purified) (瑞士Enzo life Science,货号BML-SE479-0100);鼠抗Bcl-xL单克隆IgG抗体(美国Santa Cruze,货号sc-8392 )、Caspase-2羊多克隆抗体IgG(美国Santa Cruze,货号sc-1217)和兔抗Beclin-1试剂(日本 MBL,货号 PD017);HRP 标记的羊抗小鼠IgG(北京中杉金桥,货号 ZB-2305);HRP 标记的驴抗羊IgG(美国Santa Cruze,货号sc-2020);BCA 法蛋白定量试剂盒 (杭州联科生物技术股份有限公司,货号70-M-PQ0012)。垂直电泳系统(Bio-Rad,USA);石蜡切片机(德国Leica,型号 RM2235);倒置荧光显微镜(德国Leica,型号 DMI4000B)。
1.3 方法
1.3.1 大鼠大脑中动脉阻塞(MCAO)模型制备 SD大鼠经适应性喂养1 w后,禁食12 h,自由饮水。用10%的水合氯醛腹腔麻醉(300 mg/kg)。模型组和Cystatin C各组采用线栓法制备MCAO模型。大鼠常规麻醉、消毒,取颈部正中切口,分离右侧颈总动脉(common carotid artery,CCA)、颈外动脉(external carotid arter,ECA)和颈内动脉(internal carotid artery,ICA)。用微动脉夹夹闭CCA和ICA,在ECA残端用眼科剪剪一小口,将制备好的线栓通过ECA残端插入,去掉ICA的微动脉夹后,插入ICA的颅内段。注意观察线栓方向避免误入翼腭动脉,线栓进入(18.5±0.5) mm,当有轻微阻力时停止。线栓正好进入颅内大脑前动脉,阻塞大脑中动脉的开口。术后将大鼠单笼饲养,灯照保暖至大鼠苏醒。血流阻断2 h后拔出线栓,实现再灌注。假手术组大鼠仅分离右侧血管,不插入渔线。
1.3.2 神经行为学评分 各组大鼠于术后24 h分别进行改良神经损伤严重程度评分(modified neurological severity scores,mNSS)。该评分包括运动、感觉、反射等方面,依据其损伤程度分为0分到18分:0分表示无神经功能缺损,18分表示功能缺损最严重。神经功能损伤的程度随分值增大而逐渐加重。评价模型制备成功率。
1.3.3 Western Blot检测大鼠脑皮质组织中Bcl-xL和Caspase-2蛋白水平 将各组大鼠经10%水合氯醛麻醉后,预冷0.01 mol/L PBS心脏灌流后,断头取脑。分离缺血再灌注损伤侧脑皮质组织,假手术组取相应部位脑组织。加入RIPA裂解液1 ml进行裂解、于冰上匀浆,4 ℃离心后取上清液,BCA法进行蛋白定量。每道蛋白40 μg上样,经过SDS-PAGE电泳、转膜、封闭、分别加入TBST稀释的一抗:鼠抗Bcl-xL单克隆抗体(1∶500)、Caspase-2羊多克隆抗体(1∶500)、小鼠抗β-actin单克隆抗体(1∶1000)。4 ℃孵育过夜。次日洗膜后分别加入对应的二抗:辣根过氧化酶标记的羊抗小鼠IgG(1∶2000),辣根过氧化酶标记的驴抗羊IgG(1∶2000),室温孵育1 h。使用增强型免疫发光法(ECL)曝光显影条带。采用Image-Pro-Plus 6.0软件对条带进行分析,以目的蛋白与内参β-actin的积分光密度(IOD)比值作为目的蛋白的相对表达水平。
1.3.4 免疫荧光法检测Beclin-1的表达 大鼠经断头取脑后置于4%多聚甲醛中继续固定24 h。冠状切下脑组织块,常规脱水,石蜡包埋。切片厚约为5 μm的薄片,经二甲苯脱蜡,梯度乙醇水化后,加入0.25%TrionX-100室温处理破膜。PBS摇洗3次,蒸馏水浸泡切片5 min,将切片放入柠檬酸缓冲液中(95~98 ℃) 20 min进行抗原修复,恢复至室温后取出切片,PBS浸泡5 min,10%正常山羊血清封闭60 min。加入一抗兔抗Beclin-1多克隆抗体(1∶100稀释),室温孵育1 h后4 ℃过夜。次日取出常温放置30 min,PBS洗片后滴加(1∶200稀释)Alexa Fluor®594-羊抗兔IgG荧光二抗,暗室孵育60 min。PBS避光摇洗5min × 3次,加入Hoechst(1∶1000),室温10 min,PBS摇洗3次终止染色。50%缓冲甘油封片,倒置荧光显微镜下观察并拍照。用PBS代替一抗、荧光二抗作为阴性对照,其余步骤同上。于高倍视野下拍摄5个互不重叠视野下的照片,计算阳性细胞数目,取其平均数。
1.3.5 TUNEL法检测神经细胞凋亡 采用脱氧核苷酸末端转移酶(TdT)介导的原位末端标记法(TUNEL)检测凋亡细胞。标本预处理后经蛋白酶K室温孵育15 min,PBS冲洗3次,滴加50 μl的TUNEL反应混合物后于37 ℃孵育60 min。PBS冲洗3次,滴加转化剂37 ℃孵育30 min进行信号转化。PBS冲洗3次,加入DBA底物室温孵育8 min。PBS冲洗3次后苏木素复染,蒸馏水冲洗,梯度乙醇脱水、二甲苯透明,中性树胶封片。每张切片随机选取不重复5个于200倍视野下进行凋亡细胞计数。计算凋亡细胞指数,结果取其均数。凋亡细胞指数(AI)=阳性细胞数/总细胞数 × 100%。

2 结 果
2.1 各组大鼠进行神经损伤严重程度评分 各组大鼠模型制备前mNSS评分均为0分。假手术组mNSS评分差异均无统计学意义(P>0.05),评分多为0~2分;模型组大鼠24 h均出现缺血侧同侧Horner征及对侧肢体的典型偏瘫症状,表现为:站立不稳,向左侧倾倒或转圈,提起鼠尾可见左前肢屈曲,mNSS评分在10~13分,评分数值明显高于假手术组(P<0.05),提示模型组大鼠神经功能受损严重。与模型组比,模型组大鼠mNSS评分明显减少(P<0.05),而Cystatin C高浓度组mNSS评分与模型组无明显差别(P>0.05)。说明Cystatin C低、中浓度可改善脑缺血再灌注后大鼠神经功能缺损症状,促进运动功能的恢复;而Cystatin C高浓度组大鼠神经功能缺损症状明显(见表1)。
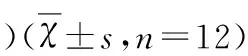
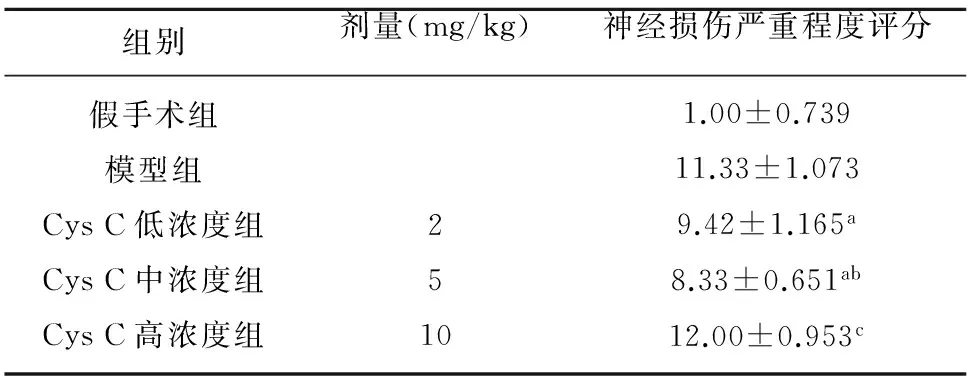
组别剂量(mg/kg)神经损伤严重程度评分假手术组模型组CysC低浓度组CysC中浓度组CysC高浓度组25101.00±0.73911.33±1.0739.42±1.165a8.33±0.651ab12.00±0.953c
a:P<0.01 vs 模型组;b:P<0.05 vs Cys C 低浓度组;c:P>0.05 vs 模型组
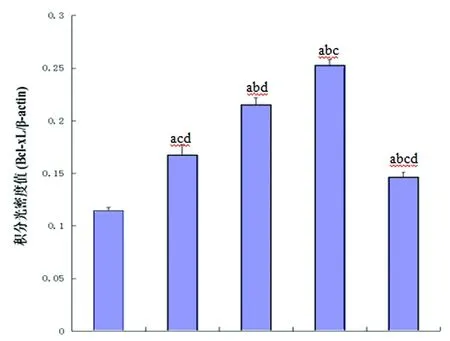
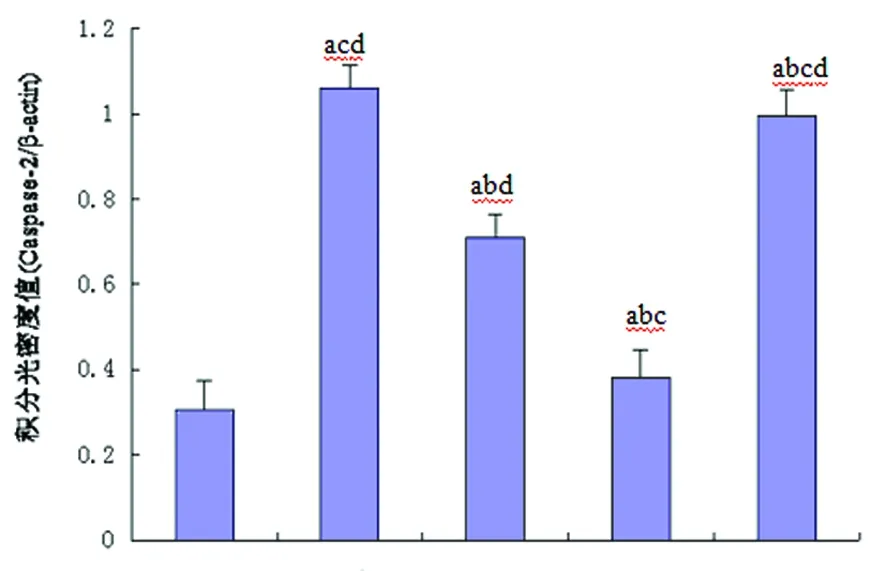
2.2 Western Blot检测Bcl-xL和Caspase-2表达情况 Western Blot检测结果显示:假手术组有少量Bcl-xL表达;模型组Bcl-xL的表达升高,Caspase-2表达也增高;Cystatin C低、中浓度组Bcl-xL表达较模型组有不同程度的增加(P<0.05),Caspase-2表达较模型组有所降低(P<0.05);而Cystatin C高浓组Bcl-xL的表达较Cystatin C低、中浓度组有所降低,Caspase-2表达较低、中浓度组表达明显增加(P<0.05)(见图1)。
假手术组 模型组 Cys C低 Cys C中 Cys C高
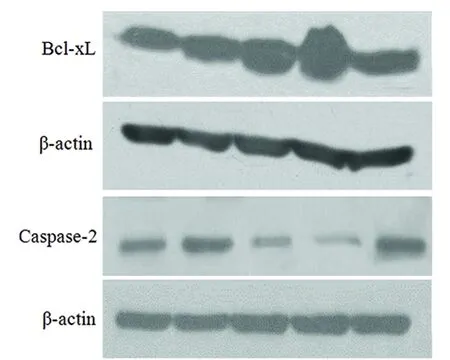
假手术组 模型组 Cys C低 Cys C中 Cys C高
假手术组 模型组 Cys C低 Cys C中 Cys C高
n=6,a:P<0.01 vs 假手术组,b:P<0.05 vs 模型组,c:P<0.05 vs Cys C 低浓度组,d:P<0.05 vs Cys C中浓度组
图1 每组大鼠Bcl-xL、Caspase-2的蛋白印迹结果
2.3 免疫荧光染色检测脑皮质Beclin-1平均荧光强度 免疫荧光染色结果显示:Beclin-1蛋白主要分布在细胞质,在脑皮质呈弥散性分布,阳性物质呈红光,蓝光显示的为Hoechst染的细胞核。假手术组Beclin-1的荧光强度较弱,模型组Beclin-1的荧光强度较假手术组有所增强;不同浓度的Cys C各组Beclin-1的荧光强度呈现出逐渐增高的趋势(P<0.05)(见表2、图2)。
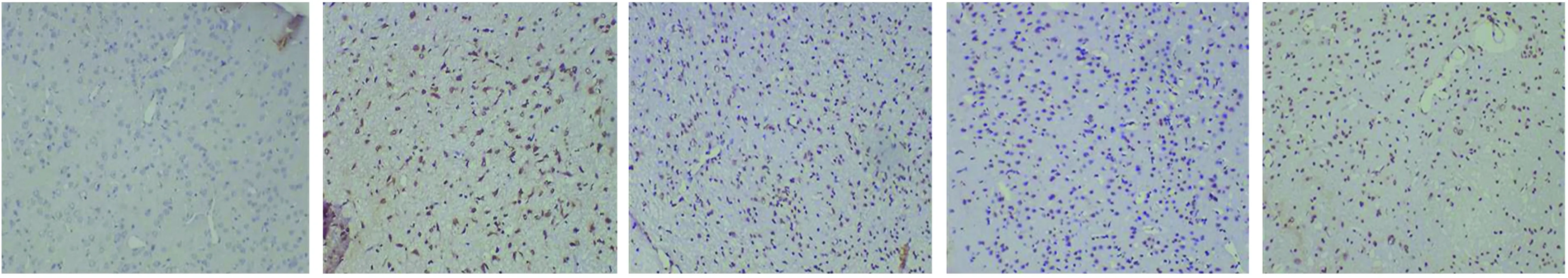
2.4 TUNEL法检测神经细胞凋亡结果 光学显微镜下观察:TUNEL染色阳性细胞核呈棕黄色,正常细胞染成蓝色。假手术组几乎没有阳性凋亡细胞,模型组细胞凋亡数目明显增多,凋亡指数较高(P<0.01);Cystatin C低、中浓度组凋亡指数较模型组有所降低(P<0.05),而Cystatin C高浓度组细胞凋亡指数较低、中浓度组明显增高(P<0.05)(见表2、图3)。
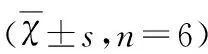

组别Beclin-1凋亡指数(%)假手术组模型组CysC低浓度组CysC中浓度组CysC高浓度组0.0305±0.00330.0585±0.0047acd0.0868±0.0056abd0.1151±0.0380abc0.1456±0.0352abcd1.14±0.0228.95±1.68acd18.40±0.81abd15.96±0.60abc22.86±1.04abcd
a:P<0.01 vs 模型组;b:P<0.05 vs 模型组;c:P<0.05 vs Cys C低浓度组;d:P<0.05 vs Cys C中浓度组
3 讨 论
细胞凋亡是一种程序性细胞死亡,它的主要功能是清除机体内损伤或过多的细胞,从而有助于机体的存活。Caspase为天冬氨酸特异性半胱氨酸蛋白酶,是一类进化上高度保守的半胱氨酸蛋白酶家族。Caspase依赖的凋亡途径是细胞程序性死亡的一种重要方式,其中Caspase-2是最保守的Caspase家族成员之一。
有文献报道Caspase-2位于Caspase-3的上游,在凋亡的发生中其先于Caspase-3被激活[4~6]。Imre等[7]发现Caspase-2为凋亡启动因子并促使细胞发生凋亡,当Caspase-2的表达下调可抑制细胞凋亡。Bcl-2蛋白家族通过线粒体通透性继而引起Caspase活化,在应激诱发的凋亡中Caspase-2对Bax转位到线粒体是必须的,说明线粒体的通透性受到Caspase-2的调控[8,9];在Fas抗体诱发的凋亡中,Caspase-8的活化和下游Bid酶切活化、DNA片段化均需Caspase-2的存在。活化的Caspase-2可以直接或者间接通过酶切Bid诱发线粒体中凋亡相关蛋白Cyt-C、Smac和AIF释放,且呈剂量依赖关系[10]。其中Cyt-C与Apaf-1和proCaspase-9形成凋亡信号复合体使Caspase-9活化,继而下游效应Caspase活化引发细胞凋亡[11]。
Bcl-xL是Bcl-2家族中重要的凋亡抑制基因。Bcl-xL作为上游凋亡相关因子能够抑制Caspase的激活及调控活性氧的毒性发挥和维持线粒体膜电位来阻止细胞凋亡[12],也可以通过抑制死亡诱导信号复合体组装抑制Caspase的活化[13]。Beclin-1是一种可以引导自噬蛋白定位于自噬小体,从而帮助其形成自噬小体双层膜结构的蛋白,也被称为自噬相关蛋白-6(autophagyrelatedgene-6,ATG-6)。主要参与哺乳动物自噬体的早期形成,也可以促进自噬小体水解蛋白。另外Beclin-1存在BH3结构域蛋白,Bcl-2蛋白家族中的Bcl-2、Bcl-xL、Bcl-w能与BH3结构域结合,抑制其抗凋亡作用;Bcl-2蛋白的功能受其蛋白产物Bax和Bcl-xL蛋白的调控。因此,Beclin-1是一个参与自噬与凋亡双重途径的调节因子,它参与调节途径的不同最终决定细胞在外界刺激下是进入自噬还是凋亡。
有文献表明,经凋亡诱导剂处理的过表达Bcl-2细胞中有自噬体大量出现,提示在Bcl-2高表达时会激活自噬[14];在Bcl-2/Bcl-xL过表达的细胞系中,缺血也能够诱导自噬的发生[15];Xu等[16]发现,自噬的激活伴随着Bcl-2蛋白的上调,增加的Bcl-2可能阻止营养剥夺条件下的自噬的过度激活和细胞死亡。Tang等[17]在研究脊髓损伤时发现,损伤大鼠经腹腔注射mTOR抑制剂Rapamycin后能增强自噬蛋白Beclin-1和LC3的表达,促进脊髓损伤神经元和胶质细胞中自噬的发生。其对神经修复的主要发生机制为:自噬的抑制能够抑制Bcl-2的表达,促进Bax的表达,自噬的增强能够促进Bcl-2的表达,抑制Bax的表达。这些结果说明Bcl-2并不是在所有条件下都抑制自噬的激活。所以抗凋亡蛋白Bcl-2家族和自噬之间的关系还需要进一步的研究。
Cystatin C是一种蛋白酶抑制剂,可以抑制mTOR通路诱导功能性自噬,有实验证明对脑损伤有保护作用[18]。在我们的前期研究结果中也发现,

图2 各组大鼠Beclin-1 免疫荧光染色结果(×400)
假手术组 模型组 Cys C低浓度组 Cys C中浓度组 Cys C高浓度组
图3 各组大鼠TUNEL染色结果(×200)
Cystatin C在一定浓度范围内可使脑缺血再灌注损伤大鼠的神经功能缺损症状明显减轻,脑梗死区体积减少(P<0.01),而高浓度的Cystatin C则引起自噬过度激活致脑损伤加重[19]。在本实验中探讨Cystatin C预处理后对Beclin-1和相关凋亡蛋白的影响机制,应用低、中浓度的Cystatin C预处理后,可增强神经细胞自噬蛋白Beclin-1的表达,使神经细胞凋亡数目减少,Bcl-xL的表达增加,Caspase-2的表达降低,从而对损伤的神经细胞起到保护作用;而高浓度Cystatin C预处理后则Bcl-xL的表达降低,Caspase-2的表达升高,神经细胞凋亡数目明显增加,导致脑损伤加重。Bcl-2蛋白及其家族成员在脑缺血再灌注损伤神经元凋亡与自噬的病理机制中起着非常重要的作用,其在不同组织和细胞相关信号通路中所产生的的协调或拮抗作用机制,尚需进一步的研究。找准作用靶点,以此治疗和挽救脑卒中患者的神经功能缺失症状,可能会成为将来临床治疗中新的思路和治疗理念。
[1]陈伟伟,高润霖,刘力生,等. 中国心血管病报告2013概要[J]. 中国循环杂志,2014,29(7):487-488.
[2]Balduini W,Carloni S,Buonocore G. Autophagy in hypoxia-ischemia induced brain injury[J]. J Matern Fetal Neonatal Med,2012,4,25(Suppl 1):30-34.
[3]Tizon B,Sahoo S,Yu H,et al. Induction of autophagy by cystatin C:a mechanism that protects murine primary cortical neurons add neuronal cell lines[J]. PLOS One,2010,5(3):9819.
[4]Lopez E,Ferrer I. Staurosporine-and H-7-induced cell death in SH-SY5Y neuroblastoma cells is associated with caspase-2 and caspase-3 activation,But not with activation of the FAS/FAS-L-caspase-8 signaling pathway[J]. Brain Res Mol Brain Res,2000,85(1/2):61-67.
[5]Cascio C,Guarneri R,Russo D,et al. A caspase-3-dependent pathway is predominantly activated by the excitotoxin pregnenolone sulfate and requires early and late cytochrome c release and cell-specific caspase-2 activation in the retinal cell death[J]. J Neurochem,2002,83(6):1358-1371.
[6]Caballero-Benitez A,Morna J. Caspase activation pathways induced by staurosporine and low potassium:role of caspase-2[J]. J Neurosci Res,2003,71(3):383-396.
[7]Imre G,Heering J,Takeda AN,et al. Caspase-2 is an initiator caspase responsible for pore forming toxin-mediated apoptosis[J]. EMBO J,2012,31:2615-2628.
[8]Lassus P,Opitz-Araya X,Lazebnik Y. Requirement for capsase-2 in stress-induced apoptosis before mitochondrial permeabilization[J]. Science,2002,297(5585):1352-1354.
[9]Lopez-Cruzan M,Sharma R,Tiwari M,et al. Caspase-2 resides in the mitochondria and mediates apoptosis directly from the mitochondrial[J]. Cell Death Discov,2016,2:16005.
[10]Droin N,Bichat F,Rebe C,et al. Involvement of capsase-2 long isoform in Fas-mediated cell death of human leukemic cells[J]. Blood,2001,97(6):1835-1844.
[11]Guo Y,Srinivasula SM,Druilhe A,et al. Capsase-2 induces apoptosis by releasing proapoptotic proteins from mitochondria[J]. J Biol Chem,2002,277(16):13430-13437.
[12]Gabriel B,Sureau F,Casselyn M,et al. Retroactive pathway involving mitochondria in electroloaded cytochrome c-induced apoptosis. Protective properties of Bcl-2 and BcL-xL[J]. Exp Cell Res,2003,289(2):195-210.
[13]Voutsadakis IA. Apoptosis and the pathogenesis of lymphoma[J]. Acta Oncol,2000,39(2):151-156.
[14]Shimizu S,Kanaseki T,Mizushima N,et al. Role of Bcl-2 family proteins in a non-apoptotic programmed cell death depending on autophagy genes[J]. Nat Cell Biol,2004,6:1221-1228.
[15]Degenhardt K,Mathew R,Beaudoin B,et al. Autophagy promotes tumor cell survival and restricts necrosis,inflammation and tumorigenesis[J]. Cancer Cell,2006,10(1):51-64.
[16]Xu HD,Wu D,Gu JH,et al. The pro-survival role of autophagy depends on Bcl-2 under nutrition stress conditions[J]. PLoS One,2013,8(5):e63232.
[17]Tang P,Hou H,Zhang L,et al. Autophagy reduces neuronal damage and promotes locomotor recovery via inhibition of apoptosis after spianl cord injury in rats[J]. Mol Neurobiol,2014,49(1):267-287.
[18]Liu Y,Li J,Wang Z,et al. Attenuation of early brain injury and learning deficits following experimental subarachnoid hemorrhage secondary to Cystatin C:possible involvement of the autophagy pathway[J]. Mol Neurobiol,2014,49(2):1043-1054.
[19]陈 萌,郭 森,王爱乐,等. 抑制mTOR通路对局灶性脑缺血再灌注损伤大鼠自噬的影响[J]. 神经解剖学杂志,2016,32(2):246-250.
EffectsofCystatinCpretreatmentonautophagyproteinBeclin-1andapoptosisrelatedproteinBcl-xL、Caspase-2aftercerebralischemia-reperfusioninrats
CHENMeng,LIANGXiujun,WANGAile,etal.
(DepartmentofElectronMicroscopeofBasicMedicalCollege,Chengde067000,China)
1003-2754(2017)09-0801-06
2017-03-20;
2017-06-20
河北省自然科学青年基金项目(No. H2015406046);承德医学院大学生科研项目(No. 201510)
(1.承德医学院基础医学院电镜室,河北 承德 067000;2.承德医学院基础医学研究所,河北 承德 067000;3.承德市中医院ICU室,河北 承德 067000;4.承德医学院2014级本科,河北 承德 067000)
陈 萌,E-mail:chenmeng05@126.com
R743.3
A
