人源α-synuclein跨细胞转运特性及对神经细胞突起的影响
2017-10-17王庆君景玉宏陈海超马学珠穆继英高丽萍
王庆君, 景玉宏, 陈海超, 马学珠, 穆继英, 高丽萍
人源α-synuclein跨细胞转运特性及对神经细胞突起的影响
王庆君1, 景玉宏2, 陈海超1, 马学珠2, 穆继英2, 高丽萍1
目的确定人源α-synuclein是否能够跨细胞转运,过表达人源α-synuclein对神经细胞突起有何影响。方法建立稳定表达人源α-synuclein的N2a细胞株,通过接触和非接触两种方法观察人源α-synuclein的转运现象,通过测量神经突起长度,评价人源α-synuclein过表达对神经细胞突起生长的影响。结果接触和非接触两种方法均能够观察到人源α-synuclein跨细胞转运,但总体转运率低。过表达人源α-synuclein导致神经细胞突起生长不良。结论人源α-synuclein跨细胞转运现象存在,转运可能受到多因素影响,效率较低。过表达人源α-synuclein蛋白对神经突起有损伤作用。
人源α-synuclein; 朊蛋白样转移; 细胞突起
Abstract:ObjectiveTo confirm whether human derived a-synuclein have ability to transfer across cell to cell. To evaluate the effect of overexpression of human derived a-synuclein on the neurite morphology.MethodsStable N2a cell lines overexpressed human derived α-synuclein were established. Contact and non-contact culture methods were used to investigate the transfer of human derived α-synuclein in vitro. The length of neurite was measured during overexpression of human derived α-synuclein.ResultsThe transfer of α-synuclein could be observed through the contact culture and non-contact culture. However,the efficiency of α-synuclein transfer was low in vitro. Additionally,high expression of human derived α-synuclein inhibited the neurite growth.ConclusionA little of human derived α-synuclein transfers from cell to cell in vitro. Over expression of human derived α-synuclein damages the neurite.
Keywords: Human derived α-synuclein; Prion-like transfer; Neurite
蛋白错误折叠及在细胞或/组织内聚集,参与了神经退行性疾病的发生和发展。其中,α-synuclein过表达及其在脑内聚集形成的包涵体,或路易小体是帕金森病(Parkinson’s disease,PD)的关键病理[1,2]。α-synuclein的聚集对神经细胞突起的生长、突触形成、递质释放及细胞代谢产生多方面影响[3~5],针对α-synuclein聚集过程、分子机制及有效降解的研究形成了PD发病、预防及治疗的关键思路[6,7]。但近年有研究发现α-synuclein具有Prion样特性,能够从最初产生的脑区向其他脑区转移,并在新的脑区产生聚集,形成新的病理样包涵体[8~10]。为了进一步确认这一现象是否稳定存在、α-synuclein转移的比例及其对细胞突起的影响,我们通过构建过表达人源α-synuclein的质粒载体,并以EGFP作为报告基因,利用接触和非接触培养两种模式观察α-synuclein转移情况,并初步定量其转移效率,在此基础上研究了α-synuclein过表达对神经细胞突起的影响。
1 材料和方法
1.1 材料 GV230载体购自上海吉凯基因化学技术有限公司;质粒小抽试剂盒(柱型)购自天根生化科技有限公司;Attractene Transfection Reagent购自QIAGEN公司;X-tremeGENE 9 Transfection Reagent购自Roche公司;MTT购自北京索莱宝科技有限公司;G418购自InvitroGen公司;Anti-α-Synuclein antibody购自Sigma公司;QtrackerR 655 Cell Labeling Kit购自Thermo Fisher公司;DMEM培养基(粉末)购自Sigma公司;小牛血清购自杭州天杭生物科技有限公司。
1.2 细胞培养 N2a(小鼠脑神经瘤细胞)购自中国科学院典型培养物保藏委员会细胞库。培养条件:37 ℃,5% CO2,DMEM培养基(添加10%小牛血清+1%Gln+1%青霉素/链霉素),传代培养。
1.3 载体构建、转染、G418分选、蛋白表达分析
1.3.1 载体构建 正常人SNCA基因过表达载体的构建由上海吉凯基因化学技术有限公司协助完成,主要步骤:GV230载体(见图1A)克隆位点双酶切;PCR扩增SNCA基因片段,双酶切产物进行琼脂糖凝胶电泳分离,回收目的条带;将PCR产物与线性化载体DNA连接后,立即加入至感受态细胞(Top10)中转化;最后对Top10菌落进行PCR鉴定,并将鉴定出的阳性克隆转化子接种培养后测序,确定与目标序列一致。GV230-SNCA-EGFP过表达质粒的Top10甘油菌菌株,保存于-80 ℃。
1.3.2 质粒转染 按1.5×105个/ml的密度将N2a接种于24孔板,接种24 h后,分别用Attractene 转染试剂和X-tremeGENE 9 转染试剂转染48 h后观察,发现Attractene 转染后的N2a细胞变圆,并且部分漂浮,X-tremeGENE 9 转染后的细胞状态良好,最后选用X-tremeGENE 9,并确定X-tremeGENE 9(μl)与DNA(μg)按照4.5∶1的比例作用于N2a时转染效率最高,且对细胞损伤较小。
1.3.3 G418筛选 利用载体的新霉素抗性,采用G418筛选阳性细胞克隆。按1×104个/ml细胞密度将N2a接种于6孔板,培养过夜,更换为含不同浓度G418的培养基(培养基中G418终浓度设置:0 μg/ml、100 μg/ml、200 μg/ml、300 μg/ml、400 μg/ml、500 μg/ml、600 μg/ml、700 μg/ml、800 μg/ml、900 μg/ml、1000 μg/ml),之后2 d更换一次培养基,连续加压培养14 d后,MTT法(设置3重复)检测细胞存活率。最终确定G418的筛选浓度为500 μg/ml。按1.5×105个 /ml细胞密度将N2a接种于24孔板,培养24 h后,采用X-tremeGENE 9转染试剂将空载体和目的载体(含SNCA-EGFP基因)分别转入N2a细胞,转染48 h后更换为含500 μg/ml G418的完全培养基,加压筛选14 h,可得到稳定转染的N2a细胞。之后用含250 μg/ml G418的完全培养基将其扩大培养,用于后期实验。
1.3.4 人源α-synuclein表达水平鉴定 采用Western Blot检测转染了空载体的N2a细胞和转染了含SNCA-EGFP基因载体的N2a细胞中α-synuclein-EGFP融合蛋白的表达情况,确定α-synuclein稳定表达。
1.4 基于Millicell小室的非接触培养模式评价α-synuclein转移 将普通N2a细胞作为受体细胞,接种于24孔板;筛选的稳定表达人源α-synuclein的N2a细胞作为供体细胞,接种于Millicell小室中(见图2A)。Millicell培养小室购自Millipore公司。选择能与24孔板相匹配、孔径为0.4 μm的Millicell培养小室,可保证在共培养过程中,细胞不会通过室膜。共培养24 h后观察。10倍物镜下随机选取9个视野,计数100个受体细胞中出现α-synuclein-EGFP的阳性细胞数。
1.5 基于Qtracker® 655 Cell Labeling的接触培养模式评价α-synuclein转移 将Qtracker® 655 Cell Labeling Kit标记后的N2a细胞作为受体细胞,筛选的稳定表达人源α-synuclein的N2a细胞作为供体细胞,两种细胞按照1∶1的比例共同接种于24孔板中(见图3A)。共培养24 h后观察。10倍物镜下随机选取9个视野,计数100个受体细胞中出现α-synuclein-EGFP的阳性细胞数。
1.6 α-synuclein高表达对N2a细胞突起的影响及评价 稳定表达人源α-synuclein的N2a细胞以及空质粒转染的N2a细胞,24孔板培养24 h后,荧光显微镜下拍照,每个孔在20倍物镜下随机选取9个视野,每个视野下测定3个细胞的突起长度,每组各测量了27个细胞的突起长度。
2 结 果
2.1 α-synuclein质粒转染效率及表达水平分析 质粒DNA抽提,经1%琼脂糖凝胶电泳分离,结果可见对照质粒和携带目标基因的质粒DNA大小符合预期(见图1A和图1B)。经G418筛选后的N2a细胞,荧光显微镜下观察,稳定表达EGFP(见图1C-1D)。收集细胞,经Western Blot鉴定,目标质粒表达人源性α-synuclein水平较高,对照空质粒转染的细胞无人源性α-synuclein表达(见图1G)。
2.2 基于Millicell小室的非接触培养条件下α-synuclein细胞间转移的定性与定量 表达人源α-synuclein的N2a细胞株作为供体细胞,培养于小室内,未经处理的普通N2a细胞作为受体细胞,培养于小室下层,共培养24 h。受体细胞置于荧光显微镜下观察并计数出现EGFP标记的细胞,可见受体细胞中部分细胞被EGFP荧光标记(见图2B和图2C),定量分析9个视野下,100个细胞,出现α-synuclein转移的细胞比例为5%(见图2D)。
2.3 接触培养条件下a-synuclein细胞间转移的定性与定量 表达人源α-synuclein的N2a细胞株作为供体细胞,Qtracker® 655 染色的普通N2a细胞作为受体细胞,首先观察Qtracker® 655 染色的细胞形态,加入Qtracker® 655 培养24 h后,明场下可见细胞形态正常(见图3B),荧光显微镜下可见细胞内出现红色颗粒(见图3C),类似囊泡形态特征。两株细胞1∶1比例混合培养24 h,于荧光显微镜下观察Qtracker® 655 和EGFP共标记细胞,结果可见部分细胞内Qtracker® 655 红色荧光和EGFP的绿色荧光共定位(见图3D和图3E)。对9个视野下,100个细胞观察定量,出现α-synuclein转移比例为7%(见图3F)。
2.4 α-synuclein高表达对神经细胞突起的影响 转染空质粒的N2a细胞培养24 h后,可见细胞突起生长良好(见图4A),表达人源性α-synuclein的N2a细胞培养24 h后,可见细胞突起生长缓慢,变短(见图4B),每组通过测量27个细胞的突起,统计结果显示两组间有统计学差异(见图4C,P<0.05)。
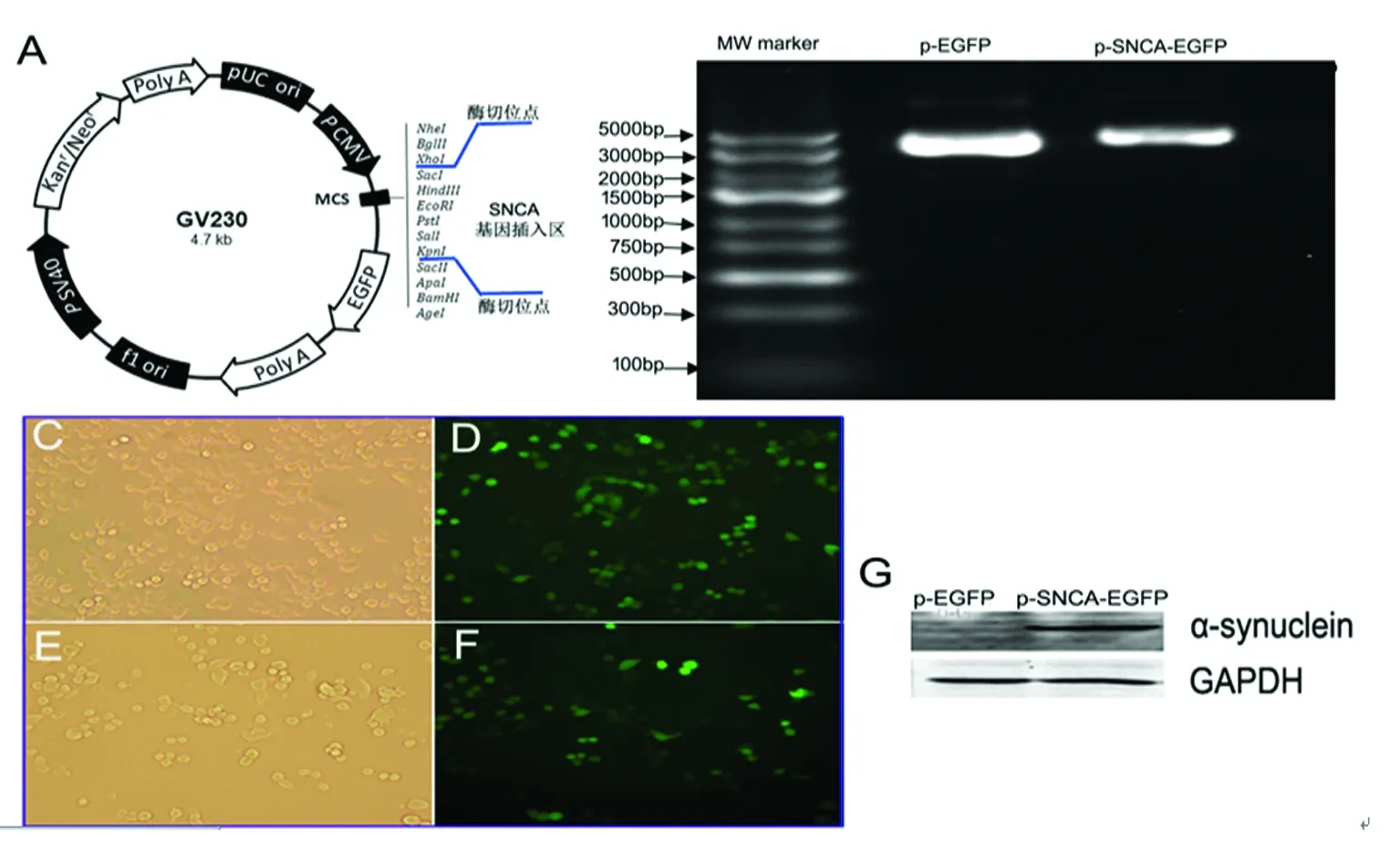
A:质粒图谱及SNCA基因插入位点;B:空质粒及携带SNCA基因的质粒DNA鉴定;C、D:G418筛选的空质粒对照组N2a细胞培养24 h后明场下细胞形态(C)及同一视野下荧光显微镜显示的细胞形态(D);E、F:G418筛选的稳定表达α-synuclein的N2a细胞培养24 h后明场下细胞形态(E)及同一视野下荧光显微镜显示的细胞形态(F),10倍物镜下拍照;G:WB技术检测α-synuclein表达水平,对照组无α-synuclein表达,目标基因组α-synuclein呈高表达
图1 α-synuclein质粒转染效率及表达水平分析

A:基于Millicell小室的非接触培养模式图;B、C:培养24 h后,观察受体细胞内EGFP标记的细胞,B为明场下的细胞形态,C为同一视野下荧光显微镜显示的细胞形态,黑色箭头示意EGFP标记的细胞,20倍物镜下拍照;D:统计显示α-synuclein转移至受体细胞的比例(n=3)
图2 非接触培养下α-synuclein转移分析

A:接触性培养模式图;B、C:Qtracker® 655 细胞染色形态,B为明场下细胞形态,C为同一视野下荧光显微镜显示的细胞形态,20倍物镜下拍照;D、E:接触培养后24 h代表性图片,D为红色荧光下可见Qtracker® 655 染色,E为共标记的细胞,白色箭头示Qtracker® 655 染色细胞,蓝色箭头示EGFP标记细胞,红色箭头示共标记细胞,20倍物镜下拍照;G:统计显示α-synuclein转移至受体细胞的比例n=3
图3 接触培养下α-synuclein转移分析
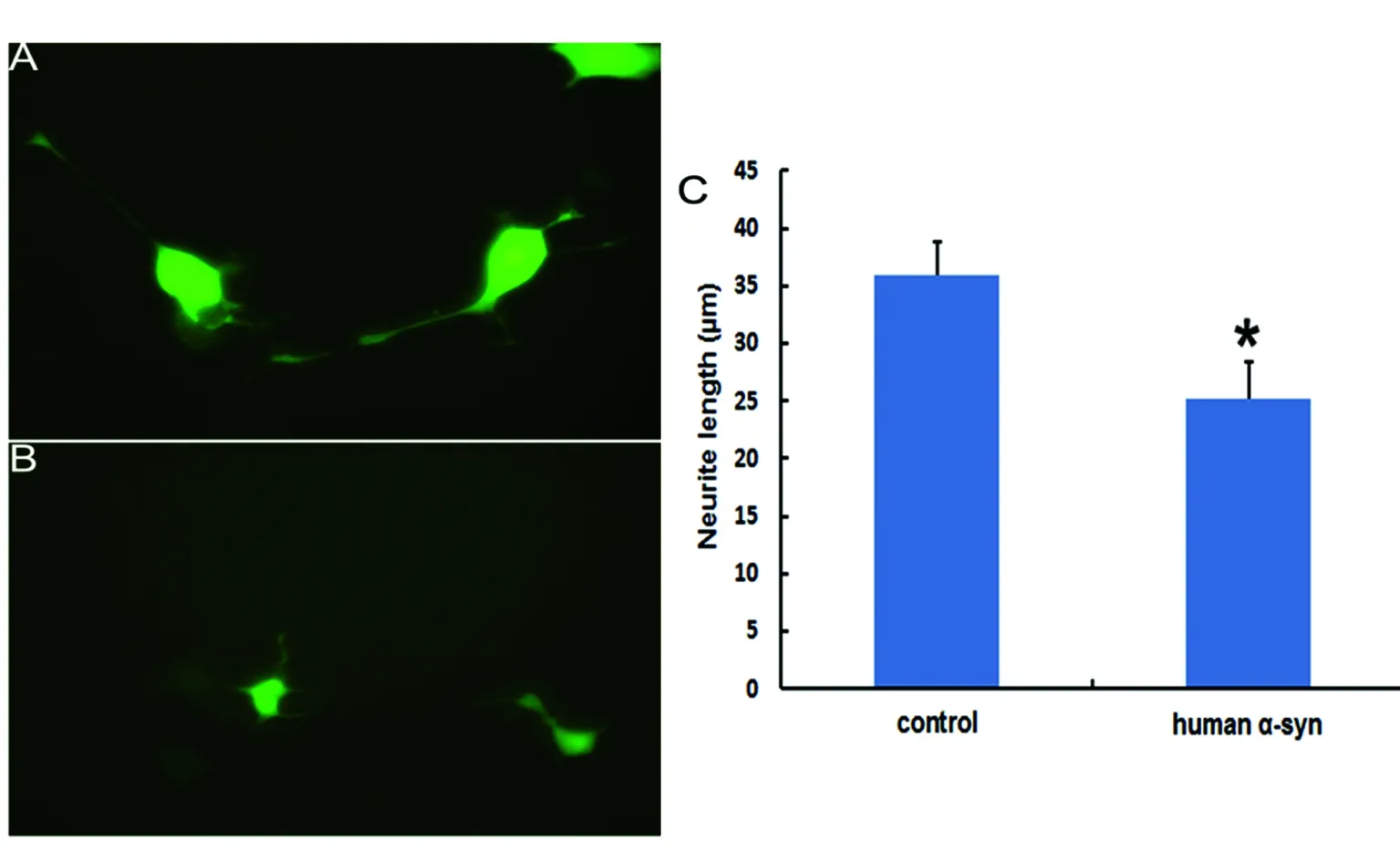
A:空质粒转染N2a细胞突起形态代表图;B:SNCA高表达质粒转染N2a细胞形态图,20倍物镜下拍照;C:两组细胞突起长度测量结果*P<0.05,n=27
图4 α-synuclein高表达对神经细胞突起的影响
3 讨 论
α-synuclein蛋白是一个天然非折叠蛋白,它的N-末端易形成α螺旋结构从而和磷脂结合,表现出膜结合特性。此外,a-synuclein易形成寡聚体,进一步聚集,从而出现β片层和纤维化构象[11]。α-synuclein可以由神经元及其他细胞分泌,在血液及脑脊液中也发现了α-synuclein的单体和寡聚体结构[12,13]。神经元内的α-synuclein主要分布于轴突末端,似乎和递质囊泡的循环有关[14,15],但更多有关α-synuclein的生理作用目前尚不清楚。
首次发现α-synuclein在细胞间转移的证据来自于PD患者去世后的脑结构分析,这些患者在去世的11~22年前曾做过胎儿中脑神经元移植手术,目的希望能够补偿患者中脑黑质多巴胺神经元的丢失。在患者移植的神经组织内发现了路易小体,而在其非移植区的神经细胞内也发现了路易小体的存在,这意味着移植神经元内的路易小体可能来自于患者自身的神经元[16~19]。该发现提出了一个极为重要的问题,α-synuclein及其构成的路易小体是否可以从一个细胞转移到另一个细胞。可能的假说是,由宿主细胞分泌的α-synuclein出现错误折叠,从而形成寡聚体、并聚集形成纤维化结构,从而向其他神经元扩散,在其他神经元内形成路易小体的病理特征,该假说经过Braak及其同事的工作,再次得到部分验证,他们的研究发现家族遗传性PD患者中,α-synuclein可以从周围神经、胃肠道神经及嗅球向脑的特定部位转移[20,21]。但依然无法证明α-synuclein从一个神经元向另一个神经元转移的动态过程及转移机制。
α-synuclein转移的先决条件是什么?是否一定伴随构象的改变,出现何种构象。在转移过程中需要哪些分子参与,目前这些问题尚没有答案。因此我们试图建立人源α-synuclein转移的细胞模型,希望在此模型上研究α-synuclein转移的分子机制,及其在PD病理中的作用。
从我们目前的结果看,接触培养和非接触培养均能观察到α-synuclein转移现象,但转移比例比较低,尚无法判断转移比例低的原因是否因为野生型α-synuclein不易形寡聚体。同时因为在细胞系上开展的实验,可能细胞的耐受程度要大于原代培养的神经细胞。其次,我们无法确定转移的α-synuclein是否就是寡聚体或是纤维化形式。尽管α-synuclein在细胞间转移效率比较低,但依然可见过表达α-synuclein的细胞突起缩短,表现出失营养性改变。这可能意味着α-synuclein过表达导致细胞损伤,代谢异常,损伤后的细胞无法降解α-synuclein,通过胞吐释放到细胞外,这也可能是α-synuclein转移的途径。进一步工作准备在培养的原代神经细胞上,观察野生型和突变型α-synuclein转移的差别,建立更为可靠的细胞模型,开展此研究。
[1]Braak H,Del Tredici K,Rub U,et al. Staging of brain pathology related to sporadic Parkinson’s disease[J]. Neurobiol Aging,2003,24(2):197-211.
[2]Spillantini MG,Crowther RA,Jakes R,et al. Alpha-synuclein in filamentous inclusions of Lewy bodies from Parkinson’s disease and dementia with lewy bodies[J]. Proc Natl Acad Sci U S A,1998,95(11):6469-6473.
[3]Yokota O,Tsuchiya K,Uchihara T,et al. Lewy body variant of Alzheimer’s disease or cerebral type lewy body disease? Two autopsy cases of presenile onset with minimal involvement of the brainstem[J]. Neuropathology,2007,27(1):21-35.
[4]Jensen PH. Functional Defect Conferred by the Parkinson’s Disease-Causing α-Synuclein (Ala30Pro) Mutation[J]. Methods Mol Med,2001,62:67-72.
[5]Norris KL,Hao R,Chen LF,et al. Convergence of Parkin,PINK1,and α-Synuclein on Stress-induced Mitochondrial Morphological Remodeling[J]. J Biol Chem,2015,290(22):13862-13874.
[6]Dhavale DD,Tsai C,Bagchi DP,et al. A sensitive assay reveals structural requirements for alpha-synuclein fibril growth[J]. J Biol Chem,2017,292(22):9034-9050.
[7]欧阳亮,张 岚,刘 博. 帕金森病中的自噬途径与关键药物靶点[J]. 药学学报,2016,51(1):9-17.
[8]Angot E,Steiner JA,Lema Tome CM,et al. Alpha-synuclein cell-to-cell transfer and seeding in grafted dopaminergic neurons in vivo[J]. PLoS One,2012,7(6):e39465.
[9]Kordower JH,Dodiya HB,Kordower AM,et al. Transfer of host-derived alpha-synuclein to grafted dopaminergic neurons in rat[J]. Neurobiol Dis,2011,43(3):552-557.
[10]Hanse C,Angot E,Bergstrom AL,et al. Alpha-synuclein propagates from mouse brain to grafted dopaminergic neurons and seeds aggregation in cultured human cells[J]. J Clin Invest,2011,121(2):715-725.
[11]Sevlever D,Jiang P,Yen SH. Cathepsin D is the main lysosomal enzyme involved in the degradation of alpha-synuclein and generation of its carboxy-terminally truncated species[J]. Biochemistry,2008,47(36):9678-9687.
[12]El-Agnaf OM,Salem SA,Paleologou KE,et al. Alpha-synuclein implicated in Parkinson’s disease is present in extracellular biological fluids,including human plasma[J]. FASEB J,2003,17(13):1945-1947.
[13]El-Agnaf OM,Salem SA,Paleologou KE,et al. Detection of oligomeric forms of alpha synuclein protein in human plasma as a potential biomarker for Parkinson’s disease[J]. FASEB J,2006,20(3):419-425.
[14]Burré J,Sharma M,Tsetsenis T,et al. Alpha-synuclein promotes SNARE-complex assenbly in vivo and in vitro[J]. Science,2010,329(5999):1663-1667.
[15]Nemani VM,Lu W,Berge V,et al. Increased expression of alpha-synuclein reduces neurotransmitter release by inhibiting synaptic vesicle reclutering after endocytosis[J]. Neuron,2010,65(1):66-79.
[16]Li JY,Englund E,Holton JL,et al. Lewy bodies in grafted neurons in subjects with Parkinson’s disease suggest host-to-graft disease propagation[J]. Nat Med,2008,14(5):501-503.
[17]Kordower JH,Chu Y,Hauser RA,et al. Lewy body-like pathology in long-term embryonic nigral transplants in Parkinson’s disease[J]. Nat Med,2008,14(5):504-506.
[18]Li JY,Englund E,Widner H,et al. Characterization of Lewy body pathology in 12-and 16-year-old intrastriatal mesencephalic grafts surviving in a patient with Parkinson’s disease[J]. Mov Disord,2010,25(8):1091-1096.
[19]Kurowska Z,Englund E,Widner H,et al. Signs of degeneration in 12-22-year old grafts of mesencephalic dopamine neurons in patients with Parkinson’s disease[J]. J Park Dis,2011,1(1):83-92.
[20]Braak H,Rüb U,Gai WP,et al. Idiopathic Parkinson’s disease:possible routes by which vulnerable neuronal types may be subject to neuroinvasion by an unknown pathogen[J]. J Neural Transm,2003,110(5):517-536.
[21]Hawkes CH,Del Tredici K,Braak H. Parkinson’s disease:a dual-hit hypothesis[J]. Neuropathol Appl Neurobiol,2007,33(6):599-614.
Transferofhumanderivedα-synucleinacrosscelltocellandeffectsonneurite
WANGQingjun,JINGYuhong,CHENHaichao,etal.
(InstituteofBiochemistryandMolecularBiology,SchoolofBasicMedicalSciences,LanzhouUniversity,Lanzhou730000,China)
1003-2754(2017)09-0772-05
2017-07-10;
2017-09-01
国家自然科学基金(No. 81570725);甘肃省中医药管理局科研课题(GZK-2014-81)
(1.兰州大学基础医学院生物化学与分子生物学研究所,甘肃 兰州 730000;2.兰州大学基础医学院人体解剖与组织胚胎学研究所,甘肃 兰州 730000)
高丽萍,E-mail:gaolp@lzu.edu.cn
R742.5
A
