膀胱癌临床血清样本N-连接糖链的表达分析
2017-10-16王雯雯孙承文杨刚龙
王雯雯,孙承文,杨刚龙,关 锋
(1. 江南大学 生物工程学院 糖化学与生物技术教育部重点实验室, 无锡 214122; 2. 江南大学 附属医学院泌尿科, 无锡 214122)
膀胱癌临床血清样本N-连接糖链的表达分析
王雯雯1,孙承文2,杨刚龙1,关 锋1
(1. 江南大学 生物工程学院 糖化学与生物技术教育部重点实验室, 无锡 214122; 2. 江南大学 附属医学院泌尿科, 无锡 214122)
膀胱癌是发生在膀胱黏膜上的恶性肿瘤,是最常见的泌尿系统肿瘤之一。国内外研究表明糖链表达的异常改变与肿瘤的发生、发展和转移紧密关联。分析膀胱癌临床样本糖链的表达变化可以为膀胱癌研究提供有效的分析手段,有助于发现潜在的临床早期诊断标志物。首先利用乙酰肼修饰糖链唾液酸,用PNGase F酶将糖蛋白质N-连接糖链释放出来,通过基质辅助激光解析电离飞行时间质谱(MALDI-TOF/TOF-MS)技术对20例膀胱癌血清,11例正常人血清中糖蛋白N-连接糖链进行相对定量分析。共鉴定出42种N-连接糖链结构,其中15种N-连接糖链在两组样本中含量差异明显。此外,通过分析不同类型的糖链在两组临床样本中的分布差异,发现唾液酸化、复合型的N-连接糖链在膀胱癌血清中呈现显著升高的趋势,而高甘露糖型、平分型N-连接糖链表达呈下降趋势,说明这些糖链结构的表达变化与膀胱癌的发生有关,从而有助于进一步阐明膀胱癌发生过程中糖链相关的分子机理,并可为膀胱癌的早期诊断、恶性演进和转移预测提供数据支持。
膀胱癌;血清;N-连接糖链;生物标志物;MALDI-TOF/TOF-MS
AbstractBladder cancer is one of the most common cancers and which occurs in the bladder mucosa.The aberrant changes of glycans have been shown to be associated with tumorigenesis, tumor progression and metastasis. The study focused on structures and functions of tumor-specific glycans was useful for the discovery of new candidate biomarkers of bladder cancer. In this study, N-glycans in glycoproteins in 20 bladder cancer and 11 normal samples were released by PNGase F, and sialic acids were modified by acetohydrazide. A total of 42 N-glycan structures were identified and 15 N-glycans were thought to be candidate biomarkers. It indicated that complex type and sialylation type N-glycans were increased significantly, while the high-mannose type and bisecting N-glycans were decreased significantly in bladder cancer sera. These findings showed the expression of glycan structure is associated with the occurrence of bladder cancer, which is important to reveal the glycan mechanism in the development of bladder cancer. The differential glycans could be useful for the early diagnosis.
Keywordsbladder cancer; serum; N-linked glycan; biomarkers; MALDI-TOF/TOF-MS
膀胱癌(Bladder cancer)指发生在膀胱黏膜上的恶性肿瘤,它是世界范围内最常见的恶性肿瘤之一[1]。膀胱癌大多为膀胱尿路上皮癌,膀胱尿路上皮癌根据不同的分子特征和临床结果分为非肌层浸润性和肌层浸润性,低级的非肌层浸润性肿瘤复发频繁,但很少发展为浸润性,而肌层浸润性肿瘤通常需要重新诊断并且经常转移[2]。目前,膀胱癌已有的生物标志物如尿纤维蛋白原(FB)、纤维蛋白降解产物(FDP)、细胞核基质蛋白22(NMP22)、膀胱肿瘤抗原(BTA)等的敏感度不高且易受到泌尿系统良性疾病的影响[3]。膀胱镜检能够灵活的检查出膀胱肿瘤,特异性高,但这是一项繁重的过程且价格昂贵,对级别低的肿瘤灵敏度低,膀胱癌患者将需要进行多年的定期监测[4]。因此,膀胱癌的早期诊断、复发监测以及预后判断都急需一种高灵敏度、高特异性的方法。
糖基化是最常见的翻译后修饰反应,且比磷酸化更频繁。大多数哺乳动物的蛋白质都发生了糖基化且分布广泛[5]。糖基化导致糖蛋白各种功能的变化,包括细胞表面受体和黏附分子如钙黏蛋白、整合蛋白的变化,这些变化赋予肿瘤细胞独特的表型特征。糖基化修饰大多由细胞高尔基体内不同的糖基转移酶催化而成,这些酶催化糖复合物(如糖蛋白、糖脂、蛋白聚糖)的糖基化。负责糖基化的糖基转移酶和糖苷酶是在生命的发育和生理中必不可少的。糖基转移酶的活性和基因表达受生理环境的影响,包括癌症对其表达水平产生的影响,而糖基转移酶表达的高低将会影响糖基化效率[6]。例如,唾液酸化N-连接糖链高表达与唾液酸化糖链合成相关的唾液酸糖基转移酶高表达有关,所以研究N-连接的糖型变化也为研究糖基转移酶的分子机制提供理论基础。
糖组学是对糖在生物学上表达的综合研究,是一种简单而又高度灵敏的诊断疾病的发生与发展的新兴工具。它为认识和有效治疗疾病提供信息,现在糖组学领域主要研究人类健康和疾病的重要性,特别是细胞膜蛋白N-糖基化和癌症之间的联系[7]。近年来,糖组学应用于多种癌症机制及生物标志物的研究,利用多种技术结合生物信息学解析糖链结构,定量并比较癌症和对照组之间糖链的差异,为研究癌症的发生和发展机制提供理论基础,并发现一些特异性生物标志物,应用于癌症的早期诊断和治疗。Bones等用糖组学方法分析胃癌病人和正常人血清,发现sialyl Lewis X (SLex)糖链在胃癌中显著增加,可以作为胃癌的潜在标志物[8]。Miyoshi等利用凝集素纯化技术、SDS-PAGE和质谱发现岩藻糖化的结合珠蛋白是胰腺癌的生物标志物[9]。
利用糖组学技术研究膀胱癌已有报道,但大多是利用膀胱癌细胞株和癌症标本进行研究且研究主要集中在mRNA编码的糖基转移酶表达水平,没有对于糖链的表达种类和丰度变化进行深入研究。例如:Ambrose等利用凝集素亲和色谱、LC-MS/MS等方法检测膀胱癌病人尿液中糖蛋白,但用凝集素富集尿液中糖蛋白的方法不能准确测定糖基化的变化[10]。Takuechi等利用糖印迹、质谱等方法分析了膀胱癌血清中的O-连接糖链,发现膀胱癌中唾液酸化糖链增加[11]。本实验室前期研究已经对不同病理状态的膀胱上皮细胞的糖组进行了相对定量分析,发现细胞中的唾液酸型糖链呈显著上升趋势[12]。由于在细胞培养中细胞具有去分化、不稳定性等缺点,本研究进一步采用20个膀胱癌血清样本和11个正常人血清样本,用乙酰肼化学法分离糖蛋白,再用酶解的方法分离糖链进行质谱鉴定,对膀胱癌血清中糖蛋白N-连接糖链变化情况进行分析,以期对膀胱癌的诊断或治疗提供理论依据。
1 材料与方法
1.1 材料
膀胱癌血清临床样本由无锡市第四人民医院提供,实验室-80℃保存。膀胱癌血清样本共31例,其中包括癌症血清20例,正常人血清11例,正常人的年龄在40岁以上(与膀胱癌病人的年龄基本一致)。
BCA蛋白检测试剂盒购自碧云天生物技术研究所;盐酸(HCl)购于国药集团(上海)化学试剂公司;离心超滤管Amicon Ultra-0.5 10 ku购于美国 Millipore公司;PNGase F酶购自美国New England Biolabs公司;尿素(Urea)、乙酰肼(Acethydrazide)、EDC( N-(3-Dimethylaminoproply) -N’-ethylcarbodlimide hydrochloride)、二硫苏糖醇(DTT)、碘乙酰胺(IAM)、正丁醇(1-Butanol)、甲醇(Methanol)、碳酸氢铵(NH4HCO3)、2,5-二羟基苯酸乙酯(DHB)和 Sepharose CL-4B(琼脂糖凝胶)购于美国Sigma-Aldrich公司。
1.2 方法
1.2.1 膀胱癌血清样本中蛋白的提取和浓度测定
采集膀胱癌病人的血清于抗凝管中,室温静置30 min,待血清凝集后,1000~2000 r/min冷冻离心15 min分层,勿打乱分层效果,吸取液体部分,50 μL分装血清,避免反复冻融,保存于-80℃,用BCA蛋白浓度测定试剂盒测定蛋白浓度,取2 mg血清蛋白进行下一步实验。
1.2.2 样品中蛋白质的变性处理
取2 mg血清蛋白溶液于已加入200 μL 8 mol/L尿素的10 ku超滤管中,12 000 r/min 离心15 min。弃去流出液,加入200 μL的8 mol/L尿素12 000 r/min离心15 min。弃去流出液,加入200 μL的10 mmol/L DTT溶液,于干式恒温器中56℃ 孵育45 min。反应结束后,12 000 r/min 离心10 min。弃去流出液,加入200 μL 20 mmol/L IAM溶液,混匀后避光静置反应30 min。反应完成后,12 000 r/min 离心15 min,弃去流出液。加入150 μL超纯水,充分混匀,12 000 r/min离心15 min,弃去流出液,重复3次,清洗掉溶液中的IAM避免影响之后的反应。
1.2.3 糖链中唾液酸的乙酰肼修饰及释放
加入100 μL 1 mol/L乙酰肼,20 μL 1 mol/L盐酸,20 μL 2 mmol/L EDC,将超滤管置于120 r/min摇床保证蛋白悬浮反应,于室温下反应4 h。反应完成后,12 000 r/min离心10 min,弃去流出液。加入150 μL 40 mmol/L NH4HCO3溶液,12 000r/min 离心10 min。弃去流出液,用NH4HCO3溶液重复清洗3次。加入300 μL 40 mmol/L NH4HCO3溶液,2 μL PNGaseF,37 ℃静置孵育12 h,12 000 r/min 离心15 min,加入200 μL超纯水重复清洗1次,收集流出液,冻干。
1.2.4 N-连接糖糖链的纯化
分别向1.5 mL的离心管中加入100 μL Sepharose 4B和体积比为1∶1的甲醇/水溶液1 mL,10 000 r/min离心5 min,弃上清,重复洗2次。再向离心管中加入5∶1∶1(V/V/V)的正丁醇/甲醇/水溶液1 mL,10 000 r/min离心5 min,弃上清,重复清洗2次。向冻干的糖链样品中加入500 μL 5∶1∶1(V/V/V)的正丁醇/甲醇/水溶液,上样至装有Sepharose 4B的离心管中,于80 r/min摇床室温振荡反应1 h。10 000 r/min离心5 min,弃上清,用5∶1∶1(V/V/V)的正丁醇/甲醇/水溶液重复清洗3 次。再各加入1∶1(V/V) 甲醇/水溶液1 mL,于140 r/min摇床室温振荡反应30 min,10 000 r/min离心5 min,收集上清液,1∶1 (V/V)甲醇/水溶液1 mL重复离心1次,合并收集的样品并于冷冻干燥仪中冻干。
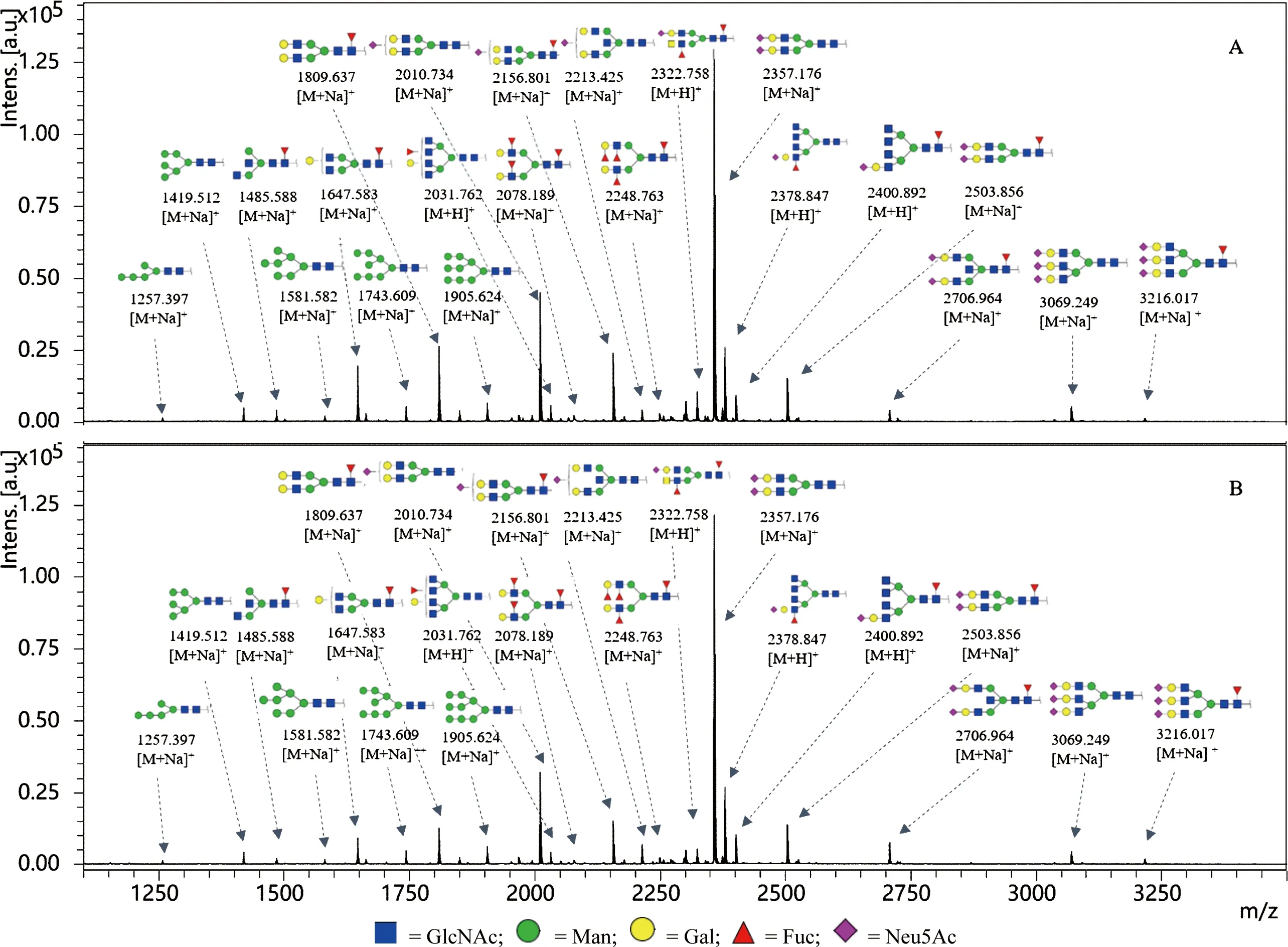
图1膀胱癌和正常人血清中N-连接糖链一级质谱图
Fig 1 MALDI-TOF-MS spectra of N-glycans in normal human and bladder cancer sera Partial information for the N-linked glycans of normal human serum (A) and bladder cancer serum (B)
A:正常人; B:膀胱癌病人
1.2.5 N-连接糖链的质谱检测及数据分析
用5 μL甲醇∶水(1∶1,V/V)溶解糖链,混匀,2 μL上样至MTP Anchorchip 384 点的靶板上;待样品干燥结晶后,再加1 μL含0.1 mmo/L NaCl 的DHB 基质,干燥结晶;用MALDI-TOF/TOF-MS(UltrafleXtreme,Bruker Daltonics)进行检测。一级质谱方法参数如下:离子模式,阳离子;离子源1,7.50 kV;离子源2,6.75 kV,反射电压1,29.5 kV;反射电压2,13.95 kV;LIFT1,19 kV;LIFT2,3.7 kV。激发光源为N2激光(337 nm),分子质量检测范围为900~3500 u。从一级图谱中选择质谱峰进行二级质谱分析,其分析方法参数如下:离子源1,25 kV;离子源 2,22.40 kV;反射电压1,26.45 kV;反射电压2,13.35 kV;LIFT1,19 kV;LIFT2,3.7 kV。分子质量检测范围为900~3500 u。利用FlexAnalysis 软件结合Glycoworkbench 2 软件手动分析糖链结构,选择GlycomeDB 数据库,离子选择[M+Na]+和[M+H]+。利用GraphPads Prism 5 软件,对目标糖链进行统计及t检验分析,以P< 0.05为差异有统计学意义。
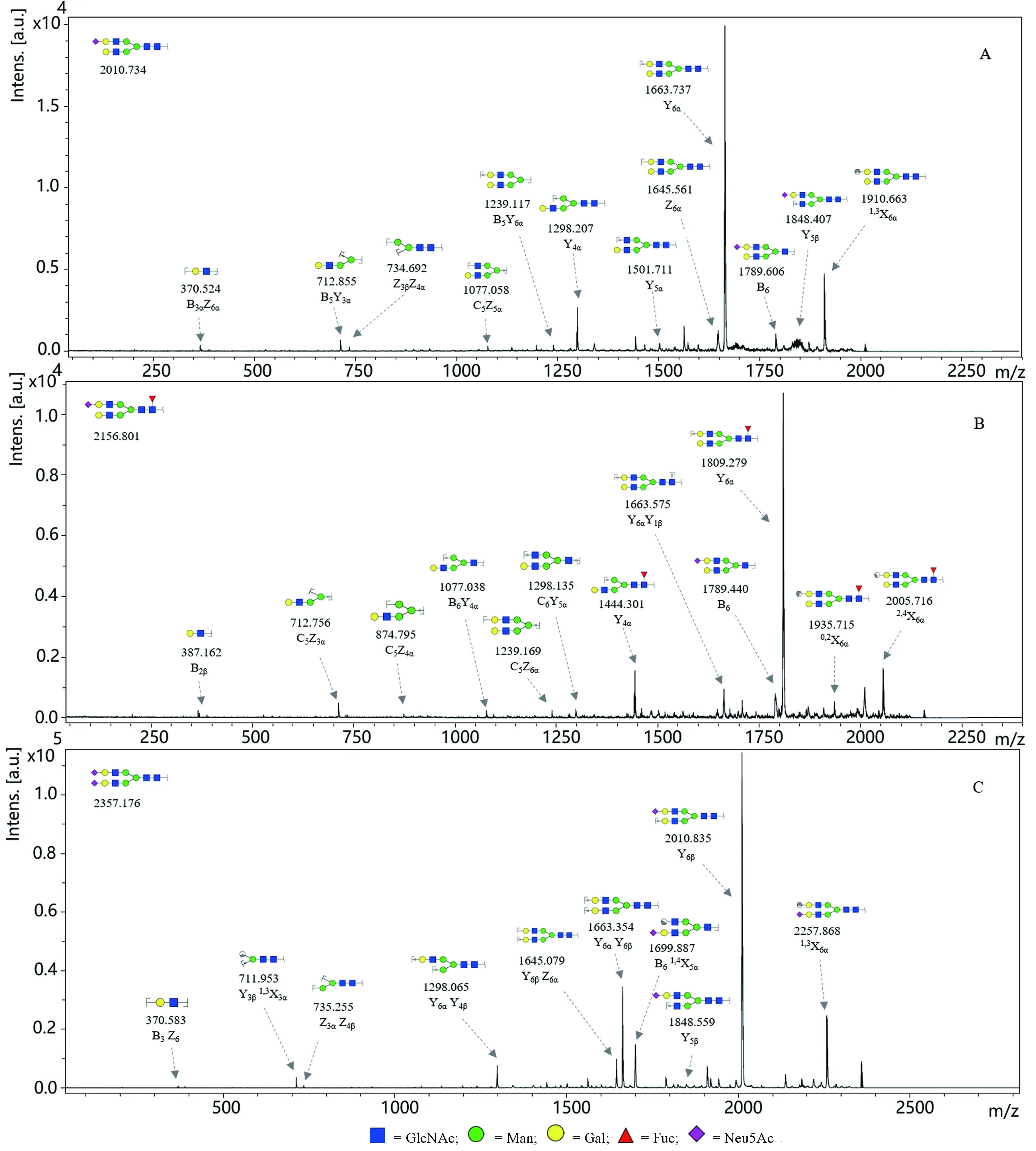
图2膀胱癌和正常人血清中N-连接糖链的二级质谱图
Fig 2 MALDI-TOF/TOF-MS/MS spectra of N-glycans in normal human and bladder cancer sera
A:质荷比为2010.734的糖链的二级谱图;B:质荷比为2156.801的糖链的二级谱图;C:质荷比为2357.176的糖链的二级谱图
2 结果与分析
2.1 血清临床样本中N-连接糖链组图谱分析及结构解析
由于人体血液系统包含所有组织,而血清是肿瘤细胞和组织随时间变化的信息库。蛋白质的糖基化修饰与肿瘤的发生发展密切相关,利用MALDI-TOF/TOF-MS对两组临床样本的N-糖链样品进行检测,其中包括膀胱癌病人血清20例,正常人血清11例。由于个体差异,使得各糖链出现频率不同。将样品分为正常组和膀胱组,某个糖链在各组中偶然出现,则不具有统计学意义,所以选取出现概率不小于50%的糖链结构进行鉴定和解析,一级谱图如图1,二级谱图如图2。利用一级质谱检测糖链样品获得糖链的分子质量及相对丰度,参考GlycoWorkbench软件中的GlycomeDB 糖链数据库,推断可能出现的所有糖链结构通过二级质谱获得不同糖链结构的断裂结构,并结合已鉴别的人类细胞中N-连接糖链结构特点,从而推断出糖链的完整结构。共鉴定42个N-连接糖链结构,然后通过质谱检测到的质谱峰面积比值(Area ratio)进行相对定量分析,以确定该糖链在癌症组和正常组中的表达水平结果如表1。

表1 膀胱癌血清和正常人血清N-糖链结构分析结果
续表1(Continued table 1)
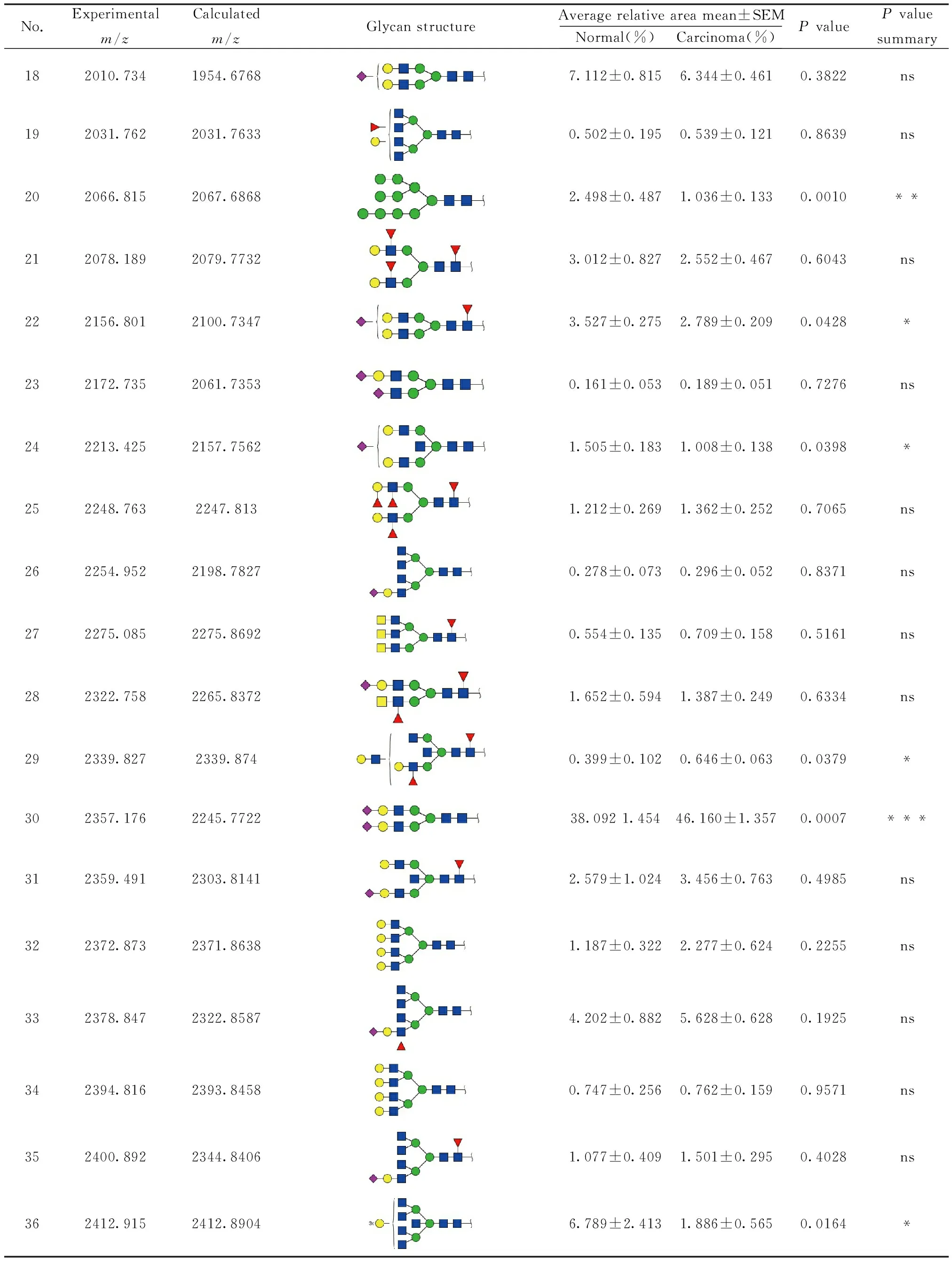
No.Experimentalm/zCalculatedm/zGlycanstructureAveragerelativeareamean±SEMNormal(%)Carcinoma(%)PvaluePvaluesummary182010.7341954.67687.112±0.8156.344±0.4610.3822ns192031.7622031.76330.502±0.1950.539±0.1210.8639ns202066.8152067.68682.498±0.4871.036±0.1330.0010**212078.1892079.77323.012±0.8272.552±0.4670.6043ns222156.8012100.73473.527±0.2752.789±0.2090.0428*232172.7352061.73530.161±0.0530.189±0.0510.7276ns242213.4252157.75621.505±0.1831.008±0.1380.0398*252248.7632247.8131.212±0.2691.362±0.2520.7065ns262254.9522198.78270.278±0.0730.296±0.0520.8371ns272275.0852275.86920.554±0.1350.709±0.1580.5161ns282322.7582265.83721.652±0.5941.387±0.2490.6334ns292339.8272339.8740.399±0.1020.646±0.0630.0379*302357.1762245.772238.0921.45446.160±1.3570.0007***312359.4912303.81412.579±1.0243.456±0.7630.4985ns322372.8732371.86381.187±0.3222.277±0.6240.2255ns332378.8472322.85874.202±0.8825.628±0.6280.1925ns342394.8162393.84580.747±0.2560.762±0.1590.9571ns352400.8922344.84061.077±0.4091.501±0.2950.4028ns362412.9152412.89046.789±2.4131.886±0.5650.0164*
续表1(Continued table 1)

No.Experimentalm/zCalculatedm/zGlycanstructureAveragerelativeareamean±SEMNormal(%)Carcinoma(%)PvaluePvaluesummary372503.8562391.83012.935±0.3092.772±0.2110.6582ns382559.9912448.85160.453±0.1340.128±0.0490.0101*392706.9642594.90951.033±0.1341.126±0.1320.6505ns402722.0832610.90440.536±0.0480.499±0.0440.5948ns413069.2492901.99981.935±0.2862.281±0.3220.4822ns423216.0173048.05770.466±0.1480.839±0.1000.0399*
ns: Means of no significant
2.2 膀胱癌和正常人血清中具有明显差异的N-连接糖链的分析
利用GraphPads Prism 5软件,对得到的42个糖链在不同样品组中的相对面积进行统计分析,P值在统计学上代表显著性,P值的结果≤0.05被认为是统计学意义的边界线,结果0.05≥P>0.01被认为是具有统计学意义,而0.01≥P≥0.001被认为具有高度统计学意义。根据P值的范围判断糖链在膀胱癌和正常人中差异的显著程度。表达差异为P< 0.05的糖链的质荷比分别为1485.588、1663.590、2156.801、2213.425、2339.827、2412.915、2559.991、3216.017,表达差异为P< 0.01的糖链的质荷比分别为1647.5865、1703.692、1809.637、1865.656、2066.815,表达差异为P< 0.001的糖链的质荷比为1541.692、2357.176,统计学差异如图3所示。
2.3 不同糖型的N-连接糖链在两组样本中的比较分析
将鉴定到的42 种N-连接糖链分为高甘露型糖链、平分型糖链、杂合型糖链、复合型糖链、二天线型糖链、三天线型糖链、四天线型糖链、唾液酸化糖链和岩藻糖化糖链9类,累加每个样本中各类型糖链相对峰面积的值。利用GraphPad Prism 5 软件对膀胱组和正常组的不同糖型分别进行统计学分析。从表2中可以看出复合型糖链、唾液酸化糖链在膀胱癌中有明显的上调趋势,而高甘露糖型、平分型糖链在膀胱癌中呈显著下降趋势。此外,杂合型、岩藻糖型、二天线型、三天线型和四天线型糖链在正常人和膀胱癌病人中没有发现明显的变化。由此可以推测出,高甘露糖型、平分型、复合型糖链、唾液酸化糖链与膀胱癌的发生过程密切相关。而不同糖型的变化与糖链合成相关的酶的表达有关,这为研究相关糖基转移酶表达的变化提供了信息基础。
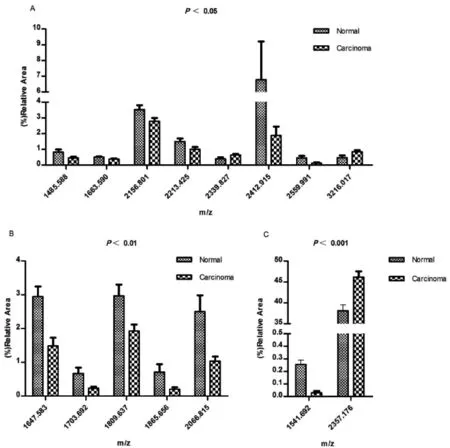
图3 不同组样本中差异N-糖链的 t-test分析图
A:P< 0.05的糖链;B:P< 0.01的糖链;C:P< 0.001的糖链
3 讨论
糖类和蛋白质组成的糖复合物通过复杂的分子机制,包括直接的和间接的聚糖识别糖复合物的构象和表达而发挥其生物学功能。多糖能够被糖蛋白直接识别,糖蛋白和聚糖的相互作用可促进细胞黏附、胞外基质的相互作用、细胞信号传导、蛋白折叠和内/外靶向细胞器等过程[13]。聚糖在癌症中的作用即聚糖在糖基化中的改变调节癌症的发生和发展,聚糖作为重要的生物标志物为治疗和干预癌症提供一组特异的目标标志物[14]。根据细胞表面的糖链结构的变化能够预测癌症的发生与发展。例如,O-连接糖链的水平升高(T抗原)预示着某些类型癌症的存活率较低[15]。N-羟乙酰神经氨酸(Neu5Gc)与人类细胞中唾液酸N-乙酰神经氨酸(Neu5Ac)具有一个氧原子的差别[16],而Neu5Gc不能在人体内合成,往往是通过摄入外源肉类而积累获得,因此Neu5Gc含量的增加伴随抑制N-羟乙酰神经氨酸的抗体增加,因此,Neu5Gc抗体的表达可作为肿瘤生物标志物[17]。

表2 不同类型糖链在两种临床样本中含量的t test分析结果
ns: Means not significant
本研究利用质谱技术对癌症组和正常组的N-连接糖链进行相对定量分析,获得N-连接糖链的谱图,鉴定出42种N-连接糖链。通过对两组临床样本的相对面积进行比较,确定15个N-连接糖链在膀胱组和正常组的表达差异,为膀胱癌发现新的生物标志物提供理论基础。人体唾液酸水平的异常升高往往与肿瘤的发生发展密切相关,测定血清中的唾液酸含量对恶性肿瘤的早期诊断与预后具有重要的临床价值。本研究利用乙酰肼修饰糖链唾液酸,对糖链上的唾液酸进行了保护。将鉴定到的糖链进行分类,累加每个样本中各类型糖链相对峰面积的值,对获得的糖链结构进行糖型分析后发现,高甘露糖型和平分型糖链的整体表达水平在膀胱癌中显著下降,而复合型糖链、唾液酸化糖链则在膀胱癌中有明显的上调趋势。糖基化大多是由细胞高尔基体中不同的糖基转移酶催化的,糖基转移酶的活性和基因表达受癌症影响。因此,推测唾液酸化N-连接糖链在膀胱癌血清中高表达与唾液酸化糖链合成相关的唾液酸糖基转移酶的高表达有关。综合前期工作和以上研究结果,细胞和血清中唾液酸呈显著上升趋势,推测唾液酸化糖链的高表达与唾液酸化糖链合成相关的唾液酸糖基转移酶高表达有关,这为研究唾液酸分子生物学提供了理论基础。
[1]BARNES S C, LAWLESS B M, SHEPHERD D E T, et al. Viscoelastic properties of human bladder tumours [J]. J Mech Behav of Biomed Mater, 2016, 61: 250-257.
[2]KNOWLES M A, HURST C D. Molecular biology of bladder cancer: new insights into pathogenesis and clinical diversity [J]. Nat Rev Cancer, 2015, 15(1): 25-41.
[3]张丽秀, 赵金匣, 王志平. 膀胱癌肿瘤标志物的研究进展 [J]. 国际检验医学杂志, 2015, 36(9): 1267-1269.
[4]SOLOWAY M S. EAU guidelines on non-muscle-invasive urothelial carcinoma of the bladder [J]. Eur Urol, 2008, 54(2): 303-314.
[5]ZIELINSKA D F, GNAD F, WISNIEWSKI J R, et al. Precision mapping of an in vivo N-glycoproteome reveals rigid topological and sequence constraints [J]. Cell, 2010, 141(5): 897-907.
[6]TANIGUCHI N, KIZUKA Y. Glycans and cancer: role of N-glycans in cancer biomarker, progression and metastasis, and therapeutics [J]. Adv Cancer Res, 2015, 126:11-51.
[7]ADAMCZYK B, THARMALINGAM T, RUDD P M. Glycans as cancer biomarkers [J]. Biochim Biophys Acta , 2012 , 1820(9): 1347-1353.
[8]BONES J, BYRNE J C, O′DONOGHUE N, et al. Glycomic and glycoproteomic analysis of serum from patients with stomach cancer reveals potential markers arising from host defense response mechanisms [J]. J Proteome Res, 2010, 10(3): 1246-1265.
[9]MIYOSHI E, MAEKAWA T, UEDA M, et al. A strategy for detecting high-risk groups for pancreatic cancer with glycol-biomarkers [J]. Cancer Res, 2016, 76(14): 3122.
[10]AMBROSE S R, GORDON N S, GOLDSMITH J C, et al. Use of aleuria alantia lectin affinity chromatography to enrich candidate biomarkers from the urine of patients with bladder cancer[J]. Proteomes, 2015, 3(3): 266-282.
[11]TAKUECHI M, AMANO M, KITAMURA H, et al. N- and O-glycome analysis of serum and urine from bladder cancer patients using a high-throughput glycoblotting method[J]. J Glycomics Lipidomics, 2013, 3(108): 1-8.
[12]杨刚龙, 张甲戌, 刘昌梅, 等. 不同转移潜能膀胱癌细胞糖组相对定量分析 [J]. 生物化学与生物物理进展, 2015, 42(12): 1144-1154.
[13]CUMMINGS R D, PIERCE J M. The challenge and promise of glycomics [J]. Chem & Biol, 2014, 21(1): 1-15.
[14]PINHO S S, REIS C A. Glycosylation in cancer: mechanisms and clinical implications [J]. Nat Rev Cancer, 2015 , 15(9): 540-555.
[15]OHTSUBO K, MARTH J D. Glycosylation in cellular mechanisms of health and disease [J]. Cell, 2006, 126(5): 855-867.
[16]VARKI A. Uniquely human evolution of sialic acid genetics and biology [J]. Proc Natl Acad Sci U S A, 2010, 107(2): 8939-8946.
[17]PADLER-KARAVANI V, HURTADO-ZIOLA N, PU M, et al. Human xeno-autoantibodies against a non-human sialic acid serve as novel serum biomarkers and immunotherapeutics in cancer [J]. Cancer Res, 2011, 71(9): 3352-3363.
Analysis of N-linked glycans in bladder cancer
WANG Wen-wen1, SUN Cheng-wen2, YANG Gang-long1, GUAN Feng1
(1. Key Laboratory of Carbohydrate Chemistry & Biotechnology, Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi 214122; 2. Department of Urology, Affiliated Hospital of Jiangnan University, Wuxi 214122, China)
R737.14
A
2095-1736(2017)05-0007-08
2016-09-02;
2016-09-14
国家自然科学基金(81672537); 国家自然科学基金(81402115)
王雯雯,硕士研究生,专业方向为轻工技术与工程,E-mail: 6140206015@vip.jiangnan.edu.cn
关 锋,博士,教授,研究方向为糖生物学,E-mail: fengguan@jiangnan.edu.cn
doi∶10.3969/j.issn.2095-1736.2017.05.007
