低氧诱导引发乳腺肿瘤细胞MDA-MB-231 N-糖链表达差异研究
2017-10-16王晨星杨刚龙刘昌梅
王晨星, 郭 佳, 杨刚龙, 刘昌梅, 关 锋
(江南大学 生物工程学院 糖化学与生物技术教育部重点实验室, 无锡 214122)
低氧诱导引发乳腺肿瘤细胞MDA-MB-231 N-糖链表达差异研究
王晨星, 郭 佳, 杨刚龙, 刘昌梅, 关 锋
(江南大学 生物工程学院 糖化学与生物技术教育部重点实验室, 无锡 214122)
低氧是肿瘤组织中常见的病理现象之一,低氧微环境能改变细胞内葡萄糖代谢途径,增加胞内葡萄糖摄取,提高核苷酸糖含量。以人源恶性乳腺肿瘤细胞MDA-MB-231为研究对象,发现低氧培养较常氧培养的细胞形态呈纤维化,细胞迁移能力提高,上皮细胞标志物β-catenin表达下调,间质细胞标志物fibronectin表达上调,说明低氧促进了细胞发生上皮间质转化。利用基质辅助激光解析电离飞行时间质谱(MALDI-TOF-MS)比较低氧前后细胞内N-糖链表达差异,发现常氧和低氧培养MDA-MB-231细胞中均鉴定到17种N-糖链结构,但糖链丰度存在差异;且在低氧培养细胞中高甘露糖型、复合型中四天线型N-糖链表达升高,而杂合型、平分型、复合型(包括二天线型和三天线型)、岩藻糖化和唾液酸化N-糖链的表达降低。凝集素Con A和LCA细胞荧光染色结果与质谱分析一致。表明低氧可改变乳腺肿瘤细胞中N-糖链的表达,为进一步寻找肿瘤特征性糖链、探索低氧诱导N-糖链表达差异的分子机理提供前期基础。
低氧;上皮间质转化;MALDI-TOF/TOF-MS;N-糖链
AbstractTumor hypoxia is a common pathological feature in many cancers. Hypoxic microenvironments dramatically shift the pattern of intracellular glucose metabolism, which increase glucose uptake and nucleotide sugar levels. In this study, hypoxia-induced malignant breast tumor (MDA-MB-231) cell model was established. Under hypoxia conditions, MDA-MB-231 cells showed the fibrosis morphology. Expression level of β-catenin in hypoxia-treated cells was reduced, fibronectin was increased, and cell motility was enhanced, which indicated that hypoxia induces the epithelial-mesenchymal transition. The structures of N-glycans from normoxia and hypoxia-treated cells were further analyzed by matrix-assisted laser desorption ionization time of flight mass spectrometry (MALDI-TOF-MS). Seventeen N-glycans were differentially expressed in normoxia and hypoxia-treated MDA-MB-231 cells. The high-mannose and tetra-antennary type of N-glycans were increased, while the hybrid type, bisecting type, biantennary type, triantennary type, fucosylation and sialylation of N-glycans were decreased in hypoxia-treated MDA-MB-231 cells. The study of lectin Con A and LCA fluorescence staining consistented with MS analysis. The present research indicates that hypoxia alters the expression of N-glycans in malignant breast tumor cells, which may provide the fundamental observations for further understanding functional roles of differential expression of N-glycans in hypoxia-treated cells.
Keywordshypoxia; epithelial-mesenchymal transition; MALDI-TOF/TOF-MS; N-glycan
病理性低氧是实体肿瘤发展过程中普遍存在的现象,也是肿瘤微环境的特征之一[1]。低氧能诱导肿瘤细胞发生细胞代谢异常、血管生成、侵袭及迁移能力的改变。在临床上,低氧对常规疗法如化疗和放疗有抵抗作用,也与不同类型癌症治疗中表现出的预后差、易转移相关[2]。研究发现,低氧也是诱导上皮间质转化(Epithelial-mesenchymal transition,EMT)过程的因素之一[3-4]。EMT是指上皮细胞在特定生理病理情况下获得显著的迁移和侵袭能力,转化为具有间质细胞表型和特性的细胞。有研究指出EMT过程中,糖聚合物及糖基转移酶均有异常表达[5-6]。
糖基化修饰是蛋白质一种重要的翻译后修饰,真核生物中大部分蛋白质发生了糖基化[7]。细胞中的糖蛋白质参与了多种生物学过程,包括细胞黏附、受体激活、信号转导和内吞作用[9]。在许多疾病,如感染、炎症反应、癌细胞增殖及转移中均发现异常的糖基化现象[9]。研究表明,低氧能改变细胞内葡萄糖代谢,使其从有氧呼吸转变为无氧糖酵解,增加胞内葡萄糖摄取,同时提高胞内核苷酸糖含量,特别是UDP-N-乙酰葡糖胺的含量,导致糖链结构及细胞功能的改变[10]。Koike等[11]研究发现低氧增加了细胞表面唾液酸化Lewis x(E-选择素的特殊配体)的含量,并提高整合素α5和黏结蛋白聚糖4的表达。而低氧对细胞整体糖链表达谱的影响并无相关报道。
本文以人恶性乳腺肿瘤细胞MDA-MB-231为模型,研究低氧对细胞表型、细胞行为及糖链表达的影响,利用MALDI-TOF/TOF-MS技术和凝集素细胞荧光染色比较分析N-糖链的变化差异,以期从糖组学水平上寻找到肿瘤特征性糖链,并为深入研究低氧诱导肿瘤发展的分子机制提供技术支持。
1 材料与方法
1.1 材料
人恶性乳腺肿瘤细胞MDA-MB-231购于ATCC。DMEM基础培养基、胎牛血清、青霉素和链霉素均购于Life technologies公司,低氧培养室购于Stemcell technologies公司。
抑肽酶,苯甲基磺酰氟(PMSF),T-PER裂解液和Hoechst染色液购自Thermo Scientific公司;BCA蛋白检测试剂盒和辣根过氧化酶标记山羊抗小鼠IgG抗体购自碧云天生物技术研究所;Glut1抗体购于英国Abcam公司;β-catenin抗体购于美国BD公司;HIF-1a抗体购自Cell signaling公司;β-tubulin、fibronectin抗体购于美国Sigma公司;Pro-Light HRP化学发光检测试剂购于天根生化科技有限公司。PNGase F酶购自美国New England Biolabs公司;Amicon Ultra-0.5 10 ku超滤管购于美国Millipore公司;Sepharose CL-4B琼脂糖凝胶、尿素(Urea)、正丁醇(1-Butanol)、甲醇(Methanol)、碳酸氢铵(NH4HCO3)、二硫苏糖醇(DTT)、碘乙酰胺(IAM)和2,5-二羟基苯酸乙酯(DHB)购于美国Sigma-Aldrich公司;伴刀豆凝集素(Conconvalin A, Con A),小扁豆凝集素(Lens culinaris agglutinin, LCA)购自Vector公司。
1.2 方法
1.2.1 细胞培养
使用含10%胎牛血清(FBS)、100 mg/L青霉素和100 mg/L链霉素的DMEM培养基,于37℃含5% CO2及饱和湿度的细胞培养箱中培养MDA-MB-231细胞。待MDA-MB-231融合度至70%后,将细胞置于含1% O2、5% CO2和94% N2混合气体的低氧培养室中37℃培养24 h。常氧对照组细胞置于5% CO2普通细胞培养箱内。
1.2.2 蛋白质印迹
收集细胞,预冷PBS润洗3次,加入适量含1% PMSF和0.1%抑肽酶的T-PER裂解液,冰浴30 min,离心收集上清。使用BCA试剂盒测定蛋白浓度后进行7.5%聚丙烯酰胺凝胶电泳。电泳结束后,将蛋白转移至0.45 μm PVDF膜,用5%脱脂奶粉37℃封闭2 h,加入抗HIF-1a、fibronectin、β-catenin、Glut1或β-tubulin一抗4℃孵育过夜,TBST漂洗5次;加入辣根过氧化物酶标记的二抗室温孵育1 h,TBST漂洗5次,使用Pro-Light HRP化学发光检测试剂显色,用Bio-Rad ChemiDocTMXRS+成像系统进行图像采集。
1.2.3 细胞划痕实验
将适量MDA-MB-231细胞接入6孔板,在完全培养基中培养过夜,分别低氧常氧培养24 h,吸去培养基,用加样器枪头在每个孔中划线,PBS润洗3次,加入不含血清的培养基,分别在培养0、24 h时进行拍照。
1.2.4 N-糖链的释放
取2 mg蛋白样品于10 ku超滤管中离心浓缩。加入8 mol/L尿素,10 mmol/L DTT溶液和20 mmol/L IAM溶液使蛋白变性溶解。加入40 mmol/L NH4HCO3溶液润洗3次,将超滤管转移至洁净的收集管中,加入300 μL 40 mmol/L NH4HCO3溶液溶解的1 μL PNGase F酶溶液37℃静置反应12 h,离心收集流出液,冷冻干燥。
1.2.5 N-糖链的除盐处理
将100 μL Sepharose 4B加入离心管中,用1∶1的甲醇∶水(V/V) 和5∶1∶1的正丁醇∶甲醇∶水(V/V/V)离心清洗,获得预处理的Sepharose 4B凝胶。用500 μL的5∶1∶1正丁醇∶甲醇∶水(V/V/V)溶解N-糖链样品,上样至预处理好的Sepharose 4B凝胶中,室温80 r/min振荡反应1 h,离心弃上清。用1 mL的5∶1∶1的正丁醇∶甲醇∶水(V/V/V)溶液重复清洗3次。加入500 μL的1∶1的甲醇∶水(V/V)溶液室温140 r/min振荡20 min洗脱N-糖链,离心收集上清,冷冻干燥后用MALDI-TOF/TOF-MS进行检测。
1.2.6 凝集素细胞染色
取适量细胞接种于24孔板中制作细胞爬片,待细胞融合度达到60%时,分别常氧低氧培养24 h。吸弃培养基,PBS润洗3次,4%多聚甲醛固定细胞,PBS润洗3次。加入0.1% TritonX-100溶液通透细胞,PBS润洗3次,3%牛血清蛋白(BSA)溶液4℃封闭过夜。然后加入Cy3标记的凝集素Con A和凝集素LCA室温下避光孵育3 h,PBS润洗3次,5 mg/L Hoechst染色10 min,PBS润洗3次,最后将爬片倒扣在滴有Glycergel固封剂的载玻片上。用Nikon Eclipse E600激光共聚焦显微镜在10×60倍下观察。
2 结果与分析
2.1 低氧对MDA-MB-231细胞形态及上皮间质转化的影响
MDA-MB-231是一株人恶性乳腺肿瘤细胞株,常氧培养细胞形态为细长梭状,排列整齐,间隙均匀。低氧培养24 h后,观察到细胞形态更瘦长,分布更松散(图1-A)。通过划痕实验(图1-B)发现,低氧培养后MDA-MB-231细胞迁移能力较常氧培养提高。

图1 MDA-MB-231细胞低氧培养前后的特征比较
A:细胞形态(×100);B:细胞迁移能力(×100);C:蛋白标志物表达
上皮间质转化过程中伴随着β-catenin (上皮细胞标志物)等连接分子表达下调,fibronectin(间质细胞标志物)表达上调。利用蛋白质印迹法检测,发现低氧处理后,低氧诱导因子1α(HIF-1α)表达上调,β-catenin表达下调,fibronectin表达上调,同时发现葡萄糖转运蛋白1(Glut1)的表达显著上调(图1-C)。以上结果表明,低氧促进细胞发生EMT,是引发上皮间质转化的重要诱导因素。
2.2 MDA-MB-231细胞低氧前后N-糖链的质谱分析
N-糖链参与多种生物学过程,包括细胞间识别,细胞黏附,细胞信号传导等。本实验借助MALDI-TOF/TOF-MS比较MDA-MB-231细胞低氧前后N-糖链的变化。利用糖链结构分析软件GlycoWorkbench参考GlycomeDB糖链数据库筛选糖链质谱峰并进行结构鉴定和标注(图2)。从图2中可以看出N-糖链主要分布在质荷比(m/z) 1200~2700之间。在常氧培养和低氧培养的MDA-MB-231细胞中各检测到17种N-糖链,其中16种糖链在两种培养条件下都可检测到,但m/z1499.240的N-糖链在常氧培养下特异性表达,而m/z1890.780的N-糖链在低氧培养下特异性表达。为了精确测定糖链结构,本实验又对不同分子量的糖链进行了二级质谱解析。图3为2个随机挑选的N-糖链二级质谱峰图,分别为m/z1743.626和m/z1905.801的高甘露糖型N-糖链,通过质谱二级碎裂信息结合GlycoWorkbench软件确定其糖链结构。之后借助质谱检测到的质谱峰强度比值(Intensity ratio)进行相对定量分析,以确定该糖链在常氧培养及低氧培养下的表达水平,结合二级质谱分析推定的糖链结构,各N-糖链质荷比理论值、质荷比实验值、推定结构以及相对表达强度如表1所示。结果表明,N-糖链在低氧培养和常氧培养后表达水平差异明显,如m/z为1403.480、1565.265、1727.082、1759.678和1809.743等N-糖链在低氧培养后低表达,而m/z为1419.657、1905.722和2067.783的N-糖链在低氧培养后高表达。
为了分析MDA-MB-231细胞在常氧培养和低氧培养下不同类型糖链结构的表达差异,将其分类成高甘露糖型、杂合型、复合型(包括二天线型、三天线型和四天线型)、平分型、岩藻糖化和唾液酸化N-糖链,如表2所示,分别累加不同类型糖链的相对强度并计算其在对应实验组中的比重。结果表明,与常氧培养细胞相比,低氧培养细胞高甘露糖型(High-mannose type)及复合型中四天线型(Tetra-antennary type)糖链的含量升高,而杂合型(Hybrid type)、复合型(Biantennary and triantennary type,包括二天线型和三天线型)、平分型(Bisecting type)、岩藻糖化(Fucosylated)和唾液酸化(Sialylated)糖链的含量降低。

图 2 常氧培养MDA-MB-231细胞与低氧培养MDA-MB-231细胞N-糖链一级质谱图
2.3 MDA-MB-231细胞低氧前后凝集素荧光染色
为了进一步验证MDA-MB-231细胞低氧前后N-糖链质谱分析结果的准确性,选取凝集素Con A、LCA进行凝集素细胞荧光染色验证。伴刀豆凝集素Con A与甘露糖有较强的亲和力,可用于检测细胞糖链中高甘露糖型的表达,而小扁豆凝集素LCA能特异性亲和核心岩藻糖结构的糖链。结果如图4所示,相比常氧培养细胞,低氧培养细胞凝集素Con A染色后荧光强度增强,表明低氧培养后胞内高甘露糖型糖链表达上升;而凝集素LCA染色后,低氧培养细胞荧光强度降低,表明低氧培养后胞内核心岩藻糖化的糖链表达下降。以上2种凝集素低氧前后细胞荧光染色结果与糖链质谱分析结果相一致。
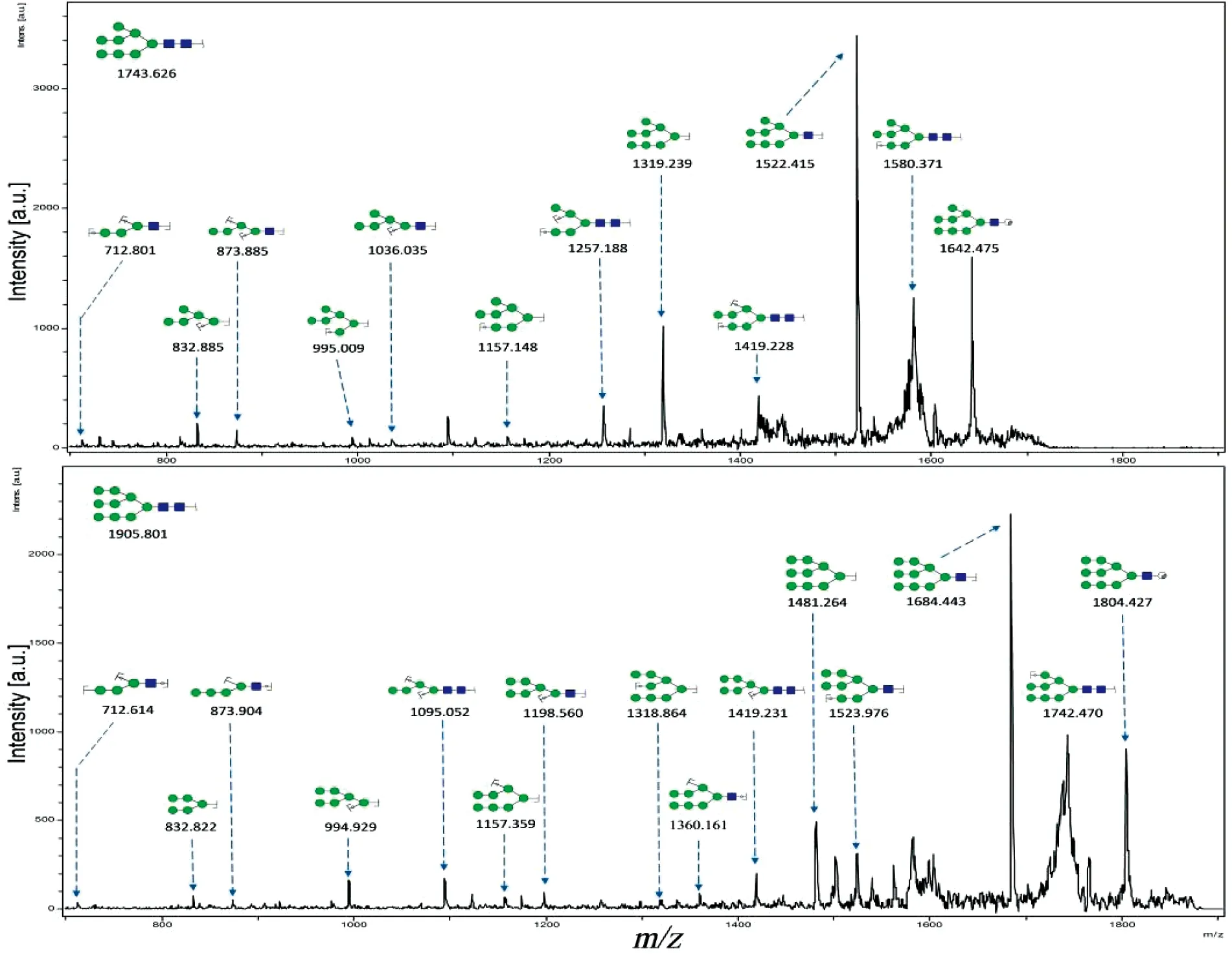
图 3 m/z 1743.626和1905.801的糖链二级质谱图
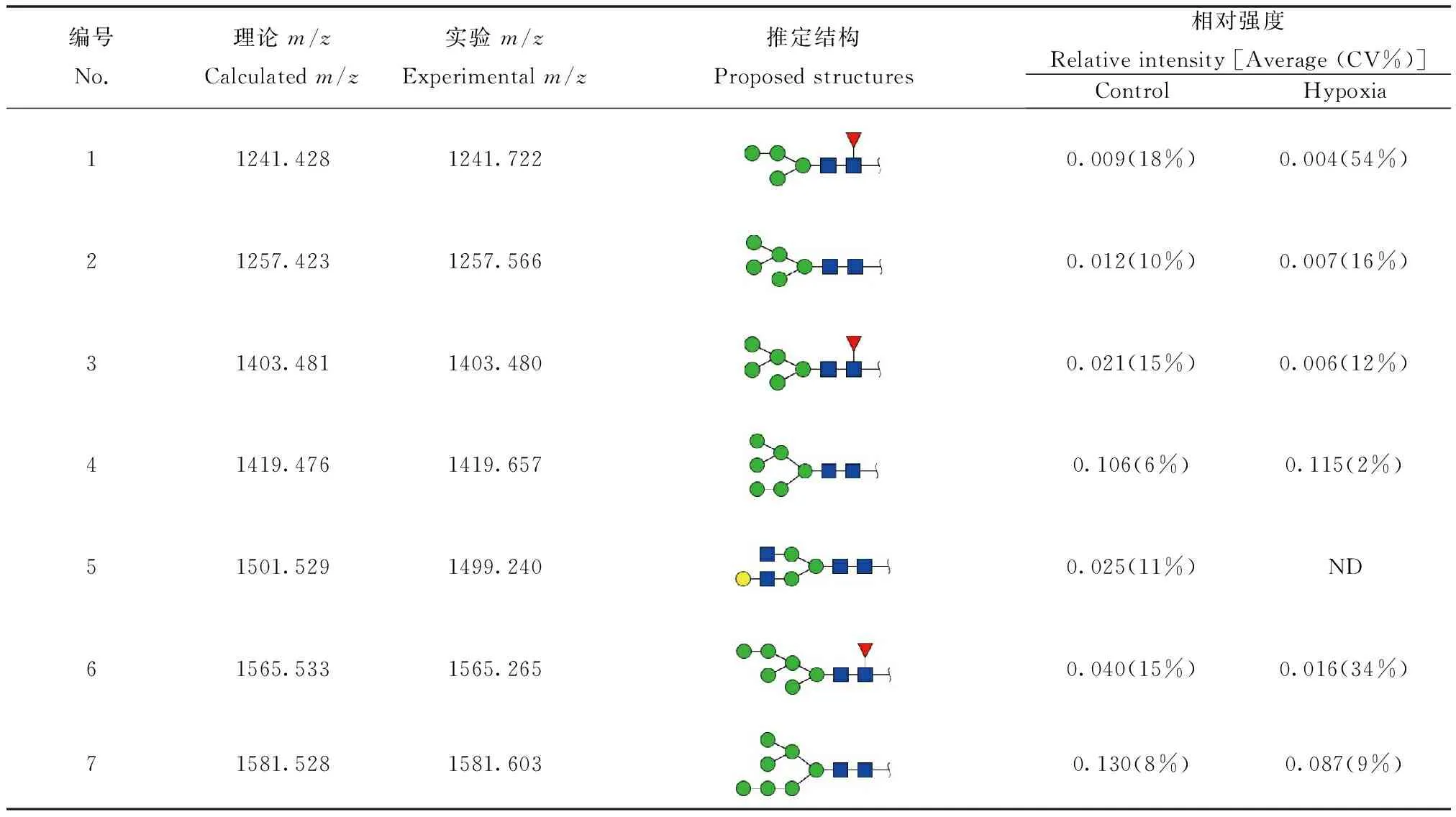
编号No.理论m/zCalculatedm/z实验m/zExperimentalm/z推定结构Proposedstructures相对强度Relativeintensity[Average(CV%)]ControlHypoxia11241.4281241.7220.009(18%)0.004(54%)21257.4231257.5660.012(10%)0.007(16%)31403.4811403.4800.021(15%)0.006(12%)41419.4761419.6570.106(6%)0.115(2%)51501.5291499.2400.025(11%)ND61565.5331565.2650.040(15%)0.016(34%)71581.5281581.6030.130(8%)0.087(9%)
续表1(Continued table 1)
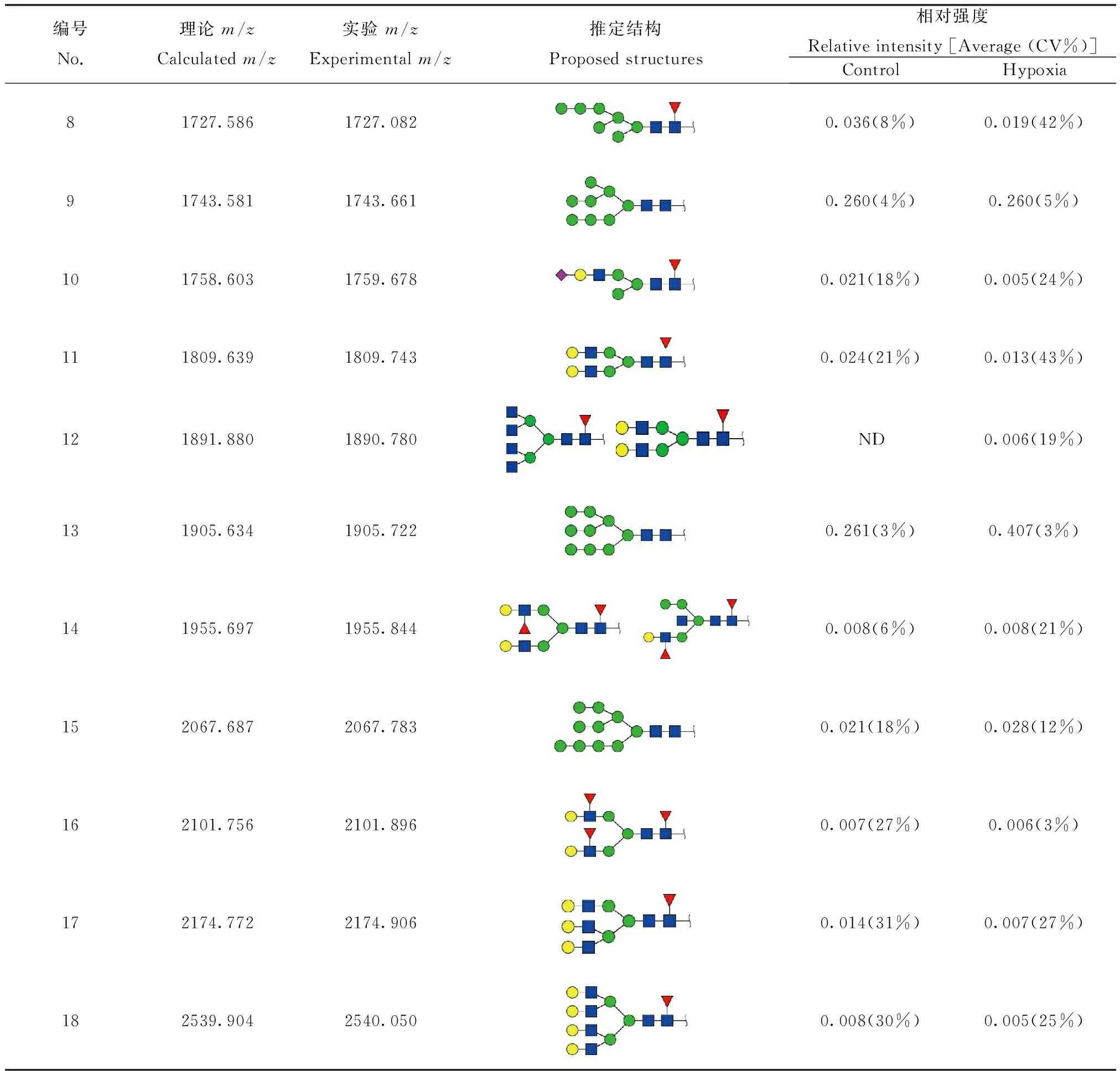
编号No.理论m/zCalculatedm/z实验m/zExperimentalm/z推定结构Proposedstructures相对强度Relativeintensity[Average(CV%)]ControlHypoxia81727.5861727.0820.036(8%)0.019(42%)91743.5811743.6610.260(4%)0.260(5%)101758.6031759.6780.021(18%)0.005(24%)111809.6391809.7430.024(21%)0.013(43%)121891.8801890.780ND0.006(19%)131905.6341905.7220.261(3%)0.407(3%)141955.6971955.8440.008(6%)0.008(21%)152067.6872067.7830.021(18%)0.028(12%)162101.7562101.8960.007(27%)0.006(3%)172174.7722174.9060.014(31%)0.007(27%)182539.9042540.0500.008(30%)0.005(25%)
ND:not detected in the samples
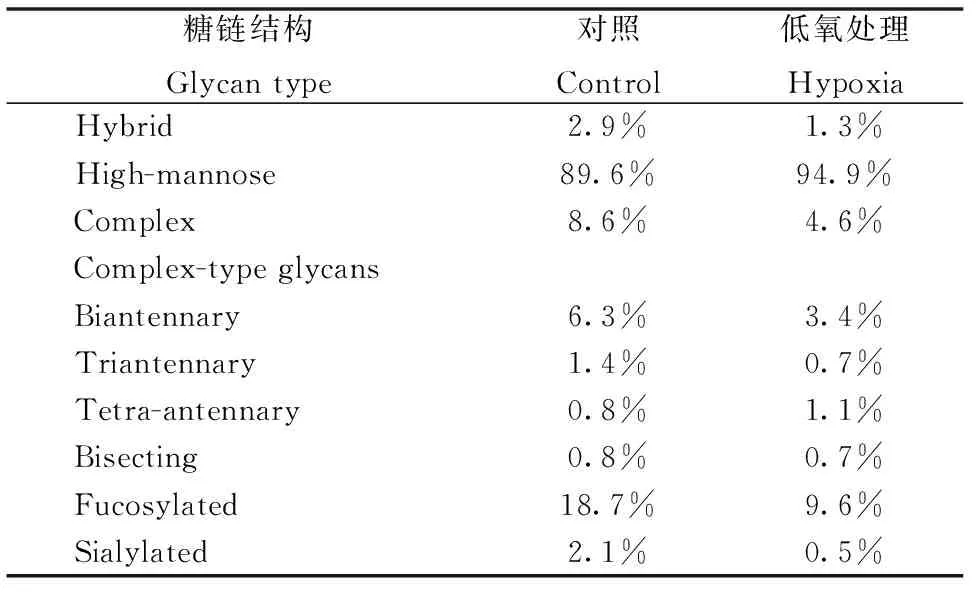
表2 不同类型N-糖链的相对变化
3 讨论
乳腺癌是常见的女性恶性肿瘤,近年来发病率一直呈上升趋势。而在浸润型乳腺癌中约有25%~40%含有低氧区域[12]。低氧是肿瘤微环境的基本特征之一[2]。肿瘤细胞对低氧的应激一方面表现为低氧诱导因子介导的信号通路改变,影响肿瘤细胞的血管生成、侵袭和迁移能力;另一方面低氧促进肿瘤细胞高糖酵解能量代谢表型的改变,促使肿瘤细胞摄入更多葡萄糖,积累UDP-GlcNAc,引发肿瘤细胞糖基化修饰的改变。当前很多研究多从基因水平及蛋白质水平探究低氧对细胞生物学行为的影响,而低氧过程诱导的细胞糖谱变化还没有系统的研究。因此本文主要研究低氧对间质转化及糖组学的影响。
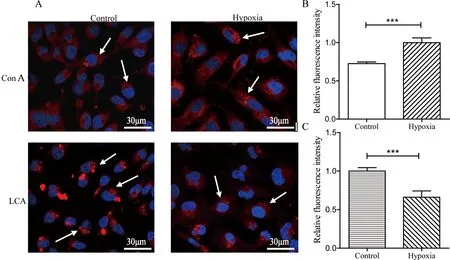
图 4 低氧前后MDA-MB-231细胞凝集素荧光染色图
A:细胞凝集素荧光染色(×400);B:Con A凝集素染色相对荧光强度分析(***P<0.001);C:LCA凝集素染色相对荧光强度分析(***P<0.001)
通过实验发现,低氧诱导恶性乳腺癌细胞后EMT上皮细胞标志物β-catenin下调,间质细胞标志物fibronectin上调,细胞形态细长,松散更具间质细胞表型,细胞迁移能力增强,说明低氧是引发间质转化的重要诱导因素。另外,细胞在低氧条件下Glut1表达显著上调,与低氧促进细胞代谢表型及糖基化修饰变化密切相关。本实验借助质谱技术对低氧培养及常氧培养恶性乳腺肿瘤细胞MDA-MB-231进行N-糖链图谱鉴定,分别鉴定和注释了17种N-糖链及其结构。通过对N-糖链的量化分析对比,确定了其在低氧培养前后恶性乳腺癌细胞中的表达差异。糖链结构的表达差异源于合成该糖链的相应糖基转移酶表达的改变,有报道表明,低氧影响多种糖基转移酶的表达。Belo等[13]研究发现HIF-1α的高表达抑制了α 1,2-岩藻糖基转移酶fut1和fut2的表达,同时下调胰腺肿瘤细胞表面α 1,2-岩藻糖基化糖链的含量。Yin等[14]报道低氧诱导人结肠肿瘤细胞LS174T后β-1,4-半乳糖转移酶V基因水平表达上调。此外,近年的研究还表明低氧诱导细胞糖基化水平的改变促进肿瘤的发展。Ren等[15]研究发现低氧培养表皮鳞癌细胞A431后,细胞表面整合素α3糖基化发生改变同时促进细胞的侵袭能力。
总之,本研究为低氧诱导乳腺肿瘤细胞相关的糖组学研究提供了前期基础。将来的工作将根据特异性改变的糖链结构,通过对相关糖基转移酶基因的过表达或干扰表达,增强或减弱对应糖链结构的表达,进一步探索N-糖链与低氧诱导乳腺癌发展之间的分子机制。
[1]SEMENZA G L. Targeting HIF-1 for cancer therapy[J]. Nat Rev Cancer, 2003, 3(10): 721-732.
[2]BUFFA F M, HARRIS A L, WEST C M, et al. Large meta-analysis of multiple cancers reveals a common, compact and highly prognostic hypoxia metagene[J]. Br J Cancer, 2010, 102(2): 428-435.
[3]LIU L, SALNIKOV A V, BAUER N, et al. Triptolide reverses hypoxia-induced epithelial-mesenchymal transition and stem-like features in pancreatic cancer by NF-κB downregulation[J]. Int J Cancer, 2014, 134(10): 2489-2503.
[4]LIU Y, LIU Y, YAN X, et al. HIFs enhance the migratory and neoplastic capacities of hepatocellular carcinoma cells by promoting EMT[J]. Tumour Biol, 2014, 35(8): 8103-8114.
[5]GUAN F, SCHAFFER L, HANDA K, et al. Functional role of gangliotetraosylceramide in epithelial-to-mesenchymal transition process induced by hypoxia and by TGF-β[J]. FASEB J, 2010, 24(12): 4889-4903.
[6]GUAN F, HANDA K, HAKOMORI S I. Specific glycosphingolipids mediate epithelial-to-mesenchymal transition of human and mouse epithelial cell lines[J]. Proc Natl Acad Sci U S A, 2009, 106(18): 7461-7466.
[8]LI M, SONG L, QIN X. Glycan changes: cancer metastasis and anti-cancer vaccines[J]. J Biosci, 2010, 35(4): 665-673.
[9]LAU K S, PARTRIDGE E A, GRIGORIAN A, et al. Complex N-glycan number and degree of branching cooperate to regulate cell proliferation and differentiation[J]. Cell, 2007, 129(1): 123-134.
[10]SHIRATO K, NAKAJIMA K, KOREKANE H, et al. Hypoxic regulation of glycosylation via the N-acetylglucosamine cycle[J]. J Clin Biochem Nutr, 2011, 48(1): 20-25.
[11]KOIKE T, KIMURA N, MIYAZAKI K, et al. Hypoxia induces adhesion molecules on cancer cells: A missing link between Warburg effect and induction of selectin-ligand carbohydrates[J]. Proc Natl Acad Sci U S A, 2004, 101(21): 8132-8137.
[12]LUNDGREN K, WIGERUP C, LANDBERG G. Common molecular mechanisms of mammary gland development and breast cancer[J]. Cell Mol Life Sci, 2007, 64(24): 3233-3247.
[13]BELO A I, VLIET S J, MAUS A, et al. Hypoxia inducible factor 1α down regulates cell surface expression of α1,2-fucosylated glycans in human pancreatic adenocarcinoma cells[J]. FEBS Lett, 2015, 589(18): 2359-2366.
[14]YIN J, MIYAZAKI K, SHANER R L, et al. Altered sphingolipid metabolism induced by tumor hypoxia - new vistas in glycolipid tumor markers[J]. FEBS Lett, 2010, 584(9): 1872-1878.
[15]REN Y, HAO P, LAW S K, et al. Hypoxia-induced changes to integrin α 3 glycosylation facilitate invasion in epidermoid carcinoma cell line A431[J]. Mol Cell Proteomics, 2014, 13(11): 3126-3137.
Differential expression of N-glycans in hypoxia-induced human malignant breast tumor cells MDA-MB-231
WANG Chen-xing, GUO Jia, YANG Gang-long, LIU Chang-mei, GUAN Feng
(Key Laboratory of Carbohydrate Chemistry & Biotechnology, Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi 214122, China)
R737.9
A
2095-1736(2017)05-0001-06
2016-08-30;
2016-09-13
国家自然科学基金项目(编号:81672537)
王晨星,硕士研究生,专业方向为生物工程,E-mail:wangchenxing1992@163.com
关 锋,博士,教授,研究方向为糖生物学,E-mail:fengguan@jiangnan.edu.cn
doi∶10.3969/j.issn.2095-1736.2017.05.001
