以恩诺沙星为检测对象探究恩诺沙星与牛血清白蛋白的相互作用
2017-10-16胡晓红远新新张玉婵
傅 丽, 胡晓红, 鞠 岩, 高 帆, 远新新, 张玉婵
(廊坊师范学院化学与材料科学学院,河北廊坊 065000)
恩诺沙星(Enrofloxacin,EFLX)属喹诺酮类新一代的广谱抗菌药物,具有高效的杀菌效果,家畜经药物注射后不良反应轻微,且与其他药物同时使用时不会造成交叉耐药现象。因此,恩诺沙星被广泛应用于以牛、羊为代表的家畜感染病的防治。牛血清白蛋白(Bovine Serum Albumin,BSA)是一种球型蛋白,承担着血液中各种小分子物质的运输和贮存作用。因此,研究EFLX与蛋白的作用,有助于帮助我们了解药物在动物体内的存储和转运过程,同时能为药物的设计、开发及药理研究提供有价值的信息。蛋白具有内源荧光,可与许多生物小分子相互结合。研究药物与蛋白的相互作用,荧光光谱法相比于平衡透析法[1]、毛细管电泳法[2]、高效亲和色谱法[3]等更简单、快速,因此荧光光谱法成为人们研究蛋白与其他物质相互作用的主要手段。
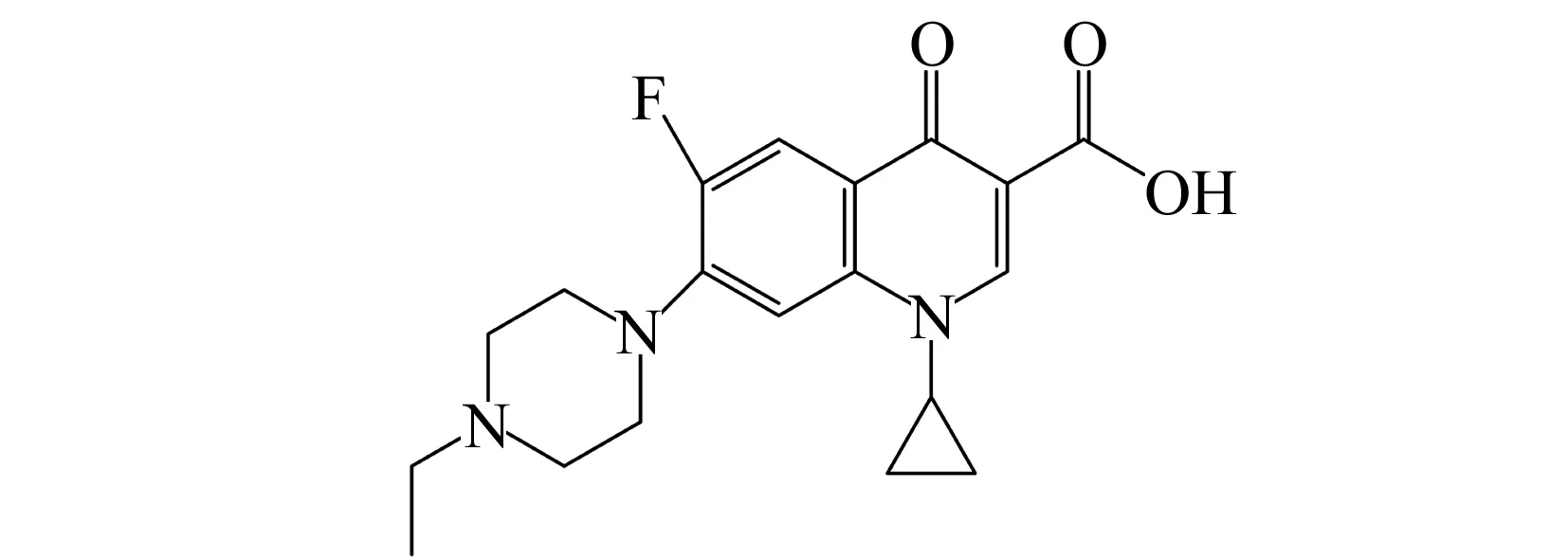
图1 恩诺沙星结构式Fig.1 The structure of EFLX
经典的荧光光谱法通常采用以血清白蛋白为检测对象,随药物小分子的不断加入,蛋白在340 nm波长处的荧光强度有规律地减弱,据此建立起蛋白与药物相互作用的荧光光谱法。但当激发波长为280 nm时,340 nm处的荧光是由色氨酸残基发出的[4]。生物体蛋白包含20种氨基酸[5],而其他19种氨基酸都有可能参与到相互作用的过程中,因此,色氨酸残基的荧光并不能准确地反映药物与蛋白的相互作用信息[6]。相反,药物小分子的荧光代表的是药物整体的荧光,可获得蛋白与药物更为准确和全面的相互作用信息。
本文以第三代喹诺酮类兽用EFLX为检测对象(结构式如图1),在模拟生理条件下,分别以BSA和EFLX为研究对象,采用荧光光谱法研究了EFLX与BSA的相互作用,并获得了二者的猝灭常数、结合常数、结合位点数、热力学等参数。此外,考察了离子强度对EFLX-BSA体系荧光强度的影响及I-对该体系的荧光猝灭。通过EFLX与曙红B(EB)、盐酸柔红霉素(DH)、赫斯特荧光染料(Hoechst)的竞争实验,推测了EFLX与BSA的结合方式。
1 实验部分
1.1 仪器与试剂
F-4600型荧光光度计(日立,日立公司);UV-2550型紫外-可见分光光度计(日本,岛津公司);SYC-15型超级恒温水浴(南京桑力电子设备厂)。
牛血清白蛋白(BSA)配成1.0×10-4mol/L的标准溶液;曙红B(EB)配成1.072×10-4mol/L的标准溶液;盐酸柔红霉素(DH)配成1.0×10-4mol/L的标准溶液;赫斯特荧光染料(Hoechst)配成1.086×10-3mol/L的标准溶液(以上试剂均为分析纯,由大连美仑生物科技股份有限公司提供);恩诺沙星注射液(文登市雨泽银丰动物药业有限公司)配成1.043×10-3mol/L的标准溶液;pH=7.34的Tris-HCl缓冲溶液;0.1 mol/L 的NaCl标准溶液;0.1 mol/L 的KI 标准溶液。实验用水均为二次蒸馏水。
1.2 实验方法
1.2.1以BSA为检测对象的荧光光谱法在10 mL比色管中,依次加入2 mL Tris-HCl缓冲溶液,1 mL 0.1 mol/L 的NaCl溶液,1 mL 1.0×10-5mol/L BSA溶液,然后加入不同体积的EFLX标准溶液,用水定容至10 mL,配制成系列溶液。分别于温度298 K、303 K、308 K和313 K下静置反应15 min。设置荧光光谱仪的激发和发射狭缝均为10 nm,激发波长为280 nm,负高压为410 V,记录BSA在波长340 nm处的荧光强度。
1.2.2以EFLX为检测对象的荧光光谱法在10 mL比色管中,依次加入2 mL Tris-HCl缓冲溶液,1 mL 0.1 mol/L NaCl溶液,0.5 mL 1.043×10-4mol/L EFLX溶液,然后加入不同体积的BSA标准溶液,用水定容至10 mL,配制成系列溶液,以下同1.2.1。在激发波长为270 nm,负高压为410 V,记录EFLX在410 nm处的荧光强度。
1.2.3紫外吸收光谱法同1.2.2,以相应浓度的BSA溶液做参比,扫描其在250~350 nm波长范围内的紫外光谱,记录EFLX在270 nm处的吸光度A。
1.2.4作用方式的判断实验条件及仪器参数与1.2.2同,实验温度298 K。通过测定二元体系EFLX-NaCl/(KI) 在410 nm处EFLX发射峰的荧光强度,以及三元体系EFLX-BSA-NaCl/(KI)在340 nm处的荧光强度,判断作用力方式是否为静电作用。通过对比二元体系EB-BSA(DH-BSA)与三元体系EB-BSA-EFLX(DH-BSA-EFLX)发射峰荧光强度的变化,判断作用力方式是否为嵌入式。通过对比二元体系Hoechst-BSA与三元体系Hoechst-BSA-EFLX发射峰荧光强度的变化,判断作用方式是否为沟槽式。
2 结果与讨论
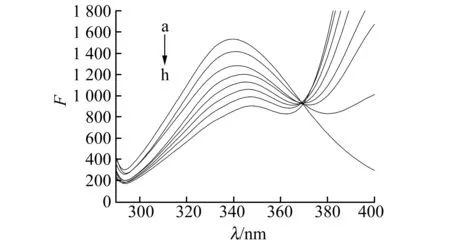
图2 BSA-EFLX体系的荧光光谱(303 K)Fig.2 The fluorescence spectra of the BSA-EFLX system(303 K)cBSA=1.0×10-6 mol/L;slit widths:10 nm;cEFLX(a-h):0,2.086,4.172,6.258,8.272,10.34,12.408,14.476(×10-6 mol/L).
2.1 EFLX-BSA体系的经典荧光光谱
BSA分子中因含有色氨酸、酪氨酸等氨基酸残基而能发射较强的荧光[7]。图2表明,固定BSA浓度不变,随着EFLX浓度的增加,BSA的荧光强度有规律的降低,发射峰位置从340 nm依次红移至349 nm,峰形基本保持不变,表明两者存在相互作用。
通常,可根据猝灭常数随温度的变化及猝灭速率常数的大小来区分动态和静态猝灭。由动态猝灭遵循Stern-Volmer方程[8]计算猝灭常数KSV及猝灭常数Kq,见表1。由表1可以看出,随着温度升高,KSV依次减小,由此推断该反应为静态猝灭过程[9]。Kq均大于最大扩散猝灭常数(2.0×1010L/(mol·s))[10],进一步证明EFLX与BSA形成复合物而发生静态猝灭。
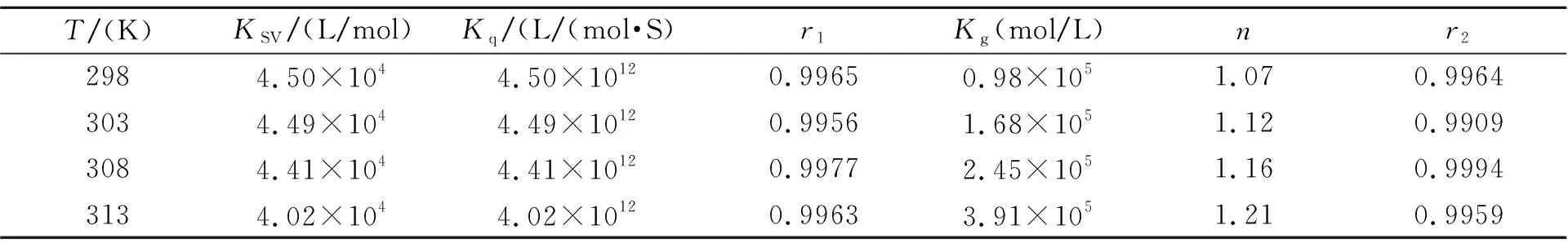
表1 EFLX与BSA在不同温度下的猝灭反应参数
Note:r1is the correlation coefficients ofF0/F-[Q];r2is the correlation coefficients of log[(F0-F)/F]-log[Q].
由静态猝灭遵循的Scatchard 方程[11]计算体系的结合常数Ka和结合位点数n列入表1。可以看出,不同温度下Ka数量级皆为105,这表明EFLX与BSA有很强的结合能力,在血液中可以通过血清白蛋白对EFKX进行储存和运输。温度的变化对结合位点影响不大,表明EFKX与BSA结合的稳定性;n接近于1,说明二者相互作用时形成了1∶1的复合物。
2.2 以恩诺沙星为研究对象的该体系的荧光光谱
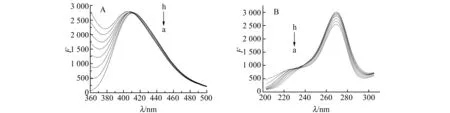
图3 EFLX-BSA体系的荧光光谱(303 K)Fig.3 The fluorescence spectra of the EFLX-BSA system(303 K)A:Emission spectra;B:Excitation spectra.cEFLX=5.215×10-6 mol/L;cBSA(a-h):0,0.5,1.0,1.5,2.0,2.5,3.0,3.5(×10-6 mol/L).
据1.2.2得到不同温度下EFLX与BSA相互作用的荧光谱图,结果见图3。由图3可以看出,随着BSA浓度依次增高,EFKX的荧光强度呈增强的趋势,而它在410 nm处的发射峰彼此重叠,但这并不是由荧光的敏化增强作用引起的,从激发图谱可知这二者的荧光严重交叠所致,在EFLX的检测条件下,BSA仍然具有较强的发射荧光,且荧光强度随浓度的增大而增大,使得EFLX的荧光受到严重干扰。因此,本研究以图3中相应浓度的纯BSA溶液作空白,在相同的仪器条件下扫描BSA的荧光光谱,所得数据与图3中的数据联合处理后,得到EFLX随BSA浓度变化的真实荧光谱图如图4所示。可见随着BSA浓度的增加,EFLX的荧光强度呈递减趋势。由动态方程分别得出相应温度下的KSV、Kq、Ka和n及对应的线性相关系数r3、r4,结果列于表2。

表2 恩诺沙星与BSA在不同温度下的猝灭反应参数
Note:r3is the correlation coefficients ofF0/F-[Q];r4is the correlation coefficients of lg[(F0-F)/F]-lg[Q].
由表2的数据得出该体系的猝灭方式为静态猝灭。对比经典荧光光谱法,可以得出无论是以蛋白还是以药物为检测对象,得出的二者相互作用的机理是一致的。结合常数和结合位点数,相同温度下,以药物为检测对象的数值均大于以蛋白为检测对象的数值,表明BSA肽链中除色氨酸残基外,其它残基也与EFLX发生了相互作用。该相互作用信息能在恩诺沙星的荧光谱图上表现出来。由此可以得出,相对于经典荧光光谱法,以药物小分子为检测对象的分析方法能更全面、准确地传达药物与蛋白分子的整体作用信息。
2.3 恩诺沙星-BSA体系的紫外光谱
EFLX与不同浓度的BSA结合反应的紫外吸收光谱如图5。BSA与EFLX的结合常数Kb关系[13]:
(1)
其中A0、A是猝灭剂加入前后的吸光度值,[L]表示猝灭剂的浓度。由图5得出EFLX在波长270 nm的吸收峰是随BSA浓度的增大而降低并且发生蓝移[14],从而表明BSA与EFLX的作用方式为沟槽式。由于BSA在EFLX紫外吸收峰处有影响,故采用对应相同浓度的蛋白作为参比。由式(1)得出的方程列于表3。由表3中的结合常数可以看出,它与以EFLX为检测对象的数据更接近。

图4 EFLX-BSA体系的荧光光谱(303 K)Fig.4 The fluorescence spectra of the EFLX-BSA system(303 K)cEFLX=5.215×10-6 mol/L,cBSA(a-h):0,0.5,1.0,1.5,2.0,2.5,3.0,3.5(×10-6 mol/L).

图5 EFLX-BSA体系的紫外(UV)光谱 (303 K)Fig.5 The UV spectrum of the EFLX-BSA systemcEFLX=5.215×10-6 mol/L;cBSA(a-g):0,0.5,1.0,1.5,2.0,2.5,3.0(×10-7 mol/L).

T/(K)Kb/(L/mol)Equation of linear regressionr52989.82×105(A0-A)-1=2.931+2.984×10-6[L]-10.99763032.55×106(A0-A)-1=5.734+2.250×10-6 [L]-10.99603084.13×106(A0-A)-1=7.185+1.739×10-6[L]-10.99803135.00×106(A0-A)-1=14.487+2.894×10-6[L]-10.9903
Note:r5is the correlation coefficients of (A0-A)-1-[L]-1.
2.4 热力学函数的变化与作用力的判断
药物与蛋白之间的主要作用力类型包括疏水作用力、氢键、范德华力和静电引力等[15]。EFLX-BSA 体系的热力学参数计算[16 - 17]结果见表4。可知,EFLX-BSA体系在不同温度下的△G< 0、△S>0,相互作用是一个熵驱动的过程;△H>0、△S>0,表明作用力主要以疏水作用力为主。

表4 不同温度下EFLX-BAS体系荧光猝灭过程的热力学参数
Note:r6is the correlation coefficients ofRlnKa-1/T.
2.5 恩诺沙星与BSA的作用方式
2.5.1NaCl、KI对EFLX和EFLX-BSA体系的影响按1.2.4的实验方案,分别固定EFLX-BSA体系和EFLX的量,加入不同量的NaCl溶液,依次测量各荧光发射峰强度,见图6(A)。由图可知,随着离子强度的增大,EFLX-BSA体系和EFLX自身的荧光强度基本保持不变,说明Na+并未发生与EFLX和BSA的竞争作用,即EFLX与BSA之间不是静电作用[18]。由图6(B)可以看出I-离子对EFLX-BSA体系的影响小于对EFLX单独的影响,进一步表明EFLX与BSA之间不是静电作用。EFLX由于与BSA结合而部分被保护,故有可能二者是嵌入式作用或沟槽式作用[19]。
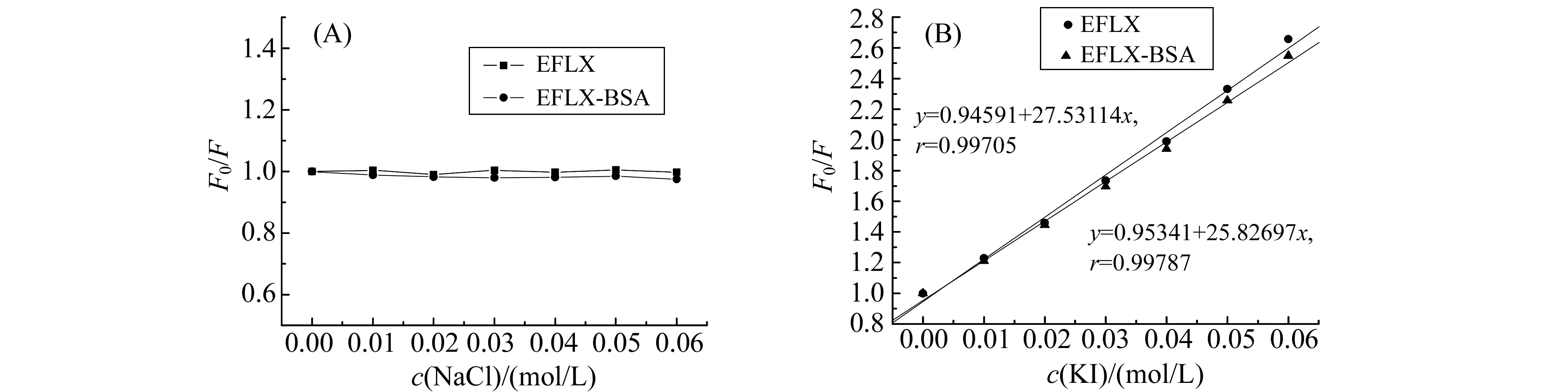
图6 NaCl/KI对EFLX和EFLX-BSA体系的影响 Fig.6 The influence of NaCl/KI on the fluorescence intensity of the EFLX-BSA system cEFLX=5.215×10-6 mol/L;cBSA=1.0×10-6 mol/L.
2.5.2EFLX与EB、DH、Hoechst荧光染料的竞争作用由于EB和DH与BSA的作用方式是典型的嵌入式作用,而Hoechst荧光染料则是与BSA以沟槽式结合[20 - 21],可通过分别比较EB-BSA、DH-BSA、Hoechst-BSA的二元复合物结合常数和加入EFLX后的三元复合物体系的结合常数的大小,来判断药物小分子以何种方式与BSA结合,依1.2.4中的方法扫描各个体系的荧光光谱图,再依据Scatchard方程得出它们的结合常数,列于表5,由表中数据可知典型的嵌入式代表物EB和DH的Ka均比加入EFLX后的三元复合物的结合常数高出一个数量级,故EFLX与EB及EFLX与DH均不存在竞争作用,即EFLX与BSA之间不是嵌入式作用方式。由Hoechst荧光染料的荧光图谱数据可知,EFLX与BSA相互作用为沟槽式。对比表1、表2与表5也可以看出EFLX-BSA与Hoechst+BSA、EFLX+Hoechst-BSA的Ka同属一个数量级,进一步表明EFLX与BSA的作用方式为沟槽式。

表5 EFLX与曙红B、盐酸柔红霉素、赫斯特荧光染料的竞争作用
Note:r7is the correlation coefficients of lg[(F0-F)/F]- lg[Q].
3 结论
利用经典的以蛋白为检测对象的荧光光谱法和以药物小分子为检测对象的荧光光谱法探究了药物小分子与BSA的相互作用,并以紫外光谱法进一步验证。结果表明以具有荧光的药物分子为检测对象的探究方法比经典的以蛋白为检测对象的方法,能更全面、更准确地表达蛋白与药物小分子的相互作用。同时本研究还通过离子强度的影响,以及与染料的竞争实验,进一步验证了EFLX与BSA的作用力类型,并得出EFLX与BSA的结合方式是沟槽式,从分子层面上进一步了解了EFLX的药效、药理,对于新的喹诺酮类光谱抗菌药的开发具有一定的指导作用。
