一种比率型Cu2+电化学传感器及其分析应用
2017-10-16赵灵芝苗延青刘春叶
赵灵芝, 赵 柳, 苗延青, 刘春叶
(1.西安医学院药学院,陕西西安 710021;2.生命分析重点实验室,陕西师范大学化学化工学院,陕西西安 710062;3.北京农业质量标准与检测技术研究中心,北京 100097)
铜是自然环境中普遍存在的重金属,也是人体必需的微量元素之一,但过多的摄入铜会导致中毒,甚至威胁健康,所以建立准确、灵敏检测痕量Cu2+的分析方法具有十分重要的意义[1 - 2]。目前,Cu2+的测定方法主要有原子吸收光谱法、电感耦合等离子体质谱法、紫外-可见分光光度法、荧光法等[3 - 10]。电化学方法检测Cu2+具有仪器设备便宜、操作简便、灵敏度高等诸多优点。该方法是通过把对Cu2+具有富集作用的分子修饰到电极表面来提高Cu2+检测的电化学信号,如聚苯胺、聚氨基酸、聚噻吩等[8,11 - 13]。此外,纳米材料如碳纳米管、石墨烯以及多种纳米材料的复合材料也被引入电极表面来提高Cu2+检测的响应信号[14 - 17]。然而,比率型Cu2+电化学传感器却鲜有报道[18 - 19]。比率型电化学传感方法引入了内参比探针分子,并以目标物的响应信号与内参比探针的响应信号的比值来定量目标物,这种方法可以较好的避免系统误差和人为误差,具有更好的重现性和稳定性。
本研究以吩噻嗪类染料硫堇的聚合物作为内参比探针分子,结合单壁碳纳米管(SWNTs)在结构和电化学催化方面的优越性,通过电化学聚合法将硫堇固定于SWNTs修饰玻碳电极(GCE)上,制得聚硫堇/单壁碳纳米管/玻碳电极(poly-Th/SWNTs/GCE),以该修饰电极为工作电极,建立一种比率型电化学传感器检测Cu2+的电化学新方法,并成功用于自来水样中Cu2+的检测。
1 实验部分
1.1 主要仪器和试剂
CHI760D电化学工作站(上海辰华);SU8020高分辨场发射扫描电镜(日立,日本公司)。电化学实验使用三电极体系:以GCE(Φ=20 mm,高仕睿联公司)或poly-Th/SWNTs为工作电极,Ag/AgCl(饱和KCl溶液)作为参比电极,铂丝作为对电极。
SWNTs(直径<2 nm,长5~30 μm) 购自中国科学院成都有机化学有限公司,碳纳米管在使用之前在2.6 mol/L浓HNO3中回流纯化5 h,过滤清洗,蒸干溶剂,氩气氛围中600 ℃加热3 h,备用。硫堇(Th)购自北京化学试剂公司。掺杂氟的SnO2透明导电玻璃(FTO) 购自深圳华南湘城科技有限公司。1倍的磷酸盐缓冲溶液(PBS)配制:136.7 mmol/L NaCl、2.7 mmol/L KCl、87 mmol/L Na2HPO4·12H2O、14 mmol/L K2HPO4溶于二次蒸馏水,再用NaOH溶液调节pH值。2倍的PBS配制:1倍的PBS所含有盐浓度的2倍,再用NaOH溶液调节pH值。实验中所用的PBS除了实样检测部分,均为1倍的PBS。实验中其它试剂均为分析纯。实验用水为二次蒸馏水。
1.2 修饰电极的制备
GCE在使用之前在抛光布上依次用0.3、0.05 μm的Al2O3粉悬浊液抛光,然后依次用丙酮和二次水超声清洗2 min,N2吹干。3 μL 1 mg/mL SWNTs的N,N-二甲基甲酰胺(DMF) 的悬浮液滴在处理干净的GCE上,红外灯下挥发去溶剂,制得 SWNTs/GCE。将SWNTs/GCE浸泡在含有1 mmol/L Th的PBS中,在电位-0.40~0.10 V范围内,以50 mV/s扫描速度循环扫描30圈,可得到性能优良的蓝色聚合物膜,取出用二次水清洗,以除去吸附不牢的Th,得到poly-Th/SWNTs/GCE。
1.3 实际样品的制备
自来水样品采集于陕西师范大学实验室自来水,样品被收集后与2倍的PBS(pH=7.4)以体积比1∶1混合后作为检测液,将Cu2+标准液用1倍的PBS(pH=7.4)配制10-2、10-3mol/L的原溶液,再将其与检测液以适当比率混合得到相应的加标检测样品。
2 结果与讨论
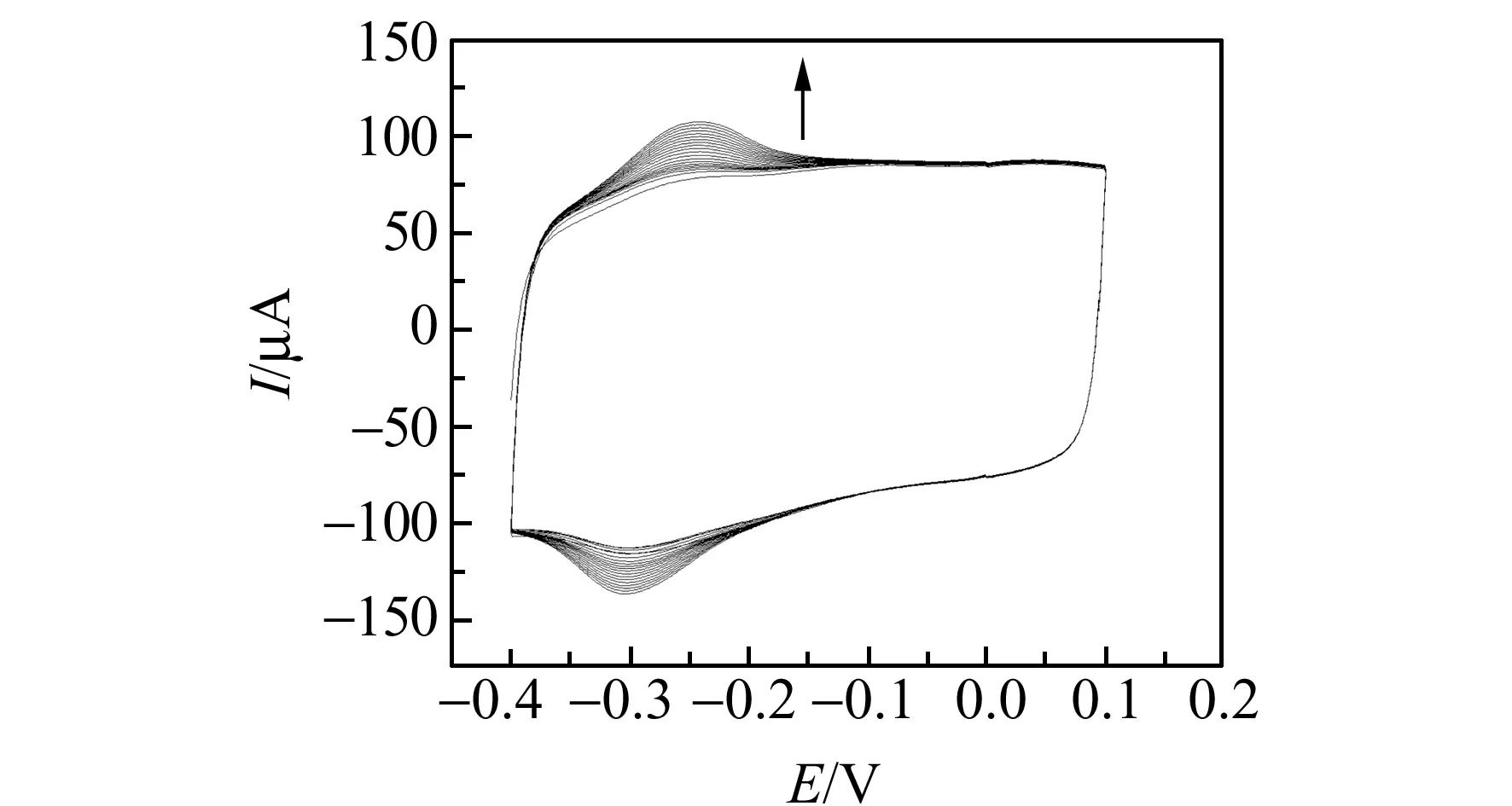
图1 1 mmol/L Th在SWNTs/GCE表面发生电化学聚合的循环伏安图Fig.1 Cyclic voltammograms of the growth process of the polymerization film for 1 mmol/L thiomine at poly-Th/SWNTs/GCEBuffer:0.1 mol/L PBS(pH=7.4);Scan rate:50 mV/s.
2.1 聚硫堇在SWNTs上的电化学行为和表征
本工作选择聚硫堇修饰SWNTs/GCE作为检测Cu2+的传感电极,图1是SWNTs/GCE在含有1 mmol/L硫堇的PBS(pH=7.4)中发生电化学反应的循环伏安图,在-0.28 V电位处,有一对可逆的氧化还原峰,且峰电流随着扫描圈数的增加而增加,说明硫堇在PBS(pH=7.4)中于SWNTs/GCE上发生电化学聚合产生了聚硫堇。在聚合30圈后,取出poly-Th/SWNTs/GCE,重新放入PBS(pH=7.4)复扫得到一稳定的循环伏安图(图略),说明通过电化学聚合法得到了具有稳定聚合物膜修饰的SWNTs/GCE。此外,用扫描电镜(SEM) 表征了硫堇在SWNTs上电聚合后的表面形貌。图2A、2B分别为SWNTs/FTO和poly-Th/SWNTs/FTO的SEM图。未聚合硫堇的FTO表面SWNTs表面光滑;而聚合硫堇的FTO表面SWNTs表面粗糙,这说明成功地通过电化学聚合法将硫堇电聚合至SWNTs表面。

图2 SWNTs/FTO(A)和poly-Th/SWNTs/FTO(B)的扫描电镜(SEM)图Fig.2 SEM images of SWNTs/FTO(A) and poly-Th/SWNTs/FTO(B)
2.2 Cu2+在poly-Th/ SWNTs/GCE上的电化学行为
为建立一种比率型电化学传感器检测Cu2+的电化学方法,本研究比较了Cu2+在不同修饰电极上的电化学行为。首先,将SWNTs修饰于电极表面以期增大Cu2+在电极表面的吸附量从而增大Cu2+溶出峰电流。从图3A可看出,Cu2+溶出峰电位在-0.1 V附近,10 μmol/L Cu2+阳极溶出峰电流响应值约为2 μA;此外,在裸GCE电聚合了硫堇,以期poly-Th表面的大量氨基通过与Cu2+发生的配位作用将更多Cu2+富集于电极表面,从而增大Cu2+的电化学响应。结果如图3B,Cu2+溶出峰电位在0.0 V附近,10 μmol/L Cu2+阳极溶出峰电流约为7 μA。比较上述两图可得以下结论,与裸GCE相比较,SWNTs修饰的GCE加快了Cu2+在电极表面溶出的电子转移速度,使Cu2+在裸GCE上的溶出峰电位由0.0 V负移至-0.1 V;而poly-Th的存在仅增大了Cu2+阳极溶出峰电流,并没有影响Cu2+溶出峰电位。基于此结果,为进一步增大Cu2+的电化学响应,将SWNTs和poly-Th相结合,以poly-Th/SWNTs/GCE作为工作电极,建立一种比率型电化学传感检测Cu2+的电化学方法。如图3C所示,Cu2+的溶出峰电位在-0.1 V附近,10 μmol/L Cu2+阳极溶出峰电流响应值约为25 μA。将结果与上述两图比较,SWNTs和poly-Th的结合进一步增大了Cu2+的电化学响应和降低了Cu2+检测限。
然而,要建立一种比率型电化学传感器检测Cu2+的电化学方法需要满足:第一,可作为内参比的探针在电极表面应具有可逆的氧化还原行为和电化学行为具有稳定性和重现性。poly-Th具有一对可逆的氧化还原峰,在进行多次电化学扫描后以及存储一星期再进行电化学扫描,其氧化还原峰电位均不变,氧化还原峰电流损失不到5%,这些现象说明poly-Th可作为内参比的探针;第二,定量Cu2+是以其电化学响应值与作为内参比探针的电化学响应值比值为定量信号,所以要求内参比探针的氧化还原并不干扰Cu2+的电化学行为。从图3C可知,Cu2+的溶出峰电位-0.1 V与poly-Th的氧化还原峰电位-0.25 V相差0.15 V,所以poly-Th氧化还原并不干扰Cu2+的电化学行为。从以上两点可得出,以poly-Th/SWNTs/GCE作为工作电极,即以poly-Th作为内参比探针,可建立一种比率型检测Cu2+的电化学方法。

图3 Cu2+在不同电极上的循环伏安图Fig.3 Cyclic Viltammograms of Cu2+ at different electrode(A) SWNTs/GCE,the concentration of Cu2+:0,10,100,500 μmol/L (a,b,c,d);(B) poly-Th/GCE,the concentration of Cu2+:0,10,30,50 μmol/L (a,b,c,d);(C) poly-Th/ SWNTs/GCE,the concentration of Cu2+:0,10,30,50 μmol/L (a,b,c,d).buffer:0.1 mol/L PBS(pH=7.4).accumulation potential:-0.80 V,accumulation time:100 s,scan rate:50 mV/s.
2.3 检测条件的优化
实验首先考察了pH对poly-Th在SWNTs/GCE上氧化还原行为的影响,见图4A。结果表明:在pH=5.0~12.0范围内,poly-Th氧化还原峰电流在pH=10.0时达到最大值,但总体上poly-Th氧化峰电流随pH 变化差异不大;poly-Th氧化还原峰电位均随着pH值增大而负移,表观电位:E=(Epa+Epc)/2,随溶液pH值的变化率为51 mV/pH(25 ℃),因此说明poly-Th电化学氧化还原过程中有质子参与反应。在此基础上,考察了pH对Cu2+在poly-Th/SWNTs/GCE上溶出行为的影响,见图4B。结果表明:在pH=5.0~12.0范围内,Cu2+氧化还原峰电流在pH=5.0时达到最大值,这归结于Cu2+在pH<7的酸性条件下,有较大的溶解度;而在pH>7的碱性条件下,易形成Cu(OH)2沉淀使溶液中Cu2+浓度大幅度降低。由于后续要将所建方法用于自来水中Cu2+检测,所以选择pH=7.4为后续实验条件。

图4 (A) poly-Th/SWNTs/GCE在不同缓冲溶液中的循环伏安图;(B)20 μmol/L Cu2+在poly-Th/SWNTs/GCE上于不同缓冲溶液中的循环伏安图Fig.4 (A) Cyclic voltammograms of poly-Th/SWNTs/GCE in different buffer;(B) Cyclic voltammograms of 20 μmol/L Cu2+ at poly-Th/SWNTs/GCE in different buffer solutionfrom left to right:0.1 mol/L NH4Cl-NH3 buffer(pH=12.0,a;pH=10.0,b) 0.1 mol/L PBS(pH=7.4,c),0.1 mol/L HAc-NaAc buffer(pH=5.0,d ).accumulation potential:-0.80 V,accumulation time:100 s,scan rate:50 mV/s.
此外,考察了富集电位和富集时间对Cu2+在poly-Th/SWNTs/GCE上溶出行为的影响。对于富集电位,分别选择-0.80、-0.60、-0.40、-0.20 V为代表值,发现随着富集电位负移,Cu2+溶出峰电流增大,所以后续实验均选用-0.80 V为富集电位。对于富集时间,分别选择0、20、40、80、100、120 s为代表,结果表明:在-0.8 V处,100 s以内Cu2+的溶出峰电流随着富集时间增加而增加;继续增大富集时间,Cu2+的溶出峰电流与100 s的峰电流基本重合,说明100 s后峰电流趋于稳定,Cu2+已达吸附平衡,因此本实验选择最佳富集时间为100 s。
2.4 干扰离子的影响
考虑到poly-Th/SWNTs/GCE对其他金属离子也会产生吸附作用,从而可能对Cu2+测定造成干扰,实验考察了部分常见离子对修饰电极测定20 μmol/L Cu2+的影响。结果见表1。

表1 干扰离子对检测结果的影响
2.5 线性范围与检测限
以pH=7.4 PBS作为测定Cu2+的底液,设置富集电位为-0.8 V,富集时间为100 s,采用阳极溶出线性扫描法测定不同浓度的Cu2+在电极上的伏安曲线。实验结果显示:Cu2+在1~25 μmol/L范围内,阳极溶出峰电流ICu2+与poly-Th的氧化峰电流ITh的比值与Cu2+的浓度呈很好的线性关系,线性方程为:ICu2+/ITh=0.095cCu2+(μmol/L)+0.205,相关系数R值达0.98,检测限为96 nmol/L。
2.6 实际样品测定
利用该电化学传感器对实验室自来水样进行检测,根据标准曲线计算水样中含有Cu2+约1.3 μmol/L,再向实验室自来水样品加入Cu2+标准溶液,进行回收率试验。结果表明,在优化条件下,利用poly-Th/SWNTs/GCE对加标样品测定3次,加标回收率较好,可用于实际样品的分析。

表2 加标水样中Cu2+含量的测定(n=3)
3 结论
本研究以硫堇聚合物作为内参比探针分子,通过电化学聚合的方法将硫堇聚合于单壁碳纳米管修饰的玻碳电极上,并以该修饰电极为工作电极,采用阳极溶出法检测Cu2+,进而建立了一种比率型电化学传感器检测Cu2+的电化学方法。实验结果表明,该电化学分析方法可以有效的避免系统误差和人为误差,方法的检测限为96 nmol/L,具有比直接定量的方法更好的重现性和稳定性,为快速、简便、准确的检测Cu2+提供了新的思路。
