聚苯乙烯-甲基丙烯醛缩氨基硫脲固相萃取填料的制备及性能的研究
2017-10-16申书昌冷茉含
申书昌*, 王 洋, 于 静, 冷茉含
(齐齐哈尔大学分析测试中心,黑龙江齐齐哈尔 161006)
重金属会在生物体内蓄积而致机体中毒而损坏[1 - 2]。但由于基体干扰或含量达不到检测限,使得环境样品中痕量重金属的检测还难于直接进行仪器分析[3]。因此对目标物进行分离和预富集的样品前处理方法的研究成为了一项重要的课题。重金属分析的样品前处理方法中,固相萃取是一种具有操作简单、快速、避免乳化现象、便于自动化操作的新技术[4 - 7]。由于螯合型固相萃取吸附剂的吸附性能优于离子交换型,因此目前的研究主要集中在螯合型固相萃取吸附剂的吸附机理上[8 - 11]。螯合型固相萃取吸附剂依靠其高分子链上的官能团与金属离子配位形成螯合物,因此其配体的结构是决定螯合树脂配位性能的关键[12 - 14]。金属螯合物的稳定性与螯合基团的种类、螯合物结构和金属离子种类相关,不同的螯合基团对不同的金属离子具有不同的选择吸附能力[15 - 17]。螯合基团与被萃取的金属离子生成的螯合物越稳定,萃取效率越高。配位基团数目越多、吸附容量越大。最常见的配位原子有氧、硫、氮、磷等。高分子链结构对吸附性能也有较大的影响。聚苯乙烯类载体具有较高的机械强度和耐酸碱性,合成反应易于控制。
本文以苯乙烯为骨架单体,甲基丙烯醛为亲水单体,合成带有醛基的聚合物,再与螯合基团氨基硫脲进行缩合成聚苯乙烯-甲基丙烯醛缩氨基硫脲螯合树脂。与传统的聚苯乙烯骨架螯合树脂的合成方法相比,工艺简单,无副产物,环境友好,配位原子含量高,对金属离子吸附容量大。以该树脂作为固相萃取填料用于水中痕量Ag+、Pb2+、Mn2+、Cu2+、Cd2+、Fe3+、Hg2+、Ni2+、Co2+和Cr3+的分离与富集,获得了满意的效果。
1 实验部分
1.1 仪器与试剂
S-3400扫描电子显微镜(日本,日立公司);ICE3500原子吸收光谱仪(美国,赛默飞世尔科技公司);Spectrun one FT-IR红外光谱仪(美国,Pekin Elmer公司);EscaLab 250Xi X射线光电子能谱仪(美国,Thermo Scientific公司);固相萃取(SPE)装置(美国,Supelco公司);Milli-Q Advantage超纯水制备仪(东南科仪)。
Ag+、Pb2+、Mn2+、Cu2+、Cd2+、Fe3+、Hg2+、Ni2+、Co2+、Cr3+标准溶液(国家有色金属及电子材料分析测试中心)。Cd(NO3)2、Cu(NO3)2、Ni(NO3)2、AgNO3、FeCl3、CoCl2(分析纯,天津市光复科技发展有限公司),MnSO4(分析纯,沈阳试剂二厂),Pb(NO3)2(分析纯,沈阳试剂四厂),Hg(NO3)2(分析纯,天津耀华化工厂),Cr(NO3)3、无水乙醇、冰乙酸、偶氮二异丁腈、NaOH(分析纯,天津市凯通化学试剂有限公司),聚乙烯吡咯烷酮、苯乙烯(分析纯,天津市大茂化学试剂厂),HNO3(高纯,天津市风船化学试剂科技有限公司),甲基丙烯醛(分析纯,阿拉丁试剂有限公司),甲醇(色谱纯,天津市光复精细化工研究所),硫代氨基脲(分析纯,阿拉丁试剂有限公司),三乙醇胺(分析纯,哈尔滨市新达化工厂)。
1.2 合成步骤
1.2.1苯乙烯-甲基丙烯醛聚合物的制备向三口瓶中加入26 mL水和0.28 g的聚乙烯吡咯烷酮至溶解,再将0.15 g偶氮二异丁腈和2.8 mL苯乙烯、2.0 mL甲基丙烯醛混合倒入三口瓶中,在N2保护下于70 ℃恒温水浴,400 r/min搅拌的条件下反应8 h,得到白色固体。产物经洗涤、真空抽滤后放入60 ℃真空干燥箱中干燥24 h,备用。
1.2.2聚苯乙烯-甲基丙烯醛缩氨基硫脲的合成称取0.5 g聚苯乙烯-甲基丙烯醛聚合物溶于10 mL N,N-二甲基甲酰胺中,将溶液移入100 mL三口烧瓶内,缓慢加入10 mL的0.5 g氨基硫脲-N,N-二甲基甲酰胺溶液,再向三口瓶内滴加8滴冰乙酸,磁力搅拌,于温度85 ℃下反应4 h,得到黄色溶液,蒸去溶剂后得到黄色固体,产物经洗涤、真空抽滤后,放入120 ℃真空干燥箱中干燥24 h,研磨备用。
1.2.3固相萃取小柱的制备将固相萃取小柱管和筛板用甲醇洗净、晾干后,将筛板平放至小柱底端并压实,称取一定量自制的固相萃取填料装入固相萃取小柱内,将筛板放入固相萃取小柱中并压实。
1.3 金属离子的吸附实验
1.3.1标准溶液的配制分别取0.01、0.05、0.1、0.3、0.5、0.7、1 mL的1 000 mg/L Ag+、Pb2+、Mn2+、Cu2+、Cd2+、Fe3+、Hg2+、Ni2+、Co2+和Cr3+标准溶液并定容至100 mL容量瓶中,得到Ag+、Pb2+、Mn2+、Cu2+、Cd2+、Fe3+、Hg2+、Ni2+、Co2+、Cr3+分别为0.1、0.5、1、3、5、7、10 mg/L的标准系列溶液。
1.3.2实验样品的配制准确称取0.0787 g AgNO3,0.0799 g Pb(NO3)2,0.1372 g Cd(NO3)2,0.1901 g Cu(NO3)2,0.1538 g MnSO4,0.2478 g Ni(NO3)2,0.3848 g Cr(NO3)3,0.0854 g Hg(NO3)2,0.2420 g FeCl3,0.2019 g CoCl2混合溶解后,定容至500 mL容量瓶中,取10 mL此溶液于100 mL容量瓶中,用水定容,得到各金属离子的浓度均为10 mg/L。
1.3.3金属离子的萃取及分析将制备的固相萃取小柱安装在固相萃取装置上,以0.5 mL/min的流速将100 mL实验样品通过固相萃取小柱,待小柱内溶液抽至近干后,用10 mL 5 mol/L HNO3和0.25 mL三乙醇胺的混合液洗脱,洗脱液用水定容至100 mL,然后用原子吸收法分别测定各金属离子含量。
2 结果与讨论
2.1 产物的表征与分析
2.1.1红外光谱分析图1为产物的红外光谱图。由图可知,3 000 cm-1左右处为苯环-CH的伸缩振动;756.95 cm-1和697.58 cm-1为苯环的一取代峰;1 372.5 cm-1为甲基中-CH的伸缩振动;1 649.68 cm-1是C=N伸缩振动;1 203.72 cm-1为C=S的伸缩振动;3 372.69 cm-1是-NH的伸缩振动。由此说明产物为聚苯乙烯-甲基丙烯醛缩氨基硫脲。
2.1.2扫描电子显微镜分析图2为聚苯乙烯-甲基丙烯醛缩氨基硫脲固相萃取填料的电子扫描显微镜图。从该图可见该固相萃取填料的尺寸为40×30 μm到60×30 μm。
2.1.3元素分析通过扫描电镜对制备的固相萃取填料表面进行元素分析。结果表明:C、N和S三种元素的质量百分比分别为65.97%、18.54%和15.49%,原子百分比分别为75.32%、17.87%和6.81%,测定值与理论值相符。图3为制备的固相萃取填料中N元素和S元素的表面微区分布图,表明N元素和S元素均匀分布在颗粒表面,能够使萃取填料有较大的萃取容量和较好的重现性。
2.1.4X射线光电子能谱分析X射线光电子能谱(XPS)能够测定固体表明的化学组成或元素组成,原子的化学环境。图4为N元素和S元素的XPS图,经过分峰后得出,结合能位置在399.74 eV处拟合峰为-NH2基团;结合能位置在400.00 eV处拟合峰为-NH基团;结合能位置在401.00 eV处拟合峰为C=N 基团;结合能位置在162.00 eV处拟合峰为S=C基团,说明该固相萃取填料中含有C=N、-NH、-NH2和C=S。

图1 聚苯乙烯-甲基丙烯醛缩氨基硫脲填料的红外光谱图Fig.1 The infrared spectrum of polystyrene-methacrolein thiosemicarbazone fillers

图2 聚苯乙烯-甲基丙烯醛缩氨基硫脲填料扫描电镜(SEM)图Fig.2 SEM of polystyrene-methacrolein thiosemicarbazone fillers

图3 填料表面N元素和S元素的面扫描图Fig.3 Surface scan of nitrogen and sulfur elements on the surface of the fillers 图4 聚苯乙烯-甲基丙烯醛缩氨基硫脲填料中N元素和S元素的XPS分峰拟合图Fig.4 XPS spectra of nitrogen and sulfur elements of polystyrene-methacrolein thiosemicarbazone filler
2.2 固相萃取填料对重金属离子的吸附性能
2.2.1吸附容量称取0.05 g自制固相萃取填料制成固相萃取小柱,取100 mL 10 mg/L的混合金属离子溶液,在溶液pH=5、流速为0.5 mL/min的条件下通过萃取柱,每隔20 min测定流出液浓度,计算得出吸附容量,并以时间为横坐标,吸附容量为纵坐标绘制曲线,见图5。由图5可知,固相萃取填料对Ag+、Pb2+、Mn2+、Cu2+、Cd2+、Fe3+、Hg2+、Ni2+、Co2+和Cr3+的吸附容量分别为12.21、11.42、7.20、12.42、10.07、9.28、11.78、7.34、9.64和10.42 mg/g。
2.2.2流速对回收率的影响在pH=5的条件下,将10 mg/L的混合金属离子溶液以不同的速度通过固相萃取小柱,洗脱定容后,通过原子吸收法对金属离子的浓度进行测定,计算得出回收率。以流速为横坐标,回收率为纵坐标绘制曲线,见图6。由图6可知,随着流速增加,固相萃取填料对金属离子的回收率逐渐降低。当流速为0.5 mL/min 时,萃取小柱对Ag+、Pb2+、Mn2+、Cu2+、Cd2+、Fe3+、Hg2+、Ni2+、Co2+和Cr3+的回收率分别为98.94%、97.80%、92.17%、99.80%、96.36%、94.59%、98.24%、93.23%、95.35%和96.98%。
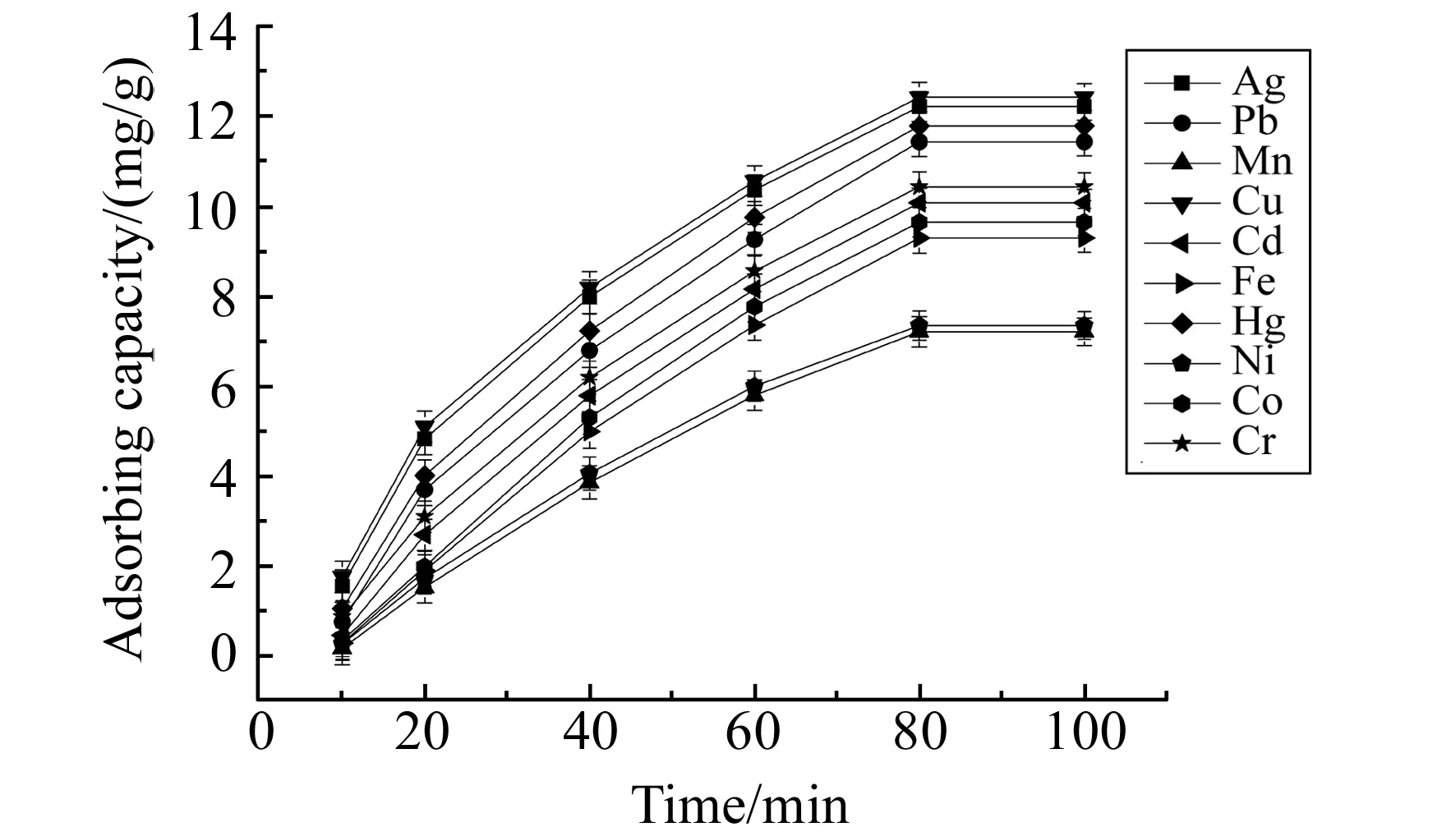
图5 金属离子在吸附剂上吸附容量与时间的关系曲线Fig.5 The time dependence of the adsorption capacity of metal ions on the adsorbent

图6 流速对回收率的影响Fig.6 The influence of velocity on recovery
2.2.3pH对回收率的影响取10 mg/L的混合金属离子溶液,用稀HCl调节到不同的pH值,在流速为0.5 mL/min的条件下经过固相萃取小柱,洗脱定容后,通过原子吸收法对金属离子的浓度进行测定,计算回收率。以pH值为横坐标,回收率为纵坐标绘制标准曲线,见图7。由图7可知,随着pH值的增加,填料对重金属离子的回收率逐渐升高,但当pH值大于5后回收率逐渐降低,因此,制备的固相萃取填料对重金属吸附的最佳pH值为5。
2.2.4萃取小柱的穿透体积分别取0.5 mL 1 000 mg/L的混合金属离子储备液加入到盛有10、20、40、60、80、100、120、140、160、180、200、220、240和250 mL纯水的烧杯中,经固相萃取小柱萃取,再用10 mL 5 mol/L的HNO3和三乙醇胺的混合溶液洗脱,将洗脱液定容至100 mL,采用原子吸收法检测各金属离子的浓度,计算金属离子的回收率。以金属离子的回收率为纵坐标,流过小柱的体积为横坐标绘制穿透曲线。由图8可见,试样过柱体积应小于120 mL。

图7 pH对回收率的影响Fig.7 The influence of pH on recovery
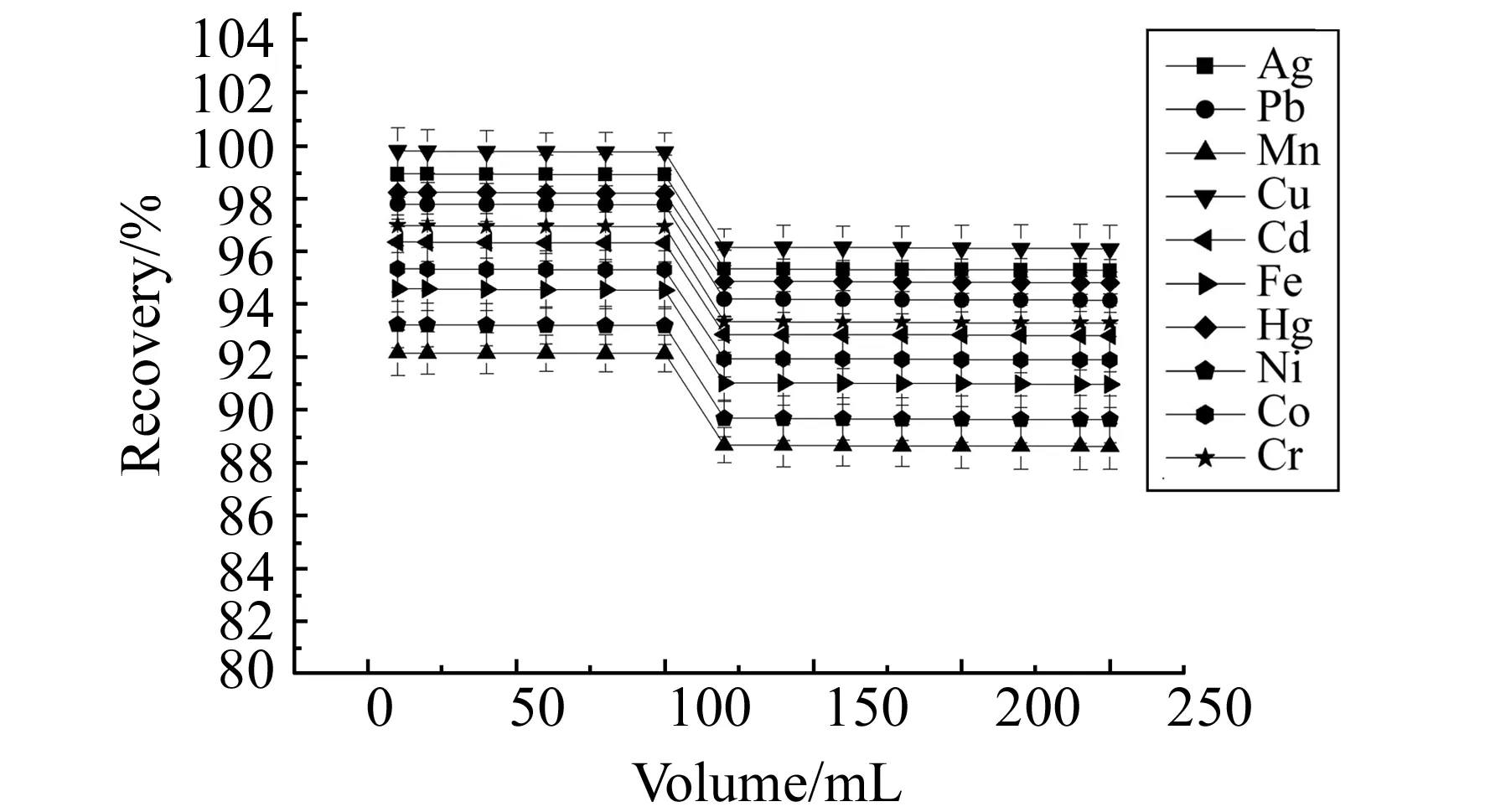
图8 固相萃取小柱的穿透体积曲线Fig.8 The breakthrough curves of the solid phase extraction column
2.3 方法的线性关系及检出限
根据原子吸收法对标准溶液的测定数据,在0.1~10 mg/L范围内,分别以浓度(x)为横坐标,吸光度(y)为纵坐标绘制标准曲线,再利用纯水做空白溶液重复测定11次,计算标准偏差,并以3倍空白溶液的标准偏差除以斜率得出检出限,结果见表1。

表1 方法的回归方程、检出限和相对标准偏差(n=11)
3 结论
以苯乙烯、甲基丙烯醛和硫代氨基脲制备的聚苯乙烯-甲基丙烯醛缩氨基硫脲固相萃取填料,对Ag+、Pb2+、Mn2+、Cu2+、Cd2+、Fe3+、Hg2+、Ni2+、Co2+和Cr3+的吸附容量分别为12.21、11.42、7.20、12.42、10.07、9.28、11.78、7.67、9.64和10.42 mg/g。样品的最佳流速为0.5 mL/min,最佳pH值为5,穿透体积为120 mL。
