改良大鼠离体肝脏灌注模型在供肝冷保存中的应用研究*
2017-10-16施少军郑建新李小康
施少军 郑建新 秦 天 李小康 薛 峰 夏 强&
上海交通大学医学院附属仁济医院肝脏外科1(200127) 日本国立儿童成长与发育研究所2
·论 著·
改良大鼠离体肝脏灌注模型在供肝冷保存中的应用研究*
施少军1#郑建新1秦 天1李小康2薛 峰1夏 强1&
上海交通大学医学院附属仁济医院肝脏外科1(200127)日本国立儿童成长与发育研究所2
背景:供肝冷保存和缺血再灌注损伤是影响肝移植患者预后的关键因素,建立稳定的冷保存再灌注动物模型是开展相关研究的基础。目的:建立适用于综合评价供肝质量的改良大鼠离体肝脏灌注模型,为供肝冷保存研究提供合适的离体再灌注模型。方法:12只Sprague-Dawley大鼠随机分为两组,对照组正常获取供肝后进行离体灌注90 min,实验组供肝经30 min热缺血后获取,冷保存24 h后再行离体灌注。离体灌注期间监测灌注液转氨酶水平、电解质浓度和pH值;以压力感受器监测供肝门静脉压力;以超微自由基探针监测肝组织过氧化氢(HPO)水平。灌注结束后记录胆汁流出量,检测供肝组织丙二醛(MDA)、超氧化物歧化酶(Cu/Zn SOD)水平及其组织病理学改变和肝细胞凋亡情况。结果:与对照组相比,实验组供肝AST、ALT水平、门静脉压力和HPO水平明显增高,胆汁流出量显著减少,肝组织Cu/Zn SOD水平显著降低。对照组供肝组织病理学损伤和肝细胞凋亡相对较轻。结论:经热缺血和冷保存后,供肝的肝功能和抗氧化能力均明显降低。本研究构建的改良大鼠离体肝脏灌注模型可有效监控和评估大鼠供肝冷保存再灌注损伤情况。
肝移植; 器官保存; 离体灌注; 再灌注损伤; 大鼠,Sprague-Dawley
Correspondenceto: XIA Qiang, Email: xiaqiang@shsmu.edu.cn
Background: Cold storage and ischemia-reperfusion injury of liver grafts are critical for the prognosis of patients undergoing liver transplantation. Establishing a stable cold storage and reperfusion animal model is a fundamental measure for related studies.Aims: To establish a modified isolated perfused rat liver model for comprehensive assessment of liver grafts in studies on preservation of liver grafts before transplantation.Methods: Twelve Sprague-Dawley rats were randomly allocated into two groups. Livers of rats in control group were retrieved and perfused immediately for 90 minutes without preservation. In experimental group, liver grafts underwent a 30-minute warm ischemia followed by 24-hour cold storage beforeexvivoperfusion. The perfusate was collected dynamically for monitoring the levels of transaminases, electrolytes and pH value; the portal vein pressure of liver grafts was measured by pressure sensor, and the hepatic hydrogen peroxide (HPO) level was assessed by microprobe for free radicals. The bile production was recorded after theexvivoperfusion; meanwhile, the levels of malondialdehyde (MDA) and superoxide dismutase (Cu/Zn SOD), the histopathological changes and apoptosis of hepatocytes of liver grafts were examined.Results: Compared with the control group, the levels of AST and ALT, the portal vein pressure and the HPO level of liver grafts in experimental group were obviously increased throughout the perfusion. Furthermore, the bile production and level of Cu/Zn SOD of liver grafts in experimental group were significantly decreased. The histopathological injury and hepatocytes apoptosis of liver grafts were milder in control group.Conclusions: The liver function and antioxidant effect were reduced in warm ischemic and cold preserved liver grafts. The modified isolated perfused rat liver model established in this study is useful for monitoring and evaluation of the cold storage and reperfusion injury in liver grafts.
KeywordsLiver Transplantation; Organ Preservation; Isolated Perfusion; Reperfusion Injury; Rats, Sprague-Dawley
肝移植术后出现原发性移植肝无功能和移植肝功能恢复延迟是目前肝移植领域面临的严峻挑战之一,而供肝冷保存和缺血再灌注损伤是导致上述问题,进而影响肝移植患者预后的关键因素。大鼠离体肝脏灌注(isolated perfused rat liver, IPRL)模型是研究肝脏生理学和病理生理学改变的理想模型,在肝脏药理毒理学研究中有着广泛的应用。本研究拟建立适用于综合评价供肝质量的改良大鼠离体肝脏灌注(modified IPRL, MIPRL)模型,以期为供肝冷保存研究提供合适的离体再灌注模型,从而有利于器官保存液的研发和筛选。
材料与方法
一、实验动物、主要试剂和仪器
近交系雄性Sprague-Dawley大鼠12只,体质量(250±16) g,购自上海杰思捷实验动物有限公司。Celsior器官保存液(Catalent, Inc.);改良Krebs-Henseleit灌注液(Sigma-Aldrich Co. LLC.);丙二醛(MDA)检测试剂盒、超氧化物歧化酶(Cu/Zn SOD)检测试剂盒(上海碧云天生物技术有限公司);TUNEL法细胞凋亡检测试剂盒(Roche公司)。水浴恒温振荡器(上海梅香仪器有限公司);精密蠕动泵(泵头YZ1515x,兰格恒流泵有限公司);大鼠型膜式氧合器、大鼠型热交换器(西安西京医疗用品有限公司);YP200压力换能器(北京新航兴业科贸有限公司),PowerLab 4/26数据采集分析系统(ADInstruments Ltd.);超微自由基探针、气体信号分子和生物自由基检测仪(WPI公司)。
二、方法
1. 分组:将12只Sprague-Dawley大鼠随机分为对照组和实验组。对照组:正常获取供肝后进行离体灌注90 min;实验组:供肝经30 min热缺血后获取,置于4 ℃ Celsior器官保存液中保存24 h,再行离体灌注90 min。
2. MIPRL模型建立:术前不禁食,戊巴比妥钠(35 mg/kg)腹腔注射麻醉。正中十字切口开腹,逐层解剖止血,游离肝脏周围韧带;游离胆总管,插入直径1 mm PE导管,结扎固定;经股静脉注射50 IU肝素;游离门静脉,结扎侧支静脉,16G静脉留置针插管,连接高度15 cm的灌注吊瓶。热缺血时间为门静脉插管起至离体灌注前。于右肾侧上方结扎分离肝下下腔静脉;打开膈肌,肝上上腔静脉处插管,经吊瓶滴注4 ℃含肝素Ringer’s液50 mL;获取供肝,称取肝重(liver weight, LW)。对照组供肝立即行离体灌注,实验组供肝置于4 ℃Celsior器官保存液中密封保存24 h后再行离体灌注。
离体再灌注系统由置肝皿、存液瓶、水浴恒温振荡器(2个)、蠕动泵、膜式氧合器、热交换器、压力感受器、胆汁收集管、过氧化氢(hydrogen peroxide, HPO)探针和管道组成(图1)。灌注前将灌注液pH值调定至7.4,加温至37 ℃。供肝离体再灌注循环由门静脉流入,流速设定为3 mL·g-1·min-1,经肝脏从上腔静脉流出至置于37 ℃水浴中的存液瓶,再经蠕动泵抽取,泵入膜式氧合器氧合,通氧流量为1 L/min,入肝前经热交换器加温,维持37 ℃的灌流温度。
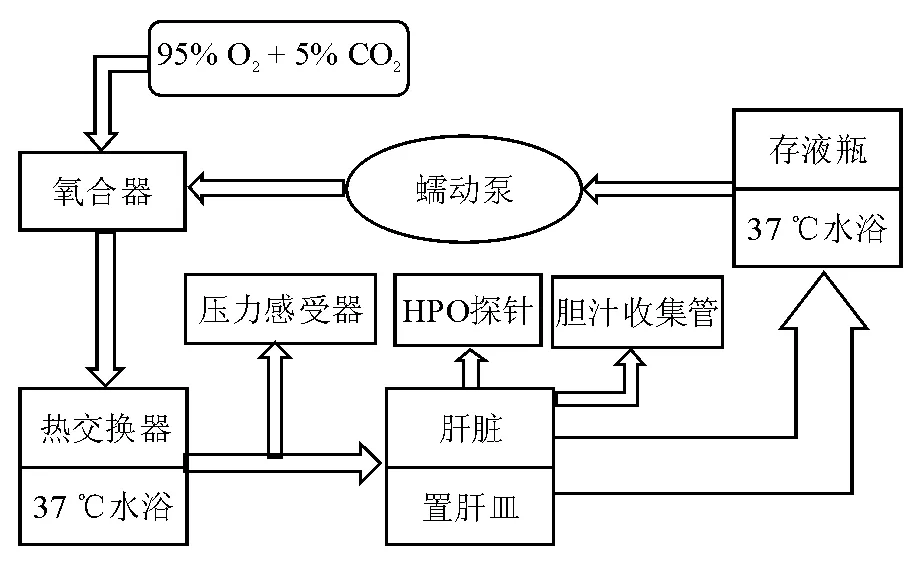
图1 离体再灌注系统组成及其循环模式
3. 离体再灌注系统监控指标:监控时间点为再灌注15、30、60、90 min。①灌注液AST、ALT水平、电解质浓度和pH值;②门静脉压力(portal vein pressure, PVP):以压力感受器进行监测,数据以门静脉压指数(PVP/LW, mm Hg/g)呈现;③HPO电压值(HPOv):以HPO探针插入供肝固定位置(左外侧叶)进行监测,数据以HPOv/LW(mV/g)呈现; ④胆汁流出量:于灌注结束时测量。
4. MDA、Cu/Zn SOD检测:灌注结束后切取少量供肝组织(左外侧叶),与0.9% NaCl溶液按 1∶9制备成10%组织匀浆0.1 mL,3 000 r/min离心10 min,取上清。分别采用硫代巴比妥酸法和WST-8法检测MDA和Cu/Zn SOD水平,按试剂盒说明书进行操作。
5. 供肝组织病理学检查:灌注结束后,切取大小为0.5 cm×0.5 cm×0.5 cm的供肝组织(左外侧叶),4%多聚甲醛固定24 h,石蜡包埋,8 μm厚切片,HE染色,光学显微镜下观察。
6. 肝细胞凋亡检测:供肝组织石蜡切片常规脱蜡、水化,按TUNEL试剂盒说明书流程操作。肝细胞出现调亡时,阳性细胞核呈黄色或棕色,衬染细胞核呈蓝色。随机选取10个400倍视野,计算细胞核中有棕黄色颗粒的凋亡细胞在同一视野下所有细胞中所占比例,即凋亡指数。
三、统计学分析
结 果
一、离体再灌注系统监控指标
对照组和实验组供肝灌注液中的转氨酶水平和电解质浓度均随灌注时间的延长而逐步升高,pH值则随灌注时间的延长而逐步降低,其中实验组各时间点AST水平和30、60、90 min时的ALT水平显著高于对照组(P<0.05)(图2A、2B),两组间各时间点Na+、K+浓度和pH值差异则无统计学意义(P>0.05)(表1、图2C);两组供肝PVP/LW在灌注过程中基本平稳,其中实验组30、60 min时显著高于对照组(P<0.05)(图2D);两组供肝组织HPOv/LW均随灌注时间的延长而逐步升高,其中实验组 30 min 时显著高于对照组(P<0.05)(图2E)。实验组供肝在再灌注过程中的胆汁流出量为(38.1±22.8) μL,显著低于对照组的(98.4±56.3) μL(P<0.01)。
二、氧化应激指标
离体灌注结束后,实验组供肝组织MDA水平为(6.20±3.07) nmol/mg,虽然略高于对照组的(4.17±1.61) nmol/mg,但两组间差异无统计学意义(P>0.05);实验组Cu/Zn SOD水平为(36.76±13.85) U/mg,低于对照组的(83.34±9.79) U/mg,两组间差异有统计学意义(P<0.05)。
三、供肝组织病理学表现和肝细胞凋亡情况
对照组离体灌注结束后供肝肉眼观察呈均匀的土黄色,表面光滑,质地柔软;光学显微镜下肝小叶组织结构完整,肝细胞条索排列整齐, 未见明显肿胀、变性、坏死(图3A),TUNEL染色鲜有阳性细胞(图3C)。实验组离体灌注结束后供肝肉眼观察肝叶边缘有散在的淤血灶,余均呈均匀的土黄色;光学显微镜下可见部分肝小叶破坏,肝细胞条索排列紊乱,部分肝细胞肿胀变性,但鲜有坏死灶(图3B),TUNEL染色可见较多阳性细胞(图3D),凋亡指数显著高于对照组(P<0.05)(图3E)。
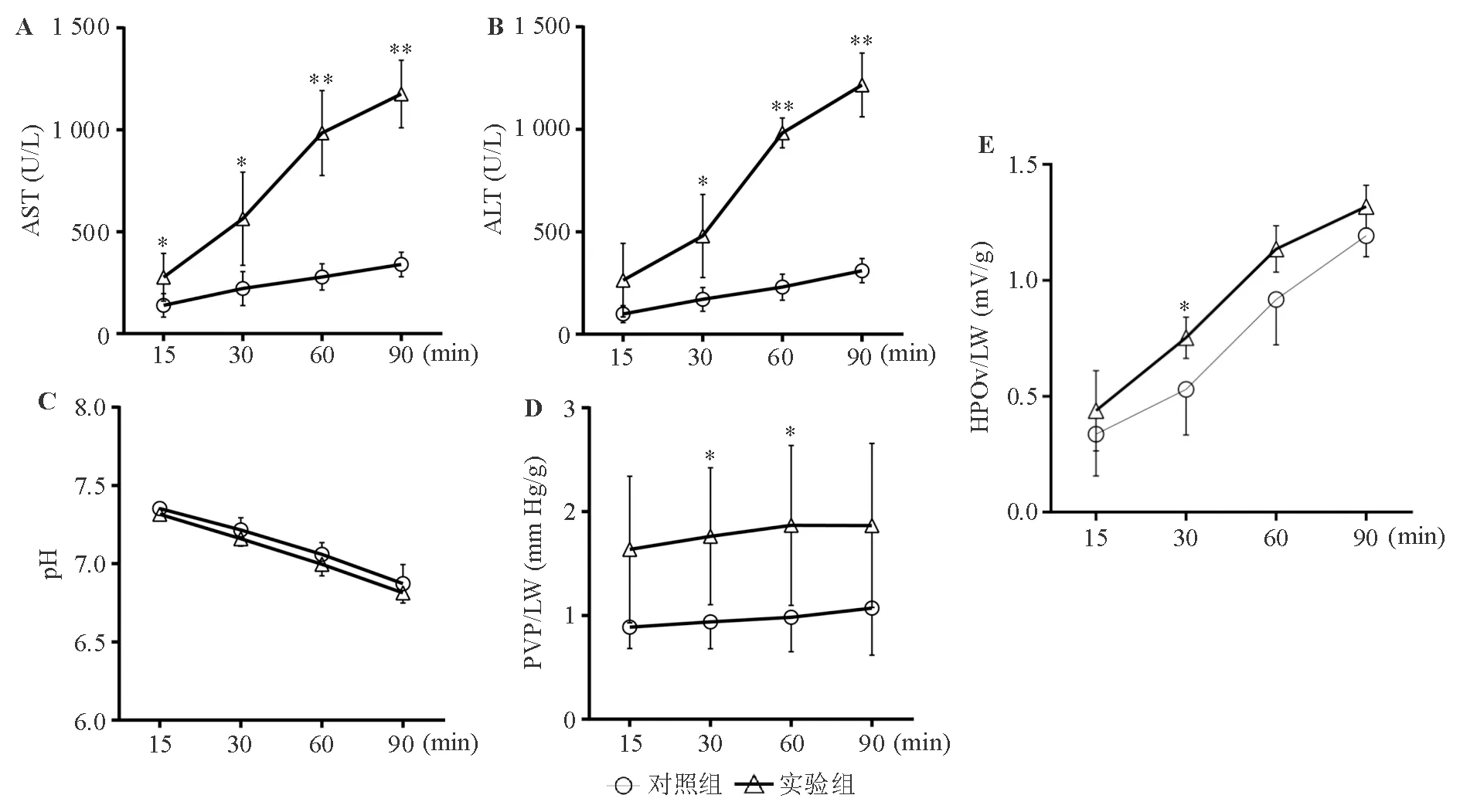
两组间比较,*P<0.05,**P<0.01
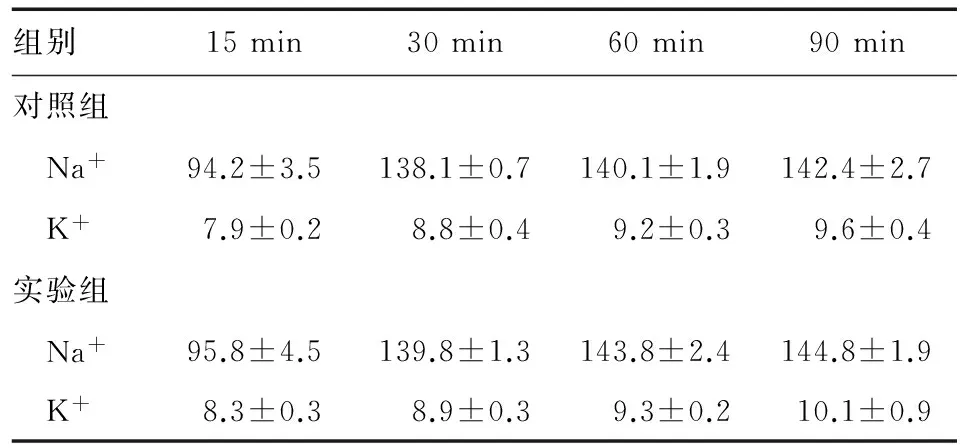
组别15min30min60min90min对照组 Na+94.2±3.5138.1±0.7140.1±1.9142.4±2.7 K+7.9±0.28.8±0.49.2±0.39.6±0.4实验组 Na+95.8±4.5139.8±1.3143.8±2.4144.8±1.9 K+8.3±0.38.9±0.39.3±0.210.1±0.9
讨 论
肝移植是绝大部分终末期肝病患者惟一有效的治疗方式。随着手术技术、围手术期护理以及免疫抑制治疗的长足进展,接受肝移植患者的短期和长期生存率都得到了很大的提升。尽管如此,随访数据表明移植肝原发性肝功能障碍、迟发性肝无功能、原发性肝无功能以及血管和胆管并发症的发生率仍高达20%[1]。此外,供肝短缺仍是肝移植领域中最根本的问题。有学者认为“边缘供肝”是解决目前供肝短缺困境的有效途径之一,然而边缘供肝往往来源于老龄、伴发脂肪肝以及无心跳供体(non-heart-beating donors, NHBD),对缺血再灌注损伤的耐受性较差,原发性移植肝无功能的发生率往往高于活体肝移植供体或脑死亡供体[2-3]。因此,对供肝冷保存和再灌注采取必要的保护性干预措施,从而减小损伤、改善供肝质量是目前肝移植研究领域的热点课题之一。
在冷保存期间,供肝N+-K+-ATP酶活性受到抑制,引起N+、Cl-内流增加、继发性胞内Ca2+失衡以及细胞水肿。同时,无氧代谢导致线粒体功能障碍和中性粒细胞激活,促使大量自由基产生并损伤血管内皮细胞[4]。由于肝脏血管内皮细胞对缺氧和低能量供应非常敏感,供肝易发生结构改变和损伤[5]。研究表明,供肝冷保存期间的肝血管内皮细胞损伤是缺血再灌注损伤的起始因子,可直接引发血小板激活、血管收缩、中性粒细胞聚集、Kupffer细胞激活、氧化应激等一系列病理生理级联反应,最终导致肝功能障碍[6]。
随着供肝的复流,“氧爆发”所致的自由基生成和炎症反应直接损伤肝组织,引发一系列细胞毒性反应。目前主流观点认为,缺血再灌注损伤可分为早期和后期两个阶段[7]。供肝复流后2 h内为早期阶段,这一阶段以氧化应激损伤为主,过量生成的自由基可直接与胞内大分子如DNA、蛋白质、脂质等结合,从而损害细胞功能[8]。巨噬细胞激活是氧化应激的主要机制,其能损伤血管内皮细胞,并释放大量细胞外来源的自由基和炎症介质[9]。此外,中性粒细胞激活[9]、线粒体功能障碍[10]、内质网应激[11]均能促进自由基生成以及细胞坏死或凋亡。缺血再灌注损伤的后期阶段一般发生在供肝复流后6~24 h[12]。现有研究表明,缺血再灌注后期阶段的损伤主要是由胞外自由基介导的炎症反应所引起,中性粒细胞激活、肿瘤坏死因子-α(TNF-α)、自由基、白细胞介素-1β(IL-1β)均为该过程中的关键因子[13]。
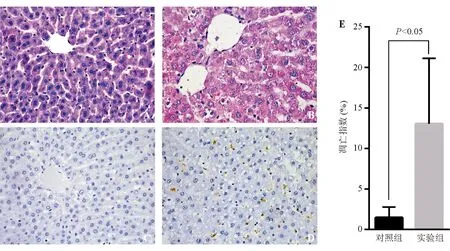
A、C:对照组供肝组织HE染色(×400)和TUNEL染色(×400);B、D:实验组供肝组织HE染色(×400)和TUNEL染色(×400);E:对照组与实验组凋亡指数比较
图3对照组与实验组供肝组织病理学表现和肝细胞凋亡情况比较
综上,供肝冷保存和缺血再灌注损伤是目前制约肝移植发展的一个主要因素,而氧化应激损伤为其关键机制之一[14]。有效的抗氧化干预往往能缓解缺血再灌注损伤,提升供肝质量[15-17]。器官保存液的研发和改良是实现抗氧化干预的有效途径,而建立稳定的冷保存再灌注动物模型,从而有效评估供肝质量和冷保存再灌注损伤程度是开展相关研究的基础。
IPRL模型是研究供肝生理学和病理生理学改变的模型,经典IPRL模型系由Gores等[18]于1986年所构建,其后经诸多改良,目前在肝脏药理毒理学研究领域有着广泛的应用,可在体外独立体系中评估肝细胞损伤和肝功能。在肝移植研究领域,IPRL模型与大鼠肝移植模型相比具有操作简便、所需大鼠数量较少、标准化程度较高的优势,适用于需进行大量筛选评估工作的器官保存液的研发和改良研究[19]。有鉴于此,本研究拟在经典IPRL模型的基础上根据本单位在抗氧化器官保存液研究方面的目的和要求,采取对应的措施进行改良,从而建立、稳定可靠的改良模型(MIPRL),以之对供肝质量进行全面、有效的评估。具体而言,本研究在经典IPRL模型的基础上,通过双水浴与热交换器相结合以及优化管道设计的方式,减少循环传输中的热消耗,有效保证合理、恒定的入肝温度。同时,门静脉压力感受器和HPO探针的加入能动态观察供肝的生化和氧化还原状态。而对供肝灌注液转氨酶、电解质和酸碱状况进行实时监测以有效保证供肝的生理活性,亦为该模型的一大优势。
从本研究结果可见,在90 min的再灌注过程中,对照组和实验组供肝灌注液中的转氨酶水平均逐步升高,实验组各时间点AST水平均显著高于对照组,提示热缺血和冷保存过程对肝脏生理和生化功能有较大影响。实验组胆汁流出量较对照组显著减少,表明供肝胆汁生成能力受损。实验组30、60 min时的门静脉压指数PVP/LW显著高于对照组,亦间接反映供肝损伤程度加重,与供肝组织中HPOv/LW随灌注时间的延长而逐步升高、30 min时实验组显著高于对照组的变化趋势相一致。尽管灌注结束后供肝组织MDA检测显示两组间脂质过氧化水平无明显差异,但实验组Cu/Zn SOD水平显著低于对照组,提示SOD消耗显著多于对照组,可以认为是由于热缺血和冷保存过程中供肝抗氧化物质大量消耗,导致其抗氧化能力明显降低。结合灌注结束后供肝组织病理学表现和细胞凋亡情况可以发现,在未经热缺血和冷保存处理的情况下,MIPRL模型能保证离体供肝组织的基本形态和活性。
综上所述,经热缺血和冷保存后,大鼠供肝的肝功能和抗氧化能力均明显降低,而本研究构建的MIPRL模型能直观、实时、量化地反映供肝冷保存再灌注损伤情况,为后续抗氧化器官保存液的研发和改良提供了一种可靠的供肝系统评估工具,从而能对供肝进行有效的监控和评估,是研究供肝冷保存后再灌注的理想模型。
1 Trotter JF. Liver transplantation around the world[J]. Curr Opin Organ Transplant, 2017, 22 (2): 123-127.
2 Bartczak A, Ma XZ, Manuel J, et al. Towards the repair of marginal liver grafts:ExvivoMesenchymal stromal cell perfusion[J]. J Immunol, 2016, 196 (1 Supplement): 140.16.
3 Maathuis MH, Leuvenink HG, Ploeg RJ. Perspectives in organ preservation[J]. Transplantation, 2007, 83 (10): 1289-1298.
4 Zumrutdal E, Karateke F, Eser PE, et al. The Effects of Direct Oxygen Supply During Static Cold Preservation of Rat Livers: An Experimental Study[J]. Exp Clin Transplant, 2016, 14 (6): 650-655.
5 Goldaracena N, Echeverri J, Spetzler VN, et al. Anti-inflammatory signaling duringexvivoliver perfusion improves the preservation of pig liver grafts before transplantation[J]. Liver Transpl, 2016, 22 (11): 1573-1583.
6 Miyashita T, Nakanuma S, Ahmed AK, et al. Ischemia reperfusion-facilitated sinusoidal endothelial cell injury in liver transplantation and the resulting impact of extravasated platelet aggregation[J]. Eur Surg, 2016, 48: 92-98.
7 Xia Z, Chen Y, Fan Q, et al. Oxidative stress-mediated reperfusion injury: mechanism and therapies[J]. Oxid Med Cell Longev, 2014, 2014: 373081.
8 Yu S, Zheng J, Jiang Z, et al. Protective effect of N-acetylserotonin against acute hepatic ischemia-reperfusion injury in mice[J]. Int J Mol Sci, 2013, 14 (9): 17680-17693.
9 Jegatheeswaran S, Siriwardena AK. Experimental and clinical evidence for modification of hepatic ischaemia-reperfusion injury by N-acetylcysteine during major liver surgery[J]. HPB (Oxford), 2011, 13 (2): 71-78.
10 Kim JS, He L, Lemasters JJ. Mitochondrial permeability transition: a common pathway to necrosis and apoptosis[J]. Biochem Biophys Res Commun, 2003, 304 (3): 463-470.
11 Folch-Puy E, Panisello A, Oliva J, et al. Relevance of Endoplasmic Reticulum Stress Cell Signaling in Liver Cold Ischemia Reperfusion Injury[J]. Int J Mol Sci, 2016, 17 (6).pii: E807.
12 Jaeschke H. Reactive oxygen and mechanisms of inflammatory liver injury: Present concepts[J]. J Gastroenterol Hepatol, 2011, 26 Suppl 1: 173-179.
13 Cannistrà M, Ruggiero M, Zullo A, et al. Hepatic ischemia reperfusion injury: A systematic review of literature and the role of current drugs and biomarkers[J]. Int J Surg, 2016, 33 Suppl 1: S57-S70.
14 Elias-Miró M, Jiménez-Castro MB, Rodés J, et al. Current knowledge on oxidative stress in hepatic ischemia/reperfusion[J]. Free Radic Res, 2013, 47 (8): 555-568.
15 Ben Mosbah I, Roselló-Catafau J, Alfany-Fernandez I, et al. Addition of carvedilol to University Wisconsin solution improves rat steatotic and nonsteatotic liver preservation[J]. Liver Transpl, 2010, 16 (2): 163-171.
16 Srinivasan PK, Yagi S, Doorschodt B, et al. Impact of venous systemic oxygen persufflation supplemented with nitric oxide gas on cold-stored, warm ischemia-damaged experimental liver grafts[J]. Liver Transpl, 2012, 18 (2): 219-225.
17 Shimada S, Wakayama K, Fukai M, et al. Hydrogen Gas Ameliorates Hepatic Reperfusion Injury After Prolonged Cold Preservation in Isolated Perfused Rat Liver[J]. Artif Organs, 2016, 40 (12): 1128-1136.
18 Gores GJ, Kost LJ, LaRusso NF. The isolated perfused rat liver: conceptual and practical considerations[J]. Hepatology, 1986, 6 (3): 511-517.
19 Bessems M, ’t Hart NA, Tolba R, et al. The isolated perfused rat liver: standardization of a time-honoured model[J]. Lab Anim, 2006, 40 (3): 236-246.
(2017-03-29收稿;2017-04-10修回)
EstablishingAModifiedIsolatedPerfusedRatLiverModelforAppliedinStudyofColdStorageofLiverGrafts
SHIShaojun1,ZHENGJianxin1,QINTian1,LIXiaokang2,XUEFeng1,XIAQiang1.
1DepartmentofLiverSurgeryandLiverTransplantationCenter,RenjiHospital,SchoolofMedicine,ShanghaiJiaoTongUniversity,Shanghai(200127);2NationalResearchInstituteforChildHealthandDevelopment,Tokyo,Japan
10.3969/j.issn.1008-7125.2017.09.002
国家自然科学基金(81470847, 81670602);上海交通大学医学院转化医学协同创新中心项目(TM201511)
#Email: 842778613@qq.com
&本文通信作者,Email: xiaqiang@shsmu.edu.cn
