血清胃蛋白酶原和胃泌素-17在胃癌和癌前病变筛查中的价值*
2017-10-16李梦颖焦晨阳陈卫昌
李梦颖 马 晨 焦晨阳 陈卫昌
苏州大学附属第一医院消化科(215006)
血清胃蛋白酶原和胃泌素-17在胃癌和癌前病变筛查中的价值*
李梦颖 马 晨 焦晨阳 陈卫昌#
苏州大学附属第一医院消化科(215006)
背景:我国是胃癌高发地区,有研究指出,血清胃蛋白酶原(PG)和胃泌素-17(G-17)水平可用于胃癌的筛查。目的:探讨血清PG和G-17水平筛查胃癌前病变和胃癌的价值。方法:选取2016年3月—2016年10月苏州大学附属第一医院经胃镜和病理学检查确诊的211例患者,以67名健康者作为对照。应用ELISA法检测血清PGⅠ、PGⅡ、G-17和Hp-IgG抗体水平。结果:与对照组相比,萎缩性胃炎组PGⅠ水平、PGR显著降低(P<0.01);低级别上皮内瘤变组、高级别上皮内瘤变组和胃癌组PGⅠ水平、PGR均显著降低(P<0.01),G-17水平显著升高(P<0.01)。根据ROC曲线,PGⅠ、PGR和G-17诊断胃癌及其癌前病变的最佳界值分别为74.74 ng/mL(敏感性88.3%,特异性78.0%)、6.59(敏感性87.0%,特异性73.8%)、13.02 pmol/L(敏感性54.2%,特异性84.4%)。PGR和G-17为胃癌及其癌前病变的独立预测因素,PGⅠ、PGR和G-17联合诊断胃癌及其癌前病变的敏感性为89.9%,特异性为84.4%。结论:血清PGⅠ、PGR、G-17可作为胃癌及其癌前病变筛查的指标。PG联合G-17诊断胃癌及其癌前病变的敏感性和特异性较单独血清PG或G-17更高。
胃蛋白酶原类; 胃泌素类; 胃肿瘤; 癌前病变; 诊断
Correspondenceto: CHEN Weichang, Email: weichangchen@126.com
Background: China is an area with high incidence of gastric cancer, studies have shown that serum pepsinogen (PG) and gastrin-17 (G-17) levels can be used for gastric cancer screening.Aims: To investigate the values of serum PG and G-17 levels in screening gastric precancerous lesion and gastric cancer.Methods: A total of 211 patients with gastroduodenal disease diagnosed by endoscopy and biopsy from March 2016 to October 2016 at the First Affiliated Hospital of Soochow University were enrolled, and 67 healthy subjects were served as controls. Serum levels of PGⅠ, PGⅡ, G-17 and Hp-IgG antibodies were determined by ELISA.Results: Compared with control group, PGⅠ level and PGR were significantly decreased in atrophic gastritis group (P<0.01); serum PGⅠ level and PGR were significantly decreased, and G-17 level was significantly increased in low grade intraepithelial neoplasia group, high grade intraepithelial neoplasia group and gastric cancer group (P<0.01). ROC curve showed that the best cutoff values of PGⅠ, PGR and G-17 for diagnosing gastric cancer and gastric precancerous lesion were 74.74 ng/mL (sensitivity 88.3%, specificity 78.0%), 6.59 (sensitivity 87.0%, specificity 73.8%), 13.02 pmol/L (sensitivity 54.2%, specificity 84.4%), respectively. PGR and G-17 were the independent predictors of gastric cancer and gastric precancerous lesion. The sensitivity and specificity of combined detection of PGⅠ, PGR and G-17 for diagnosing gastric precancerous lesion and gastric cancer were 89.9% and 84.4%, respectively.Conclusions: Serum PGⅠ, PGR and G-17 may be used as indicators of gastric cancer and gastric precancerous lesion screening. PG combined with G-17 for diagnosing gastric cancer and gastric precancerous lesion is more sensitive and specific than using serum PG or G-17 alone.
KeywordsPepsinogens; Gastrins; Stomach Neoplasms; Precancerous Lesions; Diagnosis
胃癌是临床上常见的消化系统恶性肿瘤,全球每年新发病例约为100万例,其死亡率在各类恶性肿瘤中位列第二[1]。有研究表明,早期胃癌患者行内镜下根除治疗后,5年生存率可高达90%[2],而进展期胃癌患者即使接受了以外科手术为主的综合治疗,5年生存率仅为30%左右。因此,提高胃癌前病变和胃癌的早期诊断率有助于降低胃癌的病死率。目前内镜加活组织病理学检查仍是诊断胃癌的金标准,但胃镜作为一种侵入性检查,具有创伤较大、对检查设备和医师操作水平要求较高等缺点,难以应用于胃癌的普查。近年多项研究[3-7]结果显示血清胃蛋白酶原(pepsinogen, PG)和胃泌素-17(gastrin-17, G-17)水平对癌前疾病和胃癌的诊断具有重要的临床价值。本研究通过检测不同患者血清PGⅠ、PGⅡ和G-17水平,旨在探讨其在胃癌及其癌前病变筛查中的价值,从而为胃癌及其癌前病变的筛查提供一定的理论依据。
对象与方法
一、研究对象
选取2016年3月—2016年10月苏州大学附属第一医院就诊的211例患者,其中男85例,女126例,男女比例为1∶1.48,年龄40~77岁。收集患者的基本信息(包括性别、年龄、联系方式)、肿瘤家族史、饮食生活习惯等。根据组织病理学结果将受检者分为5组:胃十二指肠溃疡组(n=33)、萎缩性胃炎组(n=73)、低级别上皮内瘤变(LGIN)组(n=31)、高级别上皮内瘤变(HGIN)组(n=20)、胃癌组(n=54)。根据WHO国际诊断标准:将LGIN定义为上皮结构和细胞学异常仅局限于上皮的下半部;HGIN定义为上皮结构和细胞学异常扩展至上皮的上半部乃至全层,相当于重度异型增生和原位癌。排除严重的心肝肾等重要脏器功能障碍者,排除既往曾接受过胃部手术者(包括外科手术、ESD和EMR)。入选前两周内未服用过影响本研究结果的药物,如质子泵抑制剂(PPI)、H2受体拮抗剂、胃黏膜保护剂等。同时选择胃镜检查结果无异常或轻度慢性非萎缩性胃炎患者67例作为对照,其中男31例,女36例,年龄43~82岁,平均(56.7±11.3)岁。各组间性别、年龄相比差异均无统计学意义(P>0.05),具有可比性。本研究方案经苏州大学附属第一医院伦理委员会批准,所有受检者均自愿参加本研究,并签署知情同意书。
二、研究方法
所有受检者均于清晨抽取5 mL空腹外周静脉血,离心后取上层血清,以酶联免疫吸附测定法(ELISA)检测血清PGⅠ、PGⅡ、G-17、幽门螺杆菌(Hp)-IgG抗体水平,并计算PGⅠ/PGⅡ比值(PGR)。Hp-IgG抗体<30 U/mL界定为Hp阴性,反之则为阳性。试剂盒均由芬兰Biohit HealthCare提供,具体步骤严格按说明书进行操作。
三、统计学分析
结 果
一、血清PG水平
与对照组相比,胃十二指肠溃疡组PGR显著升高(P<0.05);而萎缩性胃炎组、LGIN组、HGIN组和胃癌组血清PGⅠ水平、PGR均显著降低(P<0.01)。与萎缩性胃炎组相比,LGIN组、HGIN组血清PGⅠ水平和PGR均无明显差异;而胃癌组PGR显著降低(P<0.01)。胃癌组血清PGⅠ水平、PGR均显著低于LGIN组、HGIN组(P<0.05)。胃癌组、HGIN组和萎缩性胃炎组血清PGⅡ水平均显著高于对照组(P<0.05),但三组间差异无统计学意义(表1)。
二、血清G-17水平
与对照组相比,胃十二指肠溃疡组、萎缩性胃炎组血清G-17水平无明显差异(P>0.05)。胃癌组、LGIN组和HGIN组血清G-17水平显著升高(P<0.01),胃癌组又明显高于LGIN组和HGIN组(P<0.05),但LGIN组与HGIN组血清G-17水平差异无统计学意义(P>0.05)(表1)。
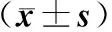
表1 各组PGⅠ、PGⅡ、PGR和G-17水平
与对照组比较,*P<0.05,#P<0.01;△与萎缩性胃炎组比较,P<0.01;▲与LGIN组、HGIN组比较,P<0.05
三、血清PG和G-17的诊断效率
PGⅠ、PGR、G-17的ROC曲线下面积分别为0.856、0.868和0.693,诊断胃癌及其癌前病变的最佳临界值分别为74.74 ng/mL(敏感性88.3%,特异性78.0%)、6.59(敏感性87.0%,特异性73.8%)和13.02 pmol/L(敏感性54.2%,特异性84.4%)(图1、图2)。

图1 PGⅠ、PGR诊断胃癌及其癌前病变的ROC曲线

图2 G-17诊断胃癌及其癌前病变的ROC曲线
四、血清PG联合G-17筛查胃癌及其癌前病变的效果评价
联合PGⅠ、PGR和G-17三个预测因子绘制ROC曲线,联合预测的诊断点为P=0.551,其敏感性和特异性分别为89.9%和84.4%(图3)。回归方程Logit(P)=4.524-0.03PGⅠ-0.241PGR+0.069G-17(表2),预测值P>0.551即为阳性,反之为阴性。

图3 PGⅠ、PGR、G-17联合诊断胃癌及其癌前病变的ROC曲线
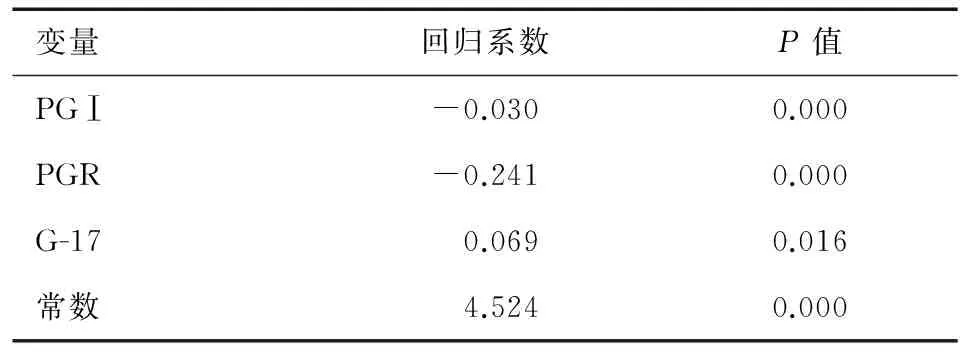
表2 PGⅠ、PGR和G-17的Logistic回归系数和P值
五、胃癌及其癌前病变的危险因素
单因素分析显示,PGR、G-17、高盐饮食、家族史、吸烟、Hp感染与胃癌及其癌前病变的发生相关(P<0.05),而性别、年龄、水果、饮酒与胃癌及其癌前病变的发生无关(P>0.05)(表3)。进一步行多因素Logistic回归分析显示,PGR、G-17水平是胃癌及其癌前病变的独立预测因素(P<0.05),高盐饮食、吸烟和Hp感染是胃癌及其癌前病变的独立危险因素(P<0.05)(表4)。

表3 胃癌及其癌前病变危险因素的单因素分析

表4 胃癌及其癌前病变危险因素的多因素分析
讨 论
PG是胃黏膜分泌的一种消化酶前体,属于门冬氨酸家族,在酸性条件下可转变为有活性的胃蛋白酶。按免疫原性不同,PG可分为PGⅠ和PGⅡ两个亚型,PGⅠ主要由胃底腺主细胞和颈黏液细胞分泌,PGⅡ除由胃底腺分泌外, 胃窦幽门腺和近端十二指肠Brunner腺亦可分泌。大部分PG分布于胃腔内,1%的PG可透过胃黏膜毛细血管进入血液循环[8],因此,外周血清PGⅠ、PGⅡ水平和PGR可在一定程度上反映胃黏膜腺体和细胞的数量和分泌功能。本研究中,胃癌前病变和胃癌患者血清PGⅠ水平、PGR较对照组显著降低(P<0.05)。胃癌组血清PGⅠ水平、PGR显著低于萎缩性胃炎组、LGIN组和HGIN组(P<0.05),与国内多项研究[9-11]结果相似。当胃黏膜萎缩时,主细胞和颈黏液细胞减少,PGⅠ水平逐渐下降;而PGⅡ来源广泛,其水平可保持相对稳定,从而导致PGR下降。随着萎缩程度加重,出现肠化生、异型增生甚至是癌变时,致癌因子使胚细胞中PG基因突变,失去分泌PG的能力,血清PG水平持续降低。因此,检测血清PG有助于评估胃黏膜的状态和功能,对胃癌前病变和胃癌的诊断具有一定意义。
胃泌素是胃窦和十二指肠G细胞分泌的一种胃肠激素,其中80%~90%为G-17。当胃黏膜萎缩以胃体细胞为主时,胃酸水平降低负反馈引起G-17水平升高;当萎缩以胃窦细胞为主时,G细胞数量减少引起G-17水平降低;当黏膜萎缩累及全胃时,其G-17水平略高于胃窦萎缩,但低于胃体萎缩。本研究中,萎缩性胃炎组血清G-17水平与对照组相比差异无统计学意义,可能由于本研究未严格区分黏膜萎缩部位所致。而胃癌组、LGIN组和HGIN组血清G-17水平较对照组显著升高,与Sun等[12]的研究结果一致。Wang等[13]的动物实验显示,胃泌素能刺激胃内壁细胞数量增加,随着胃酸分泌增多,壁细胞数量逐渐下降,胃黏膜发生萎缩、肠化生、异型增生等癌前病变,进而发展成癌症。因此,血清胃泌素水平在胃癌及其癌前病变患者中呈升高的趋势,是筛查胃癌的重要指标。
本研究结果显示,PGⅠ诊断胃癌前病变和胃癌的临界值为74.74 ng/mL(敏感性88.3%,特异性 78.0%)、PGR的临界值为6.59(敏感性87.0%,特异性 73.8%)、G-17的临界值为13.02 pmol/L(敏感性54.2%,特异性84.4%)。单因素和多因素回归分析表明,PGR、G-17水平是胃癌的独立预测因素。因此,PG和G-17可用于胃癌和癌前病变的筛查,有较好的诊断价值。本研究的最佳诊断临界值与国内外报道[14-15]不一致,可能与人种、生活习惯、实验试剂等因素有关。
有研究[16]证实联合检测血清G-17和PGⅠ、PGⅡ可明显提高胃癌的检出率。其原因主要是G-17检测可弥补血清PG筛查胃窦部病变效果不理想的缺陷,两者联合检测能较好地检出不同部位和类型的胃癌。本研究通过建立PGⅠ、PGR和G-17联合预测的回归方程,并绘制ROC曲线,确定诊断点P=0.551,联合诊断胃癌前病变和胃癌的敏感性为89.9%,特异性为84.4%。提示PGⅠ、PGR联合G-17检测的敏感性和特异性较单独检测血清PG或G-17更高,可作为胃癌前病变和胃癌的非侵入性诊断方法。
总之,本研究结果表明,胃癌前病变和胃癌患者血清PGⅠ、PGR水平显著降低,G-17水平显著升高。血清PGR和G-17均为胃癌的独立预测因素,PGⅠ、PGR和G-17联合检测具有高敏感性和特异性、可操作性强、易于被患者接受等优势,可用于胃癌前病变和胃癌的筛查和诊断,有利于提高胃癌的检出率,从而降低死亡率。但由于本研究样本量有限,存在一定局限性,将来需行大样本研究进一步验证结果并建立血清学结果的参考区间。
1 Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65 (2): 87-108.
2 朱敏, 李明阳, 吴本俨. 早期胃癌内镜下切除术后复发的相关因素分析[J]. 中华内科杂志, 2011, 50 (5): 366-369.
3 Sipponen P, Härkönen M, Alanko A, et al. Diagnosis of atrophic gastritis from a serum sample[J]. Minerva Gastroenterol Dietol, 2003, 49 (1): 11-21.
4 Yamaguchi Y, Nagata Y, Hiratsuka R, et al. Gastric Cancer Screening by Combined Assay for Serum Anti-HelicobacterpyloriIgG Antibody and Serum Pepsinogen Levels -- The ABC Method[J]. Digestion, 2016, 93 (1): 13-18.
5 Miki K. Gastric cancer screening using the serum pepsinogen test method[J]. Gastric Cancer, 2006, 9 (4): 245-253.
6 Miki K, Morita M, Sasajima M, et al. Usefulness of gastric cancer screening using the serum pepsinogen test method[J]. Am J Gastroenterol, 2003, 98 (4): 735-739.
7 吕艳丽, 李毅, 刘光顺, 等. 胃癌高发区血清胃蛋白酶原初筛加高危人群胃镜检查方案与直接胃镜筛查方案的效果比较[J]. 中华肿瘤杂志, 2013, 35 (5): 394-397.
8 Kageyama T. Pepsinogens, progastricsins, and prochymosins: structure, function, evolution, and development[J]. Cell Mol Life Sci, 2002, 59 (2): 288-306
9 马颖杰, 王惠吉. 血清胃蛋白酶原、胃泌素-17与慢性萎缩性胃炎[J]. 胃肠病学, 2007, 12 (7): 422-424.
10 付明生, 潘淑贤, 许兰涛, 等. 血清胃蛋白酶原对胃癌的诊断价值[J]. 胃肠病学和肝病学杂志, 2012, 21 (5): 420-422.
11 徐巧莲, 万小勇, 杜燕, 等. 血清胃蛋白酶原检测在胃癌筛查中的价值[J]. 胃肠病学, 2012, 17 (10): 614-617.
12 Sun L, Tu H, Liu J, et al. A comprehensive evaluation of fasting serum gastrin-17 as a predictor of diseased stomach in Chinese population[J]. Scand J Gastroenterol, 2014, 49 (10): 1164-1172.
13 Wang TC, Dangler CA, Chen D, et al. Synergistic interaction between hypergastrinemia andHelicobacterinfection in a mouse model of gastric cancer[J]. Gastroenterology, 2000, 118 (1): 36-47.
14 曹勤, 冉志华, 萧树东. 检测血清胃蛋白酶原和胃泌素-17诊断胃癌的临床价值[J]. 胃肠病学和肝病学杂志, 2007, 16 (4): 361-364.
15 Kitahara F, Kobayashi K, Sato T, et al. Accuracy of screening for gastric cancer using serum pepsinogen concentrations[J]. Gut, 1999, 44 (5): 693-697.
16 程兆明, 李龙, 陈琳娜. 血清胃蛋白酶原Ⅰ、Ⅱ与胃泌素联合检测对胃癌的诊断价值[J]. 中华消化内镜杂志, 2002, 19 (1): 32-34.
(2017-02-28收稿;2017-04-15修回)
ValuesofSerumPepsinogenandGastrin-17inScreeningGastricCancerandGastricPrecancerousLesion
LIMengying,MAChen,JIAOChenyang,CHENWeichang.
DepartmentofGastroenterology,theFirstAffiliatedHospitalofSoochowUniversity,Suzhou,JiangsuProvince(215006)
10.3969/j.issn.1008-7125.2017.09.006
江苏省科技厅生命健康专项基金BL2014046(5201011003000103)
#本文通信作者,Email: weichangchen@126.com
