全固态锂硫电池的研究进展
2017-10-14任文锋
高 静,任文锋,陈 剑
全固态锂硫电池的研究进展
高 静1,2,任文锋1,陈 剑1
(1中国科学院大连化学物理研究所,辽宁大连 116023;2中国科学院大学,北京 100049)
以金属锂为负极、单质硫为正极活性物质的锂硫电池的理论比能量为2600 W·h/kg,是全部由固态活性物质组成的、比能量最高的一种二次电池。硫和锂储量丰富、成本低廉。采用固态电解质的全固态锂硫电池能够明显提高电池的安全性并有望提高电池的循环性能,已成为储能电池技术研究和开发的热点。本文综述了近年国内外的全固态锂硫电池的研究进展,从固体电解质、硫基正极、锂基负极、“电极/电解质”界面、固态电池制备方法等方面分别进行了综述,并对全固态锂硫电池未来的发展方向和发展前景进行展望。
全固态锂硫电池;固体电解质;硫正极;锂负极;“电极/电解质”界面
锂硫电池以金属锂为负极,单质硫或硫化物为正极活性物质。其中,以单质硫为正极活性物质的锂硫电池在全部由固态元素组成的二次电池中,具有最高的理论比能量2600 W·h/kg和能量密度2800 W·h/L。锂硫电池还具有输出功率高、硫和锂储量丰富、成本低廉等优点,已成为储能电池技术竞争的制高点之一。目前,锂硫电池的循环性能仍是限制其规模应用的主要瓶颈。虽然锂硫电池的安全性得到初步验证,但本征安全的锂硫电池仍是研发的热点和难点。
目前,以单质硫为正极活性物质的锂硫电池采用醚类电解液。醚类溶剂的闪点低,在电池的生产和应用中易引发安全问题。硫的还原产物多硫化物易溶解于醚类电解液,引起“穿梭效应”,降低电池的循环寿命和库仑效率[1]。以硫化物为正极活性物质的锂硫电池采用碳酸酯电解液,虽然避免了“穿梭效应”,但有机溶剂碳酸酯仍是引发电池热失控的主要原因之一。此外,金属锂负极活泼,几乎可以与所有的有机溶剂反应,消耗电解液,降低电池的循环寿命。
以单质硫为正极活性物质、采用固体电解质的全固态锂硫电池,只在2.0 V附近出现一个放电平台[2-6];而采用醚类电解液时,则出现两个放电平台,分别在2.3 V和2.1 V附近,分别对应S8分子被电化学还原为、和等可溶性多硫化物,以及生成难溶性的Li2S2和Li2S。这些实验现象表明,在全固态电池中,单质硫的电化学还原历程不同于液相,似乎没有经历形成多硫化物这一过程[7]。同时,全固态锂硫电池不存在高温胀气和电解液腐蚀、泄漏等安全隐患,具有更高的热稳定性,安全性得到提高。并且,碳硫复合物、有机硫化物和无机硫化物的比容量一般大于700 mA·h/g,远高于目前已有的锂离子电池商品三元正极材料(如NCM和NCA)。采用优化设计的硫正极和具有高离子电导率的固体电解质,有望获得高比能量全固态锂硫 电池。
然而,全固态锂硫电池尚存在以下问题。①全部由固态物质组成的硫正极中的离子和电子传导。单质硫或硫化物的电化学还原和氧化伴随高达约70%的体积膨胀和收缩,造成电极活性物质与固体电解质、导电剂的物理接触失效,以至于锂离子和电子的传输受阻。为解决这一问题,需研究和开发电极活性材料、固体电解质和导电剂的复合工艺及电极制备技术。②固态电解质仍是决定电池电化学性能的关键因素之一,需研究和开发高离子电导率、化学稳定且与正负极兼容的固体电解质及其成膜技术。③固态电池中的电化学反应发生在由“硫或硫化物(固)/导电剂(固)/固体电解质(固)”构成的三相界(tri-phase-boundary)。三相界的性质决定电池的电化学性能和循环稳定性。因此,需要研究影响各界面(“硫或硫化物/固体电解质”界面、“锂或锂基合金/固体电解质”界面)稳定性的关键因素及其调控机制。④固体电解质的密度较有机电解液的大,采用固体电解质有可能在一定程度上消减锂硫电池高比能量的优势。如Li7La3Zr2O7(LLZO)的密度约5 g/cm3、Li1+xAlTi2x(PO4)3(LATP)约3 g/cm3、Li10GeP2S12(LGPS)约2 g/cm3[7],聚氧乙烯(下文简称PEO)络合双三氟甲基磺酸亚胺锂(下文简称LiTFSI)聚合物[(PEO)18LiTFSI]的密度相对较小,约1.2 g/cm3。
本文综述了近年来全固态锂硫电池固体电解质、硫基正极、锂基负极、“固/固”界面以及固态电池制备方法的研究进展,分析讨论了全固态锂硫电池中关键材料和部件的设计和核心科学问题,最后,对全固态锂硫电池未来的发展前景进行了展望。
1 固体电解质
理想的全固态锂硫电池用固体电解质应具有室温离子电导率高、电子绝缘、电化学窗口宽、离子迁移数接近1、对锂稳定、与正极相容性好等特点。目前用于固态锂电池的固体电解质可以分为氧化物、硫化物、聚合物固体电解质和硼氢化锂基固体电解质。其中,氧化物固体电解质室温离子电导率一般能达到10-4S/cm,但是较少应用于全固态锂硫电池,仅有几篇文献报道了采用氧化物固体电解质与有机电解液共同制备锂硫电池[8-10],不属于严格意义上的全固态锂硫电池。加之氧化物固体电解质质脆,与硫正极的界面阻抗大,存在空间电荷层,应用于全固态锂硫电池的优势并不明显,因此本文未对这种固体电解质进行综述。
1.1 硫化物固体电解质
硫化物固体电解质具有室温离子电导率高(10-4~10-2S/cm)[11]、与硫正极相容性好、较高的机械强度、易冷压成型等特点,是目前文献报道的应用于全固态锂硫电池最多的固体电解质。
硫化物固体电解质按组成可分为两类:一类是Li2S-SiS2体系,另一类是Li2S-P2S5体系。早期硫化物固体电解质的研究主要集中在Li2S-SiS2体系。这类材料的室温离子电导率约为10-4S/cm,较Li2S-P2S5体系的10-3S/cm低,且提升空间有限。MACHIDA等[12]通过高能球磨法制备了无定形的(Li2S)60(SiS2)40固体电解质粉末,室温离子电导率可达1.8×10-4S/cm,将其压片制成固体电解质隔膜。用球磨工艺制备CuS材料,再利用球磨工艺制备了(CuS)∶(AB)∶[(Li2S)60(SiS2)40]=48.4∶1.6∶50的硫正极,以锂锗合金(Li4.4Ge)为负极组装了全固态电池。在室温以0.064 mA/cm2电流密度进行充放电,循环10次后CuS的比容量为1080 mA·h/g(CuS),明显优于采用有机电解液1 mol/L的 LiClO4-PC的电池。后者在室温以0.1 mA/cm2电流密度充放电,循环5次后CuS的比容量小于100 mA·h/g(CuS)。
目前,Li2S-P2S5体系是研究得较多的一类固体电解质,按物相可分为玻璃态固体电解质、玻璃陶瓷固体电解质和陶瓷固体电解质;按组成可分为二元硫化物(主要组成为Li2S和P2S5)和三元硫化物[由Li2S、P2S5和MS2(M=Si、Ge、Sn等)组成]固体电解质。玻璃态固体电解质的制备方法主要有高温熔融法和高能球磨法两种,制得的硫化物固体电解质的室温离子电导率约10-4S/cm[13]。玻璃陶瓷固体电解质的制备方法是先采用熔融法或高能球磨法制得玻璃态固体电解质,然后在一定温度下析晶制得。这类固体电解质的室温离子电导率可达10-3S/cm[14-15]。具有更高离子电导率的原因是,在析晶过程中,玻璃粉末发生软化,降低了电解质中的界面电阻所致。陶瓷固体电解质主要采用液相法制得,是目前室温离子电导率最高的一类固体电解质,如Li10GeP2S12的室温离子电导率达到1.2×10-2S/cm[16],Li9.54Si1.74P1.44S11.7Cl0.3室温离子电导率为2.5×10-2S/cm[17],与液态电解质基本相当。
AGOSTINI等[18]通过高能球磨法制备了玻璃态(Li2S)80(P2S5)20硫化物固体电解质,研究了冷压压力对固体电解质密度和电导率的影响。发现当压力为300 MPa时,材料的离子电导率达到2.5×10-4S/cm;增大压力,材料的离子电导率基本不变。将其作为固体电解质隔膜,与球磨制备的S-中间相碳微球(MCMB)正极和金属锂负极组装制备全固态电池,在80 ℃下以0.05 C倍率进行充放电,循环20次后硫的比容量为400 mA·h/g(S)。HAYASHI等[19-20]采用高能球磨法制备(Li2S)80(P2S5)20玻璃陶瓷硫化物固体电解质,室温离子电导率为2.1×10-3S/cm,以其为固体电解质隔膜、球磨法制备的S-Cu复合物为正极,制备全固态电池。发现正极中S/Cu=3时,硫的可逆比容量最高,为650 mA·h/g(S),且首次不可逆容量最小。NAGAO等[21]采用固相法制备了锂的快离子导体thio-LISICON(Li3.25Ge0.25P0.75S4),材料的室温离子电导率达到2.2×10-3S/cm。将其作为固体电解质隔膜,以硫和有序介孔碳(CMK3)的复合材料S-CMK3为正极、Li-Al合金为负极组装全固态锂硫电池,在室温以0.13 mA/cm2电流密度进行充放电,循环20次后可逆比容量为1300 mA·h/g(S)。
采用离子电导率更高的玻璃陶瓷和陶瓷硫化物固体电解质制备硫正极,获得了更优的电化学性能,硫的比容量更高。但也应看到,虽然硫化物固体电解质具有较高的室温离子电导率,但材料对水和氧敏感,制备和使用条件苛刻。在Li2S-P2S5二元硫化物固体电解质中,(Li2S)70(P2S5)30的玻璃陶瓷电解质的离子电导率最高,但将其短时间暴露在空气中即会发生吸潮反应;而(Li2S)75(P2S5)25玻璃电解质的离子电导率相对较低,但空气稳定性最高,将其暴露于空气中7 h,材料离子电导率的保持率>95%[22]。但大部分硫化物固体电解质与金属锂负极的相容性较差,需对两者之间形成的界面进行深入研究。有关内容将在本文“电极/电解质界面”部分详细阐述。
综上所述,未来有关硫化物固体电解质的工作将主要集中在通过元素掺杂和优化制备工艺来提高硫化物固体电解质的空气稳定性,并提高材料的离子电导率;构建硫化物固体电解质与锂的稳定界面层,提高对锂的稳定性。
1.2 聚合物固体电解质
目前,研究较多的聚合物固体电解质是PEO及其衍生物络合锂盐类聚合物电解质。PEO类聚合物电解质在较高温度,如60 ℃时的离子电导率可达10-3~10-4S/cm[23],且易成膜、加工性能好,在硫正极中较易形成连续的离子传导通路,与正极的界面阻抗较小。但PEO类聚合物电解质也存在室温离子电导率低、与金属锂负极的相容性差等问题。目前,文献报道的有关工作主要集中在通过优化聚合物基体、优选锂盐和添加无机填料等来提高这一类聚合物电解质的室温离子电导率。
(1)优化聚合物基体 MARMORSTEIN等[24]以单质硫为正极活性物质、金属锂为负极,分别以3种聚合物与LiTFSI的复合物,即PEO-LiTFSI、聚亚甲基乙烯(PEMO)-LiTFSI和聚乙二醇二甲醚(PEGDME)-LiTFSI作为电解质,研究了固态锂硫电池的电化学性能。发现采用PEO-LiTFSI聚合物电解质的固态电池,在90℃以0.1 mA/cm2电流密度进行充放电,硫的首次放电比容量超过1600 mA·h/g(S),但衰减较快,20次循环后的容量保持率小于10%。采用PEGDME/LiTFSI电解质的电池,在室温以0.05 mA/cm2电流密度充放电,硫的比容量约为420 mA·h/g(S),电池25次循环后的容量保持率为50%。除聚醚、聚酯和聚胺类聚合物基体外,研究发现硅烷聚合物也可以和锂盐络合作为固体电解质,应用于全固态锂硫电池中表现出良好的电化学性能。LIN等[25]以淀粉和硅烷聚合制备了聚合物基体,与LiTFSI络合制得室温离子电导率为3.39×10−4S/cm和离子迁移数为0.80的聚合物电解质;将其用作固体电解质隔膜,以硫含量为43 %(质量分数)的聚苯胺碳硫(PANI-C-S)复合材料为正极、金属锂负极组装了全固态电池。电池在25 ℃以0.1 C(0.015 mA/cm2)倍率进行充放电,循环100次后的比容量为864 mA·h/g(S);在45 ℃下以2 C倍率进行充放电,循环2000次后的比容量为388 mA·h/g(S)。
(2)优选锂盐 MA等[26]采用简单的溶液浇铸法制备了PEO-(氟磺酰)(三氟甲基磺酰)亚胺锂(LiFTFSI)聚合物电解质。该聚合物电解质的室温离子电导率为10−5S/cm,氧化电势+4.63 V(. Li+/Li)。以S和有序介孔碳CMK3的复合物为正极活性物质制备了(S-CMK3)∶[超导炭黑(super P)]∶(PEO-LiFTFSI)∶(PVDF)=65∶10∶20∶5正极,与PEO-LiFTFSI聚合物电解质隔膜、锂负极组装了全固态电池。在60 ℃下以0.1 C倍率充放电,硫的首次放电比容量为881 mA·h/g(S),循环30次的容量保持率为73.4%。
(3)添加无机填料 加入无机粒子降低了PEO基体中聚合物链段的有序性,进而降低了聚合物的结晶度,提高了聚合物传导锂离子的能力。如HASSOUN等[27]通过热压法制备了添加10%(质量分数)ZrO2无机填料的PEO络合三氟甲基磺酸亚胺锂盐[PEO-LiCF3SO3-10%(质量分数)ZrO2]聚合物电解质。70 ℃时,该聚合物固体电解质的离子电导率为10-4~10-3S/cm。将其作为固体电解质隔膜,与[碳硫复合材料(S-C)]∶(super P)∶(PVDF)= 8∶1∶1的硫正极、金属锂负极组装全固态电池。在90 ℃以C/20倍率充放电,硫的比容量为900 mA·h/g(S);采用Li2S为活性物质,在70 ℃以30 mA/g电流密度充放电,放电比容量为600 mAh/g(Li2S)。另外,路易斯酸性的无机粒子可以起到固定锂盐阴离子和PEO片段的作用,从而提高锂离子迁移数。如JEONG等[28]采用(PEO)6LiBF4为固体电解质隔膜、单质硫为正极、金属锂为负极组装全固态电池。电池的比容量约1200 mA·h/g(S)。作者进一步在(PEO)6LiBF4中添加无机填料Al2O3制得了固体电解质。采用该固体电解质的电池的比容量为1670 mA·h/g(S),几乎达到硫的理论比容量。
综上所述,PEO及其衍生物基聚合物电解质存在室温离子电导率和离子迁移数低的缺点,电池一般需在高温下运行。这类聚合物电解质在高温下变为黏弹态,通过聚合物链段的蠕动,带动与其配位的锂离子进行迁移。这种电解质中仍存在多硫化物的溶解问题,主要是因为聚合物的锂离子迁移数低,容易造成“穿梭效应”。另外,PEO基聚合物电解质在高温下的机械强度降低,容易出现电池短路等情况[29]。为实现聚合物固体电解质的实际应用,需进一步提高聚合物的室温离子电导率,开发离子迁移数接近1的单离子导体聚合物电解质,并提高聚合物固体电解质的力学性能。
1.3 硼氢化锂基固体电解质
UNEMOTO等[30-31]分别制备了LiBH4-LiCl和LiBH4固体电解质。两种材料在120 ℃时的离子电导率分别为5×10-4S/cm和2×10-3S/cm。分别以这两种固体电极质为隔膜制备固态锂硫电池,正极组成均为(单质硫)∶(炭黑KB)∶[LiBH4(LiBH4-LiCl)] = 25∶25∶50,负极为金属锂。所制备的固态电池在120 ℃时的首次放电比容量分别为1337 mA·h/g(S)(0.03C,LiBH4-LiCl)和1140 mA·h/g(S)(0.05C,LiBH4),均表现出较好的电化学性能。但以LiBH4-LiCl为隔膜的电池的循环性能较差,5次循环后的容量保持率为46.2%;而采用LiBH4为隔膜的电池的循环性能相对较好,循环45次的容量保持率为64%。LiBH4在120 ℃以上发生晶型转变,离子电导率较高,但在低于120 ℃的温度下,材料的离子电导率明显降低,这阻碍了LiBH4的实际应用。另外,LiBH4具有强还原性,能与大多数物质发生剧烈反应,是一类危险性较高的化学物质。
综上所述,硫化物固体电解质虽然具有较高的室温离子电导率,但对水、氧敏感,制备和使用条件苛刻。聚合物固体电解质的室温离子电导率和离子迁移数有待提高。硼氢化锂固体电解质具有较强的还原性,与锂的相容性好,但只有在120 ℃或以上时,晶体结构由正交晶系转变为六方晶系时才具有较高的离子电导率,限制了其实际应用。此外,如何构建具有较高室温离子电导率、较好力学性能、致密、与正负极相容性高的固体电解质膜是全固态锂硫电池的一大挑战。从长远发展来看,无机硫化物固体电解质由于具有室温电导率较高、与硫基正极材料相容性好、不存在空间电荷层,而成为固态锂硫电池最优的选择之一。
2 硫基正极材料
目前应用于采用有机电解液的锂硫电池(下文简称液态锂硫电池)的正极活性物质,如单质硫、无机硫化物和有机硫化物,均可用作固态锂硫电池的硫正极。在液态锂硫电池中,硫正极中的电化学反应发生在硫或硫化物与导电剂、电解液形成的“固/固/液”三相界。因此,硫或硫化物的电化学还原和氧化是一个动力学控制的步骤[32]。液体的浸润性有利于三相界的形成。在固态锂硫电池的硫正极中,电化学反应发生在“固/固/固”三相界。该三相界的形成较“固/固/液”困难,因此固态锂硫电池需要首先解决硫正极的结构设计,研究和开发高效的电极制备技术,以获得具有优良离子和电子传输网络的硫正极;同时,还需维持电极结构的相对稳定,消除电极活性材料体积膨胀和收缩对离子和电子传输的影响。
2.1 单质硫
单质硫是电子和离子的绝缘体,室温下的电导率为5×10-30S/cm。在制备电极时通常需要添加较多的导电剂和固体电解质。另外,电池放电时正极的反应产物硫化锂的体积较单质硫增大约70%。反复的膨胀、收缩导致活性物质与导电剂和固体电解质之间的“固/固”物理接触失效,进而导致电极失效。目前,固态锂硫电池硫正极的制备方法主要是采用物理混合法(如研磨、球磨等)、优选导电剂和固体电解质以及采用多孔碳硫复合材料等。
采用球磨的方法制备硫正极,是将单质硫、导电剂和固体电解质混合球磨,然后压片制得正极片。如ZHU等[33]分别采用球磨和在惰性气氛中、180 ℃下热处理制备了(单质硫)∶(PEO)=3∶7的硫正极。将所制备的硫正极与添加10%(质量分数) LiAlO2无机填料的聚氧化乙烯络合双三氟甲基磺酸亚胺锂盐[P(EO)20LiTFSI-10%(质量分数)LiAlO2]固体电解质隔膜和金属锂负极组装全固态电池。室温下,采用球磨工艺的硫正极的首次放电比容量为609 mA·h/g(S),高于采用热处理工艺的硫正极的452 mA·h/g(S)。但后者的循环寿命优于前者,循环50次后的容量保持率分别为14.9%和40.7%。采用聚合物固体电解质的全固态锂硫电池中硫的比容量较低,可能与聚合物固体电解质的电导率低有关。
采用离子电导率更高的硫化物固体电解质可以提高全固态锂硫电池的电化学性能。如KINOSHITA等[2]采用两步球磨法制备了(单质硫)∶(碳纤维)∶(Li3PS4)=3∶1∶6的正极,其中硫的担载量为4.29 mg/cm2,与无定形Li3PS4固体电解质隔膜和锂硅合金(Li4.4Si)负极,组装了全固态锂硫电池。在25 ℃以0.1 mA/cm2电流密度进行放电,首次比容量为1320 mA·h/g(S),50次循环后的容量保持率为90%,电池的平均工作电压为1.5 V。但是,已有研究表明,正极中固体电解质的电导率并不是影响电池电化学性能的唯一因素。如NAGATA等[6]比较研究了(单质硫)∶(Li2S-P2S5)∶(KB)=5∶4∶1的硫正极中添加不同磷硫比(P/S)的Li2S-P2S5固体电解质对电池电化学性能的影响。研究发现,随着电极中固体电解质P/S值的增大,正极中硫的比容量先增大后降低;其中以P/S=0.308、电导率为2×10-5S/cm的Li1.5PS3.3为固体电解质的电极中硫的比容量最高,在25 ℃分别以0.64 mA/cm2和6.4 mA/cm2电流密度进行放电,比容量分别为1568 mA·h/g(S)和1096 mA·h/g(S)。与此形成对照的是,正极中添加P/S=0.222、电导率更高为5×10-4S/cm的Li4.0PS4.5固体电解质时,以0.64 mA/cm2电流密度进行放电,硫的比容量为1250 mA·h/g(S)。
研究还表明,正极中的导电剂也可影响全固态电池的电化学性能。如NAGATA等[34]将单质硫分别与导电碳黑乙炔黑(AB)、Ketjenblack(KB)和活性炭(AC)球磨制备了(硫)∶[固体电解质(Li1.5PS3.3)]∶(导电碳)=5∶4∶1的正极,与Li10GeP2S12固体电解质隔膜和Li-In合金负极组装了全固态电池;发现以AB为导电剂的电池不能充放电,而以KB和AC为导电剂的电池以0.64 mA/cm2电流密度放电的比容量约为1600 mA·h/g(S),且以AC为导电剂的电极的比容量较以KB为导电剂的高10%。作者认为这是因为AC具有更高的比表面积而与硫的接触更充分所致。为改善硫正极中硫与导电剂和固体电解质的接触,也可以先将硫与多孔碳制得碳硫复合物,再与固体电解质混合。AGOSTINI等[18]首先联用热处理和球磨工艺制备了硫含量为50%(质量分数)的S-MCMB复合材料,再采用球磨工艺制备了(S-MCMB)∶(super P)∶[(Li2S)80(P2S5)20]=5∶5∶1的硫正极,以无定形固体电解质(Li2S)80(P2S5)20为隔膜、金属锂为负极组装了全固态锂硫电池。在80 ℃下以C/20倍率进行充放电,循环20次硫的比容量保持在400 mA·h/g(S),电池的平均工作电压为2.1 V。研究表明,用作碳硫复合材料的碳基底材料的孔结构和孔径也可以影响固态电池的电化学性能。如LIANG等[35]采用具有规则介孔结构的碳为载体制得硫含量为67%(质量分数)的碳硫复合材料(S-OMCs)。再进一步以该复合物制备了(S-OMCs)∶(PEO)∶(AB)=6∶2∶2的硫正极,与添加了10%(质量分数)SiO2无机填料的PEO络合LiTFSI[P(EO)18LiTFSI-10%(质量分数)SiO2]隔膜和金属锂负极组装了全固态锂硫电池。在70℃下以0.1 mA/cm2电流密度充放电,循环25次后硫的比容量为800 mA·h/g(S),容量保持率为65 %。与此对照的未采用规则介孔碳的硫正极,循环25次后的容量保持率仅为22%。NAGAO等[4]以孔径为8.6 nm的介孔碳为载体制备的碳硫复合材料,在室温以0.065 mA/cm2电流密度进行充放电,20次循环后硫的比容量为366 mA·h/g(S)。而采用孔径分别为42.2 nm和117.2 nm的孔径更大的介孔碳做载体时,相同条件下测试20次循环后的比容量分别为126 mA·h/g(S)和57 mA·h/g(S)。另外,研究表明,碳硫复合材料的热处理温度也可以影响电池的电化学性能。如NAGAO等[3]采用热熔融法制备了硫含量为30%(质量分数)的S-CMK3复合材料,再进一步采用球磨工艺制备了(S-CMK3)∶[thio-LISICON(Li3.25Ge0.25P0.75S4]=5∶5的硫正极,以thio-LISICON(Li3.25Ge0.25P0.75S4)为固体电解质隔膜、锂铝合金(Li-Al)为负极组装了全固态锂硫电池。发现热处理S-CMK3的温度由170 ℃增加到230 ℃,电池30次循环后的可逆比容量由500 mA·h/g(S)提高到1300 mA·h/g(S)。小角和宽角XRD研究表明[36],经230 ℃热处理,硫无规则地分散在CMK3的内壁上,提高了硫的电化学性能和循环稳定性。
为促进固态电池硫正极中“固/固/固”三相界的形成,降低界面阻抗,可采用原位生长技术有效提高固体电解质与活性材料和导电剂的接触,或者在硫正极中添加化学稳定性和热稳定性高的离子液体,来提高全固态锂硫电池的电化学性能。如NAGATA等[5]采用球磨法制备了(硫)∶(P2S5)∶(活性炭)=6∶3∶1的硫正极,再利用恒流、恒压电解法在极片中原位生成了固体电解质Li1.41PS2.5;再以Li10GeP2S12为固体电解质隔膜、锂铟合金(Li-In)为负极组装固态电池。电池在25 ℃下以1.6 mA/cm2电流密度进行充放电,循环10次后的比容量为1200 mA·h/g(S)。KINOSHITA等[37]在(硫)∶(Li3PS4)∶(碳纤维)=3∶6∶1的硫正极中添加离子液体[EMI][TFSI]。发现[EMI][TFSI]的含量为0.2%(质量分数)时,在25℃以0.1 mA/cm2(24 mA/g)电流密度进行放电,硫的首次放电比容量为1270 mA·h/g(S),循环50次后容量保持率为97%,性能优于不添加离子液体的全固态锂硫电池。而[EMI][TFSI]的含量为4%(质量分数)时,硫的比容量反而降低。
综上所述,文献报道的以单质硫为正极活性物质的固态锂硫电池采用的固体电解质主要是硫化物固体电解质和添加无机填料的PEO络合锂盐聚合物固体电解质。硫正极的制备方法主要是球磨工艺或联用热处理的球磨工艺,再将粉末材料压片制得硫正极,或制得浆料涂覆于集流体表面制得硫正极。方法非常单一,缺乏构建高效三相反应界的技术手段。采用硫化物固体电解质、以单质硫为正极的固态锂硫电池,硫正极中硫的含量约15%~60%(质量分数),典型值50%(质量分数),极片中硫的典型担载量约4 mg/cm2,比容量1000~1300 mA·h/g(S),循环次数一般20~100次。
2.2 无机硫化物
与单质硫相比,无机硫化物具有相对较高的电子电导率和离子电导率,如FeS电子电导率约0.021 S/cm[38],CuS电子电导率为103S/cm[39]。早期的全固态锂硫电池一般采用无机硫化物作为正极活性物质。表1总结了近年来发表的以无机硫化物为正极的全固态锂硫电池的电化学性能。从表中数据可以看出,FeS和CuS均表现出较高的电化学性能,比容量分别达到了430 mA·h/g(理论值609 mA·h/g)和350 mA·h/g(理论值560 mA·h/g);对应的正极中活性物质的含量分别为70%和38%(质量分数)。早期报道的以无机硫化物为正极的固态电池的循环次数一般难以超过100次[12, 19-20, 39-54]。
纳米尺度的硫化物材料不但可以提高材料的电化学性能,还具有较高的抗应力变化能力,提高固态锂硫电池的循环稳定性。NAGAO等[48]分别利用3种物理混合工艺制备了硫正极。方法一是将Li2S、导电剂AB和固体电解质(Li2S)80(P2S5)20混合,然后研磨(Li2S + AB + SE);方法二,首先球磨Li2S与AB制得混合物,再加入固体电解质(Li2S)80(P2S5)20进一步研磨成(Li2S-AB + SE);方法三是将Li2S、AB和固体电解质(Li2S)80(P2S5)20混合,然后球磨(Li2S-AB-SE)。图1是分别采用3种物理混合工艺制备的Li2S/AB/(Li2S)80(P2S5)20电极的SEM图。可以看出3种电极的形貌不同。Li2S+ AB + SE电极中的Li2S的粒径>100 μm,且与固体电解质和炭黑AB三者并未紧密结合;Li2S-AB-SE电极颗粒尺寸均<10 μm,且Li2S、AB和固体电解质分布均匀,结合紧密;Li2S-AB+SE电极介于两者之间。将3种正极分别与(Li2S)80(P2S5)20固体电解质隔膜和铟负极组装成固态电池,发现利用方法三球磨法制备的Li2S-AB-(Li2S)80(P2S5)20电极具有最高的比容量,为700 mA·h/g(Li2S)。表明在机械混合工艺中球磨工艺较研磨更有利于获得电化学性能优良的固态电池。
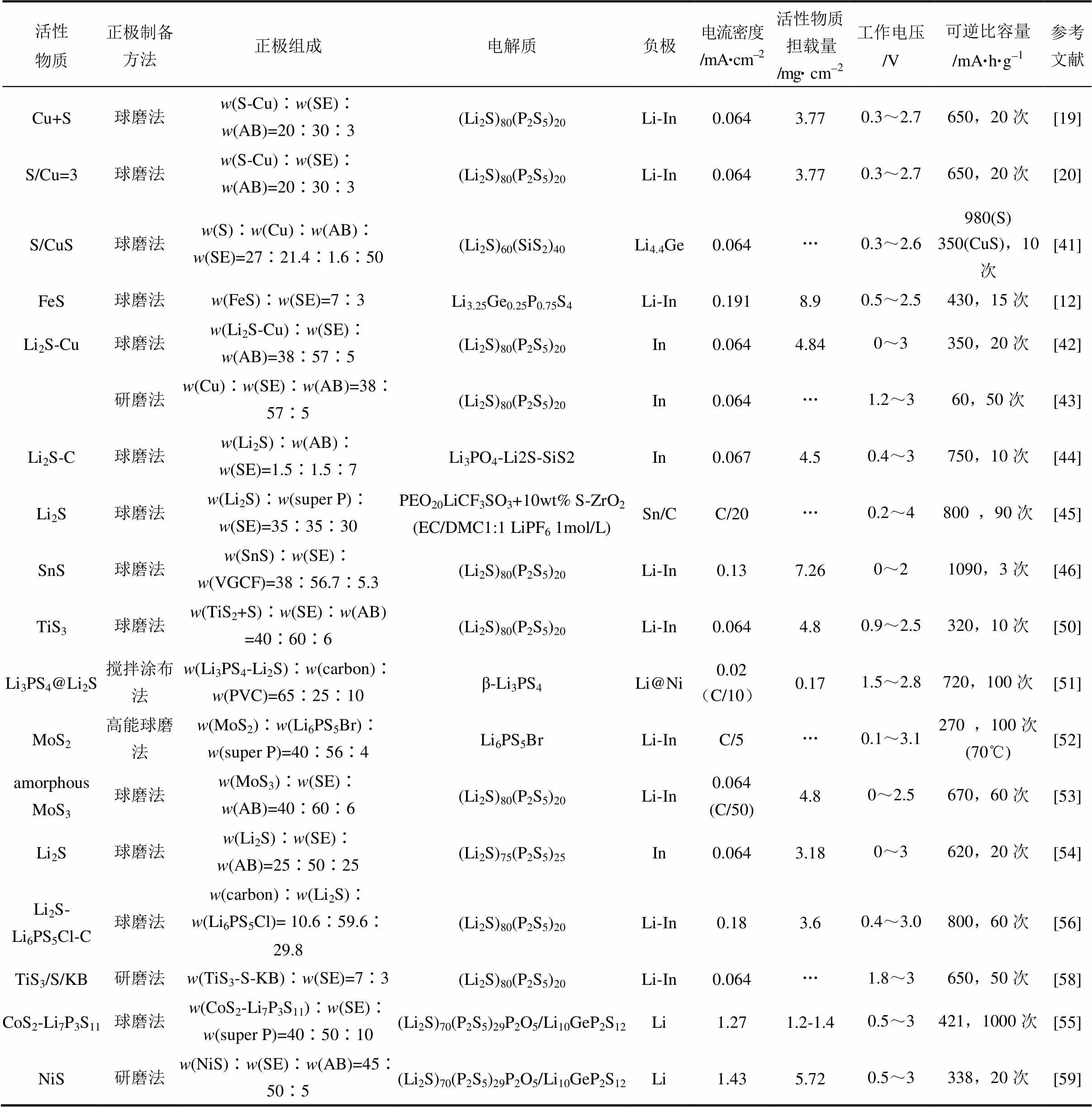
表1 无机硫化物正极在全固态锂硫电池中的电化学性能
相比于单质硫,无机硫化物正极材料的可控化学制备方法较多,甚至可进行原位生长。这对于制备具有特殊结构或形貌的纳米电极材料,提高固态锂硫电池的电化学性能具有重要意义。2016年,YAO等[55]采用原位液相法制得CoS2-Li7P3S11复合材料,如图2(a)、2(b)所示。可以看出,CoS2-Li7P3S11复合材料保持了CoS2的纳米片状结构,且粒径约10 nm的Li7P3S11均匀分布于CoS2纳米片表面。图2(c)的元素分布测试结果进一步表明,在CoS2-Li7P3S11复合材料中CoS2和Li7P3S11呈均匀分布状态。然后以(CoS2-Li7P3S11)∶(Li7P3S11)∶(super P)=4∶5∶1制备了硫正极,与Li7P3S11固体电解质隔膜、金属锂负极组装成全固态锂硫电池。在25 ℃下以1.27 mA/cm2电流密度进行充放电,电池循环1000次后的比容量为421 mA·h/g(以复合材料CoS2-Li7P3S11的质量计),容量保持率达84%。作者认为采用原位液相法将较高离子电导率(室温Li+=1.5×10-3S/cm)的Li7P3S11锚定在CoS2上,使得活性物质与固体电解质之间充分稳定地接触,有利于锂离子的快速传导,保证了电池高倍率和长循环的优异性能。LIN等[51]采用液相法在纳米Li2S表面包覆了一层固体电解质Li3PS4,将Li2S的室温离子电导率由10-13S/cm提高到10-7S/cm。再以此复合材料制备了(Li2S)∶[炭黑(WVA-1500 carbon)]∶(聚氯乙烯)=65∶25∶10的硫正极,以β-Li3PS4为固体电解质隔膜、锂包覆的镍为负极组装固态电池。在60 ℃以0.1 C倍率进行充放电,循环100次后Li2S的比容量为593 mA·h/g(Li2S),容量保持率为70%。而表面未包覆Li3PS4的Li2S,在相同条件下进行充放电,循环100次后的比容量为402 mA·h/g(Li2S)。HAN等[56]通过液相混合法制备了电子电导率和离子电导率均为10-5S/cm的Li2S-Li6PS5Cl-C复合材料,将Li2S担载量为3.6 mg/cm2、(Li2S-Li6PS5Cl-C)∶[(Li2S)80(P2S5)20]∶(AB)=6∶3∶1的正极,与(Li2S)80(P2S5)20固体电解质隔膜和金属铟(In)负极组装了全固态电池。在室温以50 mA/g电流密度进行充放电,循环60次Li2S的可逆比容量为830 mA·h/g(Li2S),活性物质的利用率为71%,容量保持率接近100%。而仅采用简单物理混合方法制得的Li2S-C/(Li2S)80(P2S5)20/AB电极在相同条件下的首次放电比容量为500 mA·h/g(Li2S),循环20次后电池失效。表明采用液相化学法制得的复合材料较简单物理混合提高了材料的电化学性能。TAKEUCHI等[45]利用放电等离子体烧结技术制备了Li2S含量为50%(质量分数)的Li2S-AB复合材料,再以此复合材料制备了(Li2S-AB)∶[(Li3PO4)0.01(Li2S)0.63(SiS2)0.36]=3∶7的硫正极,以(Li3PO4)0.01(Li2S)0.63(SiS2)0.36为固体电解质隔膜、铟为负极组装全固态电池。在室温以11.7 mA/g(0.067 mA/cm2)电流密度进行充放电,循环10次电极的可逆比容量为830 mA·h/g(Li2S),容量保持率为81%。与此对照的、采用球磨法制备的Li2S-AB材料,在相同条件下循环10次的可逆比容量仅为151 mA·h/g(Li2S),容量保持率为28%。说明放电等离子体烧结工艺较球磨工艺更有利于获得电化学性能优良的固态电池。ZHAN等[57]采用四氢呋喃作溶剂、Li3PS4和S为原料合成了室温离子电导率达3×10-5S/cm的Li3PS4+5。采用研磨法制得浆料,再涂布制得(Li3PS4+5)∶(carbon)∶(PVC)=6∶3∶1的硫正极,电极中Li3PS4+5的担载量为0.15~0.36 mg/cm2;与β-Li3PS4固体电解质隔膜、金属锂负极组装了全固态电池。在60 ℃下以0.1 C(0.015 mA/cm2)电流密度进行充放电,循环300次后的比容量为600 mA·h/g(Li3PS4+5)。
综上所述,制备无机硫化物电极方法更加丰富,除了球磨工艺外,液相化学合成方法和放电等离子体烧结技术等也被应用于材料的合成和制备,使得具有纳米结构的电极材料的可控合成成为可能。文献报道的工作中,采用硫化物固体电解质的固态锂硫电池,正极中硫化物的含量约15%~70%(质量分数),硫化物的担载量约0.17~8.9 mg/cm2,比容量约为270~1090 mA·h/g(硫化物),但循环次数一般少有超过百次。
文献报道的以无机硫化物为正极的固态锂硫电池主要采用硫化物固体电解质和添加无机填料的PEO络合锂盐聚合物固体电解质。与采用单质硫的正极相比,无机硫化物在电极中的含量和担载量更高,利用率更高,循环稳定性两者相仿。但由于无机硫化物的合成方法多样,材料组成、结构和形貌可调可控,未来有望通过材料设计、电极结构设计和制备工艺优化,来获得具有更优性能的固态锂硫电池。
2.3 有机硫化物
有机硫化物的电子电导率约为10-8~10-9S/cm[60-61],可在碳酸酯类电解液中稳定地充放电,成为锂硫电池研究的热点。硫化聚丙烯腈(SPAN)是研究的最为广泛的一类有机硫化物正极材料,在碳酸酯电解液中的放电比容量为700~800 mA·h/g[62]。
以SPAN为正极的固态锂硫电池,主要采用络合锂盐的聚合物固体电解质和硫化物固体电解质。YU等[63]以SPAN为正极活性物质,采用超声震荡和磁力搅拌方法将SPAN、固体电解质和炭黑混合制得浆料,然后涂布在集流体表面,制备了(SPAN)∶[PEO40(PEG) LiTFSI]∶(AB)=40∶48∶12的硫正极,以添加8%(质量分数)TiO2的PEO-LiTFSI聚合物[P(EO)8LiTFSI-8%(质量分数)TiO2]为隔膜、金属锂为负极组装全固态锂硫电池。在70 ℃以0.2 mA/cm2电流密度进行充放电,循环40次后SPAN的比容量为385 mA·h/g(SPAN)。ZHANG等[64]采用原位聚合和热处理的方法制备了硫含量为43%(质量分数)的聚苯胺PANI-C-S复合材料,再制得(PANI-C-S)∶(super P)∶(黏结剂)=8∶1∶1的硫正极,电极中硫的担载量为0.8 mg/cm2;以添加金属有机框架结构MIL-53(Al)的PEO-LiTFSI聚合物为隔膜、金属锂为负极组装全固态电池。在80 ℃以0.2 C倍率进行充放电,循环60次后电极的比容量达到876 mA·h/g(S);以4 C倍率进行充放电,循环1000次后电极的比容量为325 mA·h/g(S),表现出优异的电化学性能。另外,TREVEY等[65]采用研磨混合然后压片的方法,制备了(SPAN)∶[(Li2S)77.5(P2S5)22.5]∶(AB)=30∶20∶3的硫正极,以无机硫化物(Li2S)77.5(P2S5)22.5为固体电解质隔膜、金属锂粉压成的电极为负极组装了全固态电池。在60 ℃下以26.5 mA/g电流密度进行充放电,循环50次后SPAN的比容量为487 mA·h/g(SPAN)。
目前用于固态锂硫电池的有机硫化物主要有硫化聚丙烯腈和硫化聚苯胺[64],固体电解质主要采用硫化物固体电解质和添加无机填料的PEO(或PEG)络合锂盐聚合物固体电解质。正极的制备方法比较单一,主要是球磨工艺或联用热处理的球磨工艺,然后压片或涂布在集流体制得硫正极。硫化聚丙烯腈中硫的理论含量为56%(质量分数)[66],目前已有报道的硫的实际含量约为25%~45%(质量分数)[61, 67],较低。总结文献工作,有机硫化物正极中硫化物的担载量约0.15~0.8 mg/cm2,材料的比容量约为380~800 mA·h/g(硫化物),电池仍面临循环性能差的问题。
综上所述,单质硫具有较高的理论比容量,但其电子电导率和离子电导率极低,硫的电化学活性较低,且循环稳定性仍不理想。文献[34]报道的以单质硫为正极活性物质的固态锂硫电池,正极的比容量达到1600 mA·h/g(S),电极单位面积电量约7.6 mA·h/cm2,是目前电化学性能最高的固态锂硫电池。有机硫化物中硫的含量较低,对提高锂硫电池的比能量不利。另外,这两种正极材料和部件的制备方法比较单一。无机硫化物的电子和离子电导率较高,比容量相对较高,特别是制备方法多样,有望通过材料设计和创新合成而获得更高电化学性能和更优循环稳定性的固态锂硫电池。文献[55]报道的以复合材料CoS2-Li7P3S11为正极活性物质的固态锂硫电池,是目前循环性能最好的固态锂硫电池,循环1000次后的容量保持率达84%。但是,硫正极的单位面积电量较低,仅0.9 mA·h/cm2,导致电池比能量低。
3 锂基负极
全固态锂硫电池负极的研究重点是构建具有较高稳定性的“固体电解质/锂”界面层来提高锂负极与固体电解质的界面稳定性。以此为出发点,目前的研究工作主要集中在研究金属锂与固体电解质的相容性、锂合金负极的制备等。
3.1 金属锂
锂是摩尔质量最轻(6.941 g/mol)、电极电势最负的金属(-3.04 V. SHE),理论比容量3860 mA·h/g,是石墨的10倍,已被广泛应用于锂一次电池。锂应用于固态二次电池,有望提高二次电池的质量比能量和体积能量密度。然而,锂的还原性较强,能与大多数固体电解质反应。因此,在固体电解质与金属锂的界面生成一层稳定的固体电解质层,对于提高电池的电化学性能和循环稳定性具有重要作用。另外,保证电池放电过程中,锂基负极外形尺寸的稳定也是难题之一。
NAGAO等[68]通过真空蒸镀法在硫化物固体电解质(Li2S)80(P2S5)20的对锂一侧的表面沉积一层金属锂,将其应用于全固态锂硫电池。电化学测试表明以0.064 mA/cm2电流密度进行充放电,循环20次后电极的比容量为920 mA·h/g(S),容量保持率为97%,平均工作电压为2.0 V。作者认为真空蒸镀的锂层增加了固体电解质与锂负极的接触面积。
目前,关于全固态锂硫电池中金属锂的稳定性的研究相对较少。当采用聚合物电解质时,负极一般采用金属锂。虽然文献数量不多,但报道的结果表明,聚合物固体电解质对金属锂的稳定性较 好[22]。若采用硫化物固体电解质,负极均采用锂合金,主要是为了避免金属锂与硫化物之间的氧化还原反应。有关金属锂与固体电解质的兼容性将在本文“电极/电解质”界面部分详细阐述。
3.2 锂合金
采用锂合金可降低金属锂的还原性和活泼性。文献报道的用于全固态锂硫电池的锂合金负极主要有Li-In[5-6, 12, 19-20, 34, 42-46, 48, 50-53, 55-56, 58-59, 69]、Li-Ge[41]、Li-Si[2, 37]和Li-Al[3-4]等。其中,Li-In合金(Li/In=0.79,摩尔比)应用得最多,其氧化还原电势为+0.6 V(. Li+/Li)[70]。如NAGATA等[34]使用Li-In合金负极,与(单质硫)∶[固体电解质(Li1.5PS3.3)]∶(AC)=5∶4∶1的正极和硫化物Li10GeP2S12固体电解质组装了全固态电池。以1.3 mA/cm2(1C)电流密度进行充放电,电池循环100次的比容量约1600 mA·h/g(S),容量保持率接近100%。采用Li-In合金提高了负极的稳定性,但电池的放电电压约为1.5 V;而以单质硫为正极、金属锂为负极的固态电池的放电电压约为2.0 V[35]。与使用金属锂相比,采用Li-In合金降低了电池的工作电压,不利于获得高比能量的固态锂硫电池。
若正极以Li2S为活性物质,可以使用锡或硅等高比容量负极来制备固态电池,以期提高电池的循环稳定性和高温稳定性。锡或硅与锂反应可形成金属间化合物。HASSOUN等[71]以Li2S和碳的复合材料为正极、Sn/C为负极、PEO基凝胶电解质为电解质隔膜,制备了固态锂硫电池。在25 ℃下以0.2 C倍率进行充放电,电池循环100次后的比容量为300 mA·h/g(Li2S),容量保持率为71%。这类电池的比能量受负极比容量和电池放电电压低的影响而 较低。
综上所述,金属锂具有较强的还原性,需要研究与固体电解质的界面相容性,建立界面修饰方法以及研制具有高稳定三维结构的金属锂负极等。
4 “电极/电解质”界面
全固态锂硫电池中的界面主要包括正极中活性物质与离子导体的界面、正极与固体电解质隔膜的界面、负极与固体电解质隔膜的界面等。
正极活性物质在放电和充电过程发生体积的膨胀和收缩,产生的应力可导致材料粉化,破坏正极中活性物质、固体电解质和导电剂的物理接触,从而造成不可逆容量损失,降低电池的循环性能。针对上述问题,可通过制备纳米材料、多孔材料以及复合材料等加以解决。YANG等[72]利用原位透射电子显微镜观察了全固态锂硫电池正极在电化学还原过程中的S和Li2S在纳米尺度上的相分离行为,发现形成的纳米颗粒不仅缩短了电荷传输路径,而且构建了“S/Li2S”界面网络,有利于锂化过程中锂离子和电子的传输。HAN等[73]构建了正、负极及电解质均为Li10GeP2S12的全固态电池。通过在正、负极中添加导电剂,Li10GeP2S12可分别作为正、负极活性材料进行充放电。在较高电势下,LiS6作为活性物质;低电势下GeS4成为活性物质。如此,完全避免了正、负极与固体电解质的界面问题。XPS测试表明,电池充电时,正极中生成硫,负极生成锂锗合金,电池循环200次的容量保持率为77%。
金属锂具有强还原性,在固体电解质与金属锂的界面生成一层稳定的固体电解质界面层,对于稳定电池的电化学性能具有关键作用。WENZEL等[74]将金属锂与固体电解质的界面分为3种:第一种是热力学稳定的界面,如Li与LiI和Li与Li3N的界面;第二种是热力学不稳定界面,但生成稳定的固体电解质界面层(SEI);第三种是热力学不稳定界面,生成的SEI层随时间变化。为了进一步证实界面稳定层的存在,WENZEL等[75]通过原位XPS技术和实时电化学交流阻抗技术,分析了硫化物固体电解质Li7P3S11与Li的界面稳定性。结果表明,Li7P3S11与Li接触会生成一层含有Li2S和Li3P的SEI层,SEI层的厚度为几个纳米,且随着时间的延长,SEI层厚度基本保持不变。另外,该研究组采用相同技术还分析了硫化物固体电解质Li10GeP2S12(LGPS)与Li的界面稳定性[76]。研究发现,LGPS与锂接触会在界面处生成一层主要成分为Li2S、Li3P和Li-Ge合金的SEI层。作者比较了LGPS和Li7P3S11分别与Li生成的SEI层的阻抗。结果表明,固体电解质与金属锂接触一年以后,LGPS与Li的SEI层的厚度约为370 nm,面电阻为4.6 kΩ/cm2;而Li7P3S11与Li的SEI层厚度仅为23 nm,面电阻为0.28 kΩ/cm2。KANNO等[77]利用恒流电解法在Li-Al合金与固体电解质Li3.25Ge0.25P0.75S4之间原位构建一层固体电解质界面层。电化学交流阻抗测试表明,“Li-Al/Li3.25Ge0.25P0.75S4”界面阻抗基本不随循环次数的增加而变化;而作为对照的锂与固体电解质Li3.25Ge0.25P0.75S4的界面阻抗则随着循环次数的增加逐渐增大。XPS测试表明“Li-Al/Li3.25Ge0.25P0.75S4”界面层的主要成分是Li2S、Li2O、Li2CO3和LiOH,与“Li/Li3.25Ge0.25P0.75S4”界面层成分相差不大,但前者Li2O的含量更多。这可能是造成“Li/Li3.25Ge0.25P0.75S4”界面电荷传输受阻的原因之一。这些工作提示,在金属锂负极或固体电解质的表面制备一层对锂稳定的固体电解质界面层,可以稳定金属锂与固体电解质的界面。
5 固态锂硫电池制备工艺
固态锂硫电池的正极一般采用球磨工艺制备;固体电解质隔膜一般采用熔融法、高能球磨法或液相法制得后,再采用冷压成型;负极一般采用金属锂或锂合金,或者在电极的表面修饰对锂稳定的固体电解质。这些内容均已在本文的前面几节分别综述,在此不再赘述。
有关固态锂硫电池制备工艺的研究相对较少。大多数固态电池的组装工艺一般是将正极、固体电解质和负极以冷压方式成型,制成一体化电池。NAGAO等[78]采用球磨工艺制备了(Li2S)∶(AB)∶[(Li2S)75(P2S5)25]=25∶25∶50的硫正极,然后与固体电解质和铟负极通过冷压成型工艺制得固态锂硫电池。图3为制得的正极与固体电解质复合体的截面SEM图,其中,白色颗粒是固体电解质,黑色颗粒是AB,灰色颗粒是由Li2S、AB和固体电解质组成的复合物。图3(b)是图3(a)中红色矩形标识区域的放大图。可以看出,该复合体中的正极与固体电解质的界面平滑、接触紧密。深圳市盛邦科技有限公司公开了一种固态锂硫电池的制备工艺[79-80]。主要技术特点是采用多孔铝箔和多孔铜箔分别作为电池正负极的集流体。在冷压过程中,电极材料很容易嵌入到多孔集流体中,可有效粘接在一起形成一个整体,提高压片成型率,简化了制作工艺。但是,冷压成型工艺存在电池各部件之间的界面接触不良、界面阻抗大的问题。
固态锂硫电池的比能量受电池电化学性能和非活性物质含量的影响。可以用式(1)来近似地估算固态锂硫电池的比能量。需说明的是,式(1)中电池的质量只包括正极、负极和固体电解质隔膜的质量,而不包括极耳和电芯外包装等的质量。
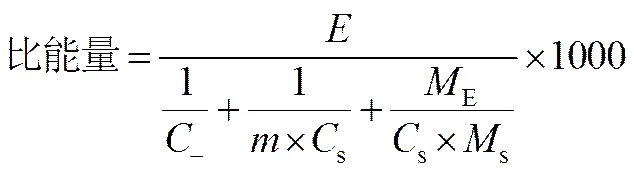
式中,为电池的电压,V;为负极的实际比容量,A·h/g,负极若是金属锂,“1/”这一项的数值等于0.259 g/A·h;为正极中活性物质硫或硫化物的百分含量;S为正极中硫或硫化物的实际比容量,A·h/g;S为单位面积正极中硫或硫化物的质量,g/cm2;E为单位面积固体电解质隔膜的质量,g/cm2。电池的比能量与电池的电压成正比;并且正极中活性物质的比容量越高,单位面积硫电极的容量(S×S)越大,单位面积固体电解质隔膜的质量越小,电池的比能量越大。以文献[34]报道数据为例,正极中硫的含量为50%(质量分数),硫的担载量约0.00478 g/cm2,比容量为1.6 A·h/g(S),单位面积固体电解质的质量为0.0891 g/cm2,利用式(1)可估算出电池的比能量仅为152 W·h/kg。该电池体系的比能量若要达到600 W·h/kg,则固体电解质单位面积的质量须小于0.014 g/cm2。若采用硫化物固体电解质,则固体电解质隔膜的厚度须小于70mm。因此,如何获得质量极轻或厚度极薄的固体电解质隔膜是获得高比能固态电池的关键之一。式(1)也适用于采用其它正极材料的固态电池。根据固态电池各部件的密度,可以大致估计固态锂硫电池体积能量密度的数值为质量能量密度数值的1.5~2倍。
综上所述,研究和开发新型的正极制备工艺,构建固-固复合体系中的离子和电子传输网络,稳定电极结构对于提高硫基正极的电化学性能和循环稳定性非常重要。通过优化电极活性材料与固体电解质的热压复合工艺,设计具有自支撑结构的正负电极,对于降低固体电解质与正负极的界面阻抗,保持固体电解质与正负极的电接触非常有必要。特别是研究和开发质轻的薄层固体电解质隔膜、制备具有高活性物质含量和高电化学活性的厚电极,对于提高固态电池的比能量意义重大。然而,这些工作鲜有报道。
6 结 语
固态锂硫电池面临的主要技术挑战包括:高离子电导率和高稳定性的固体电解质的设计和合成、高反应活性的“固/固/固”三相反应界构建、高电化学活性的超厚硫正极的设计及制备、超薄固体电解质隔膜的制备等。这里需要指出的是,硫的密度为2.07 g/cm3,而锂的过渡金属氧化物,如钴酸锂和三元正极材料的密度一般4~5 g/cm3,因此,相同厚度的电极中硫或硫化物的单位面积担载量一般仅为钴酸锂和三元正极材料的50%,一定程度地消减了固态锂硫电池质量比能量的优势,也使得固态锂硫电池的体积比能量的优势不明显。
在固态锂硫电池中,单质硫、无机硫化物和有机硫化物3种正极材料中,单质硫具有最高的比容量和放电电压;无机硫化物的电子和离子电导率均高于单质硫和有机硫化物,且以无机硫化物为活性物质的极片的制备方法多样。硫化物固体电解质是目前具有最高室温离子电导率的固态电解质,可达10-2S/cm,且密度明显小于氧化物固体电解质;聚合物固体电解质柔韧、质轻,容易获得更薄的电解质隔膜,且易于大规模生产,但室温离子电导率10-7~10-6S/cm,有待提高。金属锂是质量最轻、电极电势最负的金属,通过界面修饰稳定的固体电解质界面层可以提高锂与固体电解质的界面稳定性,仍是固态电池首选的负极。
以固体电解质取代有机电解液的全固态锂硫电池是解决电池循环稳定性和安全性的有效途径之一。目前,大量的工作集中在开发具有更高离子电导率的固体电解质。然而,为实现高安全性和高比能量全固态锂硫电池的实用化,硫正极的结构设计与制备、电极活性材料与固体电解质复合工艺的设计优化、具有自支撑结构的正负电极的制备、致密固体电解质薄膜的制备工艺、提高金属锂循环稳定性等,也应成为全固态锂硫电池研究的重点。总之,任何单一的技术进步均不能促成全固态锂硫电池的实际应用,需以上几种技术的共同突破。
[1] LIN Z, LIANG C. Lithium-sulfur batteries: From liquid to solid cells[J]. Journal of Materials Chemistry A, 2015, 3(3): 936-958.
[2] KINOSHITA S, OKUDA K, MACHIDA N, et al. All-solid-state lithium battery with sulfur/carbon composites as positive electrode materials[J]. Solid State Ionics, 2014, 256: 97-102.
[3] NAGAO M, IMADE Y, NARISAWA H, et al. All-solid-state Li-sulfur batteries with mesoporous electrode and thio-LISICON solid electrolyte[J]. Journal of Power Sources, 2013, 222: 237-242.
[4] NAGAO M, SUZUKI K, IMADE Y, et al. All-solid-state lithium- sulfur batteries with three-dimensional mesoporous electrode structures[J]. Journal of Power Sources, 2016, 330: 120-126.
[5] NAGATA H, CHIKUSA Y. Transformation of P2S5into a solid electrolyte with ionic conductivity at the positive composite electrode of all-solid-state lithium-sulfur batteries[J]. Energy Technology, 2014, 2(9/10): 753-756.
[6] NAGATA H, CHIKUSA Y. Activation of sulfur active material in an all-solid-state lithium-sulfur battery[J]. Journal of Power Sources, 2014, 263: 141-144.
[7] WU B, WANG S, EVANS I W J, et al. Interfacial behaviours between lithium ion conductors and electrode materials in various battery systems[J]. Journal of Materials Chemistry A, 2016, 4(40): 15266-15280.
[8] WANG S, DING Y, ZHOU G, et al. Durability of the Li1+xTi2–xAl(PO4)3solid electrolyte in lithium-sulfur batteries[J]. Acs Energy Letters, 2016, 1(6): 1080-1085.
[9] WU X L, ZONG J, XU H, et al. Effects of LAGP electrolyte on suppressing polysulfide shuttling in Li-S cells[J]. Rsc Advances, 2016, 6(62): 57346-57356.
[10] YU X, BI Z, ZHAO F, et al. Polysulfide-shuttle control in lithium-sulfur batteries with a chemically/electrochemically compatible NASICON-type solid electrolyte[J]. Advanced Energy Materials, 2016, 6(24): 1601392-1601400.
[11] JUNG Y S, OH D Y, NAM Y J, et al. Issues and challenges for bulk-type all-solid-state rechargeable lithium batteries using sulfide solid electrolytes[J]. Israel Journal of Chemistry, 2015, 55(5): 472-485.
[12] MACHIDA N, SHIGEMATSU T. An all-solid-state lithium battery with sulfur as positive electrode materials[J]. Chemistry Letters, 2004, 33(4): 376-377.
[13] MURAYAMA M, SONOYAMA N, YAMADA A, et al. Material design of new lithium ionic conductor, thio-LISICON, in the Li2S-P2S5system[J]. Solid State Ionics, 2004, 170(3/4): 173-180.
[14] TREVEY J, JANG J S, JUNG Y S, et al. Glass-ceramic Li2S-P2S5electrolytes prepared by a single step ball billing process and their application for all-solid-state lithium-ion batteries[J]. Electrochemistry Communications, 2009, 11(9): 1830-1833.
[15] MINAMI K, HAYASHI A, TATSUMISAGO M. Crystallization process for superionic Li7P3S11glass-ceramic electrolytes[J]. Journal of the American Ceramic Society, 2011, 94(6): 1779-1783.
[16] KAMAYA N, HOMMA K, YAMAKAWA Y, et al. A lithium superionic conductor[J]. Nat. Mater., 2011, 10(9): 682-686.
[17] KATO Y, HORI S, SAITO T, et al. High-power all-solid-state batteries using sulfide superionic conductors[J]. Nature Energy, 2016, 1(4): 16030-16036.
[18] AGOSTINI M, AIHARA Y, YAMADA T, et al. A lithium-sulfur battery using a solid, glass-type P2S5-Li2S electrolyte[J]. Solid State Ionics, 2013, 244: 48-51.
[19] HAYASHI A, OHTOMO T, MIZUNO F, et al. All-solid-state Li/S batteries with highly conductive glass-ceramic electrolytes[J]. Electrochemistry Communications, 2003, 5(8): 701-705.
[20] HAYASHI A, OHTOMO T, MIZUNO F, et al. Rechargeable lithium batteries, using sulfur-based cathode materials and Li2S-P2S5glass-ceramic electrolytes[J]. Electrochimica Acta, 2004, 50(2/3): 893-897.
[21] TREVEY J E, JUNG Y S, LEE S H. High lithium ion conducting Li2S-GeS2-P2S5glass-ceramic solid electrolyte with sulfur additive for all solid-state lithium secondary batteries[J]. Electrochimica Acta, 2011, 56(11): 4243-4247.
[22] MURAMATSU H, HAYASHI A, OHTOMO T, et al. Structural change of Li2S-P2S5sulfide solid electrolytes in the atmosphere[J]. Solid State Ionics, 2011, 182(1): 116-119.
[23] ZHAO Y, ZHANG Y, GOSSELINK D, et al. Polymer electrolytes for lithium/sulfur batteries[J]. Membranes (Basel), 2012, 2(3): 553-564.
[24] MARMORSTEIN D Y, YU T H, Striebel K A, et al. Electrochemical performance of lithium/sulfur cells with three different polymer electrolytes[J]. Journal of Power Sources, 2000, 89(2): 219-226.
[25] LIN Y, LI J, LIU K, et al. Unique starch polymer electrolyte for high capacity all-solid-state lithium sulfur battery[J]. Green Chemistry, 2016, 18(13): 3796-3803
[26] 马强, 戚兴国, 容晓飞. 新型固态聚合物电解质在锂硫电池中的性能研究[J]. 储能科学与技术, 2016, 5(5): 713-718.
MA Qiang, QI Xingguo, RONG Xiaofei. Novel solid polymer electrolytes for all-solid state lithium-sulfur batteries[J]. Energy Storage Science and Technology, 2016, 5(5): 713-718.
[27] HASSOUN J, SCROSATI B. Moving to a solid-state configuration: A valid approach to making lithium-sulfur batteries viable for practical applications[J]. Advanced Materials, 2010, 22(45): 5198-5201.
[28] JEONG S S, LIM Y T, CHOI Y J, et al. Electrochemical properties of lithium sulfur cells using peo polymer electrolytes prepared under three different mixing conditions[J]. Journal of Power Sources, 2007, 174(2): 745-750.
[29] AGRAWAL R C, PANDEY G P. Solid polymer electrolytes: Materials designing and all-solid-state battery applications: An overview[J]. Journal of Physics D: Applied Physics, 2008, 41(22): 223001-223018.
[30] UNEMOTO A, CHEN C, WANG Z, et al. Pseudo-binary electrolyte, LiBH4-LiCl, for bulk-type all-solid-state lithium-sulfur battery[J]. Nanotechnology, 2015, 26(25): 254001-254008.
[31] UNEMOTO A, YASAKU S, NOGAMI G, et al. Development of bulk-type all-solid-state lithium-sulfur battery using LiBH4electrolyte[J]. Applied Physics Letters, 2014, 105(8): 83901-83904.
[32] RYU H S, GUO Z, AHN H J, et al. Investigation of discharge reaction mechanism of lithium|liquid electrolyte|sulfur battery[J]. Journal of Power Sources, 2009, 189(2): 1179-1183.
[33] ZHU X, WEN Z, GU Z, et al. Electrochemical characterization and performance improvement of lithium/sulfur polymer batteries[J]. Journal of Power Sources, 2005, 139(1/2): 269-273.
[34] NAGATA H, CHIKUSA Y. A lithium sulfur battery with high power density[J]. Journal of Power Sources, 2014, 264: 206-210.
[35] LIANG X, WEN Z, LIU Y, et al. Highly dispersed sulfur in ordered mesoporous carbon sphere as a composite cathode for rechargeable polymer Li/S battery[J]. Journal of Power Sources, 2011, 196(7): 3655-3658.
[36] NAGAO M, IMADE Y, NARISAWA H, et al. Reaction mechanism of all-solid-state lithium-sulfur battery with two-dimensional mesoporous carbon electrodes[J]. Journal of Power Sources, 2013, 243: 60-64.
[37] KINOSHITA S, OKUDA K, MACHIDA N, et al. Additive effect of ionic liquids on the electrochemical property of a sulfur composite electrode for all-solid-state lithium-sulfur battery[J]. Journal of Power Sources, 2014, 269: 727-734.
[38] ZENG S L, WANG H X, DONG C. Synthesis and electrical conductivity of nanocrystalline tetragonal FeS[J]. Chinese Physics B, 2014, 23(8): 87203-87207.
[39] LAI C H, LU M Y, CHEN L J. Metal sulfide nanostructures: Synthesis, properties and applications in energy conversion and storage[J]. Journal of Materials Chemistry, 2012, 22(1): 19-30.
[40] KAZUNORI TAKADA K I, SHIGEO K. Lithium iron sulfide as an electrode material in a solid state lithium battery[J]. Solid State Ionics, 1999, 117: 273-276.
[41] MACHIDA N. Electrochemical properties of sulfur as cathode materials in a solid-state lithium battery with inorganic solid electrolytes[J]. Solid State Ionics, 2004, 175(1/2/3/4): 247-250.
[42] KIM B C, TAKADA K, OHTA N, et al. All solid state li-ion secondary battery with FeS anode[J]. Solid State Ionics, 2005, 176(31/32/33/34): 2383-2387.
[43] HAYASHI A, OHTSUBO R, OHTOMO T, et al. All-solid-state rechargeable lithium batteries with Li2S as a positive electrode material[J]. Journal of Power Sources, 2008, 183(1): 422-426.
[44] HAYASHI A, OHTSUBO R, NAGAO M, et al. Characterization of Li2S-P2S5-Cu composite electrode for all-solid-state lithium secondary batteries[J]. Journal of Materials Science, 2009, 45(2): 377-381.
[45] TAKEUCHI T, KAGEYAMA H, NAKANISHI K, et al. All-solid- state lithium secondary battery with Li2S-C composite positive electrode prepared by spark-plasma-sintering process[J]. Journal of the Electrochemical Society, 2010, 157(11): A1196-A1201.
[46] ASO K, HAYASHI A, TATSUMISAGO M. Synthesis of needlelike and platelike SnS active materials in high-boiling solvents and their application to all-solid-state lithium secondary batteries[J]. Crystal Growth & Design, 2011, 11(9): 3900-3904.
[47] YERSAK T A, TREVEY J E, LEE S H. In situ lithiation of TiS2enabled by spontaneous decomposition of Li3N[J]. Journal of Power Sources, 2011, 196(22): 9830-9834.
[48] NAGAO M, HAYASHI A, TATSUMISAGO M. High-capacity Li2S-nanocarbon composite electrode for all-solid-state rechargeable lithium batteries[J]. Journal of Materials Chemistry, 2012, 22(19): 10015-10020.
[49] GOLSHEIKH A M, HUANG N M, LIM H N, et al. One-pot hydrothermal synthesis and characterization of FeS2(pyrite)/graphene nanocomposite[J]. Chemical Engineering Journal, 2013, 218: 276-284.
[50] MATSUYAMA T, SAKUDA A, HAYASHI A, et al. Electrochemical properties of all-solid-state lithium batteries with amorphous titanium sulfide electrodes prepared by mechanical milling[J]. Journal of Solid State Electrochemistry, 2013, 17(10): 2697-2701.
[51] ZHAN L, LIU Z C, NANCY J, et al. Lithium superionic sulfide cathode for all-solid lithium sulfur batteries[J]. Acs Nano, 2013, 7(3): 2829-2833.
[52] CHEN M, YIN X, REDDY M V, et al. All-solid-state MoS2/ Li6PS5Br/In-Li batteries as a novel type of Li/S battery[J]. Journal of Materials Chemistry A, 2015, 3(20): 10698-10702.
[53] MATSUYAMA T, HAYASHI A, OZAKI T, et al. Electrochemical properties of all-solid-state lithium batteries with amorphous MoS3electrodes prepared by mechanical milling[J]. Journal of Materials Chemistry A, 2015, 3(27): 14142-14147.
[54] NAGAO M, HAYASHI A, TATSUMISAGO M, et al. Li2S nanocomposites underlying high-capacity and cycling stability in all-solid-state lithium-sulfur batteries[J]. Journal of Power Sources, 2015, 274: 471-476.
[55] YAO X, LIU D, WANG C, et al. High-energy all-solid-state lithium batteries with ultralong cycle life[J]. Nano Letters, 2016, 16(11): 7148-7154.
[56] HAN F, YUE J, FAN X, et al. High-performance all-solid-state lithium-sulfur battery enabled by a mixed-conductive Li2S nanocomposite[J]. Nano Letters, 2016, 16(7): 4521-4527.
[57] LIN Z, LIU Z, FU W, et al. Lithium polysulfidophosphates: A family of lithium-conducting sulfur-rich compounds for lithium-sulfur batteries[J]. Angewandte Chemie International Edition, 2013, 52(29): 7460-7463.
[58] MATSUYAMA T, HAYASHI A, HART C J, et al. Amorphous TiS3/S/C composite positive electrodes with high capacity for rechargeable lithium batteries[J]. Journal of the Electrochemical Society, 2016, 163(8): A1730-A1735.
[59] LONG P, XU Q, PENG G, et al. NiS nanorods as cathode materials for all-solid-state lithium batteries with excellent rate capability and cycling stability[J]. ChemElectroChem, 2016, 3(5): 764-769.
[60] FANOUS J, WEGNER M, GRIMMINGER J, et al. Structure-related electrochemistry of sulfur-poly(acrylonitrile) composite cathode materials for rechargeable lithium batteries[J]. Chemistry of Materials, 2011, 23(22): 5024-5028.
[61] ZHANG S. Understanding of sulfurized polyacrylonitrile for superior performance lithium/sulfur battery[J]. Energies, 2014, 7(7): 4588-4600.
[62] WANG J, YANG J, XIE J, et al. A novel conductive polymer-sulfur composite cathode material for rechargeable lithium batteries[J]. Advanced Materials, 2002, 14: 963-965.
[63] YU X, XIE J, YANG J, et al. All solid-state rechargeable lithium cells based on nano-sulfur composite cathodes[J]. Journal of Power Sources, 2004, 132(1/2): 181-186.
[64] ZHANG C, LIN Y, LIU J. Sulfur double locked by a macro-structural cathode and a solid polymer electrolyte for lithium–sulfur batteries[J]. Journal of Materials Chemistry A, 2015, 3(20): 10760-10766.
[65] TREVEY J E, GILSDORF J R, STOLDT C R, et al. Electrochemical investigation of all-solid-state lithium batteries with a high capacity sulfur-based electrode[J]. Journal of the Electrochemical Society, 2012, 159(7): A1019-A1022.
[66] DOAN T L, GHAZNAVI M, ZHAO Y, et al. Binding mechanism of sulfur and dehydrogenated polyacrylonitrile in sulfur/polymer composite cathode[J]. Journal of Power Sources, 2013, 241: 61-69.
[67] ZHENG S, HAN P, HAN Z, et al. High performance C/S composite cathodes with conventional carbonate-based electrolytes in Li-S battery[J]. Scientific Reports, 2014, 4: 4842-4848.
[68] NAGAO M, HAYASHI A, TATSUMISAGO M. Fabrication of favorable interface between sulfide solid electrolyte and Li metal electrode for bulk-type solid-state Li/S battery[J]. Electrochemistry Communications, 2012, 22: 177-180.
[69] HAN F, LI W C, LI D, et al.electrochemical generation of mesostructured Cu2S/C composite for enhanced lithium storage: Mechanism and material properties[J]. Chem. Electro. Chem., 2014, 1(4): 733-740.
[70] JOHN C, NEN R A H. Thermodynamic and mass transport properties of "LiIn"[J]. Materials Research Bulletin, 1980, 15: 1225-1234.
[71] HASSOUN J, SCROSATI B. A high-performance polymer tin sulfur lithium ion battery[J]. Angewandte Chemie International Edition, 2010, 49(13): 2371-2374.
[72] YANG Z, ZHU Z, MA J, et al. Phase separation of Li2S/S at nanoscale during electrochemical lithiation of the solid-state lithium-sulfur battery usingTEM[J]. Advanced Energy Materials, 2016, 6(20): 1600806-1600810.
[73] HAN F, GAO T, ZHU Y, et al. A battery made from a single material[J]. Advanced Materials, 2015, 27(23): 3473-3483.
[74] WENZEL S, LEICHTWEISS T, KRGER D, et al. Interphase formation on lithium solid electrolytes—Anapproach to study interfacial reactions by photoelectron spectroscopy[J]. Solid State Ionics, 2015, 278: 98-105.
[75] WENZEL S, WEBER D A, LEICHTWEISS T, et al. Interphase formation and degradation of charge transfer kinetics between a lithium metal anode and highly crystalline Li7P3S11solid electrolyte[J]. Solid State Ionics, 2016, 286: 24-33.
[76] WENZEL S, RANDAU S, LEICHTWEI T, et al. Direct observation of the interfacial instability of the fast ionic conductor Li10GeP2S12at the lithium metal anode[J]. Chemistry of Materials, 2016, 28(7): 2400-2407.
[77] KANNO R, MURAYAMA M, INADA T, et al. A self-assembled breathing interface for all-solid-state ceramic lithium batteries[J]. Electrochemical and Solid-State Letters, 2004, 7(12): A455-A458.
[78] NAGAO M, HAYASHI A, TATSUMISAGO M, et al. Li2S nanocomposites underlying high-capacity and cycling stability in all-solid-state lithium-sulfur batteries[J]. Journal of Power Sources, 2015, 274: 471-476.
[79] 段伟, 倪尔福. 一种正极片及全固态电池: 201620745321.9[P]. 2016-07-14.
DUAN W, NI E F. A cathode and all solid-state battery: 201620745321.9[P]. 2016-07-14.
[80] 段伟, 倪尔福. 一种负极片及全固态电池: 201620742611.8[P]. 2016-07-14.
DUAN W, NI E F. An anode and all solid-state battery: 201620742611.8[P]. 2016-07-14.
Research progress of all solid-state lithium sulfur batteries
1,2,1,1
(1Dalian Institute of Chemical Physics, Chinese Academy of Sciences, Dalian 116023, Liaoning, China;2University of Chinese Academy of Sciences, Beijing 100049, China)
Lithium-sulfur (Li-S) battery employing lithium as the anode and sulfur as the cathode possesses the highest theoretical energy density of 2600 W·h·kg-1among the rechargable batteries consisted by the solid-state active materials. Sulfur and lithium resources are also abundant and low cost. To replace the organic liquid electrolyte by the solid electrolyte, the all-solid-state battery systems are expected to solve the safety issues and improve the cycling stability of Li-S batteries. It is becoming the hot topic in reaseach and development of rechargeable batteries. This paper presents a comprehensive review of the progress of all solid-state Li-S batteries in recent years, including solid electrolytes, sulfur-based cathodes, lithium-based anodes, electrode/electrolyte interface, and cell fabrication methods. The developments of all solid-state Li-S batteries are prospected as well.
all solid-state lithium sulfur batteries; solid electrolyte; sulfur cathode; lithium anode; electrode/electrolyte interface
10.12028/j.issn.2095-4239.2017.0037
TM 911
A
2095-4239(2017)03-557-15
2017-04-05;
2017-04-11。
中国科学院战略性先导科技专项(XDA09010203),国家重点研发计划项目(2016YFB0100102)。
高静(1988—),女,博士研究生,主要研究方向为全固态锂硫电池,E-mail:gaojing@dicp.ac.cn;
陈剑,研究员,博士生导师,主要研究方向为化学电源,E-mail:chenjian@dicp.ac.cn。
