高效液相色谱-串联质谱法测定土壤中螺虫乙酯及其4种代谢产物
2017-10-14袁文悦庄惠生
袁文悦,庄惠生
高效液相色谱-串联质谱法测定土壤中螺虫乙酯及其4种代谢产物
袁文悦,庄惠生
(上海交通大学 环境科学与工程学院,上海 200240)
建立了超高效液相色谱串联质谱(UPLC-MS/MS)检测土壤中螺虫乙酯及其4种代谢产物残留分析方法。采用酸性乙腈提取螺虫乙酯及其4种代谢产物,UPLC-MS/MS进行定性和定量。螺虫乙酯及其4种代谢产物在0.005~0.1 mg/L范围内线性关系良好,相关系数均在0.999 5以上;在添加质量浓度为0.005~1.0 mg/kg时,回收率分别为螺虫乙酯76.5%~84.6%,S1 78.8%~88.7%,S2 82.5%~99.2%,S3 74.0%~88.2%,S4 78.4%~82.2%;最小检出量为0.05 ng。试验结果表明该法简便、定量准确、分离度好、精密度好,可实现土壤中螺虫乙酯及其4种代谢产物农残分析的要求。
螺虫乙酯;代谢产物;超高效液相色谱-串联质谱;土壤
螺虫乙酯(spirotetramat)是季酮酸类化合物,在环境中的代谢物主要是BYI08330-烯醇糖苷(S1) (spirotetramat-enol-glucoside)、BYI08330-醇酮(S2) (spirotetramat-keto-hydroxy)、BYI08330-烯醇(S3) (spirotetramat-enol)、BYI08330-羟基(S4)(spirotetramat- mono-hydroxy)[1],4种代谢产物与螺虫乙酯的生物活性关系密切。该农药具有独特的作用特征,是迄今具有双向内吸传导性能的现代杀虫剂之一。其作用机理是通过干扰昆虫的脂肪生物合成导致幼虫死亡,降低成虫的繁殖能力。螺虫乙酯具有很好的内吸性,可通过植物的木质部和韧皮部向上传导,也可在植株内由上向下传导[2]。这种独特的内吸性能可以保护新生茎、叶和根部,抑制害虫的卵和幼虫生长,且持效期长达8周。可防治多种作物的蚜虫、介壳虫、粉虱等刺吸式口器害虫[3-6]。螺虫乙酯及其4种代谢产物化学结构式详见图1。
目前查询相关文献,与螺虫乙酯相关的分析方法主要包括对原药含量及残留量的检测,如高效液相色谱法[7-8]以及高效液相色谱质谱联用法[9-11]。国内仅有施雅、张小刚等对4种蔬果中螺虫乙酯残留量测定方法的讨论,吴文铸、李菊颖等对螺虫乙酯在柑橘中的残留消减动态的讨论[1,12-13]。目前关于螺虫乙酯及其代谢产物在土壤中残留检测方法摸索与探讨鲜见报道。
本文通过对几种不同溶剂提取方法比较,得出最优前处理方法,采用高效液相色谱串联质谱对目标化合物在土壤中的残留进行检测,消除了由于样品基质的复杂性及代谢产物之间的转变所带来的干扰。试验结果表明本法简便、快速、定量准确、灵敏度和精密度好。
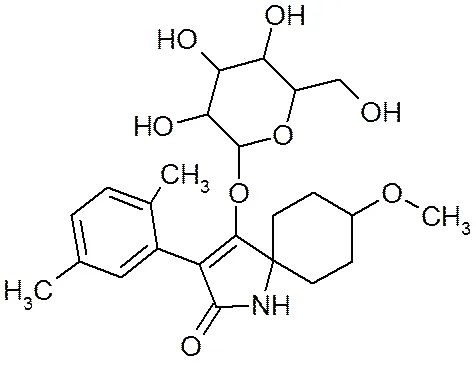
(a) BYI08330-烯醇糖苷(S1)
(b) BYI08330-醇酮(S2)
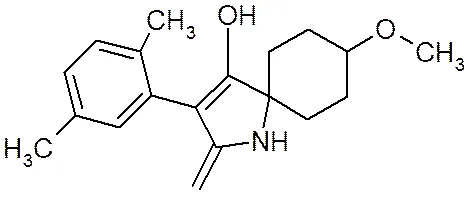
(c) BYI08330-烯醇(S3)
(d) BYI08330-羟基(S4)
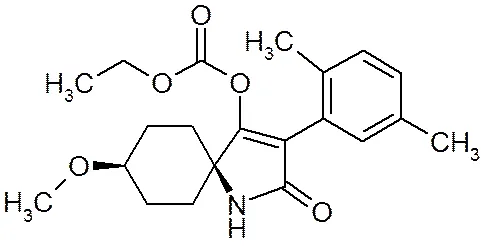
(e)螺虫乙酯
1 试验部分
1.1 仪器与试剂
电子分析天平(岛津公司Shimadzu Auw120D:42 g/0.01 mg),上海舜宇恒平科学仪器有限公司YP202N:200 g/0.01 g),氮吹仪(普立泰科),调速多用振荡器(HY-4型),三重四级杆液相色谱串联质谱仪(安捷伦LC-QQQ 6460,带安捷伦公司LC-1290超高效液相色谱仪),精密移液枪:Brand 50~200 μL,Brand 100~1 000 μL,常用玻璃仪器。
螺虫乙酯标准品:纯度96.2%,上海市农药研究所有限公司;螺虫乙酯烯醇-葡萄糖苷(S1)标准品:纯度98.6%,德国Dr.Ehrenstorfer;羟基螺虫乙酯酮(S2)标准品:纯度94.8%,德国Dr.Ehrenstorfer;螺虫乙酯烯醇(S3)标准品:纯度99.6%,德国Dr.Ehrenstorfer;单羟基螺虫乙酯(S4)标准品:纯度98.2%,德国Dr.Ehrenstorfer;乙腈、甲醇、甲酸:HPLC级,DIKMA公司;氯化钠:国药AR;磷酸:国药GR;氨水:国药AR;丙酮:国药AR;甲苯:国药AR;二氯甲烷:国药AR;C18净化小柱(天津艾洁尔)(6 mL);Carb/NH2串联萃取柱(天津艾洁尔)(6 mL);弗罗里硅土柱(上海安谱)(6 mL);所有用水均为超纯水。
螺虫乙酯及其4种代谢产物标准品均置于4 ℃冰箱中保存。使用时称取25.0 mg(精确至0.01 mg)农药标准物质于25 mL棕色容量瓶中,用甲醇定容至刻度,即为标准储备溶液,4 ℃下保存期限半年。
1.2 标准工作溶液的配制
移取一定量螺虫乙酯及4种代谢产物标样储备溶液于10 mL容量瓶中,用甲醇稀释成10 mg/L的工作溶液,再用甲醇稀释配制成浓度为0.05、0.1、0.2、0.5、1.0 mg/L的系列标样溶液;分别用UP水稀释10倍后得浓度为0.005、0.01、0.02、0.05、0.1 mg/L的系列标样溶液,用于液相色谱串联质谱仪进样。
1.3 样品处理
1.3.1提取
分别称取约20 g(精确到0.01 g)土壤样品于250 mL具塞三角烧瓶中,准确加入50.0 mL乙腈、丙酮、0.2%磷酸的乙腈溶液、1%氨水的乙腈溶液,振荡30 min,抽滤至装6~7 g氯化钠的抽滤瓶中,盖上塞子,剧烈振荡1 min,在室温下静置30 min,使有机相和水相分层。取25 mL有机层于50 mL硬质试管中在氮吹仪上45 ℃下吹扫至近干,待余温使之完全挥干,待用。同时作空白样品。
1.3.2净化
向上述残留物中分别加入2 mL对应溶剂复溶,将溶液迅速转移通过已用5 mL的UP水、5 mL甲醇活化的C18净化柱,5 mL乙腈-甲苯体积比3︰1活化的Carb/NH2串联萃取柱,5 mL丙酮-二氯甲烷体积比9︰1活化的弗罗里硅土柱。使用各自对应的淋洗液洗脱25 mL,再在45 ℃氮吹浓缩至近干,待余温使之完全挥干后,以1.0 mL甲醇定容,使用去离子水定容至10 mL,用于液相色谱串联质谱仪进样检测(表1)。

表1 几种前处理溶剂的提取比较
1.4 测定条件
1.4.1液相色谱测定条件
色谱柱:安捷伦C18,100 mm×2.1 mm(粒径2.7 μm) (前装柱前在线过滤器);流动相A:0.01%甲酸溶液;流动相B:乙腈;流动相梯度详见表2。柱温:40 ℃;进样量:10 μL。
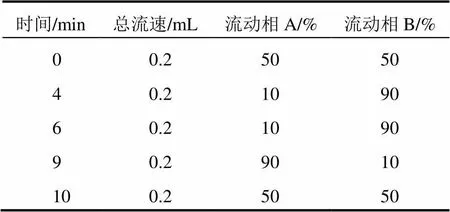
表2 流动相梯度
1.4.2质谱测定条件
离子源:电喷雾离子源AJS-ESI;扫描方式:正离子ESI+;离子源温度:100 ℃;毛细管电压:3 500 V;雾化器压力:45 psi;鞘气流速:11 L/min;鞘气温度:325 ℃;辅助器压力:100 psi;检测方式:多反应监测MRM。
质谱测定条件相关参数见表3。
2 结果和讨论
2.1 分析方法的参数优化
在上述液相及质谱条件下,对螺虫乙酯及其4种代谢产物进行测定,分离度良好,最低检出限响应良好,详见图2及图3。
2.2 线性关系的测定
移取一定量螺虫乙酯及四种代谢产物标样储备溶液于10 mL容量瓶中,用甲醇稀释成10 mg/L的工作溶液,再用甲醇稀释配制成浓度为0.05、0.1、0.2、0.5、1.0 mg/L的系列标样溶液;分别用UP水稀释10倍后得浓度为0.005、0.01、0.02、0.05、0.1 mg/L的系列标样溶液,用于液相色谱串联质谱仪进样。
标样在上述色谱操作条件下进行测定。以峰面积-质量浓度坐标作标准曲线。典型的标准溶液线性方程见表4。

表3 螺虫乙酯及其4种代谢产物质谱测定条件

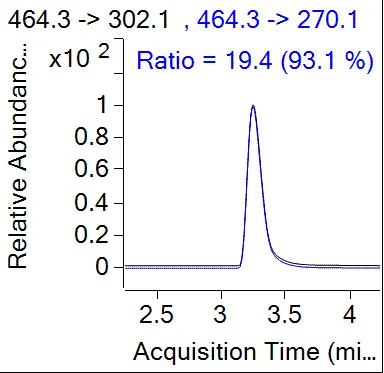
注:螺虫乙酯RT:6.365 min;S1 RT:3.244 min;S2 RT:5.607 min;S3 RT:5.227 min;S4 RT:4.742 min。

表4 螺虫乙酯及其4种代谢物线性方程和相关系数
2.3 样品前处理条件选择
根据1.3.1所述方法,对土壤样品进行各6组添加前处理处理(0.02 mg/kg)。不同溶剂提取及净化效率结果见表5。
由表5可知,采用0.5%磷酸乙腈溶液提取,甲醇洗脱C18净化柱净化所得螺虫乙酯及其代谢产物的回收率相对最好。在最佳质谱条件下进行测定,全流程空白及土壤空白添加样品的典型色谱测定结果见图4、图5。
(a)S1 离子对相对丰度图
(b) S2 离子对相对丰度图
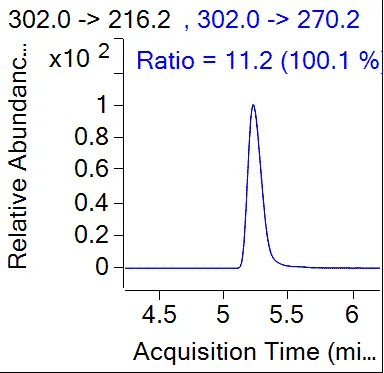
(c)S3 离子对相对丰度图
(d) S4 离子对相对丰度图
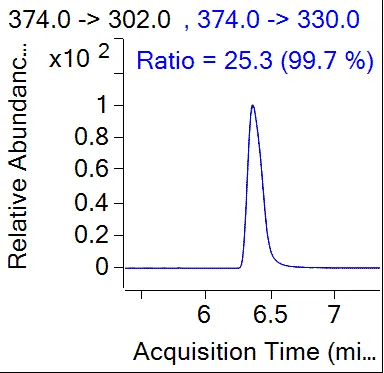
(e)螺虫乙酯离子对相对丰度图
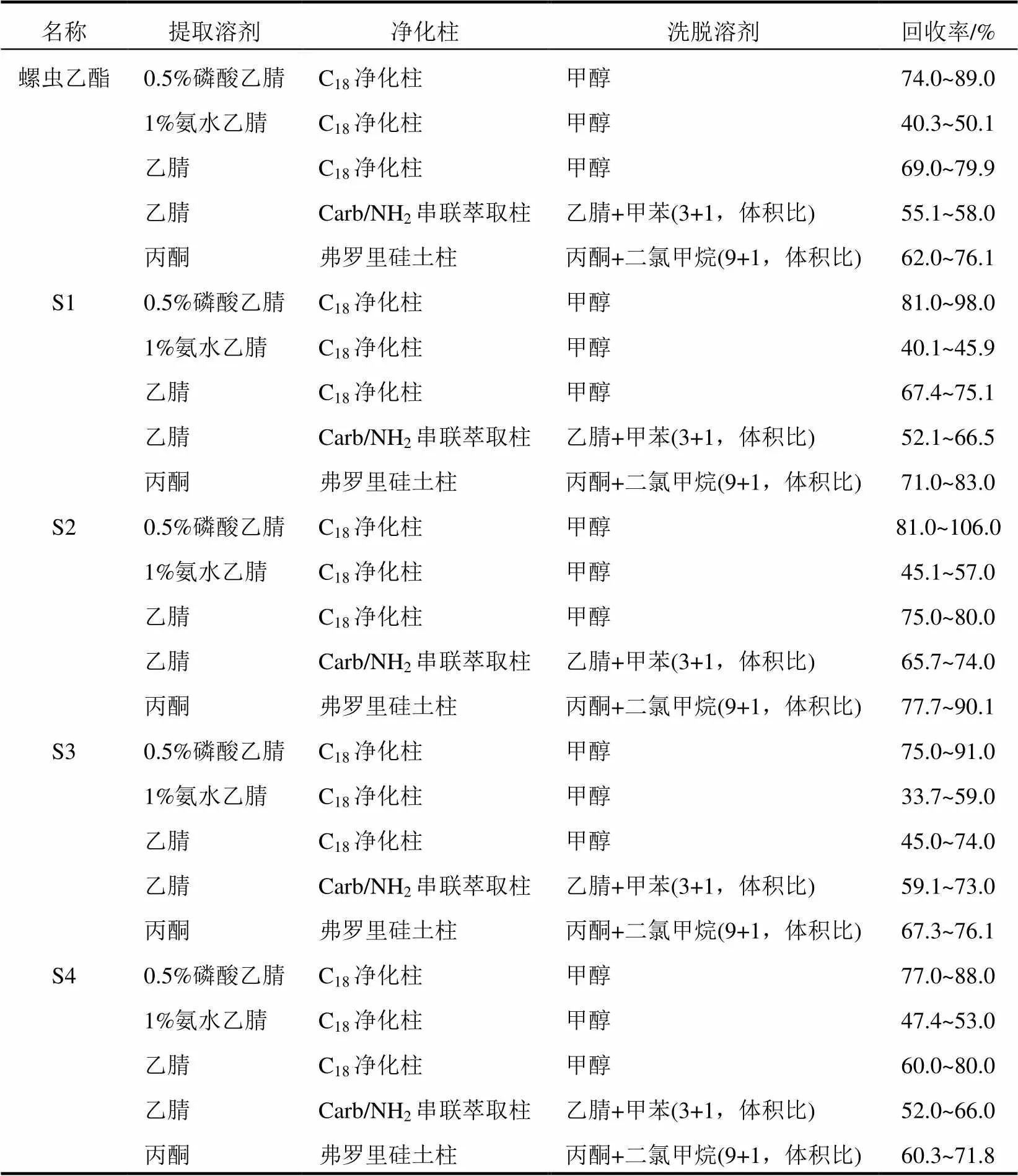
表5 几种溶剂及净化小柱对螺虫乙酯及其4种代谢物提取及净化效率比较
2.4 最小检出量及最低检出浓度
在上述条件下,螺虫乙酯及4种代谢产物的最小检出量为0.05 ng,土壤中的最低检测浓度为0.005 mg/kg,代谢物折合成螺虫乙酯表示则螺虫乙酯的最低检出浓度为0.027 mg/kg。
2.5 精密度与准确度
按照以上最优前处理方法进行加标回收试验,添加3个不同水平的混合标样,每个添加质量浓度进行重复试验6次,计算添加回收率以及测定结果的相对标准偏差,均符合残留分析的要求(表6)。
图4 0.5%磷酸乙腈溶液提取全流程空白总离子流图

图5 0.5%磷酸乙腈溶液提取0.05 mg/kg添加量土壤样品总离子流图

表6 螺虫乙酯及其4种代谢产物添加回收试验的精密度与准确度
3 结 论
本文通过几种溶剂、净化小柱提取净化前处理方法的比较,建立了酸性乙腈提取、C18小柱净化、采用UPLC-MS/MS方法测定土壤中螺虫乙酯及其4种代谢产物残留的检测方法。该方法简便、快速,结果准确、可靠,具有良好的灵敏度和理想的精密度,具有一定的实用价值。经精密度试验和方法验证试验,证明该方法完全满足农药残留检测的要求。
[1] 吴文铸, 李菊颖, 何健, 陈全博, 单正军. 螺虫乙酯在柑橘中的残留消解动态[J]. 生态与农村环境学报, 2016, 32(6): 1003-1007.
[2] 张庆宽. 双向内吸性新杀虫剂螺虫乙酯的开发[J]. 农药, 2009, 48(6): 445-447.
[3] 戈大庆, 姜兴印, 王燕, 等. 螺虫乙酯对B型烟粉虱毒力及部分生物学参数的影响[J]. 植物保护学报, 2011, 38(4): 351-356.
[4] 唐永清, 王朴, 王佳武, 等. 螺虫乙酯悬浮剂对苹果绵蚜防治效果[J]. 北方园艺, 2011, 13(1): 139-141.
[5] 王雪丽, 卢少华, 刘明杨, 等. 螺虫乙酯及其在刺吸式害虫防治中的研究进展[J]. 华中昆虫研究, 2014, 10(12): 162-167.
[6] NAUEN R, RECKMANN U, THOMZIK J,. Biological profile of spirotetramat (movento(R))-A new two way systemic(ambimobile) insecticide against sucking pest species[J]. Bayer Crop Science Journal,2008, 61(2): 245-278.
[7] MOHAPATRA S, DEEPA M, LEKHA S. Residue dynamics of spirotetramat and imidacloprid in/on mango and soil[J]. Bulletin of Environmental Contamination and Toxicology, 2012, 89(4): 862-867.
[8] MOHAPATRA S, DEEPA M, JAGADISH G K. An efficient analytical method for analysis of spirotetramat and its metabolite spiroteramat-enol by HPLC[J]. Bulletin of Environmental Contamination and Toxicology, 2012, 88(2): 124-128.
[9] SCHNING R. Residue analytical method for the determination of residues of spirotetramat and its metabilites in and on plant material by HPLC-MS/MS [J]. Bayer CropScience Journal, 2008, 61(2): 417-454.
[10] YULONG Z, XINGANG L, JUN X,. Simultaneous determination of spirotetramat and its four metabolites in fruits and vegetables using a modified quick, easy, cheap, effective, rugged, and safe method and liquid chromatography/tandem mass spectrometry[J]. Journal of Chromatography A, 2013, 1299(14): 71-77.
[11] 张孟迪, 孙克, 张敏恒. 螺虫乙酯分析方法述评[J]. 农药, 2013, 52(4): 309-311.
[12] 施雅, 张小刚, 王霞, 何亚斌, 郑小平. UPLC-MS/MS法测定四种果蔬中螺虫乙酯残留量[J] . 食品与机械, 2014, 30(5): 93-96.
[13] 李菊颖, 吴文铸, 孔德洋, 何健, 陈全博, 单正军. 超高效液相色谱-质谱法测定柑橘和土壤中螺虫乙酯及4种代谢产物[J] . 农药, 2016, 55(1): 45-47.
Determination of Spirotetramat and its Four Metabolites Residues in Soil by UPLC-MS/MS
YUAN Wenyue, ZHUANG Huisheng
(School of Environmental Science and Engineering, Shanghai Jiaotong University, Shanghai 200240, China)
An ultra-performance liquid chromatography tandem mass spectrometry (UPLC-MS/MS) analytical method was established for the determination of spirotetramat and its four metabolites residues in the soil. Samples were extracted by acid acetonitrile, spirotetramat and its four metabolites residues were detected by UPLC-MS/MS. The linear ranges of spirotetramat and its four metabolites were 0.005-0.1 mg/L, and the correlation coefficients were all more than 0.999 5. The average recoveries of spirotetramat and its four metabolites in samples ranged from 76.5 to 84.6%, 78.8% to 88.7%, 82.5% to 99.2%, 74.0% to 88.2%, 78.4 to 82.2% at the levels of 0.005-1.0 mg/kg respectively, the minimum detection volume was 0.05 ng. The method is simple, in good separation and accurate for the determination of spirotetramat and its four metabolites residues in soil.
spirotetramat; metabolite; ultra performance liquid chromatography mass spectrometry; soil
10.16201/j.cnki.cn31-1827/tq.2017.04.12
TQ450.7
A
1009-6485(2017)04-0059-05
袁文悦(1988—),女,工程师,工学学士,主要从事农药残留及重金属检测研究。
庄惠生,教授,博士,博士生导师。E-mail: hszhuang@sjtu.edu.cn。
2017-06-23。
