氯代阻燃剂得克隆对纤细裸藻的生态毒性效应
2017-10-13常叶倩于文汐俞爽刘程曦李梅
常叶倩,于文汐,俞爽,刘程曦,李梅
南京大学环境学院,污染控制与资源化研究国家重点实验室,南京210023
氯代阻燃剂得克隆对纤细裸藻的生态毒性效应
常叶倩,于文汐,俞爽,刘程曦,李梅*
南京大学环境学院,污染控制与资源化研究国家重点实验室,南京210023
得克隆(Dechlorane Plus, DP)作为全球广泛使用的氯代阻燃剂,具有POPs特性和环境毒性,但其生物毒性数据非常有限。本文选择水生初级生产者纤细裸藻(Euglena gracilis)作为研究对象,通过检测藻细胞生长状况、光合色素水平、抗氧化酶活性、谷胱甘肽(GSH)和丙二醛(MDA)含量变化,研究了不同浓度DP对其生态毒性效应的影响。结果显示,低浓度DP对纤细裸藻生长具有一定促进作用,但差异不显著;DP浓度较低时(0.1和0.5 mg·L-1DP)类胡萝卜素含量受到轻微抑制;较高浓度DP暴露导致超氧化物歧化酶(SOD)、过氧化物酶(POD)和谷胱甘肽(GSH)水平显著增加,同时高浓度DP(8 mg·L-1)下MDA含量显著上升,提示膜结构受到损伤;表明较高实验浓度范围内,DP对纤细裸藻的生长及抗氧化系统均产生一定影响,结果将为DP的环境生态风险评价提供科学依据。
得克隆(DP);纤细裸藻;毒性效应;生长;光合色素;抗氧化酶
Received16 January 2017accepted13 March 2017
Abstract: Dechlorane Plus (DP) is a widely used chlorinated flame retardant and regarded as a persistent organic pollutant (POPs) and an environmental toxin. However, the biological toxicity data of DP is still quite limited. In this study, we investigated its toxic effect on the aquatic Euglena gracilis, which is a sensitive primary producer, by analyzing the growth curves, photosynthetic pigments and activities of several enzymes such as superoxide dismutase (SOD), peroxidase (POD), glutathione (GSH) and malondialdehyde (MDA). Our results showed that low levels of DP could stimulate the growth of E. gracilis, but the effect was not obvious. It was also found that carotenoids were slightly inhibited when exposed to low levels of DP (0.1 and 0.5 mg·L-1DP). However, high levels of DP (8 mg·L-1) could lead to the accretion of GSH, SOD and POD as well as the rising level of MDA which indicated DP's potential damage of cell membranes. In a world, our results provide scientific basis for the assessment of the overall environmental ecological toxicity of DP.
Keywords: Dechlorane Plus (DP); Euglena gracilis; toxic effects; growth; photosynthetic pigments; antioxidant enzyme
得克隆(Dechlorane Plus, DP),化学名为双(六氯环戊二烯)环辛烷(DCRP),也叫敌可燃,呈白色粉末状,因具有阻燃效率高、热稳定性好、价格便宜等优点,作为添加型高氯代脂环族阻燃剂被广泛用于电子产品、家具、纺织品等高分子材料[1]。由于灭蚁灵等可能带来的环境危害,DP作为其替代品在各国工厂开始广泛生产使用[2]。据统计,DP年产量已超过5 000 t,被美国环境保护局(EPA)列为高产量化合物。尽管DP在50年前就已投产使用,但直到2006年,在北美五大湖地区沉积物和土壤样品中检测到DP后,才引发人们对它的关注[3]。作为一种新兴污染物,国内外在多种环境介质中均检出DP,包括水、沉积物、土壤、大气层和生物群落等[2,4-7]。
由于DP与多种持久性有机污染物(POPs),如氯丹、艾氏剂等结构特征类似,且在环境中分布广泛,因此具有潜在生物累积、环境持久和长距离传输等特性。近年来随着对DP污染水平的深入研究,发现虽然其环境浓度较低,却易于在生物体内积累[8]。最近研究显示,电子垃圾拆解工人血清与脂肪中DP含量上升显著[1],而在DP所有环境释放的途径中,电子垃圾拆解是DP环境释放的重要途径。因此,DP不仅会威胁生态系统的安全,也可能对人类健康产生潜在危害。
目前关于得克隆的研究主要集中在空气、水体、土壤和生物体内含量的分析方面,对DP毒性研究仍较为匮乏,尚处于起步阶段,最早数据仅限于生产DP的Oxychem化学公司提供的DP毒理学测试数据以及美国EPA高产量化合物信息系统(HPVIS)[9-10]。Oxychem认为DP是一种低毒至无毒的化合物,其中100 mg·L-1DP对蓝鳃太阳鱼(bluegill sunfish)无明显作用[9]。近年来,已有研究将注意力逐渐转移到DP毒理学效应上,受试生物多为鱼类[11-12]和陆生生物[13-18]。研究显示,斑马鱼暴露于DP可能会导致鱼体内氧化损伤和甲状腺素激素分泌不平衡[12]。对陆生生物小鼠而言,口服DP则可能引发其肝脏氧化应激性损伤和体内信号传导紊乱[13]。与有限的毒性数据相比,DP生物富集方面研究较多[17-20]。Wang等[16]研究表明DP在生物体内的富集随营养级上升,且其代谢产物脱氯DP随食物链放大的效应更为显著。最近研究显示,syn-DP易在生物体内蓄积和放大,可在鱼肝脏积累,并通过血脑屏障进入脑部[8],巩宁等[7]发现anti-DP更易在大型海藻中富集。Xian等[17]也发现DP顺反异构体具有不同的生物放大系数。对水生植物而言,姜涛等[19]研究了不同浓度DP暴露对小球藻(Chlorella vulgaris)生长、氧化应激和光合作用的影响,赵磊[20]发现一定浓度DP会降低孔石莼(Ulva pertusa)的光合效率。总体而言,DP对水生藻类,尤其是微藻的毒性效应研究仍较为缺失。
微藻是水生生态系统的初级生产者,其种类多样性和初级生产量直接影响水生生态系统的结构功能和平衡稳定。水生毒理学研究中,微藻具有个体小、繁殖快、对毒物敏感等特点,是监测评价水环境质量的重要指标[21]。纤细裸藻(Euglena gracilis)作为一种淡水单细胞微藻,类属裸藻属,又称眼虫藻属,分布广泛,富营养化浅水池塘中较常见。纤细裸藻培养简单,生长迅速,具有2种营养方式(自养和异养),其运动性能、细胞性状、光合作用等参数对环境胁迫十分敏感,故已被广泛地用作水环境监测评价的实验材料[22]。
本研究以初级生产者纤细裸藻(E. gracilis)作为受试生物,采用生物量、光合色素含量、抗氧化酶活性以及GSH和MDA含量等作为评价指标,探讨DP对纤细裸藻的毒性效应,以期深入分析其对微藻不同水平的生态毒性,进而为DP的环境生态风险评价提供基础数据。
1 材料与方法(Materials and methods)
1.1 微藻培养
纤细裸藻由中科院水生生物所典型培养物保藏委员会淡水藻类藻种库(FACHB)提供,培养基参考Checcucci等的文献[23]。考虑到DP的一般环境浓度及其在环境中的快速增长浓度,实验设置5个浓度组(0.1、0.5、1.0、4.0和8.0 mg·L-1)和1个溶剂对照组,每组3个平行,以二甲基亚砜(DMSO)助溶,同时设置空白组和溶剂对照组,所用DMSO最大添加比例不超过5‰。裸藻接种后于恒温光照培养箱培养,培养条件为:光强80~90 μm·m-2·s-1,温度(25 ± 1) ℃,光暗比12 h∶12 h,连续培养7 d。定时人工摇动,并随机移动各瓶位置,以减少因接受光照条件不同造成的误差。
1.2 裸藻生长和光合色素含量测定
以培养基作空白对照,680 nm波长下,每天定时测定藻液吸光度(721-100型紫外分光光度计),结果取3个平行平均值。根据本课题组前期研究结果进行微藻细胞数和吸光值换算:y=(94.309×OD680+0.9114)×104,y为细胞数(个·mL-1),r=0.999[21]。培养96 h后,取适量藻液,低速离心15 min,弃上清后用80%(体积比)丙酮提取,于470 nm、645 nm和663 nm处测定吸光值,根据下述公式计算各组裸藻叶绿素a(Chl a)、叶绿素b(Chl b)和类胡萝卜素(Car)含量,并与细胞数y进行换算,得出各组裸藻光合色素含量[24]。
叶绿素A:Ca(mg·L-1)= 12.7A663-2.69A645;
叶绿素B:Cb(mg·L-1)= 22.9A663-4.68A645;
类胡萝卜素:C类胡萝卜素(mg·L-1)=(1000A470-3.27Ca-104Cb)/229。
1.3 粗酶液提取和酶活性测定
离心收集培养96 h藻液,重悬于pH为7.0的适量预冷磷酸盐缓冲液,冰浴下超声破碎,4 ℃低温12 000 r·min-1离心20 min,取上清进行各项指标分析。可溶性蛋白采用考马斯亮蓝法测定,黄嘌呤氧化酶法测定超氧化物歧化酶(SOD)活性,愈创木酚法测定过氧化物酶(POD)活性,丙二醛(MDA)采用TBA法显色测定,谷胱甘肽(GSH)含量采用二硫代二硝基苯甲酸与巯基化合物反应显色测定,结果取3个平行平均值。其中,以每毫升反应液中SOD抑制率达50%时对应的SOD量为一个SOD活力单位(U)。以每分钟分解1 μmol过氧化氢所需的酶量为一个POD活力单位。
1.4 数据分析
数据统计采用SPSS和Origin 8.5软件进行分析,对试验组与对照组进行显著性t检验,以P < 0.05作为显著性依据。
2 结果与讨论(Results and discussion)
2.1 DP对纤细裸藻生长状况的影响
接种后每天定时测定纤细裸藻OD值,并换算成细胞数,不同浓度DP暴露下其生长情况由图1所示。实验结果显示,空白对照组与溶剂对照组(DMSO)间无显著性差异,提示溶剂对照对微藻生长未产生明显影响,为方便比较与分析,本文结果与讨论中直接选用溶剂对照组作为对照进行比对。由图可见,与对照组(DMSO)相比,DP各浓度组均呈现藻细胞密度随暴露时间增加而升高的趋势,具有一定的剂量-效应关系,且在5~6 d时达到最大增长速率,之后随培养时间延长,生长速度逐渐减慢。DP低浓度组在培养早期藻细胞密度随暴露时间升高趋势更为明显,提示低浓度DP对裸藻生长具有一定促进作用,7 d时最低浓度(0.1 mg·L-1)促进率为对照组的124.45%(P < 0.05);而从1 d到7 d时,最高浓度下(8 mg·L-1)裸藻生长速率均低于低浓度组生长速率,且与对照组相比较,其抑制(1~4 d)或促进作用(4~7 d)均几乎不可见。
藻类的生长试验可用来评价污染物对藻类的短期胁迫效应,进而反映污染物对水体初级生产者的影响。低浓度DP处理可促进裸藻的生长,这种污染物在较低浓度下出现的增益现象作为一种无毒情况的刺激反应,被称为“毒物的兴奋效应”(Hormesis),在多种藻类的毒性研究中得到证实[25-27];可能由于DP毒性较低,低浓度时或可改变细胞膜的通透性,使藻细胞更易吸收培养基中的营养,从而产生了毒物兴奋作用。一般认为高浓度的污染物抑制藻类生长,这是藻类对有机污染物胁迫的可能反应,在本实验中最高浓度组(8 mg·L-1)细胞数低于对照,表现为一定的抑制作用,但因DP溶解度和环境浓度限制,本研究未能进行更高浓度的实验。姜涛等[19]研究结果也显示DP不会对微藻小球藻(Chlorella vulgaris)造成生长抑制,赵磊[20]发现DP使大型藻类孔石莼(U. pertusa)的生长受到抑制,这可能是由于暴露时间、藻类的种类以及剂量设置不同所致。

图1 不同浓度得克隆(DP)影响下纤细裸藻的生长曲线Fig. 1 Growth curves of E. gracilis treated with different concentrations of Dechlorane Plus (DP)
2.2 DP对光合色素含量的影响
光合色素是植物进行光合作用的物质基础,参与吸收、传递光能或原初光化学反应,是反映植物受到环境胁迫状况的重要指标。光合作用中主要色素是叶绿素,包括Chl a和Chl b;类胡萝卜素是光系统中的辅助捕光色素,也是内源性抗氧化剂。研究表明,当生物受到环境胁迫时,作为表征生物生长的重要生理参数,反映其光合强度的叶绿素、类胡萝卜素等色素含量会发生变化,并在一定范围内与光合效率正相关[21]。
由图2可见,染毒96 h后,DP最高浓度时(8 mg·L-1)光合色素含量变化不显著,低浓度组DP(0.1和0.5 mg·L-1)对Chl a、Chl b无显著影响,但抑制Car含量,分别为对照组的86.74%和84.97%(P < 0.05)。Car作为光合作用的辅助色素,影响光能的吸收与传递,同时可清除光合电子传递过程中产生的活性氧自由基,防止光合器官的氧化损伤,因此推测DP可能对纤细裸藻光合作用系统产生轻微影响,从而降低光合效率。赵磊[20]研究发现一定浓度DP可降低孔石莼的光合效率,与本实验结果一致。而张琼等[22]研究表明二溴二苯醚(BDE-15)对纤细裸藻叶绿素、类胡萝卜素含量均有一定的促进作用,一定程度上提高微藻细胞光合效率,与本实验结果相反,可能由于污染物不同所致。

图2 不同浓度DP对纤细裸藻光合色素含量的影响(96 h)注:Chla、Chlb、Car表示叶绿素a、叶绿素b、类胡萝卜素; *表示和对照组相比差异显著(P < 0.05)。Fig. 2 Effects of DP on the photosynthetic pigments of E. gracilis (96 h)Note: Chla, Chlb, Car stand for chlorophyll a, chlorophyll b, carotenoid; * indicates significant difference compared with control group (P < 0.05).
2.3 DP对抗氧化酶活性的影响
研究表明,植物在受到外界环境刺激时,可能会通过光合和呼吸作用产生活性氧(ROS),从而对植物体内正常的代谢过程产生影响。SOD和POD作为植物体内抗氧化防御机制中酶促反应中2种重要的抗氧化酶,在植物体受到轻度环境胁迫时,为增强植物对ROS的消除能力,抗氧化酶的活性反而会有所升高[28];但当遭受重度环境胁迫时,其影响程度可能会超出机体自我调节能力,导致2种抗氧化酶的活性大幅降低,出现活性氧积累和细胞损伤现象[29],这些结论在本实验研究中也得到了证实。
不同浓度DP作用下纤细裸藻体内SOD和POD含量变化见表1。染毒96 h后,较低浓度DP对SOD活力影响不显著,但DP浓度达到8 mg·L-1时,SOD活性显著升高(P < 0.05),是DMSO对照组的158.30%,提示高浓度DP影响了纤细裸藻的抗氧化酶系统,这与上述植物受到轻度环境胁迫时的应对效应一致,表征产生轻度胁迫效应。相比之下,POD则更为敏感,呈现先升高后降低趋势。较高浓度DP(4 mg·L-1)暴露导致纤细裸藻体内POD含量显著增加(P < 0.05),当DP浓度增加到8 mg·L-1时,POD活性显著降低(P < 0.05),提示藻体产生重度应激胁迫效应。而张琼等[22]发现随着BDE-15浓度升高,纤细裸藻SOD活性受到明显抑制且呈现一定剂量-效应关系,而POD则呈现上升趋势。这与本实验结果相反,推测是由于污染物差异所导致。从本实验结果中可推测在较高浓度DP胁迫下,POD作为微藻中抗氧化的第二道防线,其清除自由基的能力会被削弱,但第一道防线SOD仍能维持相对较高的活性,即SOD较POD更能耐受DP胁迫,在DP高度胁迫时,SOD是微藻抗氧化酶系统的主要作用酶。SOD的作用是在氧化胁迫时将植物体产生的ROS转化成H2O2,而H2O2的清除需要POD的参与,因此可推测在DP高度胁迫下,植物体内可能会产生过量H2O2累积,从而引起植物体生理等方面的变化。这一点可由MDA部分实验结果证实。
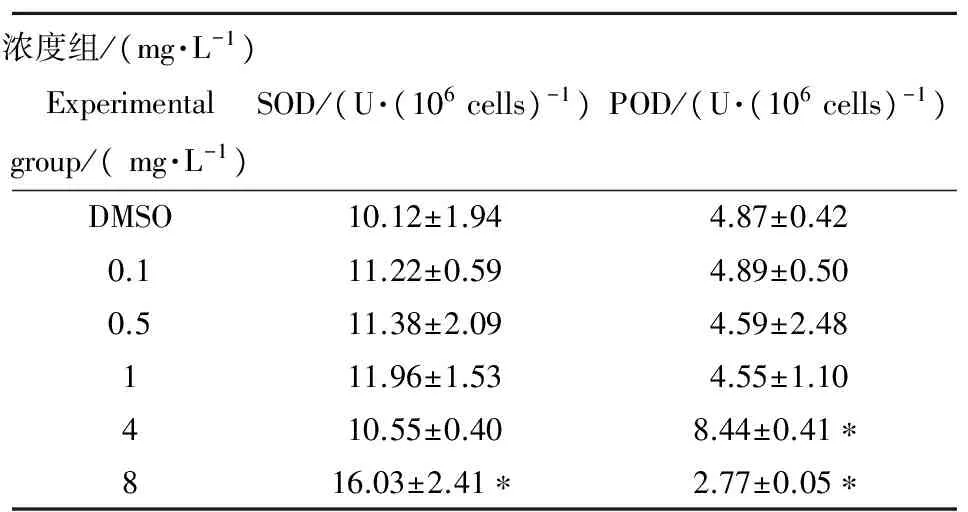
表1 不同浓度DP对纤细裸藻超氧化物歧化酶(SOD)和过氧化物酶(POD)活性的影响(96 h)Table 1 The superoxide dismutase (SOD) and peroxidase (POD) activities of E. gracilis treated with different concentrations of DP (96 h)
注:*表示与DMSO组相比存在P < 0.05的显著性差异。
Note: * indicates significant difference compared with the DMSO group (P < 0.05).
2.4 DP对GSH含量的影响
GSH作为抗氧化剂和自由基清除剂,同时具有调节其他抗氧化剂的作用,是一种由谷氨酸、半胱氨酸和甘氨酸通过肽键缩合成的非蛋白巯基三肽化合物[22]。由图3可见,染毒96 h后,较低浓度DP暴露组GSH含量无显著变化,较高浓度组(1 mg·L-1、4 mg·L-1和8 mg·L-1)GSH含量随DP浓度上升而升高(P < 0.05),呈一定剂量-效应关系,分别是对照组的142.13%、141.60%和148.24%。通过实验结果可以看出DP暴露会刺激抗氧化剂GSH含量上升,综合抗氧化酶结果推测这可能是为了消除细胞内过量氧自由基和H2O2所致。可见,GSH在纤细裸藻抗氧化过程中起着较重要的作用。田丹等[30]的研究结果显示,普通小球藻(Chlorella vulgaris)GSH含量在镉胁迫下显著升高,与本实验结果基本一致。而张琼等[22]的研究表明BDE-15会损害藻类的抗氧化功能,影响对自由基的清除能力,这与本实验结果相反,推测是由于污染物的不同所致。
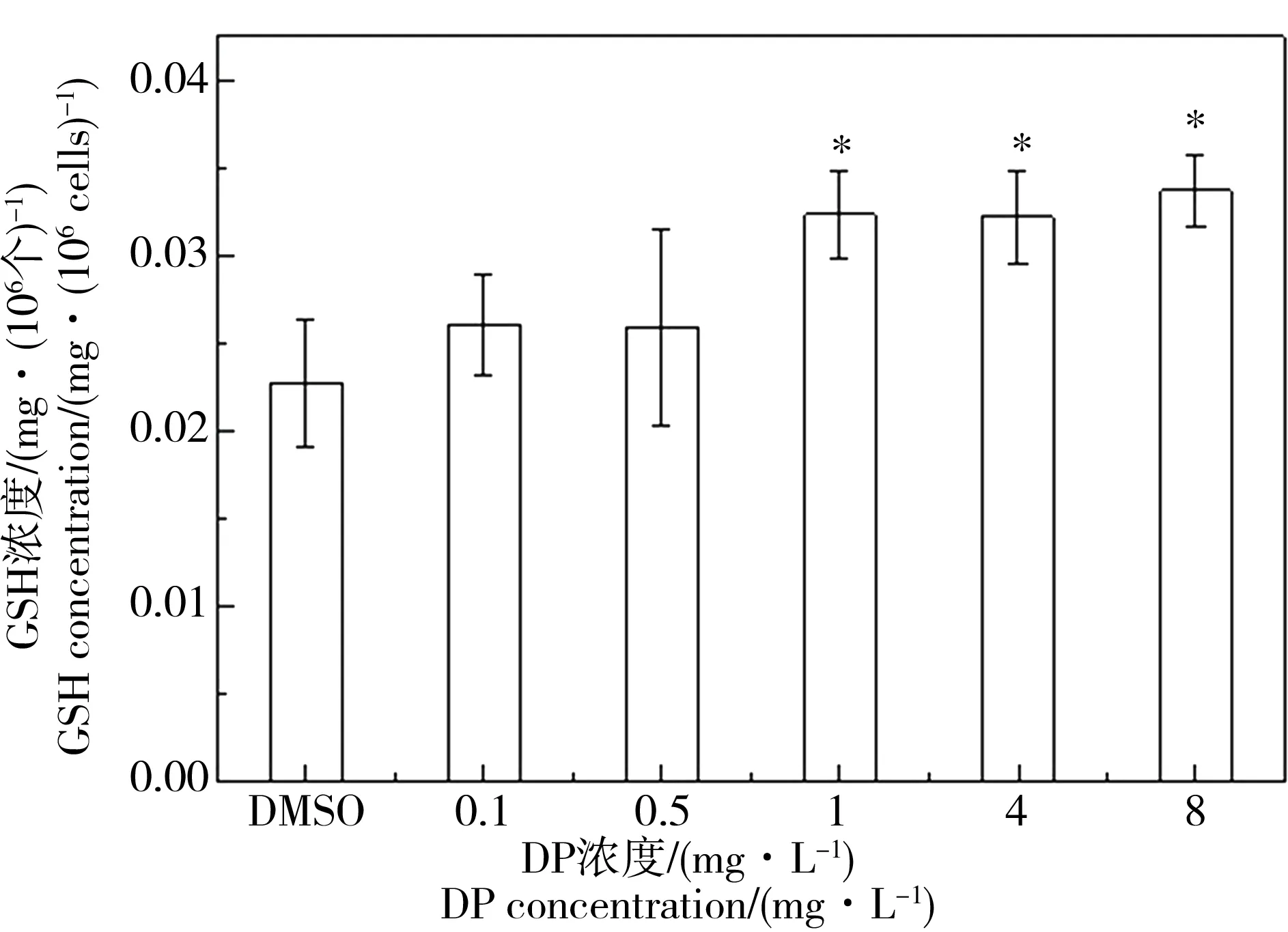
图3 不同浓度DP对纤细裸藻GSH浓度的影响(96 h)注:*表示和对照组相比差异显著(P < 0.05)。Fig. 3 GSH content of E. gracilis treated with different concentrations of DP (96 h)Note: * indicates significant difference compared with control group (P < 0.05).
2.5 DP对MDA含量的影响
丙二醛(MDA)是膜脂过氧化最重要产物之一,其含量的高低又间接反应了机体受到活性氧攻击的程度,可间接测定膜系统受损程度以及植物的抗逆性。由图4可见,染毒96 h后,随DP浓度上升,MDA含量有升高趋势,但较低浓度DP暴露下变化不显著,当DP为最高浓度8 mg·L-1时,MDA含量升高显著(P < 0.05),高达对照组的13.90倍。本实验中,在DP胁迫下,藻细胞中MDA逐渐积累,表明DP会使植物的生物膜发生脂质过氧化,膜的稳定性降低,膜结构和功能受到影响,细胞受到抗氧化胁迫,发生氧化损伤。相关研究表明,不同类型的微藻在受到外界胁迫时,均使生物体发生不同程度的脂质过氧化[25,30]。
综合抗氧化酶活性实验和GSH含量测定实验结果可知,DP会促使氧自由基的生成,从而激活SOD、POD的活性和提高GSH含量。当DP浓度上升至1 mg·L-1后,随DP浓度的上升GSH含量显著增加;当DP浓度上升至8 mg·L-1时,SOD活性显著增加,将ROS转化为H2O2的效率显著提高,而参与H2O2分解的POD酶系统活性显著降低,故虽GSH系统仍保持较高的活性参与H2O2分解,但H2O2合成和清除平衡被打破,部分H2O2在植物体内累积,生物膜发生脂质过氧化,细胞膜在一定程度上受到破坏,造成MDA累积。此外,MDA的含量在DP浓度为8 mg·L-1时显著增大,说明发生了脂质过氧化,推测是在受到DP胁迫时发生代偿性的含量升高。
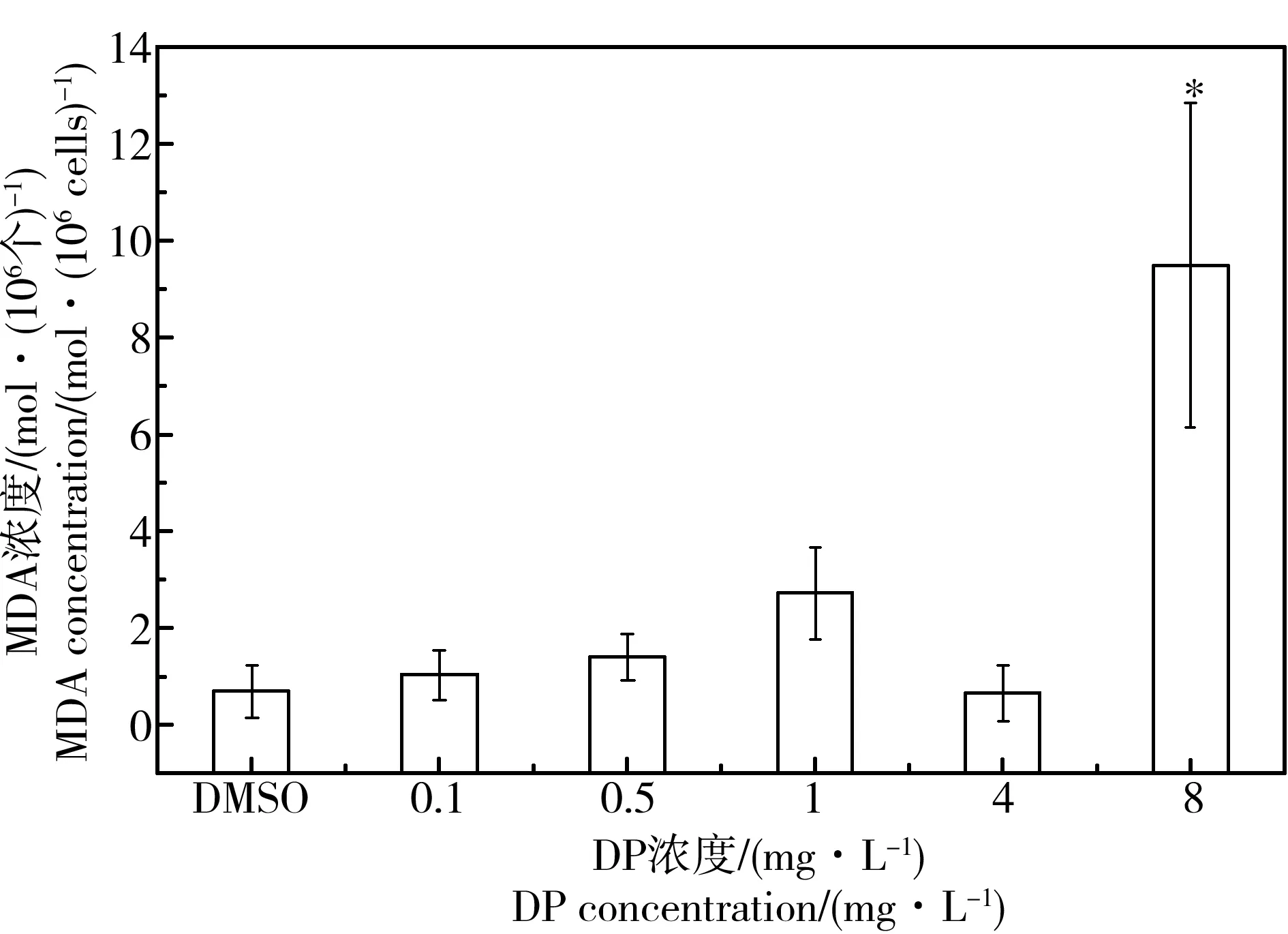
图4 不同浓度DP对纤细裸藻MDA浓度的影响(96 h)注:*表示和对照组相比差异显著(P < 0.05)。Fig. 4 MDA content of E. gracilis treated with different concentrations of DP (96 h)Note: * indicates significant difference compared with control group (P < 0.05).
综上所述:
(1)低浓度DP对纤细裸藻生长具有一定促进作用,但差异不显著。
(2)较高浓度DP暴露导致超氧化物歧化酶、过氧化物酶和谷胱甘肽水平显著增加,提示微藻在高浓度DP胁迫下产生一定程度的氧化胁迫效应。
(3)较高浓度DP使MDA含量升高,表明微藻膜结构受到损伤,提示高浓度DP可对微藻生物膜造成破坏。
[1] 任玥, 许鹏军, 齐丽, 等. 典型电子废物处置场地表层土壤中的得克隆阻燃剂研究[J]. 中国环境科学, 2013, 33(8): 1420-1425
Ren Y, Xu P J, Qi L, et al. Dechlorane Plus levels and isomer profiles in surface soils from a typical electronic waste dismantling area in China [J]. China Environmental Science, 2013, 33(8): 1420-1425 (in Chinese)
[2] Kang J H, Kim J C, Jin G Z, et al. Detection of Dechlorane Plus in fish from urban-industrial rivers [J]. Chemosphere, 2010, 79(8): 850-854
[3] Gauthier L T, Letcher R J. Isomers of Dechlorane Plus flame retardant in the eggs of herring gulls (Larus argentatus) from the Laurentian Great Lakes of North America: Temporal changes and spatial distribution [J]. Chemosphere, 2009, 75(1): 115-120
[4] Qi H, Liu L, Jia H, et al. Dechlorane Plus in surficial water and sediment in a northeastern Chinese river [J]. Environmental Science & Technology, 2010, 44(7): 2305-2308
[5] De La Torre A, Sverko E, Alaee M, et al. Concentrations and sources of Dechlorane Plus in sewage sludge [J]. Chemosphere, 2011, 82(5): 692-697
[6] Sverko E, Reiner E J, Tomy G T, et al. Compounds structurally related to Dechlorane Plus in sediment and biota from Lake Ontario (Canada) [J]. Environmental Science & Technology, 2009, 44(2): 574-579
[7] 巩宁, 邵魁双, 贾宏亮, 等. 氯代阻燃剂得克隆在大连黄海海域潮间带不同环境介质中的含量及生物富集[J]. 海洋环境科学, 2013, 32(5): 674-678
Gong N, Shao K S, Jia H L, et al. Concentration and bioaccumulation of chlorinated flame retardant Dechlorane Plus in intertidal zone of Yellow Sea, Dalian [J]. Marine Environmental Science, 2013, 32(5): 674-678 (in Chinese)
[8] Möller A, Xie Z, Sturm R, et al. Large-scale distribution of Dechlorane Plus in air and seawater from the Arctic to Antarctica [J]. Environmental Science & Technology, 2010, 44(23): 8977-8982
[9] OxyChem. Dechlorane Plus Manual [EB/OL]. [2017-01-16]. http://msds.oxy.com/DWFiles/M41759_NA_EN%232.pdf.
[10] U.S. EPA. High Production Volume (HPV) Challenge [EB/OL]. [2017-01-16]. http://www.epa.gov/chemrtk/pubs/summaries/dechlorp/c15635tc.htm.
[11] 张鸿雁, 李硕, 陈胜文. 得克隆生物积累及毒性效应[J]. 上海第二工业大学学报, 2015, 32(4): 290-297
Zhang H Y, Li S, Chen S W. Accumulation in biota and toxicological effect of Dechlorane Plus [J]. Journal of Shanghai Second Polytechnic University, 2015, 32(4): 290-297 (in Chinese)
[12] Kang H, Moon H B, Choi K. Toxicological responses following short-term exposure through gavage feeding or water-borne exposure to Dechlorane Plus in zebrafish (Danio rerio) [J]. Chemosphere, 2015, 146: 226-232
[13] Wu B, Liu S, Guo X, et al. Responses of mouse liver to Dechlorane Plus exposure by integrative transcriptomic and metabonomic studies [J]. Environmental Science &Technology, 2012, 46(19): 10758-10764
[14] Yang Y, Ji F, Cui Y, et al. Ecotoxicological effects of earthworm following long-term Dechlorane Plus exposure [J]. Chemosphere, 2015, 144: 2476-2481
[15] Barón E, Dissanayake A, Vilà-Cano J, et al. Evaluation of the genotoxic and physiological effects of decabromodiphenyl ether (BDE-209) and Dechlorane Plus (DP) flame retardants in marine mussels (Mytilus galloprovincialis) [J]. Environmental Science & Technology, 2016, 50(5): 2700-2708
[16] Wang D G, Guo M X, Pei W, et al. Trophic magnification of chlorinated flame retardants and their dechlorinated analogs in a fresh water food web [J]. Chemosphere, 2015, 118: 293-300
[17] Xian Q, Siddique S, Li T, et al. Sources and environmental behavior of Dechlorane Plus—A review [J]. Environment International, 2011, 37(7): 1273-1284
[18] Zheng X B, Luo X J, Zeng Y H, et al. Sources, gastrointestinal absorption and stereo-selective and tissue-specific accumulation of Dechlorane Plus (DP) in chicken [J]. Chemosphere, 2014, 114: 241-246
[19] 姜涛. 氯代阻燃剂得克隆(Dechlorane Plus)对海藻的生物毒性及生物富集[D]. 大连: 大连海事大学, 2011: 1-81
Jiang T. The biotoxicity and bioaccumulation of chlorinated flame retardants Dechlorane Plus on marine algae [D]. Dalian: Dalian Maritime University, 2011: 1-81 (in Chinese)
[20] 赵磊. 得克隆对藻类的生物毒性及选择性生物富集[D]. 大连: 大连海事大学, 2013: 1-68
Zhao L. Biotoxicity and stereoselective enrichment of Dechlorane Plus in marine algae [D]. Dalian: Dalian Maritime University, 2013: 1-68 (in Chinese)
[21] 刘炎, 石小荣, 崔益斌, 等. 高浓度氨氮胁迫对纤细裸藻的毒性效应[J]. 环境科学, 2013, 34(11): 4386-4391
Liu Y, Shi X R, Cui Y B, et al. Toxic effects of high concentrations of ammonia on Euglena gracilis [J]. Environmental Science, 2013, 34(11): 4386-4391 (in Chinese)
[22] 张琼, 伍琴, 高香玉, 等. 二溴联苯醚对纤细裸藻的生态遗传毒性效应[J]. 中国环境科学, 2010, 30(6): 833-838
Zhang Q, Wu Q, Gao X Y, et al. Ecogenotoxicological effects of BDE-15 on the microalga Euglena gracilis [J]. China Environmental Science, 2010, 30(6): 833-838 (in Chinese)
[23] Checcucci A, Colombetti G, Ferrara R, et al. Action spectra for photoaccumulation of green and colorless Euglena: Evidence for identification of receptor pigments [J]. Photochemistry and Photobiology, 1976, 23(1): 51-54
[24] Jeffrey S W, Humphrey G F. New spectrophotometric equations for determining chlorophylls a, b, c1 and c2 in higher plants, algae and natural phytoplankton [J]. Biochemie und Physiologie der Pflanzen, 1975, 167(2): 191-194
[25] 杨璨, 于晓娟, 王欣泽, 等. 双酚A对铜绿微囊藻生长及生理的影响[J]. 安全与环境工程, 2014, 21(5): 21-32
Yang C, Yu X J, Wang X Z, et al. Effects of bisphenol A on the growth and physiology of Microcystis aeruginosa [J]. Safety and Environmental Engineering, 2014, 21(5): 21-32 (in Chinese)
[26] 李威, 恽烨, 是怡芸, 等. 5氟尿嘧啶对蛋白核小球藻和羊角月牙藻生长及叶绿素含量的影响[J]. 生态毒理学报, 2015, 10(6): 213-218
Li W, Yun Y, Shi Y Y, et al. Effects of 5-fluorouracil on the growth and chlorophyll content of Chlorella pyrenoidosa and Selenastrum capricornutum [J]. Asian Journal of Ecotoxicology, 2015, 10(6): 213-218 (in Chinese)
[27] 张哲, 王江涛, 谭丽菊. 草甘膦对旋链角毛藻和盐生杜氏藻的毒性兴奋效应[J]. 生态毒理学报, 2010, 5(5): 685-691
Zhang Z, Wang J T, Tan L J. Stimulation effect of glyphosate on Chaetoceros curvisetus and Dunallelia salina [J]. Asian Journal of Ecotoxicology, 2010, 5(5): 685-691 (in Chinese)
[28] Alscher R G, Erturk N, Heath L S. Role of superoxide dismutases (SODs) in controlling oxidative stress in plants [J]. Journal of Experimental Botany, 2002, 53(372): 1331-1341
[29] Hankard P K, Svendsen C, Wright J, et al. Biological assessment of contaminated land using earthworm biomarkers in support of chemical analysis [J]. Science of the Total Environment, 2004, 330(1): 9-20
[30] 田丹, 赵文, 王媛, 等. 镉胁迫对两种海洋微藻生长和抗氧化系统的影响[J]. 大连海洋大学学报, 2010, 25(5): 417-421
◆
EcologicalToxicEffectsofAChlorinatedFlameRetardant—DechloranePlusonEuglenagracilis
Chang Yeqian, Yu Wenxi, Yu Shuang, Liu Chengxi, Li Mei*
State Key Laboratory of Pollution Control and Resource Reuse, School of the Environment, Nanjing University, Nanjing 210023, China
10.7524/AJE.1673-5897.20170116002
2017-01-16录用日期2017-03-13
1673-5897(2017)3-366-07
X171.5
A
李梅(1971-),女,博士,教授,主要研究方向环境毒理学,在国内外发表学术论文50余篇,其中SCI论文30余篇。
国家水体重大专项(2014ZX07204-005);国家自然科学基金项目(41571468);江苏省科技支撑项目(BE2016172)
常叶倩(1995-),女,本科,研究方向为环境毒理学,E-mail: 814910081@qq.com;
*通讯作者(Corresponding author), E-mail: meili@nju.edu.cn
常叶倩, 于文汐, 俞爽, 等. 氯代阻燃剂得克隆对纤细裸藻的生态毒性效应[J]. 生态毒理学报,2017, 12(3): 366-372
Chang Y Q, Yu W X, Yu S, et al. Ecological toxic effects of a chlorinated flame retardant—Dechlorane Plus on Euglena gracilis [J]. Asian Journal of Ecotoxicology, 2017, 12(3): 366-372 (in Chinese)
