苏博美利奴羊胎儿皮肤毛囊结构及形态发育
2017-10-13阿布来提苏来曼田月珍许琴何军敏赵冰茹徐新明付雪峰热娜古丽艾尼瓦尔江黄锡霞田可川
阿布来提·苏来曼,田月珍,许琴,何军敏,赵冰茹,徐新明,付雪峰,热娜古丽·艾尼瓦尔江,黄锡霞,田可川
苏博美利奴羊胎儿皮肤毛囊结构及形态发育
阿布来提·苏来曼1,2,田月珍1,2,许琴3,何军敏1,赵冰茹1,徐新明2,付雪峰2,热娜古丽·艾尼瓦尔江1,黄锡霞1,田可川2
(1新疆农业大学动物科学学院,乌鲁木齐830052;2新疆畜牧科学院畜牧研究所,乌鲁木齐830011;3新疆军区总医院动物实验科,乌鲁木齐830000)
【目的】研究苏博美利奴羊毛囊的组织结构与形态发育过程,为解析细毛羊毛囊发育的分子调控机制奠定组织学基础。【方法】采用石蜡切片技术分析胎龄为第65、85、105和135天的苏博美利奴羊胎儿头部、颈侧、颈上缘、鬐甲、背部、体侧、肩甲、腹部、荐部及股部等10个不同部位皮肤的组织学特性。【结果】苏博美利奴羊毛囊结构同其它动物一样,由毛球、连接组织鞘、外根鞘、内根鞘和毛干等几部分组成。在胎龄65d时初级毛囊(primary follicles, PF)已经发生形成毛芽,毛芽延长,继续向真皮层深入,形成柱状结构,通过由大量真皮细胞在末端聚集,形成帽子结构,各部位表皮均形成完整的结构。胎龄85d时毛囊上部形成一个膨大部,在毛乳头上方形成锥形结构,毛球基本形成,毛乳头长度明显大于宽度;在初级毛囊基底部可见次级毛囊(secondary follicles ,SF)的囊泡结构,并形成皮脂腺原始细胞。在胎龄105d时次级毛囊大量形成,伴随着初级毛囊毛芽伸长,次级毛囊毛芽向真皮层深入,毛乳头直径逐渐增大,皮脂腺开始形成;原始次级毛囊颈部隆突部开始再分化出再分化次级毛囊(secondary-derived follicles ,SD),并可见汗腺,毛管发育完整;已形成完整的毛囊群结构,主要为三元毛囊群,每个毛囊群由1—3个初级毛囊和围绕其周围的几个次级毛囊组成。胎龄135d时大量形成再分化次级毛囊,形成成熟的汗腺,大部分初级毛囊和部分次级毛囊发育成熟,毛囊形成角质化毛干并穿出体表。【结论】苏博美利奴羊胚胎皮肤初级毛囊约50—55d开始形成;胎龄65—75d是初级毛囊形成的重要时期;胎龄80—85d是次级毛囊形成期,此时期,初级毛囊大量形成;胎龄105—135d是次级毛囊大量再分化,再分化次级毛囊形成及发育的关键时期。
苏博美利奴羊;毛囊结构;形态变化;初级毛囊;次级毛囊;再分化次级毛囊
0 引言
【研究意义】苏博美利奴羊是中国2014年培育出的超细型细毛羊新品种,该品种具有产毛量高、羊毛品质好、羊毛细度为17.0—19.0μm、适应草原放牧、抗逆性强、繁殖成活率高等特点。毛囊是控制羊毛生长的附属物,毛囊虽然小但结构复杂,由18层独特的细胞群构成[1],分别来源于外胚层和内胚层,在毛囊中的位置、作用以及基因表达特性均不同[2]。毛囊的性状和皮肤组织结构决定着羊毛的品质和产量。近年来通过体外毛囊的培养发现,毛囊及周围组织通过自分泌和旁分泌的方式产生一些可溶性因子,它们对毛发的生长发育有重要的作用,所以研究毛囊对提高羊毛品质和产毛量等有重要的意义;同时研究毛囊发育形态结构变化及发育规律,是探究毛囊生长发育分子调控机制的基础,可为培育更高品质的细毛羊提供理论依据[3]。【前人研究进展】HARDY等[4-5]研究了澳大利亚美利奴羊和中国超细毛羊(甘肃型)皮肤毛囊发生与生长的组织学变化过程。STENN等[6]研究了成年绵羊毛囊的周期性生长变化过程。王春亮等[7]的研究主要针对敖汉细毛羊胎龄第90和120天的胎儿及出生后1 d和30 d的羔羊体侧部(多毛区)和腹股沟部(少毛区)皮肤组织的组织学研究。【本研究切入点】近年来,柳楠等[8]从分子层面上研究了细毛羊羊毛性状的形成机理。有关人和鼠毛囊结构功能和形态发生过程的相关分子调控机制已有较多研究[9-12],在成年绵羊中,毛囊周期性生长发育过程及分子调控机理也多有报道[6,13]。目前,毛囊结构功能和形态形成过程及相关分子调控机制是毛囊研究的热点,而对细毛羊胎儿期不同部位毛囊发生发育形态变化的研究报道较少。【拟解决的关键问题】本研究以苏博美利奴羊为材料,利用组织切片方法,在组织学水平上了解胎儿各时期不同部位皮肤毛囊的差异,旨在探明苏博美利奴羊胎儿皮肤毛囊发育及分化的形态结构变化,为研究毛囊生长发育及其调控机制提供组织学基础,为选育高品质细毛羊提供理论依据。
1 材料与方法
试验于2015年6月在新疆科创繁育中心进行,选购试验所需经产母羊,分别进行人工授精;2015年8—11月,根据妊娠时间分4批次剖取胎儿,并采集胎儿皮肤样本;2016年3—5月,在新疆军区总医院动物实验科完成石蜡切片、H.E.染色及图像采集。
1.1 试验动物
苏博美利奴羊经产母羊(2—3岁),新疆科创繁育中心提供。根据配种时间,分别于妊娠期第65、85、105和135天剖取胎儿,分别剪取10个不同部位的皮肤组织(图1)。每个时期分别取3只公羔,共12只,切取皮肤约2cm2,生理盐水冲洗后装入冻存管中,投入液氮中保存备用。
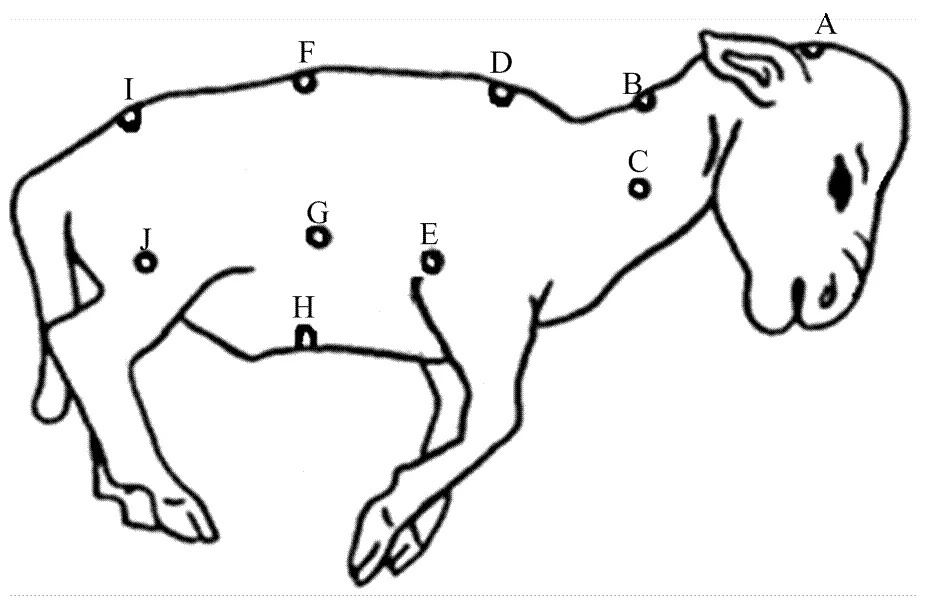
A:头部;B:颈上缘;C:颈侧;D:鬐甲部;E:肩胛;F:背部;G:体侧;H:腹部;I:荐部;J:股部
1.2 仪器和试剂
Leica RM2235切片机、Leica DM5500显微镜、THZ-C-1低温摇床、烘箱、恒温水浴槽。二甲苯、无水乙醇、4%多聚甲醛、中性树脂、苏木素、伊红、石蜡等。
1.3 试验方法
将固定好的皮样修整后,用PBS缓冲液冲洗,经逐级浓度乙醇脱水,二甲苯透明,石蜡包埋,将包埋好的蜡块固定到切片机上,连续切片,厚度为5μm。展片后用载玻片捞起,37℃干燥,H.E.染色,中性树脂封片,显微镜下观察照相。
2 结果
2.1 皮肤的结构
绵羊皮肤由表皮层(图2-A)、真皮层(图2-B)和皮下结缔组织(图2-C)构成,表皮极薄,主要由角质层和生发层构成,真皮下有疏松结缔组织。根据机能和形态特点,真皮层可分为毛囊层和网状层,乳头层以疏松结缔组织为主,内有毛囊和皮脂腺等结构。
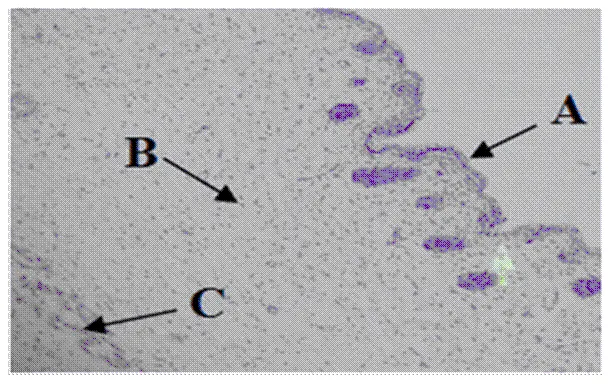
A:表皮层;B:真皮层;C:皮下结蹄组织
2.2 毛囊的结构
苏博美利奴羊皮肤毛囊结构包括连接组织鞘、外根鞘、内根鞘、毛干、毛球、毛乳头及毛母质(图3-A)。根据发生的时间和结构特点,毛囊可分为初级毛囊和次级毛囊(图3-B)。初级毛囊发生较早,毛球直径较大,毛囊长度较长,具有2个发达的皮脂腺、汗腺、竖毛肌等附属结构。次级毛囊发生较晚,毛球直径较小,深度较浅,无汗腺和竖毛肌,毛干没有髓质,有或无不发达的小型皮脂腺(图3-C和图3-D)。
2.3 初级毛囊形态发生变化过程
通过制作纵切石蜡切片,获得有关毛囊发育图像,从而全面探究毛囊发生及发育过程。以下将描述苏博美利奴羊各时期胎儿不同部位皮肤初级毛囊的发育特征。在胚胎发育过程中,毛囊最初由上皮细胞和真皮细胞间相互作用形成毛囊原始体,逐渐生长发育形成结构完整的毛囊。
苏博美利奴羊胎龄65 d时,胎儿表皮结构完整,角质化细胞整齐的排列在表皮基底层,聚集在一起形成泡团结构(图4-A-a2)。泡团从表皮细胞延伸到真皮,在真皮有大量的真皮细胞发生聚集,形成表皮囊泡结构(图4-B-b),即毛芽的前体。真皮细胞聚集在表皮囊泡的下方,形成毛芽状结构(图4-C-c1),随着毛芽状结构向真皮层伸入,它的末端逐渐膨大形成一个由多层角化细胞组成的凹形结构,这些细胞围着毛囊轴整齐排列着毛囊末端周围的成纤维原细胞向凹形末端伸入,形成一个球形的真皮毛乳头(图4-C-c2),周围伴行的成纤维细胞形成连接组织鞘(图4-D-d)。毛芽延长,继续向真皮层深入,形成了一个由上皮细胞组成的柱状结构,末端聚集大量真皮细胞,形成帽子结构(图4-E-e1—e4)。到胎龄85d时,毛囊随胎龄增加继续向真皮深层延伸,逐渐变长、变粗。毛囊上部形成一个膨大部(图4-F-f),在毛乳头上方形成一个锥形结构(图4-G-g),它将形成以后的内根鞘,毛球基本形成(图4-H-h2)。此时,毛乳头长度大于宽度,一部分毛乳头细胞已经被毛母质细胞包围住(图4-H-h3)。可见到皮脂腺原细胞(图4-H-h1),以后将形成皮脂腺。胎龄105 d时,毛芽延伸至双子叶皮脂腺基底,形成毛囊(图4-I),毛囊进一步发育至结构完整,毛管发育完成(图4-J-j1)。此时,内根鞘、外根鞘、真皮毛乳头、毛母质和毛干已经形成,毛囊基本形成完整结构(图4-I),同时也能看到汗腺(图4-K)。胎龄135 d时,皮脂腺结构完整(图4-j2),已有很多毛囊达到真皮的深部,毛干也穿出体表(图4-j1),横切切片可观察到大量毛的髓质,表明初级毛囊的发育已基本完成。
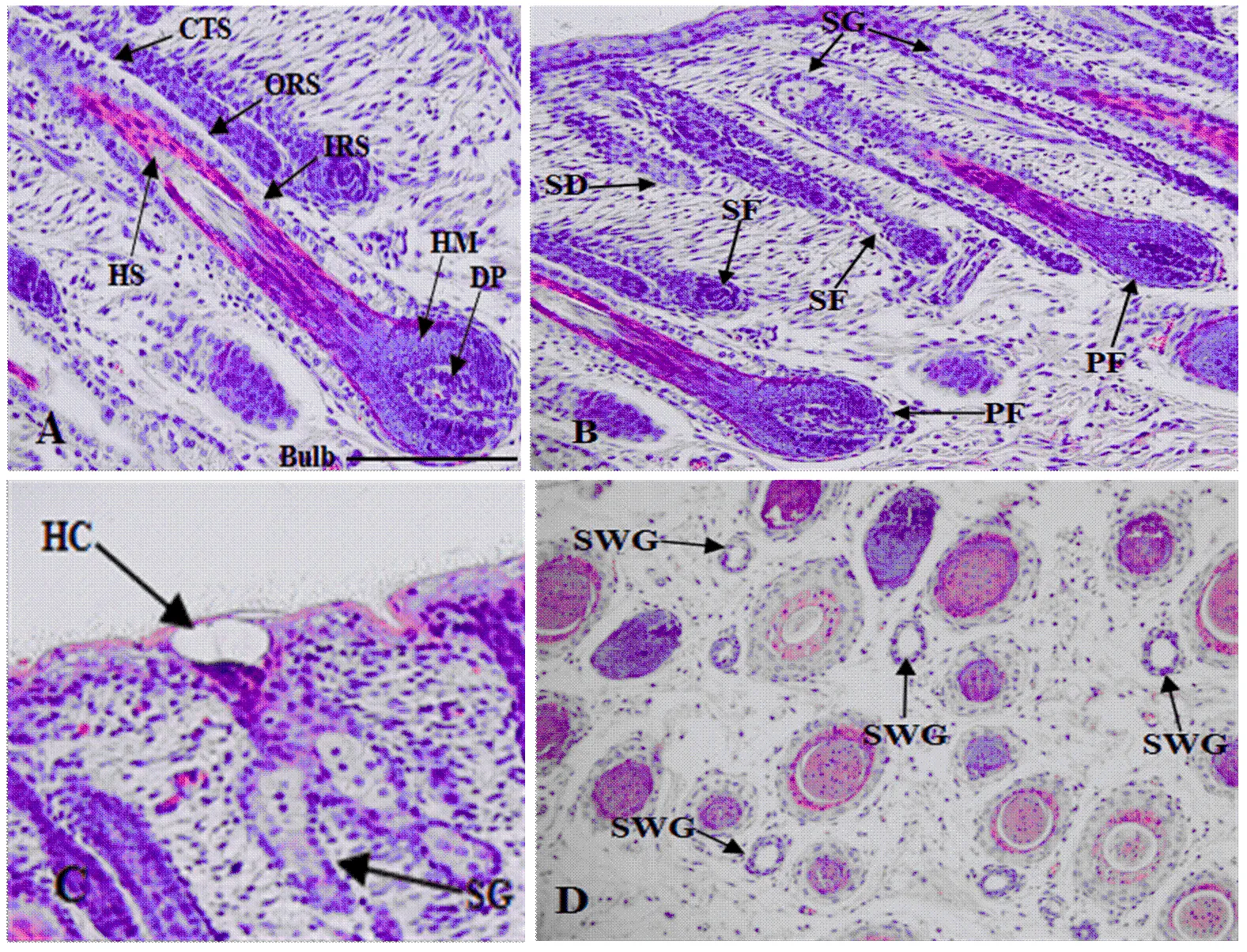
A, C, D:毛囊结构(100×);B:毛囊类型(200×)。Bulb:毛球;DP:真皮毛乳头;HM:毛母质;ORS:外根鞘;IRS:内根鞘;CTS:连接组织鞘;HS:毛干;HC:毛管;SG:皮脂腺;SWG:汗腺;PF:初级毛囊;SF:次级毛囊;SD:再分化次级毛囊
2.4 次级毛囊形态发生变化过程
苏博美利奴羊胎儿皮肤次级毛囊发生时间相对初级毛囊要晚,次级毛囊的形态变化过程大体与初级毛囊相似,在次级毛囊发育后期,原始次级毛囊(SO)或再分化次级毛囊(SD)可分化出多个再分化次级毛囊(SD)。胎龄85 d时,次级毛囊开始发生,但它不像初级毛囊那样由表皮和真皮细胞共同作用而形成,而是从初级毛囊表皮部位的膨大部(图5-A-a1)进一步发育形成次级毛囊的毛芽(图5-B-b3)。胎龄105 d时,次级毛囊大量形成,伴随着初级毛囊毛芽伸长,次级毛囊毛芽深入真皮层,真皮乳头直径逐渐增大,皮脂腺开始形成(图5-D)。此时期最重要的特点是次级毛囊再分化出再分化次级毛囊(图5-C)。在毛囊颈部的上部开始形成表皮毛管,在毛囊颈部以下部位皮脂腺细胞开始退化,形成结构完整的次级毛囊(图5-D)。胎龄135 d时,SO进一步再分化形成大量SD,大多数次级毛囊形成完整结构,一部分次级毛囊已经发育成熟,并角质化羊毛尖端开始出现在毛管中,最终穿出皮肤表面。此时,形成成熟的汗腺(图5-E)。
苏博美利奴羊再分化次级毛囊的发育过程与原始次级毛囊基本相似,胎龄105d时,再分化次级毛囊开始形成,它是来自一个SO或一个SD,而不是来自表皮层;胎龄135 d时,再分化次级毛囊大批量形成,SD纤维进入到毛管,这是由SO纤维分化形成次级毛囊束的共同毛管(图6-A,B)。
通过上述的试验结果可以推测,苏博美利奴羊胚胎皮肤初级毛囊约于胎龄50—55 d开始形成;胎龄65—75 d是初级毛囊形成的重要时期,与其他部位相比,头部初级毛囊最早发生;胎龄80—85 d是次级毛囊形成期,该时期初级毛囊数量迅速增加;胎龄105—135 d是再分化次级毛囊形成及发育的关键时期。详见图7。
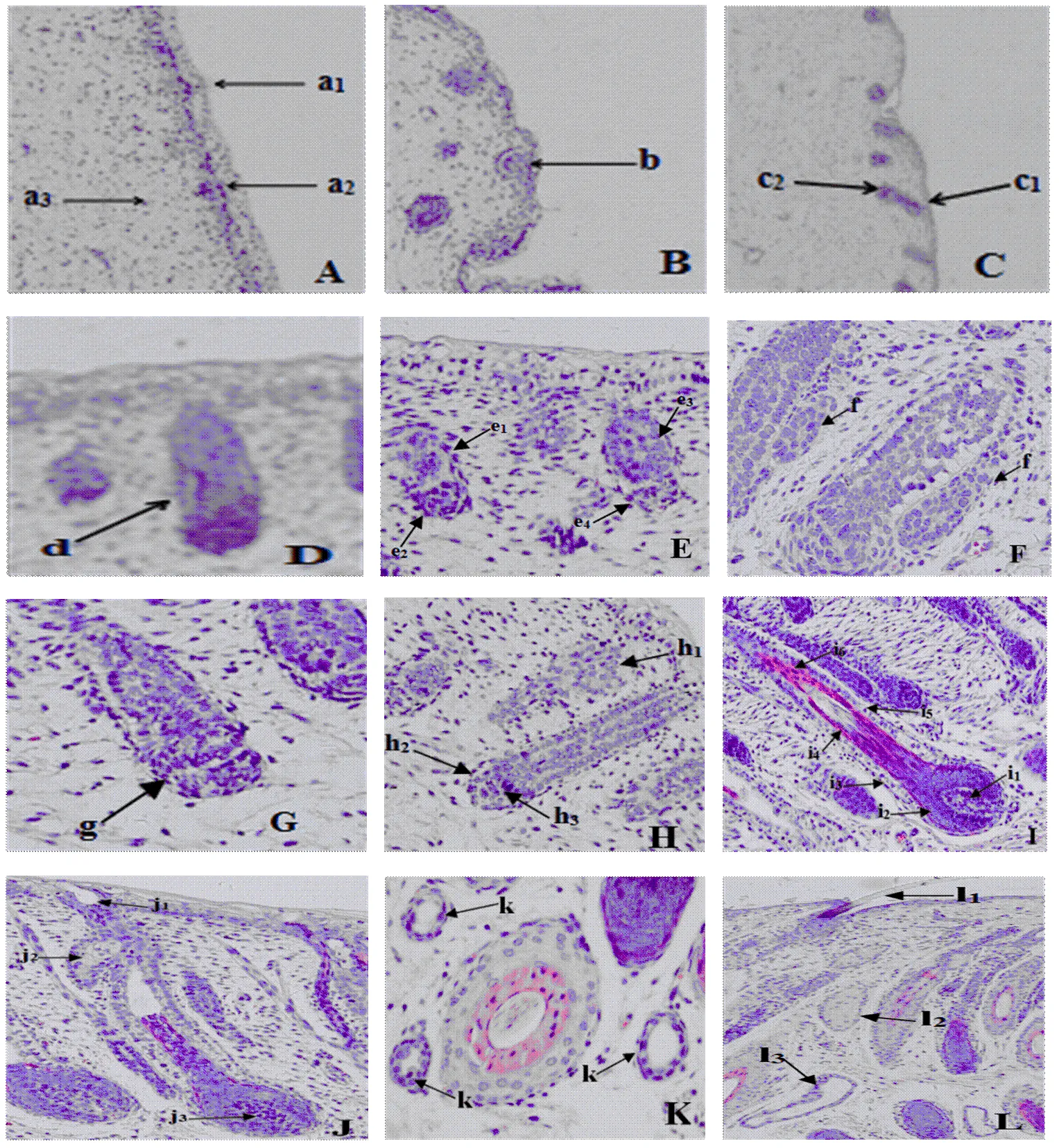
A:胎儿期65d头部(200×);B:胎儿期65d背部(200×);C:胎儿期65d体侧(200×);D:胎儿期65d肩胛部(200×);E:胎儿期65d颈上缘(200×);F:胎儿期85d颈侧(400×);G:胎儿期85d股部(200×);H:胎儿期85d荐部(200×);I:胎儿期105d腹部(100×);J:胎儿期105d体侧(100×);K:胎儿期105d背部(100×);L:胎儿期135d鬐甲部(200×)。a1:表皮;a2:泡团;a3:真皮;b:囊泡;c1:毛芽;c2:真皮纤维原细胞;d:连接组织鞘;e1, e3:增长的毛芽;e2, e4:真皮纤维原细胞组成的帽状结构;f:膨大部;g:毛锥形体;h1:皮脂腺原始体;h2:毛球;h3:真皮乳头细胞;i1:真皮毛乳头;i2:毛母质;i3:连接组织鞘;i4:内根鞘;i5:外根鞘;i6:毛干;j1:毛管;j2:皮脂腺;j3:真皮毛乳头;k:汗腺;l1:穿出体表的毛干;l2:皮脂腺;l3:汗腺
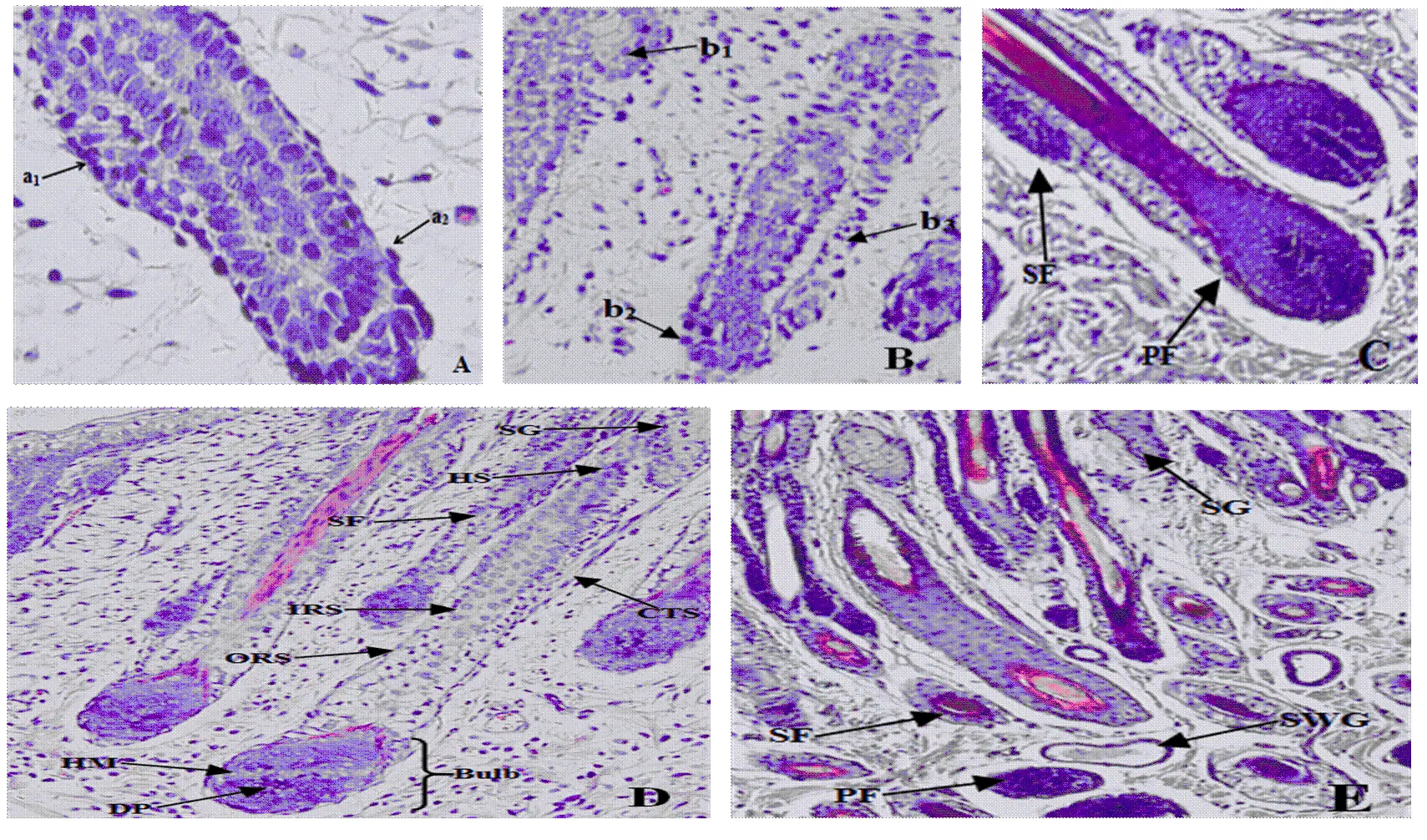
A:胎儿期85d肩胛部(200×);B:胎儿期85d背部(200×);C:胎儿期105d鬐甲(100×);D:胎儿期105d头部(100×);E:胎儿期135d体侧(100×)。a1:膨大部;a2:初级毛囊毛芽;b1:皮脂腺原始体;b2:初级毛囊毛芽;b3:次级毛囊毛芽;PF:初级毛囊;SF:次级毛囊;Bulb:毛球;DP:真皮毛乳头;HM:毛母质;CTS:连接组织鞘;ORS:外根鞘;IRS:内根鞘;HS:毛干;SG:皮脂腺;SWG:汗腺

图6 苏博美利奴羊胎儿期次级毛囊再分化变化过程(100×)
3 讨论
本研究选取了生产性能典型优质的超细型细毛羊品种苏博美利奴羊,该品种在体型和外貌上具有细毛羊的共同特征。因此作为试验样品采集的原材料,了解苏博美利奴羊毛囊结构和形态结构变化,为阐明细毛羊毛囊生长发育及分子调控机制研究具有指导意义。在确定试验样品时间点方面,根据前人的研究结果,绵羊胚胎发育约第50天,皮肤开始形成初级毛囊;胚胎发育到第85天,第一种次级毛囊开始出现;到胎龄105 d时,第二种次级毛囊开始形成;至羔羊出生时,所有的毛囊都已经形成,且初级毛囊已成熟,但是次级毛囊还没有成熟,在羔羊出生后,次级毛囊成熟还需4—5个月[14-15]。因此于胎龄65、85、105和135 d进行皮肤组织采集,为后期更好地了解毛囊的形成和形态发育规律的必须条件。
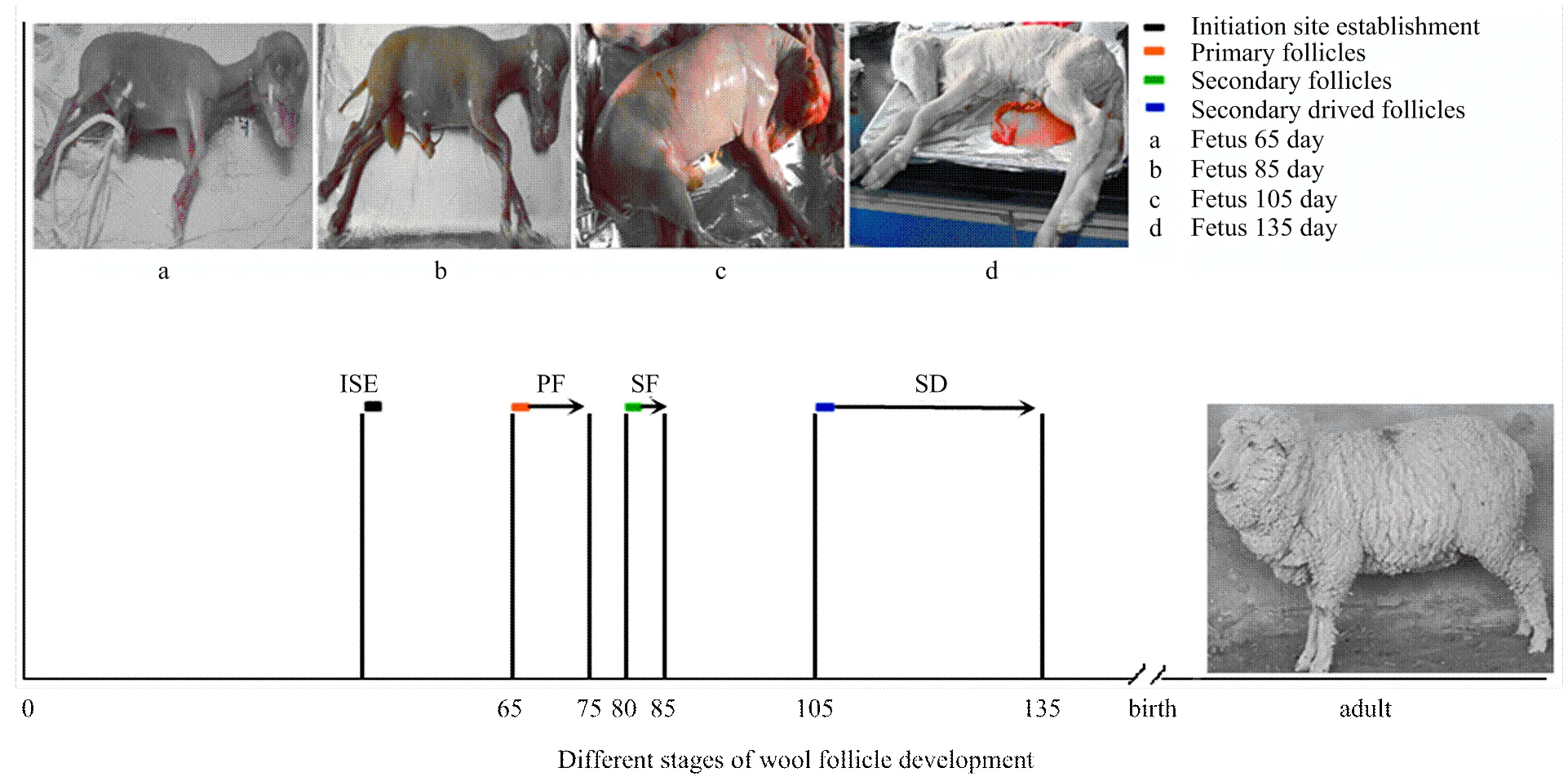
图7 苏博美利奴羊毛囊发育时间
绵羊皮肤是由表皮和真皮构成,表皮极薄,主要由角质层和生发层构成,真皮下有疏松结蹄组织。真皮层可以分为毛囊层和网状层,毛囊层以疏松结蹄组织为主,内部有毛囊和皮脂腺等结构。毛囊是调控羊毛生长的附属物,根据毛囊发生的早晚及形态特点,可将毛囊分为初级毛囊和次级毛囊两种。初级毛囊发生较早,且具有2个发达的皮脂腺、汗腺、立毛肌等附属物。而次级毛囊发生较晚,无汗腺和竖毛肌,有或无不发达的小型皮脂腺。苏博美利奴羊毛囊是以毛囊群的结构存在,每个毛囊群由1—3个初级毛囊及几个次级毛囊形成。
毛囊形态发生涉及表皮和真皮之间一系列复杂的相互作用,首先由真皮细胞发出初始信号,诱导表皮形成毛芽,毛芽释放TGF-β、Laminin-511、β-catenin等因子诱导真皮纤维原细胞形成真皮毛乳头,真皮毛乳头能调节角质细胞的活性;毛乳头由真皮细胞组成,可释放第二种信号刺激上皮细胞增生,分化形成完整的毛囊结构[9,16]。在胚胎发育过程中,初级毛囊是表皮和真皮细胞相互作用,有序增殖和分化形成的毛囊,而次级毛囊形成并不是两者相互作用形成的,而是初级毛囊的分支。
本研究发现,苏博美利奴羊在胎儿65 d时各部位均出现初级毛囊,这与张燕军[17]报道内蒙古阿尔巴斯绒山羊在胎龄55—65 d各部位开始发生形成毛芽相同,但是与吴瑜瑜[5]报道中国超细毛羊(甘肃型)的胎儿84 d时体侧部皮肤开始发生初级毛囊不同。在胎龄85 d时,初级毛囊发生形成毛芽,在初级毛囊基底部可见次级毛囊的囊泡结构,这与中国超细毛羊(甘肃型)在胎龄87 d时初级毛囊基底层次级毛囊的囊泡结构相同[5]。在胎龄105 d时,可见再分化次级毛囊,这个结果与敖汉细毛羊在胎龄120 d时再分化次级毛囊不同[18]。在胎龄135 d时,苏博美利奴羊的初级毛囊发育基本成熟。但不同动物的毛囊发生和发育成熟的时间不相同,人类在胚胎11—13周形成毛芽,26—28周成熟[19];小鼠在胚胎13.5—14.5 d形成毛芽[20],18.5 d左右成熟[21],这可能与妊娠期的长短及毛囊的类型有关。通过观察切片,苏博美利奴羊毛囊的结构和其它哺乳动物一样,由连接组织鞘、外根鞘、内根鞘、毛球(毛乳头和毛母质)和毛干几部分组成。毛乳头和连接组织鞘是由真皮细胞组成,其它部分由上皮细胞组成[22]。连接组织鞘是围绕毛囊最外层的真皮源性组织,有研究认为,连接组织鞘的真皮细胞是毛乳头细胞的储备细胞[23]。毛母质不断分裂增生向上推移形成内根鞘和毛发,虽然毛母质细胞是毛发的来源,但是毛乳头细胞对毛母质细胞的生长和分化都是必须的,毛乳头通过控制毛母质细胞的数量而控制毛发的性状和大小[11,24]。毛乳头细胞显著的生物学特性表现为凝集性的生长方式及具有诱导毛囊形成的能力,在毛囊的形态学发生及其周期性生长调控中处中心环节。与其它哺乳动物一样,毛囊发育过程一般都要经历囊泡期、毛芽期、毛钉期和毛囊期,最终发育为成熟毛囊。
不同胎龄,同一部位初级毛囊生长发育程度不同。同一部位,初级毛囊在胎龄85 d前生长速度缓慢,在胎龄85—105 d生长速度较快,胎龄105 d后生长缓慢。同一胎龄,不同部位间初级毛囊生长发育程度不同。如在胎龄65 d时,头部、颈侧及颈上缘可观察到明显的初级毛囊,背部和肩胛部出现初级毛囊原始体,其他部位的初级毛囊原始体刚刚形成。在胎龄85 d时,初级毛囊在各部位均发生,并迅速增长;在胎龄105 d时,不同部位初级毛囊生长发育缓慢;仅在胎儿头部可见穿出体表的角质化毛干;在胎龄135 d时,各部位均有穿出的毛干。同一部位的次级毛囊随胎龄的增长呈逐渐增长趋势,胎龄105 d前生长发育速度缓慢,胎龄105—135 d增长速度较快;次级毛囊在同一时期不同部位间变化有差异,但没有明显的规律。如在胎龄85 d时,在颈上缘、肩胛部、鬐甲、背部及体侧观察到明显的次级毛囊原始体,其他部位次级毛囊原始体的发生速度较慢;在胎龄105 d时,次级毛囊在各部位都大量发生;在胎龄135 d时发生速度缓慢。
苏博美利奴羊毛囊分为初级毛囊和次级毛囊,初级毛囊发生于表皮隆突部,次级毛囊来源于初级毛囊的分支。在原始次级毛囊发育后期,可分化出再分化次级毛囊,这些再分化次级毛囊围绕着次级毛囊,有各自的毛根,毛干从一侧进入同一毛管伸出体表。这与小鼠胚胎中所有初级、次级毛囊都拥有各自独立的毛管不同[25]。同一组次级毛囊共用一个毛管导致毛干在伸出体表时受到更大压力,使得毛纤维更细、更长[26]。苏博美利奴羊羊毛主要是次级毛囊产生的,其次级毛囊与初级毛囊数量之比(S/P)达20﹕1,而一般品种羊的S/P大约为5﹕1,S/P值是反映产毛量高低的指标。羊毛纤维细度、长度和密度是决定羊毛品质和产量的重要指标,皮肤毛囊的发育直接影响羊毛品质和产量。对羊毛生长的调控,遗传是最主要的因素,内分泌在其中也起着重要的作用,环境及营养最终都是通过对有关基因的表达调控而发挥作用[27]。绵羊的毛囊数是由遗传因素所决定的,美利奴羊总毛囊密度的遗传力估计值变化范围在0.20—0.60,密度和产毛量间的遗传相关估计为0.14—0.30。毛囊和产毛性状之间的遗传相关较大[28]。LINDER等[29]发现毛囊细胞在中期经历凋亡,这与bcl-2调控相关。相似的研究也发现c-myc在毛发循环中表达,可推测bcl-2和c-myc基因的表达可能是凋亡的信号,bcl-2在乳头中表达的结果表明乳头与抗凋亡基因的表达有关。经研究发现,调控绵羊毛生长的因子有类胰岛素样生长因子-I(IGF-I)、表皮生长因子(EGF)、转化生长因子-α(TGF-α)、成纤维细胞生长因子(FGF)等。PHILPORRT报道了IGFS有刺激毛囊生长的正向调节作用[30]。
遗传上优良的品种或个体,只有在优良的环境和充足的营养条件下才表现出所固有的各种优良特性和生产力水平。研究资料表明,胚胎期的营养水平对毛囊的发育至关重要,若该时期营养水平较低,则可能阻止毛囊的发育。良好的营养条件可使皮肤毛囊原始体的数量增加,随后可促使胎儿皮肤结构的发育加快,并使皮肤厚度增加,改进胶质纤维结构和特性,从而改善羊毛品质。羊毛蛋白质中含有丰富的含硫氨基酸,其中主要是胱氨酸,占羊毛蛋白质含硫氨基酸的90%以上,所以维持羊毛快速生长,须为绵羊提供足够的胱氨酸[31]。毛囊的发育以及毛囊发生的诱导和模式形成,都受到动态信号通路的严格调控。调节毛囊发育的信号通路主要有Wnt/β-catenin信号通路、Eda-A1/NF-κB、BMP信号通路、Notch信号通路以及Noggin信号通路等,其中Wnt信号通路被认为是调节毛囊形态发生诱导、起始和发育最重要的信号通路[21,32-33]。目前关于调控毛囊发育的信号通路、细胞凋亡、营养和调控因子的作用机制还需要进一步的深入研究。
4 结论
本研究通过观察苏博美利奴羊胚胎皮肤的组织切片,发现在胎龄65 d时形成完整的表皮结构,初级毛囊开始发生形成毛芽;胎龄85 d时次级毛囊开始发生并出现皮脂腺原始体;胎龄105 d时在原始次级毛囊颈部隆突部开始再分化出再分化次级毛囊,在头部可见穿出体表的毛,形成完整的皮脂腺、毛管及汗腺;胎龄135 d时大多数初级毛囊及一部分次级毛囊基本成熟;次级毛囊并不像初级毛囊通过上皮细胞和真皮细胞相互作用形成,而是它的一个分支。次级毛囊再分化是影响毛囊密度的最主要因素,它能有效地增加毛囊密度,提高羊毛细度。
References
[1] SHIMOMURA Y, CHRISTIANO A M. Biology and genetics of hair., 2010, 11(11): 109-132.
[2] AL-NUAIMI Y, BAIER G, WATSON R E, CHUONG C M, PAUS R. The cycling hair follicle as an ideal systems biology research model., 2010, 19(8) :707-713.
[3] ADELSON D L, CAM G R, DESILVA U, FRANKLINR I R. Gene expression in sheep skin and wool (hair)., 2004, 83(1): 95-105.
[4] HARDY M H, LYNE A G. The Pre-Natal Development of Wool Follicles in Merino Sheep., 1956, 9(3): 423-441.
[5] 吴瑜瑜, 岳耀敬, 郭婷婷, 王天翔, 郭健, 李桂英, 韩吉龙, 杨敏, 刘建斌, 孙晓萍, 李范文, 何玉琴, 杨博辉. 中国超细毛羊(甘肃型)体侧皮肤毛囊发育及其形态结构. 中国农业科学, 2013, 46(9): 1923-1931.
WU Y Y, YUE Y J, GUO T T, WANG T X, GUO J, LI G Y, HAN J L, YANG M, LIU J B, SUN X P, LI F W, HE Y Q, YANG B H. Study on fetal skin hair follicle development and morphology of China Super-Fine Merino (Gansu Type)., 2013, 46(9): 1923-1931. (in Chinese)
[6] STENN K S, PAUS R. Controls of hair follicle cycling., 2001, 81(1): 449-494.
[7] 王春亮, 贺建宁, 程明, 刘开东, 刘积凤, 柳楠. 敖汉细毛羊皮肤毛囊形态发育观察.黑龙江畜牧兽医, 2015(11): 44-46.
WANG C L, HE J N, CHENG M, LIU K D, LIU J F, LIU N. Observation of morphological development of the skin hair follicles in the Aohan fine-wool sheep., 2015(11): 44-46.(in Chinese)
[8] 柳楠, 卜然, 贺建宁, 程明, 刘开东, 刘积凤, 赵金山. Hox基因家族对细毛羊羊毛性状影响的研究. 中国畜牧杂志, 2014, 50(23): 6-10.
LIU N, BU R, HE J N, CHENG M, LIU K D, LIU J F, ZHAO J S. Effects of Hox gene family on wool traits of fine-wool sheep.,2014,50(23): 6-10. (in Chinese)
[9] DI-POI N, NG C Y, TAN N S, YANG Z Z, HEMMINGS B A, DESVERGNE B, MICHALIK L, WAHIL W. Epithelium-mesenchyme interactions control the activity of peroxisome proliferator activated receptor β/δ during hair follicle development., 2005, 25(5): 1696-1712.
[10] BERNARD B A. The life of human hair follicle revealed., 2006, 22(2): 138-143.
[11] MILLAR S E. Molecular mechanisms regulating hair follicle development., 2002, 118(2): 216-225.
[12] MOU C, JACKSON B, SCHNEIDER P, OVERBEEK P A, HEADON D J. Generation of the primary hair follicle pattern., 2006, 103(24): 9075-9080.
[13] PARRY A L, NIXON A J, CRAVEN A J, PEARSON A J. The microanatomy, cell replication, and Keratin gene expression of hair follicles during a photoperiod-induced growth cycle in sheep., 1995, 154(4): 283-299.
[14] ROGERS G E. Biology of the wool follicle: an excursion into a unique tissue interaction system waiting to be re-discovered. Experimental Dermatology, 2006,15(12): 931-949.
[15] GALBRAITH H. Fundamental hair follicle biology and fine fibre production in animals., 2010;4(9): 1490-1509.
[16] MATSUZAKI T, YOSHIZATO K. Role of hair papilla cells on induction and regeneration processes of hair follicles. Wound Repair and Regeneration, 1998, 6(6): 524-530.
[17] 张燕军, 尹俊, 李金泉, 李长青. 内蒙古阿尔巴斯绒山羊毛囊结构及形态发生过程研究. 中国农业科学, 2007, 40(5): 1017- 1023.
ZHANG Y J, YIN J, LI J Q, LI C Q. Study on hair follicle structure and morphogenesis of the Inner Mongolian Arbas Cashmere Goat.,2007, 40(5): 1017- 1023. (in Chinese)
[18] 柳楠, 王春亮, 贺建宁, 程明, 刘开东, 刘积凤, 赵金山. 敖汉细毛羊不同部位皮肤毛囊发育及形态结构研究. 中国畜牧杂志, 2015, 51(17): 1-5.
LIU N, WANG C L, HE J N, CHENG M, LIU K D, LIU J F, ZHAO J S. Study on skin hair follicle development and morphology of different body parts of Aohan fine wool sheep.,2015, 51(17): 1-5. (in Chinese)
[19] 姜笃银, 付小兵, 孙同柱, 陈伟, 盛志勇. FGF10及其受体对胎儿皮肤附件形成的诱导作用. 解放军医学杂志, 2003, 28(7): 583-586.
JIANG D Y, FU X B, SUN T Z, CHEN W, SHENG Z Y. The induction effects of FGF10 and ITS receptor on the formation of fetal skin appendage., 2003, 28(7): 583-586. (in Chinese)
[20] 姜笃银, 付小兵. 毛囊干细胞的基因调节、生物学特征及其与疾病发生的关系. 解放军医学杂志, 2004, 29(4): 369-370.
JIANG D Y, FU X B. The relation with illness of hair follicle stem cell gene regulation and biology character., 2004, 29(4) :369-370. (in Chinese)
[21] ACHMIDTULLRICH R, PAUS R. Molecular principles of hair follicle induction and morphogenesis., 2005, 27(3): 247-261.
[22] DRISKELL R R, CLAVEL C, RENDL M, WATT F M. Hair follicle dermal papilla cells at a glance., 2011, 124(8): 1179-1182.
[23] 钟白玉, 吕中法. 毛囊真皮鞘成纤维细胞的培养. 第三军医大学学报, 1999, 21(12): 935-936.
ZHONG B Y, LÜ Z F. Culture of fibroblasts in dermal sheath hair follicle., 1999, 21(12): 935-936. (in Chinese)
[24] PAUS R, COTSARELIS G. The biology of hair follicles., 1999, 341(7): 491-497.
[25] DAVIDSON P, HARDY M H. The development of mouse vibrissaeand, 1952, 86(4): 342-356.
[26] SHEETS T. Alpacas-A guide to getting started guide, www.ourheritagefarm. Com.
[27] 郁枫. 影响羊毛生长的遗传和环境因素. 草食家畜, 1993(2): 9-17.
YU F. Genetic and environmental factors affect the growth of wool., 1993(2): 9-17. (in Chinese)
[28] 徐子伟. 绵羊毛囊活性与羊毛生长. 草食家畜, 1990(4): 36-39.
XU Z W. Sheep wool follicle activity and growth., 1990(4): 36-39. (in Chinese)
[29] SEIBERG M, MARTHINUSS J, STENN K S. Changes in expression of apoptosis-associated genes in skin mark early catagen., 1995, 104(1): 78-82.
[30] PHILPOTT M P, GREEN M R, KEALEY T. Human hair growth., 1990, 97(Pt3): 463.
[31] 田占标, 周薇. 含硫氨基酸促羊毛生长研究进展及对策. 草食家畜, 1992(4):6-8.
TIAN Z B, ZHOU W. Progress and countermeasure of Sulfur- containing amino acids on promoting the growth of wool., 1992(4): 6-8. (in Chinese)
[32] FUCHS E. Scratching the surface of skin development., 2011, 445(7130): 834.
[33] MIKKOLA M L. Genetic basis of skin appendage development., 2007, 18(2): 225-236.
(责任编辑 林鉴非)
Study on Fetal Skin Hair Follicle Structure and Morphological Development of Subo Merino Sheep
Ablat Sulayman1,2, TIAN YueZhen1,2, XU Qin3, HE JunMin1, ZHAO BingRu1, XU XinMing2, FU XueFeng2, Ranagul Anwarjan1, HUANG XiXia1, TIAN KeChuan2
(1College of Animal Science, Xinjiang Agricultural University, Urumqi 830052;2Xinjiang Academy of Animal Science, Urumqi 830011;3Laboratory of Animal Science of General Hospital of Xinjiang Military District, Urumqi 830000)
【Objective】The main purpose of this study was to study the tissue structure and morphological development process of hair follicles in SuboMerino sheep, and results of the study will laya histological basis for further resolving the molecular regulation mechanism of hair follicle development of fine-wool sheep. 【Method】The histological characteristics of ten different parts of skin, such as (the poll, midside of neck, up side of neck, wither, back, midside of body, shoulder, belly, sacrum and femur, respectively) of Subo Merino sheep fetuses on the 65, 85, 105 and 135 day of gestational age were analyzed using paraffin section methods.【Result】The results showed that the hair follicle structure of Subo Merino sheep was in the same manner compared with other animals, which was composed of hair bulb, connective tissue sheath, outer root sheath, inner root sheath and hair shaft.At the embryonic age of 65 days,primary follicles has been formed hair germs, with the extension of the hair germs, and continue depth into the dermis, the columnar structure was formed. The cap-like structure was formed by the aggregation of a large number of dermal cells at the end parts; at this stage, the epidermis of each part were formed a complete structure.At the embryonic age of 85 days,the upper part of the hair follicle formed bulge, formed hair cone structure above the dermal papilla,hair bulb was basically formed, and the length of the hair papilla was larger than the width;the vesicle structure of the secondary follicle could be found at the bottom of the primary hair follicle, and also the original sebaceouscell were found. A great quantity of secondary follicles were formed at the embryonic age of 105 days; along with the extension of the primary follicles, secondary follicles inserted into the dermis layer, the diameter of the dermal papilla was gradually increased and sebaceous glands began to form; the secondary-derived follicles began to differentiate from the neck carina of the original secondary follicles, sweat gland and hair canal could also be found,and formed a complete hair follicle group structure,trio group was dominant; each hair follicle group was composed of 1-3 primary follicles and several secondary hair follicles surrounding it. A large number of secondary-derived follicles were formed at the embryonic age of 135 days, formed mature sweat glands, most of primary follicles and some of secondary hair follicle had matured at this stage, hair follicle formed a keratinizated hair shaft and emerged through the epidermis.【Conclusion】 It can be inferred from the experiment that primary follicles of embryonic skin in Subo Merino sheep began to form about 50-55d; gestational age of 65-75 days are an important period for forming of primary follicle; gestational age of 80-85 days are the formation period of secondary follicle, in this period, a great number of primary follicles were formed; a great deal of secondary follicles were differentiated at the gestational age of 105-135 days, this is the critical period of the formation and development of secondary follicles.
Subo Merino sheep; hair follicle structure; morphogenesis; primary follicle; secondary follicle; secondary-derived follicle
2016-10-11;接受日期:2017-06-15
国家自然科学基金(31460593,31360543)、国家绒毛用羊产业技术体系建设项目(CARS-40)
阿布来提·苏来曼,E-mail:iblat2009@sina.cn。通信作者黄锡霞,E-mail:au-huangxixia@163.com。通信作者田可川,E-mail:tiankechuan@163.com
