家蚕组织蛋白酶L(BmCathepsin L)基因鉴定、表达及其功能分析
2017-09-03潘光照张奎李重阳赵羽卒申利徐曼苏晶晶林西崔红娟
潘光照,张奎,李重阳,赵羽卒,申利,徐曼,苏晶晶,林西,崔红娟
家蚕组织蛋白酶L(Bm)基因鉴定、表达及其功能分析
潘光照,张奎,李重阳,赵羽卒,申利,徐曼,苏晶晶,林西,崔红娟
(西南大学家蚕基因组生物学国家重点实验室,重庆 400716)
【目的】鉴定克隆家蚕组织蛋白酶L基因Bm(Bm),分析其序列和表达特征。分析家蚕组织蛋白酶L在大肠杆菌诱导下mRNA表达量的变化趋势,为进一步研究家蚕组织蛋白酶L的功能打下基础。【方法】基于家蚕基因组数据库(SilkDB)中序列BGIBMGA006893设计引物,利用RACE技术克隆家蚕组织蛋白酶L基因的cDNA全长序列,通过在线工具对基因结构和蛋白质分子量及等电点进行预测;在NCBI数据库下载其他物种组织蛋白酶L同源序列,利用Clustalx(1.83)和MEGA 6.0 软件进行同源比对并构建进化树。运用RT-PCR和qRT-PCR对其时空表达特征进行分析。选取该基因的特异性片段,经PCR扩增,测序验证后将其连接至pET-28载体,转化至Rosseta感受态表达菌株,经IPTG在适宜温度条件下诱导,获得组织蛋白酶L重组蛋白。然后再利用镍离子亲和层析法对该蛋白进行纯化,获得纯度较高的重组蛋白。最后利用大肠杆菌对家蚕血液系统进行攻毒,检测家蚕组织蛋白酶L基因的表达水平。【结果】通过查询家蚕基因组数据库和生物信息学分析得出,家蚕组织蛋白酶L基因定位于家蚕第10号染色体上,基因编号为BGIBMGA006893, nscaf2860。基因开放阅读框全长687 bp,编码228个氨基酸,含有保守的Pept_C1结构域。通过在线网站预测,得出该蛋白酶的分子量为26.132 kD,等电点为4.57。进化分析表明该基因与同为鳞翅目昆虫的草地贪夜蛾和黑脉金斑蝶亲缘关系最为接近。RT-PCR显示该基因集中表达于血细胞,在血液不同龄期也较高表达。用His抗体检测经纯化后的蛋白,最终成功孵育出纯化后的蛋白条带;大肠杆菌个体攻毒免疫试验检测显示,其mRNA表达水平随攻毒时间呈现抛物线式的显著性变化规律,从而揭示出BmCat L与家蚕免疫系统的关联性。【结论】克隆获得家蚕组织蛋白酶L基因的cDNA序列,发现其特异性高表达于血细胞。通过原核表达和蛋白纯化成功获得了该基因的重组蛋白。大肠杆菌的刺激能够显著上调其表达,推测组织蛋白酶L可能参与家蚕免疫反应。
组织蛋白酶L基因;家蚕;基因克隆;原核表达;蛋白纯化;免疫应激
0 引言
【研究意义】组织蛋白酶L(CathepsinL)是一种重要的蛋白水解酶,属于溶酶体木瓜蛋白酶家族半胱氨酸蛋白酶,是蛋白酶Clan CA中的木瓜蛋白酶家族(C1)的主要成员,以酶原的形式存在于溶酶体中。组织蛋白酶是动植物体内广泛存在的一种蛋白水解酶类,从低等到高等的生物体类群中均有组织蛋白酶的发现[1]。组织蛋白酶L参与了生物体的许多生理过程,如肿瘤侵袭的调控[2]、免疫应答[3-6],甚至是某些肿瘤干细胞辐射敏感度的调控因子[7]。家蚕()作为一种鳞翅目模式昆虫,对其组织蛋白酶L进行研究,对于深入了解该酶的功能具有重要意义。【前人研究进展】组织蛋白酶这一概念最先提出于20世纪20年代,在20世纪40年代人们先发现了组织蛋白酶C,其后约40年内对组织蛋白酶的研究进展缓慢,只有组织蛋白酶B、H、L陆续被鉴定并测序,到了20世纪90年代,通过测定组织蛋白酶B的晶体结构后,越来越多的组织蛋白酶被发现,到目前为止,组织蛋白酶A—Z均已有报道[8-9]。在昆虫学的研究中,从20世纪60年代至今,已有关于家蚕、果蝇()、棉铃虫()、蚜虫以及蚊类等数种昆虫组织蛋白酶的报道;20世纪90年代,日本研究者KAGEYAMA等从家蚕卵壳中鉴定出半胱氨酸蛋白酶(BCP),并对其结构及活性作出了分析[10-11]。随着研究的不断深入,有相关研究指出组织蛋白酶类B和L在家蚕丝腺细胞程序性死亡方面起着重要的调节作用[12];近年来,对于其功能的研究也逐渐完善,对于完全变态的昆虫而言,在经历蜕皮和变态过程中,幼虫组织如血淋巴和脂肪体的重塑是非常重要的过程,组织蛋白酶在此过程中被认为起到了关键性的作用并且是非常关键的调控因子[13];在棉铃虫中有报道表明,在蜕皮期和化蛹前的表达量最大,在喂食期其表达量最低,表明Cathepsin L在对角质层和表皮的降解中的作用[14];苏晶晶等[15]发现家蚕组织蛋白酶O基因特异性持续表达于家蚕血细胞,推测在家蚕蜕皮以及变态发育过程中发挥作用。近年来有研究表明,组织蛋白酶L与人类心血管疾病机制相关,组织蛋白酶L被认为是水解胶原蛋白和弹性蛋白能力最强的蛋白水解酶,如果其表达发生异变,可能会导致心血管疾病的发生[16-19];在病理状态下,因为某些原因(如病原微生物、氧化应激、炎症因子等)所导致的细胞损伤将导致溶酶体膜稳定性降低,通透性增高甚至引起膜的破裂,致使大量组织蛋白酶L蛋白释放至细胞质或者组织间隙,并被激活,可降解细胞成分或细胞基质成分(包括层粘素、IV型胶原纤维及纤维连接素等);组织蛋白酶L还与人类许多疾病如关节炎、骨质疏松、肾病、阿尔茨海姆病、多发性硬化症及其他慢性炎症性疾病甚至肿瘤的发生发展均有关[20-25]。Lah等[26]发现Cathepsin L在乳腺癌病人中活性的提高完全“得益”于Cathepsin L与其抑制剂含量的失衡,这充分说明了的表达水平与肿瘤的发生水平存在密切关系。【本研究切入点】组织蛋白酶是一种重要的蛋白水解酶类,在动物体免疫系统中起重要作用。家蚕作为一种重要的经济昆虫,目前有关其组织蛋白酶的研究甚少,而其中对家蚕组织蛋白酶L基因的研究更是微乎其微。【拟解决的关键问题】鉴定并克隆家蚕组织蛋白酶L基因,并分析其序列特征;构建原核表达载体,诱导表达对应的重组蛋白,并将其纯化;设计免疫应激检测,探索家蚕组织蛋白酶L与免疫的联系,为后期功能研究提供依据。
1 材料与方法
试验于2015年6月至2017年4月在西南大学家蚕基因组生物学国家重点实验室完成。
1.1 材料及试剂
1.1.1 家蚕 供试家蚕品种为大造(P50),由西南大学家蚕基因资源库提供。家蚕在27℃下饲喂桑叶。
1.1.2 质粒DNA 质粒的提取运用Qiagen公司试剂盒;载体为PMD19-T simple、限制性内切酶、Taq酶及DNA Marker和T4连接酶均为TakaRa公司产品;反转录试剂运用Promega公司生产的试剂盒;RACE Kit和Trizolz试剂盒均购自Invitrogen公司;特异性引物和相关基因测序均由北京六合华大基因完成;Rosetta表达菌株及pET-32、pET-28、pET-22b表达载体由笔者实验室现有保存。甲醇、乙醇、PBS、DMSO、BSA甘油等试剂均为国产或者进口分装产品。
1.2 方法
1.2.1 总RNA的提取及cDNA的合成 将5龄3 d的家蚕幼虫置于冰盒上解剖,摘取头部、中肠、马氏管、血细胞、精/卵巢、表皮、中部丝腺、脂肪体等组织于预冷的EP管中,液氮速冻,材料收齐后于液氮中研磨,运用Trizol法先提取各组织的RNA,最后运用M-MLV反转录酶系统反转录RNA以获得cDNA。
1.2.2 家蚕Bm的克隆和分析 首先从NCBI(http://www.ncbi.nlm.nih.gov)和家蚕基因组生物学国家重点实验室数据库(SilkDB)下载Bm序列的mRNA预测序列,根据预测的CDS序列,经过比对后,运用Primer 5.0软件针对此序列设计引物。由此得到该基因的部分中间序列。再送华大基因测序,经核对序列正确后,据此序列设定基因特异性引物GSP1、NGSP1、GSP2、NGSP2(表1)。随后按照RACE试剂盒进行5′和3′ RACE扩增。将产物经1%琼脂糖凝胶电泳检测,切胶回收并将目的片段连接至PMD19-T simple载体上,转化挑选阳性克隆,送华大基因测序。分析拼接结果,最后得到cDNA序列。
1.2.3 基因结构及序列特征分析 将拼接得到的序列利用ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/ gorf.html)进行ORF预测以及氨基酸序列翻译;在家蚕数据库SilkDB中对全长cDNA进行序列比对,并运用NCBI在线程序Splign(https://www. ncbi.nlm.nih.gov/sutils/splign/splign.cgi?textpage=online&level=form)对基因的外显子和内含子结构进行鉴定分析。从GenBank下载其他物种同源的Cathepsin L基因序列,然后运用clustalx(1.83)和MEGA6.0软件构建进化树。使用SMART(http://smart.embl- heidelberg.de/)、SignalP4.1 Server(http://www.cbs.dtu. dk/services/Signalp/)、TMHMM Server v.2.0(http:// www.cbs.dtu.dk/services/TMHMM-2.0/)、ExPasy(http:// www.expasy.org/tools/)等在线网站预测蛋白结构域、分子量和等电点等信息。
1.2.4 RT-PCR检测目的基因各组织中的表达情况 提取家蚕5龄3 d各组织(血液、马氏管、头、表皮、丝腺等9个组织)的RNA,通过反转录为cDNA,并以此为模板进行PCR扩增,将产物经过以高度保守的序列Actin3(肌动蛋白3)作为内参,用1%琼脂糖凝胶进行电泳,后经EB染色,Bio-Rad凝胶成像系统成像并分析结果。为了更进一步精准地探讨其特异性表达情况,基于半定量检测结果,进行定量PCR(qRT-PCR)试验,经数据分析得出其表达结果。
1.2.5 原核表达及表达载体构建 根据测序结果和比对结果,选择比对后的特异性序列,设计相应带有H I和I酶切位点的引物进行PCR扩增,然后再进行1%琼脂糖检测,将目的片段进行切胶回收,并与pMD-19-Tsimple载体连接并转化、阳性克隆菌的筛选及检测,扩大培养,提取质粒,产物用H I和I进行双酶切,得到目的片段Bm,同时将pET-32、pET-22b和pET-28质粒载体也用同样的酶进行双酶切,得到载体骨架。最后把目的片段和载体连接得pET32-Bm、pET22b-Bm、pET32-Bm重组表达质粒。
1.2.6 菌株转化涂板诱导表达 将连接的pET-28/32/22b-Bm重组质粒2 μL转化Rosetta感受态细胞,37℃,220 r/min条件下振荡培养1 h,后取10 μL菌液+10 μL相应抗生素(载体为pET-32和pET-22b的用氨苄青霉素,载体为pET-28的用卡那霉素)+ 90 μL ddH2O涂板,37℃培养,0.5 h后倒置平板,后37℃过夜培养。挑选单菌落,各载体中各选取两个单克隆斑接入到25—30 mL含有相应抗生素(载体为pET-32和pET-22b的用氨苄青霉素,载体为pET-28的用卡那霉素)的LB液体培养基三角瓶中,37℃,250 r/min条件下扩大培养过夜。设计预试验,探索不同浓度的IPTG和不同温度条件下表达质粒对蛋白表达的影响,进行条件优化,选择最佳的条件进行蛋白诱导。通过条件优化试验,最后选择pET-28-Bm进行诱导,诱导培养温度16℃,IPTG诱导物浓度为0.1 mmol·L-1,220 r/min转速和诱导时间24 h条件下,诱导Bm重组蛋白的表达,以获得较高表达量的目的蛋白。
1.2.7 BmCat L蛋白纯化 按照上述优化条件,将大规模诱导表达的2 L菌液在5 000 r/min,常温条件下离心20 min收菌,倒掉培养基;使用25 mmol·L-1Tris重悬洗涤菌体,4℃,15 000 r/min下离心15 min,弃上清,用25 mmol·L-1Tris重悬菌体;然后将悬于25 mmol·L-1Tris液体中的菌进行高压破碎,4℃,15 000 r/min下离心15 min,分别收集上清和沉淀;5%乙酸、1% Triton以1﹕20的质量体积比洗涤BmCat L蛋白包涵体50 min,高速冷冻离心,分别收集上清和沉淀;5%乙酸、1% Triron X-100重复上一步洗涤沉淀一次;随后用2 mol·L-1尿素、25 mmol·L-1Tris、5 mmol·L-1EDTA洗涤沉淀一次,高速冷冻离心,分别收集上清和沉淀;2 mol·L-1尿素、25 mmol·L-1Tris、5 mmol·L-1EDTA重复上一步洗涤沉淀一次;20 mmol·L-1Tris、0.5 mol·L-1NaCl、50%乙醇,pH 7.0洗涤,高速冷冻离心,分别收集上清和沉淀;20 mmol·L-1Tris、0.5 mol·L-1NaCl、50%乙醇,pH 7.0重复上一步洗涤沉淀一次;用双蒸水洗涤沉淀而去盐,高速冷冻离心,分别收集上清和沉淀;用8 mol·L-1尿素,25 mmol·L-1Tris-HCl,0.3 mol·L-1NaCl, pH 8.0溶解包涵体,调pH至11.5—12.0,搅拌过夜,次日离心(20 000 r/min,30 min),分别收集上清和沉淀;将以上上清pH调回8.0,再用0.22 μm微孔滤膜过滤后备用。最后用Ni+柱(Ni+-NTA)纯化重组蛋白(按照GE公司提供的操作说明进行),收集洗脱液,利用SDS-PAGE分析洗脱蛋白质的组分。
1.2.8 Bm免疫应激检测 为了检测家蚕组织蛋白酶L的免疫应答功能,选择具有致病能力的大肠杆菌作为致病源。利用LB培养基接种大肠杆菌,并经37℃过夜培养后,4℃1 000×离心15 min,然后用1×PBS重悬菌液。取5龄2 d处于盛食的健康家蚕,并将其分为两组,分别向每组中注射10 μL(107CFU/幼虫)的大肠杆菌液和等体积1×PBS缓冲液,分别于0.5、2、6、12、24、48 h后取血,经快速离心,弃去上清,加入1 mL Trizol放于-80℃冰箱冷冻保存,待材料收齐后,取出融化并提取RNA,经反转获得cDNA材料,定量PCR检测其表达水平。
2 结果
2.1 Bm克隆与序列分析
通过PCR技术获得了Bm大片段克隆产物,其大小约为1.6 kb的单带(图1-A);对Bm进行大片段PCR扩增后,对此片段进行切胶回收、T/A克隆,转化并筛选阳性克隆测序,所得结果经比对为Bm大片段。根据Bm大片段序列和巢式PCR原理设计Bm的3′/5′ RACE引物,并进行3′/5′ RACE反应,结果显示3′ RACE后检测有一条条带,大小约为600 bp;5′ RACE后也为一条大小约为700 bp的条带(图1-A)。将RACE产物进行切胶回收,连接T载,转化并挑选阳性克隆进行测序,将结果与Bm大片段进行拼接,获得全长序列。通过比对发现该序列与NCBI数据库预测的序列一致,从而进一步证实Bm的正确性(图1-B)。BmcDNA全长为871 bp,包括24 bp的5′ UTR和160 bp的3′ UTR;该基因由6个外显子和5个内含子组成,全长为4 228 bp,含有完整的开放阅读框,其大小为687 bp(图1-C)。通过将克隆序列在家蚕数据库(SilkDB)中进行比对,结果显示该基因定位于第10号染色体。

表1 家蚕组织蛋白酶L基因引物
GSP: Gene specific primes; NGSP: Nested gene specific primes; Bm-YH引物划线部分为酶切位点,划线后部分序列为oligo序列 Restriction enzyme cutting sites of Bm-YH prime were underlined, followed by Oligo sequence

M:核酸分子量标准DNA molecular weight standards;1:大片段产物The large pieces product;2、3:3′ RACE产物3′ RACE products;4、5:5′ RACE产物5′ RACE products。A:1%琼脂糖分析检测家蚕BmCat L克隆大片段Using 1% agarose to test the clone product of BmCat L;B:1%琼脂糖检测BmCat L全长扩增产物Using 1% agarose to test the PCR amplification of the complete cDNA sequence;C:BmCat L基因组信息分析(黑色框为外显子,折线表示内含子)The structure diagram of the BmCat L (exon and intron were represented by black box and black lines, respectively)
家蚕组织蛋白酶L开放阅读框从ATG开始,终止子为TAA,利用SMART蛋白结构预测和SignalP信号肽预测等在线软件分析其蛋白结构,发现该基因编码的蛋白质存在信号肽,氨基酸从第1—25位是信号肽(图2-A),第26—227位氨基酸区域为保守的Pept_C1结构域(图2-B),属于溶酶体木瓜蛋白C1家族。通过预测,该蛋白质分子量平均大小为26.132 kD,理论等电点为4.57。
2.2 Bm同源进化分析
为了进一步研究Bm与其他物种同源基因在进化上的亲缘关系,对其与其他20种物种的Cathepsin L进行比对,进行聚类分析,并运用MEGA 6.0软件NJ法构建进化树。从进化树来看,共分为两大支。海绵纲的堡礁海绵位于单独一大支,其中家蚕组织蛋白酶L(Bm)与同属鳞翅目的草地贪夜蛾(rd)和黑脉金斑蝶的同源基因()亲缘关系最为相近,而与海绵纲的堡礁海绵和双翅目的果蝇、地中海实蝇等亲缘关系相对较远;通过clustalx(1.83)软件对序列比对分析得知这些物种的氨基酸序列均存在很大的相似度,说明该基因进化过程中的保守性(图3)。

A:家蚕组织蛋白酶L全长cDNA 推导以及氨基酸序列分析(红色方框为信号肽,黑色方框为保守的Pept_C1结构域)The predicted full length cDNA sequence of BmCat Land its amino acids (The signal peptide and Pept_C1 domain were represented by red boxs and black boxs, respectively);B:家蚕组织蛋白酶L结构域预测The protein domains prediction of Bmcat L

图3 家蚕与其他物种Cathepsin L聚类分析
2.3 时空表达分析
通过查询家蚕基因组数据库(http://www.silkdb. org/silkdb)发现,对应的芯片探针号为sw08544和sw17791。通过家蚕基因芯片数据库(http://www.silkdb.org/microarray/)发现,sw08544探针显示,该基因集中表达于头部和血细胞,极少数表达于外表皮和脂肪等,而sw17791探针显示,集中表达于头部和血细胞。由此推测该基因在血细胞和头部具有表达特异性。
为了探索Bm在家蚕各组织的表达情况,运用RT-PCR分析幼虫4龄4 d与5龄3 d血细胞、马氏管、精巢等9种组织表达情况,结果显示Bm在4龄4 d与5龄3 d均表达于血细胞,而其他组织表达均较不显著或者不表达,预测Bm具有血细胞表达特异性(图4-A)。针对此结果,进一步探索该基因在血细胞各时期的表达情况,当PCR循环数为35个时,结果如图4-B,从图中可看出4龄3 d至预蛹1 d血细胞中均有表达,但无明显的表达变化趋势;而当PCR循环数为25个时,4龄3 d至预蛹1 d Bm均有表达,但随龄期的变化呈规律性变化。基于在血细胞表达特异性,针对其在各组织和各龄期进行qRT-PCR检测,结果显示家蚕仍在血细胞居高表达,而在头部次之(图4-C),与数据库(silkDB)预测结果相似。而4龄2 d至PP2时期,Bm表达水平呈现波折性变化(图4-D),与RT-PCR结果相似。推测这可能与家蚕变态发育过程中血淋巴随龄期的变化有关。
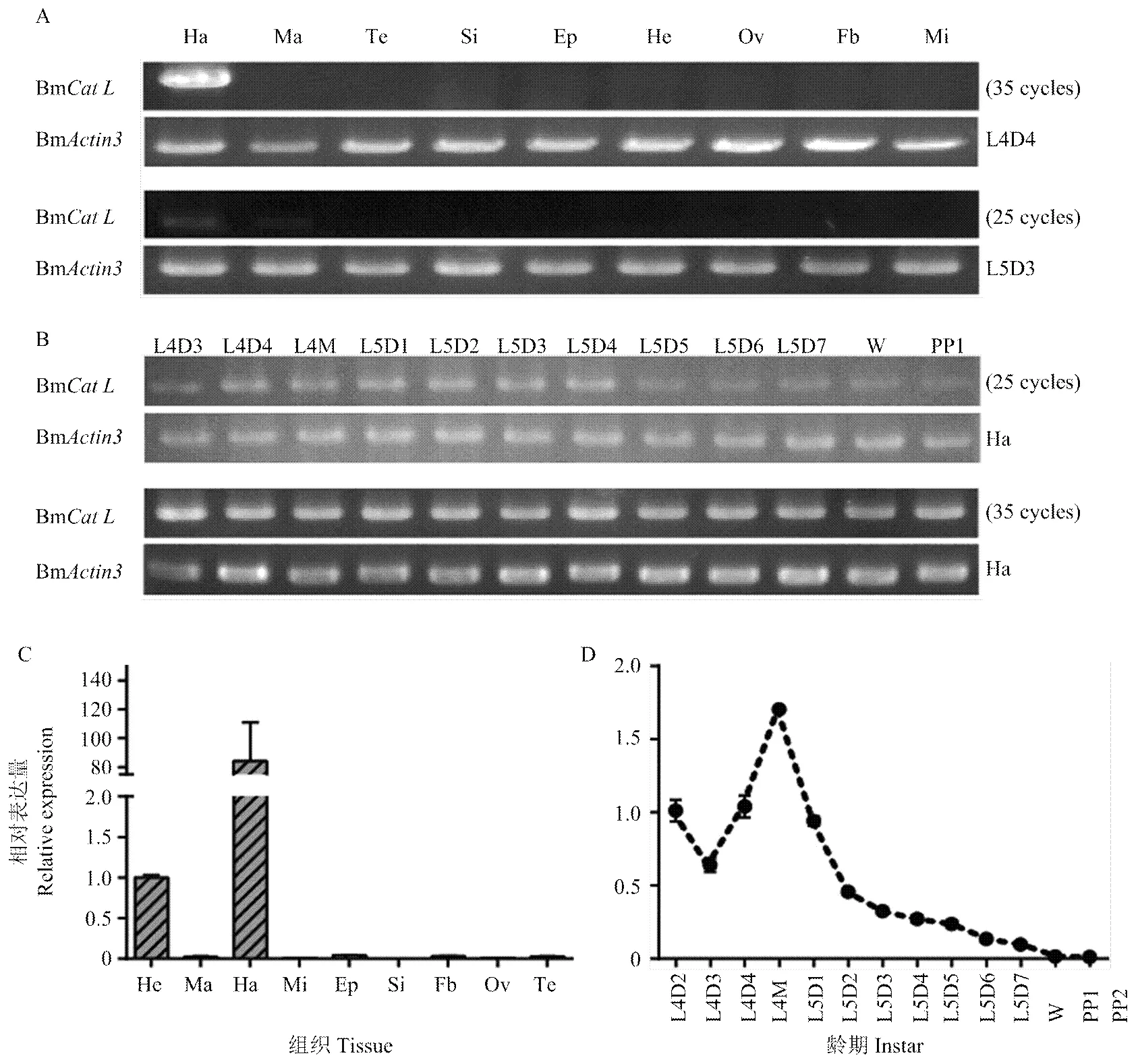
A:RT-PCR检测BmCat LmRNA在4龄4 d和5龄3 d各组织表达情况the expression of BmCat L mRNA in different tissues of the 4th day of 4th and 3rd day of 5th larvae tested by RT-PCR。Ha:血细胞haemocyte;Ma:马氏管malpighian tubules;Te:精巢testis;Si:丝腺silk gland;Ep:表皮epidermis;He:头部head;Ov:卵巢ovary;Fb:脂肪体fat body;Mi:中肠midgut;B:RT-PCR检测BmCat L mRNA在4龄3 d起至预蛹1 d血细胞中表达情况The expression of BmCat L mRNA in haemocyte from the molting period of the 3rd day of 4th instar larvae to the 1st day prepupa tested by RT-PCR;C:qRT-PCR分析BmCat L在4龄4 d各组织表达情况the expression of BmCat L in different tissues of the 4th day of 4th larvae analyzed by qRT-PCR;D:qRT-PCR分析BmCat L在4龄2 d至预蛹2 d mRNA表达情况The mRNA expression of BmCat L from the 2nd day of 4th instar larvae to the 2nd day of prepupa analyzed by qRT-PCR
2.4 原核表达及蛋白纯化
根据Bm全长序列以及BmCat L蛋白亲水性在线软件分析,选取该基因ORF序列(除信号肽外的部分)设计特异性原核表达引物Bm-YH(表1),通过PCR得到一条长约为640 bp的目的DNA片段,将该片段测序,比对无误后连接于H I和I酶切处理的pET-28原核表达载体,得到Bm-pET-28重组质粒(图5-A)。再经双酶切检测,显示得到一条约为630 bp的片段(图5-A),与预期结果相符,表明重组质粒构建成功。转化至Rosseta感受态菌株,经多次条件试验检测,得到16℃时,IPTG终浓度为0.1或0.2 mmol·L-1,220 r/min摇菌转速下诱导20 h后,可在破菌后的包涵体中获得高表达量的目的蛋白,经过15% SDS-PAGE电泳检测,结果如图5-B箭头所指。为了更进一步验证纯化过程中目的蛋白去向,分别检测了纯化过程中各个阶段的蛋白收集品,结果如图5-C所示,由于原核表达载体自带His-Tag,所以为了进一步验证原核表达产物为目标蛋白,运用His抗体进行Western blot杂交试验验证,得到一条清晰可见、大小约为30 kD的目标蛋白条带(图5-D)。最后,经蛋白浓缩超滤膜用聚乙二醇浓缩后,得到了较为纯净的蛋白样品。

A:pET-28-BmCat L原核表达载体的构建The construction of the PET-28-BmCat L plasmid;M:核酸分子量标准DNA marker;1:pET-28空质粒检测结果pET-28-plasmid;2:BmCat L扩增产物PCR product of BmCat L;3:pET-28-BmCat L质粒pET-28-BmCat L plasmid;4:pET-28-BmCat L质粒酶切验证The restriction enzyme digestion analysis of pET-28-BmCat L plasmid。B:16℃,IPTG浓度梯度下诱导20 h,pET-28-BmCat L的表达情况The expression of BmCat L plasmid were induced 20 h through different concentrations of IPTG at 16℃;M:彩色预染蛋白Marker Prestained color protein Marker;1、2:非诱导上清、沉淀Non-IPTG induced supernatant/sediment;3、4:0.05 mmol·L-1 IPTG诱导上清、沉淀0.05 mmol·L-1 IPTG induced supernatant/sediment;5、6:0.1 mmol·L-1 IPTG诱导上清、沉淀0.1 mmol·L-1 IPTG induced supernatant/sediment;7、8:0.2 mmol·L-1 IPTG诱导上清、沉淀0.2 mmol·L-1 IPTG induced supernatant/sediment。C:16℃,0.1 mmol·L-1 IPTG条件诱导20 h,包涵体的His-镍柱纯化结果检测The result detection of the purified inclusion body after being induced 20 h by 0.1 mmol·L-1 IPTG at 16℃;M:彩色预染蛋白Marker Prestained color protein Marker;1:穿透液Flowthrough;2:复平衡Rebalance;3:40 mmol·L-1咪唑40 mmol·L-1 imidazole;4:60 mmol·L-1咪唑60 mmol·L-1 imidazole;5:100 mmol·L-1咪唑(洗脱峰1)100 mmol·L-1 imidazole (eluting peak 1);6:100 mmol·L-1咪唑(洗脱峰2)100 mmol·L-1 imidazole (eluting peak 2);7:200 mmol·L-1咪唑(洗脱峰1)200 mmol·L-1 imidazole (eluting peak 1);8:200 mmol·L-1咪唑(洗脱峰2)200 mmol·L-1 imidazole (eluting peak 2);9:200 mmol·L-1咪唑(洗脱峰3)200 mmol·L-1 imidazole (eluting peak 3);10:200 mmol·L-1咪唑(洗脱峰4)200 mmol·L-1 imidazole (eluting peak 4);11:浓缩后的蛋白泳道The protein after concentrated。D:运用His抗体通过Western blot检测纯化后的家蚕组织蛋白酶L Using His antibody to detect the purified protein by western blot;1、2:均为纯化后的蛋白样品Both 1 and 2 were protein samples
2.5 免疫应激检测
为了检测BmCat L在免疫应答中的作用,通过向5龄2 d处于盛食期的家蚕注射大肠杆菌和等体积的1×PBS,然后分别于不同时间点取血,待材料收齐后提取mRNA,经反转录获得其cDNA,以1×PBS 组为对照组,qRT-PCR检测其mRNA表达水平,结果如图6所示。从图中可以看出,对照组中,BmmRNA表达水平基本保持不变;而试验组中,其mRNA的变化在短时间内呈上升的趋势,在12 h达到一个峰值,随后又下降至一个常规水平。
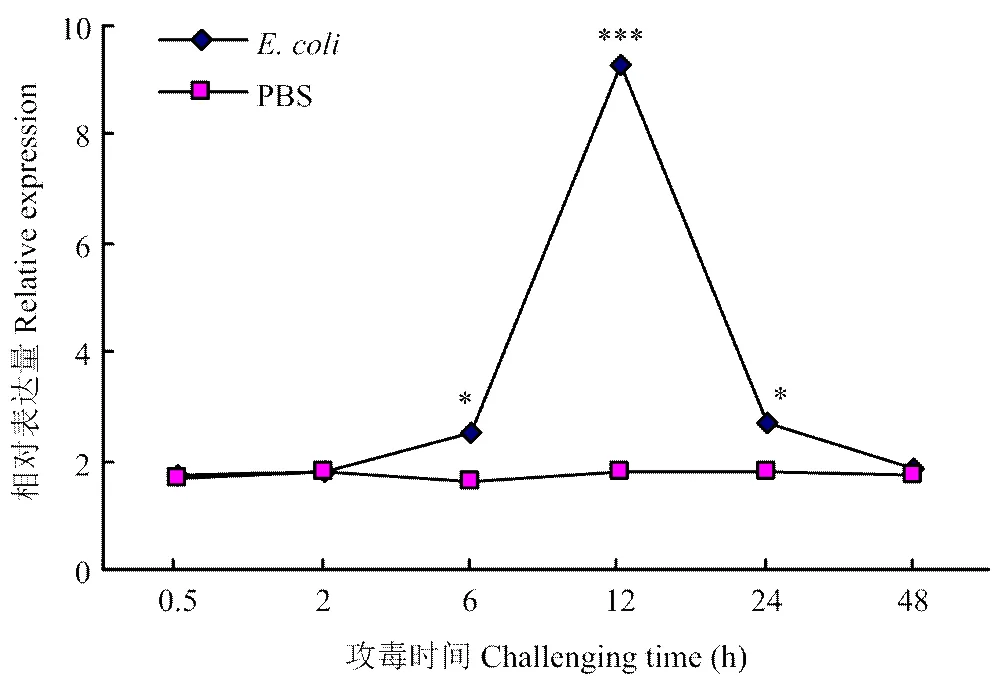
t检验Student’s t-test:*P<0.05; **P<0.01; ***P<0.001
3 讨论
已有研究报道,组织蛋白酶L对细胞凋亡[27]、生物免疫等均有重要作用,随着生物技术的发展,研究者们投入了更多精力研究细胞凋亡以及免疫相关的机制,以期开发新的药物和疾病治疗手段;近年来发现溶酶体也与细胞凋亡有着密不可分的关系,而目前关于溶酶体与细胞凋亡的关系研究最多的是溶酶体中的组织蛋白酶,组织蛋白酶L也参与了相关的细胞凋亡过程。也有研究表明在T细胞的分选过程中组织蛋白酶L扮演着十分重要的角色。在细胞进行内吞作用时,组织蛋白酶L可将MHCⅡ分子的恒定链迅速降解,然而降解下来的多肽始终会与MHCⅡ相结直到在分子伴侣H-2M的协同下才会分离[28]。Hou等[29]研究发现,组织蛋白酶L也会通过调节辅助T细胞Th17的分化从而间接地调控生物体的免疫作用;此外,在昆虫的生长发育过程中,组织蛋白酶也起着极其重要的作用,组织蛋白酶作为重要的蛋白水解酶类,在线虫、果蝇、棉铃虫、家蚕、二化螟等无脊椎动物中均检测到了组织蛋白酶的表达。目前为止,关于哺乳动物组织蛋白酶的研究已相当深入,而对于昆虫组织蛋白酶的研究仍暂处于滞后阶段。
通过检索NCBI数据库和家蚕基因资源库,发现生物体普遍存在组织蛋白酶L。利用家蚕大造P50品种作为试验材料,通过RACE和PCR技术成功获得其全序列片段的克隆。为了探索组织蛋白酶L在家蚕中的作用,本研究检测了Bm在幼虫4龄4 d与5龄3 d血细胞、马氏管、精巢等9种组织中的表达情况,发现其在家蚕血细胞、头部、外表皮等均有表达,尤其在血细胞中表达值得注意,预测这种特异性的表达与家蚕血液系统的某些相关功能存在着不可分割的联系。通过大肠杆菌添毒免疫应激检测,初步推论出BmCat L在家蚕血液免疫系统中的关联作用。有研究显示,组织蛋白酶L的功能行驶往往伴随着其他组织蛋白酶的作用而进行,Shiba等[30]研究发现,在家蚕化蛹期丝腺和脂肪体进行组织溶解时,组织蛋白酶B伴随组织蛋白酶L一起表达,而参与到细胞的程序性死亡过程中去,在蛹期之后,幼虫的脂肪体和肠道会被组织溶解以便形成成虫的脂肪体,而在这其中,天冬氨酸组织蛋白酶D会伴随着组织蛋白酶B在5龄幼虫的脂肪体和蛹的肠道中大量表达[31]。因此,可以推测家蚕组织蛋白酶L与家蚕变态发育各龄期蜕皮化蛹也有关。
4 结论
从家蚕大造P50品种中克隆得到了家蚕组织蛋白酶L基因(Bm)的cDNA全序列,基因开放阅读框全长687 bp,编码228个氨基酸。表达分析显示该基因特异性高表达于家蚕血细胞。通过原核表达和蛋白纯化,成功获得了该基因较高纯度的重组蛋白。利用大肠杆菌刺激幼虫能够显著上调该基因的表达量,由此推测组织蛋白酶L可能参与家蚕免疫反应。
References
[1] Fabien L, Jadwiga K, Dieter B. Human and parasitic papain- like cysteine proteases: their role in physiology and pathology and recent developments in inhibitor design.,2002, 102(12): 4459-4488.
[2] ZHANG Q, HAN M, WANG W, SONG Y, CHEN G, WANG Z, LIANG Z. Downregulation of cathepsin L suppresses cancer invasion and migration by inhibiting transforming growth factor‑‑mediated epithelial‑mesenchymal transition., 2015, 33(4): 1851-1859.
[3] Shen J D, Cai Q F, Yan L J, Du C H, Liu G M, Su W J, Ke C, Cao M J. Cathepsin L is an immune-related protein in Pacific abalone ()-Purification and characterization., 2015, 47(2): 986-995.
[4] Lefebvre C, Vandenbulcke F, Bocquet B, Tasiemski A, Desmons A, Verstraete M, Salzet M, Cocquerelle C. Cathepsin L and cystatin B gene expression discriminates immune cœlomic cells in the leech., 2008, 32(7): 795-807.
[5] Dixit A K, Dixit P, Sharma R L. Immunodiagnostic/protective role of Cathepsin L cysteine proteinases secreted by., 2008, 154(3/4): 177-184.
[6] Santana B G, Dalton J P, Camargo F V, Parkinson M, Ndao M. The diagnosis of human fascioliasis by enzyme-linked immunosorbent assay (ELISA) using recombinant Cathepsin L protease., 2013,7(9): e2414.
[7] Wang W, Long L, Wang L, Tan C, Fei X, Chen L, Huang Q, Liang Z. Knockdown of Cathepsin L promotes radio sensitivity of glioma stem cells bothand., 2016, 371(2): 274-284.
[8] Turk V, Turk B, Gunčar G, Turk D, Kos J. Lysosomal cathepsins: Structure, role in antigen processing and presentation, and cancer., 2002, 42(1): 285-303.
[9] Berdowska I. Cysteine proteases as disease markers., 2004, 342(1/2): 41-69.
[10] KAGEYAMA T, TAKAHASH1 S Y. Purification and characterization of a cysteine proteinase from silkworm eggs., 1990, 193(1): 203-210.
[11] Yamamoto Y, Takimoto K, Izumi S, Toriyama-Sakurai M, Kageyama T, Takahashi S Y. Molecular cloning and sequencing of cDNA that encodes cysteine proteinase in the eggs of the silkmoth,.1994, 116(6): 1330-1335.
[12] Shiba H, Uchida D, Kobayashi H, Natori M. Involvement of cathepsin B- and L-like proteinases in silk gland histolysis during metamorphosis of., 2001, 390(1): 28-34.
[13] Saikhedkar N, Summanwar A, Joshi R, Giri A. Cathepsins of lepidopteran insects: Aspects and prospects., 2015, 64: 51-59.
[14] He H J, Wang Q, Zheng W W, Wang J X, Song Q S, Zhao X F. Function of nuclear transport factor 2 and Ran in the 20E signal transduction pathway in the cotton bollworm,.,2010, 11: 1.
[15] 苏晶晶, 陈思源, 张奎, 余霜, 李钰添, 梁航华, 赵羽卒, 晁会娟, 崔红娟. 家蚕组织蛋白酶O (BmCatO) 基因鉴定及表达分析. 中国农业科学, 2015, 48(22): 4564-4573.
SU J J, CHEN S Y, ZHANG K, YU S, LI Y T, LIANG H H, ZHAO Y Z, CHAO H J, CUI H J. Identification and expression analysis of Cathepsin O gene in silkworm ()., 2015, 48(22): 4564-4573. (in Chinese)
[16] 张新刚, 于小华, 王时俊, 李双杰,李高平, 陈瑞珍, 杨英珍. 扩张型心肌病心肌组织中组织蛋白酶L与心功能的关系. 中国临床医学, 2005, 12(4): 566-568.
ZHANG X G, YU X H, WANG S J, LI S J, LI G P, CHEN R Z, YANG Y Z. Relationship between Cathepsin L and dilated cardiomyopathy.,2005, 12(4): 566-568. (in Chinese)
[17] 杜九中, 于小华, 吕建华, 邓晖, 李双杰, 赵刚, 赵新刚, 王时俊, 陈瑞珍, 杨英珍. 溶酶体组织蛋白酶 L在小鼠病毒性心肌炎心肌组织中表达及意义. 临床儿科杂志, 2005, 23(6): 388-390.
DU J Z, YU X H, LÜ J H, DENG H, LI S J, ZHAO G, ZHAO X G, WANG S J, CHEN R Z, YANG Y Z. The expression and significance of lysosome cathepsin L in the cardiac tissue of viral myo-carditis in mice., 2005, 23(6): 388-390. (in Chinese)
[18] 王峻, 刘颖娴, 李向平, 彭道泉, 谭峥, 刘鸿敏, 秦英楠, 薛彦琼. 组织蛋白酶L与冠心病及其危险因素的相关性. 中南大学学报 (医学版), 2009, 34(2): 130-134.
WANG J, LIU Y X, LI X P, PENG D Q, TAN Z, LIU H M, QIN Y N, XUE Y Q. Association of cathepsin L with coronary heart disease and its risk factors., 2009, 34(2): 130-134. (in Chinese)
[19] Kitamoto S, Sukhova G K, Sun J, Yang M, Libby P, Love V, Duramad P, Sun C, Zhang Y, Yang X, Peters C, Shi G P. Cathepsin L deficiency reduces diet-induced atherosclerosis in low-density lipoprotein receptor-knockout mice., 2007, 115(15): 2065-2075.
[20] Kos J, Lah T T. Cysteine proteinases and their endogenous inhibitors: target proteins for prognosis, diagnosis and therapy in cancer (review)., 1998, 5: 1349-1361.
[21] Tagami K, Kakegawab H, Kamioka H, Sumitani K, Kawataa T, LenarEiE B, Turk V, Katunumab N. The mechanisms and regulation of procathepsin L secretion from osteoclasts in bone resorption., 1994, 342(3): 308-312.
[22] Fagotto F, Maxfield F R. Yolk platelets inmaintain an acidic internal pH which may be essential for sodium accumulation., 1994, 125(5): 1047-1056.
[23] Chauhan S S, Goldstein L J, Gottesman M M. Expression of cathepsin L in human tumors., 1991, 51(5): 1478-1481.
[24] Fröhlich E, Schlagenhauff B, Möhrle M, Weber E, Klessen C, Rassner G. Activity, expression, and transcription rate of the cathepsins B, D, H, and L in cutaneous malignant melanoma., 2001, 91(5): 972-982.
[25] Kageshita T, Yoshii A, Kimura T, Maruo K, Ono T, Himeno M, Nishimura Y. Biochemical and immunohistochemical analysis of cathepsins B, H, L and D in human melanocytic tumours., 1995, 287(3/4): 266-272.
[26] Lah T T, Calaf G, Kalman E, Shinde B G, Somers R, Estrada S, Salero E, Russo J, Daskal I. Cathepsins D, B, and L in transformed human breast epithelial cells.,1996, 39(2): 221-233.
[27] Yang C, Lin X W, Xu W H. Cathepsin L participates in the remodeling of the midgut through dissociation of midgut cells and activation of apoptosis via caspase-1., 2017, 82: 21-30.
[28] Wolf P R, Ploegh H L. How MHC class II molecules acquire peptide cargo: biosynthesis and trafficking through the endocytic pathway., 1995, 11: 267-306.
[29] Hou L, Cooley J, Swanson R, Ong P C, Pike R N, Bogyo M, Olson S T, Remold-O’Donnell E. The protease cathepsin L regulates Th17 cell differentiation., 2015, 65: 56-63.
[30] Shiba H, Uchida D, Kobayashi H. Involvement of Cathepsin B- and L-Like proteinases in silk gland histolysis during metamorphosis of., 2001, 390(1): 28-34.
[31] Lee K S, Bo Y K, Choo Y M. Expression profile of cathepsin B in the fat body ofduring metamorphosis., 2009, 154(2): 188-194.
(责任编辑 岳梅)
Identification, Expression, and Functional Analysis ofin Silkworm ()
PAN GuangZhao, ZHANG Kui, LI ChongYang, ZHAO YuZu, SHEN Li, XU Man, SU JingJing, LIN Xi, CUI HongJuan
(State Key Laboratory of Silkworm Biology, Southwest University, Chongqing 400716)
【Objective】The objective of this study is to identify and clone the Bm(Bm) from silkworm (), investigate its sequence features and expression profiles, and to clarify the response of Bmunderstimulate in. Results of the study will provide a theoretical basis for further studying the function of Bmin.【Method】The primers was designed based on the sequence of BGIBMGA006893 in SilkDB database. The full length cDNA of Bmwas acquired by RACE (rapid-amplification of cDNA ends) technology. The protein structure and molecular weight waspredicted online. About the homologous sequences of Cathepsin L from other species were downloaded from NCBI, and the deduced amino acid sequence of putative Bmwas aligned using the Clustal X (1.83) software, phylogenetic tree was constructed using MEGA 6.0. Its expression profile was performed by RT-PCR and qRT-PCR. Specific primers were designed to amplify the high specificity fragment, and then the PCR product was ligated to the PET-28 vector, which was transformed into RosettaThe recombinant protein was induced by IPTG and purified by Ni+affinity chromatography. Finally, the immune response was challenged byIts relative mRNA level was detected by qRT-PCR.【Result】Bmwas clustered on nscaf2860 which was located on chromosome 10, and the gene number in silkDB was BGIBMGA006893. Full length of its ORF is 687 bp, encoding 228 amino acids, there is a conservative Pept_C1 domain structure. The molecular weight and isoelectric point of the deduced protein is 26.132 kD and 4.57, respectively. Phylogenetic analysis showed that it is close to its homologous protein fromandRT-PCR results showed that Bmwas specifically and highly expressed in haemocyte. The recombinant protein of Bmwas produced and purified, and finally verified by His-antibody. The immune challenge experiments results revealed the relationship between Cathepsin L gene and its immune system in.【Conclusion】 TheBmcDNA was cloned. It was specific highly expressed in haemocytes. The recombinant proteins were obtained through prokaryotic expression and protein purification. More importantly, the expression of Bmwas significantly increased after treating within haemocytes. It is speculated that Bmmight be involved in the immune response of.
Bm;; gene cloning; prokaryotic expression; protein purification; immune challenge
2017-03-07;接受日期:2017-04-26
国家自然科学基金(31672496)、重庆自然科学基金(cstc2016jcyjA0425)、重庆高校创新团队建设计划(CXTDX201601010)
潘光照,Tel:023-68251712;E-mail:m18983708534_2@163.com。张奎,E-mail:zhangk87@163.com。潘光照和张奎为同等贡献作者。通信作者崔红娟,Tel:023-68251713;E-mail:Hongjuan.cui@gmail.com;hcui@swu.edu.cn
