固相碳源脱氮同步去除壬基酚的试验研究
2017-10-13孙佳宁吴为中
王 婷,孙佳宁,吴为中
固相碳源脱氮同步去除壬基酚的试验研究
王 婷,孙佳宁,吴为中*
(北京大学环境科学与工程学院,北京100871)
采用一种基于PHBV研发的新型固相碳源NS,构建同步硝化反硝化脱氮生物反应器,同时探究常见的内分泌干扰物壬基酚(NP)在系统中的同步去除特性,并运用IlluminaMiSeq高通量测序和荧光定量PCR(qPCR)技术,对微生物群落进行解析.反应器运行效果良好,硝酸盐氮和氨氮去除率可分别达到96.18%和82.54%,出水COD平均浓度为27.48mg/L,壬基酚平均去除率为81.17%.高通量测序结果表明,(脱氯单胞菌属)和(动胶菌属)等报道的具脱氮作用的菌属在无壬基酚条件下占据优势地位.加入壬基酚的条件下,菌种总数和多样性降低.荧光定量PCR结果表明,系统中氮循环基因丰度较高,基因丰度最大,而基因丰度最低.进水中存在壬基酚的条件下碳源表面基因丰度较低.
固相碳源;同步硝化反硝化;壬基酚;微生物群落结构;功能基因
水体富营养化是我国亟待解决的重大环境问题之一.2015年《中国环境状况公报》显示,在开展营养状态监测的61个湖泊(水库)中,有14个湖泊呈轻度和中度富营养状态[1],而氮、磷等营养元素的过量输入是导致水体富营养化的重要原因.我国污水处理厂出水氮素不达标现象普遍存在,这加剧了地表受纳水体的富营养化风险.除氮素外,内分泌干扰物(EDCs)污染的日益加重也引起了社会的广泛关注[2].其中壬基酚(NP)是一类有代表性的环境内分泌干扰物,主要来自洗涤纺织等行业中使用的表面活性剂壬基酚聚氧乙烯醚(NPEO)的分解[3].研究表明,壬基酚可促使雄性鱼和蟾蜍表现出雌性特征[4],具有显著雌激素效应和生物毒性,被联合国环境保护署(UNEP)确定为27种优先控制的持久性有毒污染物之一[5].上海污水处理厂受纳水体中壬基酚浓度在41.1~370.0ng/L之间,而出水壬基酚浓度达到125~1140ng/L,显著高于地表水浓度[6].
因此实现对污水处理厂出水的同步深度脱氮和壬基酚等内分泌干扰物的去除具有十分重要的意义.
可生物降解聚合物作为一种新型外加固相碳源在脱氮工艺中的应用已被广泛研究,相较于传统液体碳源,固相碳源具有无毒无害和缓释有机物的特性,可有效控制碳源过量和二次污染,同时可以作为反硝化生物膜的优良载体[7-9].国内外学者在以天然纤维素或高分子聚合物为固相碳源的脱氮系统中探究了五氯酚[10],氯吡硫磷,氯氰菊酯[11]和对氯苯酚[12]等农药的去除特性,发现农药的去除过程中吸附和生物降解作用同时存在,5mg/L氯酚类农药去除率约为45%[10].目前利用固相碳源脱氮系统同步脱氮和去除壬基酚的研究鲜有报道.
本研究采用基于PHBV研发的新型固相碳源NS,构建微曝气条件下的同步硝化反硝化生物反应器,并探究了固相碳源脱氮系统中壬基酚的同步去除效果.运用Illlumina高通量测序技术和荧光定量PCR技术,解析系统中微生物群落组成和氮循环基因丰度,探究有无壬基酚的情况下菌群和基因丰度的差异.本研究可为污水处理厂深度脱氮技术改造提供理论依据与技术指导.
1 材料与方法
1.1 生物反应器的构建、驯化与运行
生物反应器采用上流式,主要部分为有机玻璃制成的圆柱体,内径5cm,出水口距反应器底部45cm.将基于PHBV研发的新型固相碳源NS和生物陶粒共混作为填料,按体积比1:3混合填充,填充高度为24cm.试验所用接种活性污泥取自清华大学中水站回流污泥池,具有较好的脱氮性能.静态驯化1~2周后,开始连续流实验.进水采用人工配水,NH4+-N、NO3--N和PO43--P浓度分别为5,10和3mg/L.使用甲醇溶液将4-壬基酚标准物配置成500mg/L的储备液,贮藏于-20℃,间隔3周更换储备液.在第113d开始加入壬基酚,进水壬基酚初始浓度为0.5mg/L,第155d提高至1mg/L,第196d提高至2mg/L.进水箱和反应器均用锡纸包裹以避免光的干扰作用.维持水力停留时间(HRT)为2h,总氮容积负荷为180gN/(m3·d),壬基酚容积负荷分别为6、12、24gNP/(m3·d),温度(28±2)℃,曝气量控制在3~ 5mL/min.装置如图1所示.
1.进水箱;2.蠕动泵;3.填料(固相碳源NS与陶粒按体积比1:3混合);4.生物反应器;5.气泵;6.出水箱
1.2 水质分析方法
反应器连续运行期间,定期取反应器进出水过0.45μm滤膜后,测定氨氮、硝酸盐氮和COD浓度.氨氮、硝酸盐氮根据国环保局发布的标准方法,分别采用紫外分光光度法检测(岛津,UV- Vis2401紫外-可见分光光度仪),COD采用快速消解法比色法测定(WTW, phtoLad S6, CR3200).反应器溶解氧及温度使用便携式溶氧仪测定(WTW,AM39).
壬基酚(4-NP)标准物购于Adamas公司.反应器进、出水中壬基酚采用固相萃取法(SPE)提取,采用SPE固相萃取装置(SUPELCO公司)和HLB固相萃取小柱(博纳生物,6mL,500mg).取水样500mL过0.45μm滤膜待测.依次用3mL二氯甲烷、3mL甲醇和3mL超纯水活化HLB小柱,然后以3mL/min流速使水样通过HLB小柱,再用6mL超纯水淋洗,减压抽干30min,最后用10mL二氯甲烷分两次洗脱,洗脱液在40℃以下用氮气吹干,用1mL流动相定容,过0.22μm滤膜到进样小瓶中待测[13].
壬基酚采用高效液相色谱串联紫外检测器(HPLC-UV,岛津公司,10-ADVp)测定,所采用的液相色谱柱为迪马公司树脂反相色谱柱(250mm×4.6mm×5μm),流动相采用甲醇-水(体积比89:11),流速1mL/min,紫外检测波长225nm,柱温35℃,进样量20μL[14].出峰时间7.7min,回收率113%.
1.3 Illumina高通量测序分析和荧光定量PCR
在壬基酚加入之前反应器稳定运行的第96d,以及壬基酚加入之后的稳定运行时期、全过程第226d,分别从反应器底部随机取一定质量的固相碳源和生物陶粒,超声震荡后悬浊液过0.22μm滤膜.将滤膜剪碎,使用微生物DNA提取试剂盒(博彩生物,上海)提取DNA.高通量测序及初步分析由北京美吉桑格生物医药科技有限公司完成,以16srRNA基因V3~V5区作为测序段,引物为515F(5‘-GTGCCAGCMGCCGCGG-3’)和907R (5‘-CCGTCAATTCMTTTRAGTTT-3’),在0.03水平进行OTU聚类和物种分类分析.基于16s rRNA基因和氮循环基因基因进行荧光定量PCR实验,由微基生物(上海)有限公司完成,引物信息如表1所示.
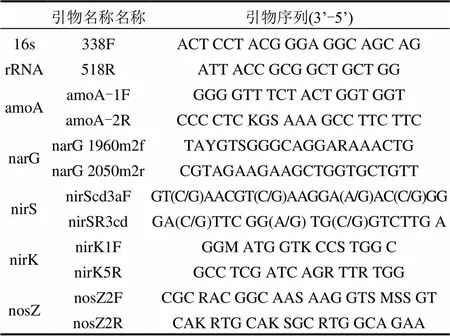
表1 荧光定量PCR引物名称及序列
水质部分及荧光定量PCR部分数据统计分析采用软件SPSS.18.0.Illumina高通量测序部分物种总数及多样性指数分析采用PAST 3.0分析.
2 结果与讨论
2.1 同步硝化反硝化脱氮效果
反应器硝酸盐氮去除情况如图2(a)所示.反应器启动较快,运行过程中硝酸盐氮去除率较高且稳定.平均进水浓度为(11.49±1.22) mg/L,出水浓度为(0.44±0.64)mg/L,平均去除率为(96.18± 5.63)%.由图2(a)可见,反应器开始运行到第50d,硝酸盐氮去除率在90%~100%之间波动,50~70d基本稳定在95%以上.在第105~142d内,硝酸盐氮去除率再次出现轻微波动,可能是因为第113d壬基酚加入后,反硝化作用受到了轻微的影响.此后经过一段时间的适应,硝酸盐氮去除率恢复稳定.加入壬基酚之前和之后的稳定阶段硝酸盐氮去除率无显著差异(独立样本检验,>0.05),表明加入壬基酚并没有对反硝化过程造成明显影响.
氨氮去除效果如图2(b)所示.全过程氨氮平均进出水浓度分别为(5.13±0.37)mg/L和(1.14±1.07)mg/L.相较于硝酸盐氮去除率,氨氮去除率较低且波动较大,平均去除率为(82.54± 15.35)%.在反应器运行初期,硝化功能启动较慢,氨氮去除率波动明显,连续运行50d后才逐渐趋于稳定.在113d加入0.5mg/L壬基酚之后,氨氮去除率出现了明显波动.此后较长一段时间内未恢复,可能是受到壬基酚的影响较为明显.当壬基酚浓度继续提高至2mg/L时,氨氮去除率再次产生波动.随着运行时间的增加,硝化性能逐渐得到恢复.
影响氨氮去除率的因素包括溶解氧和壬基酚的加入等.充足的溶解氧是硝化反应进行的必要条件.杨飞飞探究了以PHBV/PLA共混高聚物为固相碳源的同步硝化反硝化系统运行效果,平均溶解氧为3.18mg/L,HRT为4h,硝酸盐氮去除率为68.1%[15].Chu等[16]在以PCL为碳源的同步硝化反硝化系统中将溶解氧控制在2.7~3.7mg/L之间,获得较好的氨氮去除效果.本实验将反应器溶解氧均值控制在2.13mg/L左右,反硝化效果十分稳定,但硝化效果受到轻微影响,且启动较慢,说明较低的DO对氨氮去除存在一定影响.当系统中COD过高时,好氧异养菌会同氨氧化菌竞争氧气,从而抑制硝化作用.
Stasinakis发现壬基酚对活性污泥中自养菌有一定的毒性效应,可能抑制自养菌对氨氮的利用,造成污水处理系统氨氮处理效率的降低[17].另有研究证实,0.5mg/L的壬基酚即可对氨氮的转化速率产生影响[18],但也有研究发现壬基酚浓度为10mg/L时才对氨氮的去除率产生轻微影响[19],这说明不同系统中不同的氨氧化菌和硝化菌群落对壬基酚有不同的耐受力.本研究中低浓度壬基酚的加入对氨氮去除率造成了短期影响,但一段时间后即可恢复.加入壬基酚前后稳定运行状态下的氨氮去除率并无显著差异(独立样本检验,>0.05),说明本研究中壬基酚的加入对氨氮去除没有长期的显著影响.
2.2 出水COD浓度变化情况
全程COD变化如图3所示.反应器运行前期,COD浓度较高,70d之后基本稳定在50mg/L以下.由于固相碳源被微生物消耗,反应器运行中期补充碳源至最初体积比例,待系统稳定后继续监测COD,其浓度始终稳定在50mg/L以下.全过程COD均值为(27.48±13.28)mg/L,稳定期间偶尔的过度释碳可能是反应器反冲洗不及时所导致.COD在第一阶段呈现先上升后下降的状态,与杨飞飞[20]及Shen等[21]的研究结果相同.在反应器运行初期,固相碳源降解菌处于驯化阶段,降解速率慢,出水COD较低.随着菌群的丰富,异养菌对固相碳源的降解速率增加,未被完全利用的有机物随着出水排出,导致COD增加.此后,固相碳源外层疏松的易降层被降解完全,其降解速率和降解产物的利用速率达到了一定的平衡,出水COD也随之下降并稳定.壬基酚加入前后稳定运行阶段,COD无显著差异(独立样本检验,>0.05).
2.3 壬基酚去除效果
壬基酚进水浓度和去除率如图4所示,第113d进水壬基酚0.5mg/L,第155d浓度升至1mg/L,196d升至2mg/L.初次测定时平均去除率为48.9%左右,此后去除率有所提升.提高进水壬基酚浓度后首次测定时去除率降低,随后随着反应器的持续运行而回升.全程壬基酚平均去除率为81.17%.不同壬基酚初始浓度下,去除率没有显著差异(one-way anova方差分析,>0.05).
壬基酚在不同工艺条件下的去除效果存在较大差异.戴玉女等[22]采用自然曝气生物滤床去除二级污水处理厂尾水中的内分泌干扰物,氨氮和壬基酚负荷分别为1.28gNP/(m3·d)和0.046gNP/(m3·d),去除率分别达到77%和63%.相比之下本研究可以在高负荷条件下获得更高的去除率.国外学者在曝气生物填充床和序批膜生物反应器中也实现了高效率的壬基酚去除[23-24].Su等[25]发现易降解有机物可与壬基酚产生竞争机制,从而抑制壬基酚的生物转化效率.但本研究在添加了易生物降解固相碳源的条件下,仍然获得了较高的壬基酚去除率.根据Rojas的综述可知,壬基酚被USEPA定义为可生物降解物质,在实验室规模研究中的去除率最高可达99%[26],在本实验中也获得了较高的去除率,表明固相碳源并未对壬基酚的生物降解过程产生明显影响.
2.4 系统填料表面微生物群落组成分析
通过Illumina高通量测序,获取了壬基酚加入前(96d)和加入后(223d)固相碳源和陶粒表面生物膜微生物群落结构特征.属分类水平下的微生物群落结构如图5所示,图中样品NS_0, C_0分别代表未加入壬基酚时新型碳源NS和陶粒ceramsite,样品NS_1,C_1分别代表加入壬基酚时新型碳源和陶粒.在4个样品中丰度均低于5%的属已合并为OTHERS在图中显示.未加入壬基酚时,系统中的优势菌属有(脱氯单胞菌属)、(红环菌科)、(动胶菌属)以及(生丝单胞菌科).属常在脱氮除磷系统中被发现,可以硝酸盐氮为电子受体矿化芳香族化合物,是典型的脱氮菌[27-29].中的许多菌属同样具有反硝化功能[30],且可能具有基因[31].属于一类贫营养条件下生长的好氧反硝化菌,因此多附着在生物陶粒表面.菌属携带和基因,具有好氧反硝化功能,并且对氨氮的去除也有贡献[32].多个属具有反硝化功能,且通常在贫营养和高溶解氧的条件下生存[33],此多聚集在陶粒表面.
存在壬基酚且系统稳定时,除(脱氯单胞菌属)和(红环菌科)仍保持优势地位之外,(属于螺旋体科)和成为新的优势菌.是一类潜在致病菌属,多见于动物体内[34],文献对该菌的报道较少.是一类聚糖菌, McIlroy等[31]报道了具有反硝化功能的,其基因组具备完整的反硝化通路,因此具有反硝化功能.此外,部分菌属在加入壬基酚的条件下相对丰度发生了明显变化.具有反硝化功能的(生丝单胞菌科)基本被淘汰,(球衣细胞属)和(属于红螺菌科)比例也明显降低,但(属于黄杆菌科)菌属比例则明显提高.在生活污水[35]和河湖底泥[36]中分离得到,多数不具备反硝化功能,但可降解多种有机物质.
抽平后的样品序列数、覆盖度、OTU总数、物种总数估计指数Ace和物种多样性Shannon指数见表2. 4个样品的测序覆盖度均高于0.997,说明测序结果可以基本反应样品中菌群结构.加入壬基酚前,生物反应器系统中陶粒表面物种总数和物种多样性均高于碳源表面,这与荧光定量PCR中16s rRNA基因的绝对丰度结果相反(见表3),说明碳源表面虽然微生物丰度大,但是物种数较少,多样性较低.加入壬基酚的条件下,物种总数和多样性比无壬基酚条件下较低.
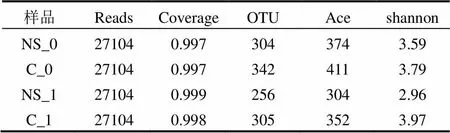
表2 微生物群落丰度和多样性分析
其它研究也曾报道壬基酚加入使实验体系中微生物菌种总数和多样性降低的情况[37-38].外源有机物的加入使土壤样品中微生物多样性下降,可能因其易被降解,降解菌被筛选出来且逐渐形成优势,从而降低了Shannon多样性指数[39].本实验中微生物物种总数和多样性降低的原因推测为以下两点:1)壬基酚加入,尤其是其浓度升高之后,可能对微生物群落产生了干扰作用,使不适应的菌种丰度降低或被淘汰,因此降低了菌种总数和多样性.这种短期干扰作用有可能会在后期恢复[40];2)固相碳源表面能够降解壬基酚的菌种比例增加,从而降低了均匀度,也使得Shannon指数降低.虽然物种总数和多样性降低,但系统COD和脱氮效果并未受到显著影响,可能因为淘汰的物种多为相对丰度较低的菌属,而影响系统运行效果的优势菌和主要的脱氮菌相对丰度较为稳定(图5).
Venn图(图6)表示有无壬基酚条件下固相碳源NS和陶粒表面生物膜中共有和独有的OTU数目.两种条件下,固相碳源表面共有的OTU有163个,另有141和93个OUT分别存在于无壬基酚和有壬基酚的情况下.陶粒表面的共有OTU和单独OTU数分别为194、148和111.可见适应壬基酚的菌种数量更少,这与物种估计总数Ace的结果相一致(表2).
2.5 氮循环基因绝对及相对丰度分析
通过荧光定量PCR实验,获取了壬基酚加入前(96d)和加入后(223d)16s rRNA及氮循环基因和的绝对和相对丰度(表3).
由表3可知,16srRNA、和在碳源表面的绝对丰度均显著高于陶粒表面(One-Way ANOVA,Student-Newman- Keuls检验[41],<0.05),这与碳源表面营养物质丰富密切相关.由氮循环基因的相对丰度(氮循环基因占16s rRNA基因绝对丰度的百分比)可知,除基因,其他基因在碳源表面的相对丰度均显著低于陶粒表面(<0.05).陶粒表面较高的反硝化基因丰度表明附着于陶粒表面的微生物也具有较高的脱氮性能.由于固相碳源在微生物的降解作用下形成可溶性有机物释放到周围水相中,可被陶粒表面的微生物继续利用,从而促进了反硝化微生物的生长.和基因分别编码细胞色素型亚酸盐还原酶和Cu型亚硝酸盐还原酶[42],可将亚硝酸盐还原为一氧化氮.根据基因绝对丰度可知,基因比基因丰度高接近3个数量级,说明填料表面携带基因的反硝化菌占主导.在其他固相碳源脱氮系统和人工湿地脱氮系统中发现相似的结果[20,43].基因丰度最低,这也可能是硝化功能较弱且不稳定的原因.
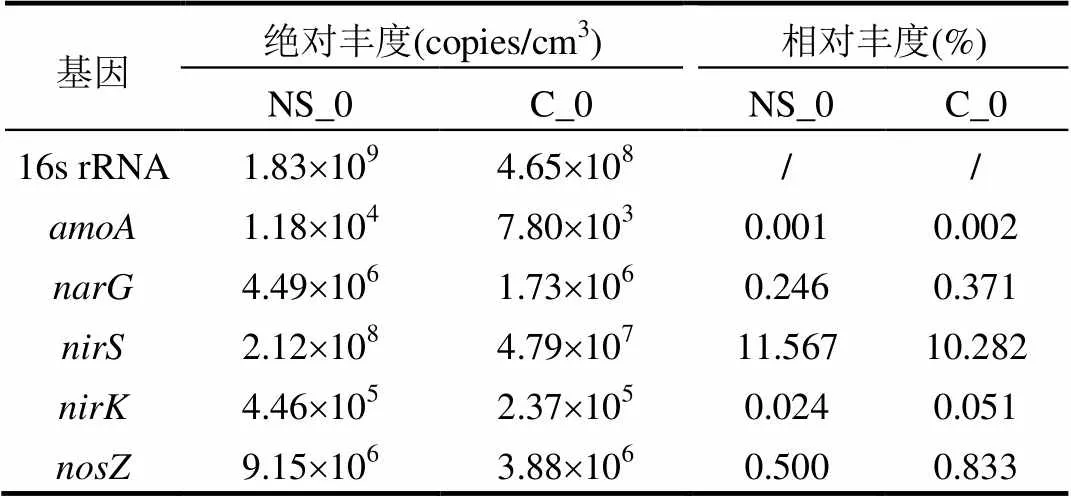
表3 壬基酚加入前固相碳源和陶粒表面氮循环基因绝对和相对丰度
通过比较有无壬基酚条件下基因相对丰度差异(图7)可知,添加壬基酚的条件下,和基因的相对丰度并无显著变化(>0.05),基因相对丰度显著增加(<0.05).碳源表面的基因相对丰度显著增加,基因显著减少(<0.05),而陶粒表面的这2种基因相对丰度均无显著变化(>0.05).基因在碳源表面的相对丰度较无壬基酚的条件下降低了约25.4%,绝对丰度也降低了18.5%,但陶粒表面的基因丰度没有显著变化,有可能是壬基酚的加入降低了携带基因的反硝化菌对碳源的利用能力.虽然基因丰度出现了大幅减少,但是反硝化效果依然非常稳定.可能是由于反应器进水的硝氮浓度低(10mg/L),携带基因的反硝化菌丰度波动后仍然大量存在,足以转化这部分硝酸盐氮.定量PCR结果表明,存在壬基酚的情况下,除碳源表面基因较低之外,其他基因丰度没有受到大幅度的负面影响.
3 结论
3.1 填有固相碳源NS和惰性生物陶粒的同步硝化反硝化反应器在溶解氧较低的条件下(2.13±0.77)mg/L,具有稳定良好的硝酸盐氮脱除效果,平均去除率为96.18%.氨氮去除率波动较大,平均去除率为82.54%.
3.2 壬基酚平均去除率为81.17%,不同初始浓度下壬基酚的去除率没有显著差异,表明反应器具有较高的耐冲击能力
3.3 系统中、_、和_、等为优势菌属,除之外,其他菌属多具有脱氮功能.存在壬基酚的条件下系统菌种总数和多样性较低.
3.4 添加壬基酚的条件下,碳源表面基因丰度显著低于未添加壬基酚的时期,但没有影响生物反应器的脱氮效能.
[1] 佚 名,2015年中国环境状况公报(摘录) [J]. 环境保护, 2016,(11):43-51.
[2] Belfroid A C, Van der Horst A, Vethaak A D, et al. Analysis and occurrence of estrogenic hormones and their glucuronides in surface water and waste water in The Netherlands [J]. Science of the Total Environment, 1999,225(1/2):101-108.
[3] Soares A, Guieysse B, Jefferson B, et al. Nonylphenol in the environment: A critical review on occurrence, fate, toxicity and treatment in wastewaters [J]. Environment International, 2008, 34(7):1033-1049.
[4] Arnold S F, Klotz D M, Collins B M, et al. Synergistic activation of estrogen receptor with combinations of environmental chemicals [J]. Science, 1996,272(5267):1489-1492.
[5] Mao Z, Zheng X F, Zhang Y Q, et al. Occurrence and Biodegradation of Nonylphenol in the Environment [J]. International Journal of Molecular Sciences, 2012,13(1):491-505.
[6] Xu G, Ma S, Tang L, et al. Occurrence, fate, and risk assessment of selected endocrine disrupting chemicals in wastewater treatment plants and receiving river of Shanghai, China [J]. Environmental science and pollution research international, 2016,23(24):25442-25450.
[7] Boley A, Muller W R, Haider G. Biodegradable polymers as solid substrate and biofilm carrier for denitrification in recirculated aquaculture systems [J]. Aquacultural Engineering, 2000,22(1/2): 75-85.
[8] Boley A, Mergaert J, Muller C, et al. Denitrification and pesticide elimination in drinking water treatment with the biodegradable polymer poly(epsilon-caprolactone) (PCL) [J]. Acta Hydrochimica Et Hydrobiologica, 2003,31(3):195-203.
[9] Wu W Z, Yang L H, Wang J L. Denitrification performance and microbial diversity in a packed-bed bioreactor using PCL as carbon source and biofilm carrier [J]. Applied Microbiology and Biotechnology, 2013,97(6):2725-2733.
[10] Wang X M, Xing L J, Qiu T L, et al. Simultaneous removal of nitrate and pentachlorophenol from simulated groundwater using a biodenitrification reactor packed with corncob [J]. Environmental Science and Pollution Research, 2013,20(4): 2236-2243.
[11] Feng L J, Yang G F, Zhu L, et al. Enhancement removal of endocrine-disrupting pesticides and nitrogen removal in a biofilm reactor coupling of biodegradable Phragmites communis and elastic filler for polluted source water treatment [J]. Bioresource Technology, 2015,187:331-337.
[12] 赵 兰,王 婷,吴为中.以PHBV为固相碳源同时去除地下水中硝酸盐氮和对氯苯酚的试验研究 [J]. 生态环境学报, 2015,(2):300-304.
[13] 陈剑刚,赵倩宁,谭爱军.固相萃取-液相色谱-串联质谱法测定水源水中的壬基酚、辛酚和双酚A [J]. 中国卫生检验杂志, 2012,(12):2798-2801.
[14] 蔡全英,黄慧娟,吕辉雄,等.超声提取/高效液相色谱法测定土壤中的4-壬基酚 [J]. 分析测试学报, 2012,31(2):185-189.
[15] 杨飞飞.可生物降解聚合物应用于同步硝化反硝化脱氮研究 [D]. 北京:北京大学, 2014.
[16] Chu L, Wang J. Nitrogen removal using biodegradable polymers as carbon source and biofilm carriers in a moving bed biofilm reactor [J]. Chemical Engineering Journal, 2011,170(1):220-225.
[17] Stasinakis AS, Mamais D, Thomaidis NS, et al. Inhibitory effect of triclosan and nonylphenol on respiration rates and ammonia removal in activated sludge systems [J]. Ecotoxicol Environ Saf, 2008,70(2):199-206.
[18] Dokianakis SN, Kornaros M, Lyberatos G. Impact of five selected xenobiotics on isolated ammonium oxidizers and on nitrifying activated sludge [J]. Environmental Toxicology, 2006,21(4):310- 316.
[19] 徐文韬,何义亮,张小凡.壬基酚对序批式活性污泥法处理氨氮废水系统的影响 [J]. 环境污染与防治, 2013,35(2):57-61.
[20] 杨飞飞,吴为中.新型固相碳源应用于同步硝化反硝化脱氮试验研究[C]//年中国环境科学学会学术年会, 2015.
[21] Shen Z, Wang J. Biological denitrification using cross-linked starch/PCL blends as solid carbon source and biofilm carrier [J]. Bioresource Technology, 2011,102(19):8835-8838.
[22] 戴玉女,杨 扬,阿 丹,等.自然曝气生物滤床去除二级污水处理厂尾水中酚类内分泌干扰物的应用 [J]. 生态科学, 2012, 31(3):267-272.
[23] Soares A, Murto M, Guieysse B, et al. Biodegradation of nonylphenol in a continuous bioreactor at low temperatures and effects on the microbial population [J]. Applied Microbiology and Biotechnology, 2006,69(5):597-606.
[24] Buitrón G, Torres-Bojorges AX, Cea-Barcia G. Removal of p-nonylphenol isomers using nitrifying sludge in a membrane sequencing batch reactor [J]. Chemical Engineering Journal, 2015,281:860-868.
[25] Su L, Aga D, Chandran K, et al. Factors impacting biotransformation kinetics of trace organic compounds in lab-scale activated sludge systems performing nitrification and denitrification [J]. Journal of Hazardous Materials, 2015, 282:116-124.
[26] Rojas M R, Leung C, Bonk F, et al. Assessment of the Effectiveness of Secondary Wastewater Treatment Technologies to Remove Trace Chemicals of Emerging Concern [J]. Critical Reviews in Environmental Science and Technology, 2013, 43(12):1281-1314.
[27] Coates J D, Chakraborty R, Lack J G, et al. Anaerobic benzene oxidation coupled to nitrate reduction in pure culture by two strains of Dechloromonas [J]. Nature, 2001,411(6841):1039-43.
[28] Wang B, Peng Y, Guo Y, et al. Illumina MiSeq sequencing reveals the key microorganisms involved in partial nitritation followed by simultaneous sludge fermentation, denitrification and anammox process [J]. Bioresource Technology, 2016,207:118-125.
[29] Shu D T, He Y L, Yue H, et al. Microbial structures and community functions of anaerobic sludge in six full-scale wastewater treatment plants as revealed by 454high-throughput pyrosequencing [J]. Bioresource Technology, 2015,186:163-172.
[30] Tian H L, Zhao J Y, Zhang H Y, et al. Bacterial community shift along with the changes in operational conditions in a membrane-aerated biofilm reactor [J]. Applied Microbiology and Biotechnology, 2015,99(7):3279-3290.
[31] Saito T, Ishii S, Otsuka S, et al. Identification of Novel Betaproteobacteria in a Succinate-Assimilating Population in Denitrifying Rice Paddy Soil by Using Stable Isotope Probing [J]. Microbes and Environments, 2008,23(3):192-200.
[32] Huang T L, Zhou S L, Zhang H H, et al. Nitrogen Removal Characteristics of a Newly Isolated Indigenous Aerobic Denitrifier from Oligotrophic Drinking Water Reservoir, Zoogloea sp N299 [J]. International Journal of Molecular Sciences, 2015,16(5):10038-10060.
[33] Alain K, Tindall B J, Intertaglia L, et al. Hellea balneolensis gen. nov., sp nov., a prosthecate alphaproteobacterium from the Mediterranean Sea [J]. International Journal of Systematic and Evolutionary Microbiology, 2008,58(11):2511-2519.
[34] Defosse D L, Johnson R C, Paster B J, et al. Brevinema- andersonii gen-nov, sp-nov, and infectious spirochete isolated from the short-tailed shrew (blarina-brevicauda) and the white-footed mouse (peromyscus-leucopus) [J]. International Journal of Systematic Bacteriology, 1995,45(1):78-84.
[35] Allen T D, Lawson P A, Collins M D, et al. Cloacibacterium normanense gen. nov., sp nov., a novel bacterium in the family Flavobacteriaceae isolated from municipal wastewater [J]. International Journal of Systematic and Evolutionary Microbiology, 2006,56(6):1311-1316.
[36] Cao S J, Deng C P, Li B Z, et al. Cloacibacterium rupense sp. nov., isolated from freshwater lake sediment [J]. International Journal of Systematic and Evolutionary Microbiology, 2010,60(9):2023- 2026.
[37] Wang Z, Yang Y, He T, et al. Change of microbial community structure and functional gene abundance in nonylphenol- degrading sediment [J]. Appl Microbiol Biotechnol, 2015, 99(7):3259-3268.
[38] Wang Z, Yang Y, Dai Y, et al. Anaerobic biodegradation of nonylphenol in river sediment under nitrate- or sulfate-reducing conditions and associated bacterial community [J]. J Hazard Mater, 2015,286:306-314.
[39] Zhang Y, Sei K, Toyama T, et al. Changes of catabolic genes and microbial community structures during biodegradation of nonylphenol ethoxylates and nonylphenol in natural water microcosms [J]. Biochemical Engineering Journal, 2008,39(2): 288-296.
[40] Stenrød M, Klemsdal SS, Norli HR, et al. Effects of Picoxystrobin and 4-n-Nonylphenol on Soil Microbial Community Structure and Respiration Activity [J]. Plos One, 2013,8(6):e66989.
[41] Dai Y, Yang YY, Wu Z, et al. Spatiotemporal variation of planktonic and sediment bacterial assemblages in two plateau freshwater lakes at different trophic status [J]. Applied Microbiology and Biotechnology, 2016,100(9):4161-4175.
[42] Jung J, Yeom J, Han J, et al. Seasonal Changes in Nitrogen-Cycle Gene Abundances and in Bacterial Communities in Acidic Forest Soils [J]. Journal of Microbiology, 2012,50(3):365-373.
[43] Zhi W, Yuan L, Ji G, et al. Enhanced Long-Term Nitrogen Removal and Its Quantitative Molecular Mechanism in Tidal Flow Constructed Wetlands [J]. Environmental Science & Technology, 2015,49(7):4575-4583.
Simultaneous removal of nitrogen and nonylphenol using solid phase carbon source.
WANG Ting, SUN Jia-ning, WU Wei-zhong*
(College of Environmental Science and Engineering, Peking University, Beijing 100871, China)., 2017,37(8):2915~2923
The simultaneous nitrification and denitrification bioreactors in this research were packed with a new type of solid phase carbon source NS, which was invented based on PHBV. The removal rate of nitrogen and nonylphenol (NP) in the reactor was investigated. Illumina MiSeq high-throughput sequencing and quantitative PCR (qCPR) were applied to analyze the microbial community structure and functional genes. The removal rates of nitrate and ammonia nitrogen were 96.18% and 82.54%, respectively. Average COD concentration was 27.48mg/L in effluent.The average removal efficiency of NP was 81.17%. The results of high-throughput sequencing illustrated that the previously reported denitrifiers including,andwere the dominant microbe genus on the surface of solid carbon when NP was not added. The estimated total number of bacteria species anddiversity decreased after NP was added in the influent. According to outcomes of qPCR, functional genes of nitrogen cycle had rich abundance in the bioreactor. Abundances ofgene andgene were the highest and lowest, respectively. However,abundance reduced when NP was added in the influent.
solid phase carbon source;simultaneous nitrification and denitrification;nonylphenol;microbial community structure;functional genes
X522
A
1000-6923(2017)08-2915-09
王 婷(1991-),女,山东济南人,北京大学硕士研究生,主要从事水污染治理理论与技术研究.
2016-12-26
国家自然科学基金资助项目(51378021);国家水体污染控制与治理重大科技专项(2012ZX07102002)
* 责任作者, 副教授, wzwu@pku.edu.cn
