溯源至相同标准物质的2种前清蛋白测量系统检测结果的正确性和一致性观察*
2017-10-12李敏孙慧颖胡滨韩玉霞贾晓鹏陈宝荣
李敏,孙慧颖,胡滨,韩玉霞,贾晓鹏,陈宝荣
(北京航天总医院检验科,北京 100076)
·质量管理研究·
溯源至相同标准物质的2种前清蛋白测量系统检测结果的正确性和一致性观察*
李敏,孙慧颖,胡滨,韩玉霞,贾晓鹏,陈宝荣
(北京航天总医院检验科,北京 100076)
目的评价2种溯源至相同标准物质的前清蛋白测量系统检测结果的正确性和一致性。方法在日立7170A全自动生化分析仪上分别复现A和B 2种前清蛋白厂家测量系统,分别检测27例新鲜单人份血清样品和有证标准物质ERM-DA470k,用配对t检验评价2种测量系统检测结果的差异。结果有证标准物质ERM-DA470k的测量值分别为0.21 g/L和0.23 g/L;27例新鲜单人份血清样品的前清蛋白浓度范围分别为0.05~0.46 g/L和0.06~0.50 g/L;对A、B组测量结果进行配对t检验,差异有统计学意义(t=-10.257,P<0.01)。结论2种厂家前清蛋白测量系统正确性满足要求,但缺乏一致性。
前清蛋白;溯源;标准物质;不确定度;正确性;一致性
血清前清蛋白升高和降低可反映肝细胞合成和分泌蛋白质的功能,是早期肝功能损害及恢复的重要监测指标,同时也可作为营养不良的诊断和监测指标[1-2]。为客观评估A、B厂家试剂盒的测量效果,用该2种试剂盒分别在7170A生化分析仪上复现A、B厂家测量系统,同时检测27例新鲜患者血清样品和有证标准物质,比较2个厂家系统的检测效果。
1 材料与方法
1.1样品 无黄疸、溶血、脂浊的门诊及住院患者新鲜血清27份。有证标准物质ERM-DA470k,IFCC认定值为0.220 g/L,不确定度为0.018 g/L(k=2)。
1.2仪器与试剂 日立7170A全自动生化分析仪;试剂A(批号86073;校准品批号86107);试剂B(批号L640A;校准品批号1715199)。
1.3方法 实验前按操作规程维护与保养仪器。根据试剂盒说明书在日立7170A全自动生化分析仪上复现A、B厂家测量系统,按常规方法校准并测定质控品,质控在控后测定27例新鲜血清样品和ERM-DA470K,每个样品重复检测3次,3次测量均值作为评价数据。
1.4统计学分析 用Microsoft Office Excel 2007软件分析并作散点图,2组结果均数间的比较用配对t检验,P<0.05为差异有统计学意义。
2 结果
2.1有证参考物质测量结果 A与B测量系统对ERM-DA470k的测量值分别为(0.21±0.01)g/L和(0.23±0.00)g/L,均在“认定值±不确定度”范围内,表明2种厂家测量系统均具有溯源性。
2.227份新鲜患者血清样品测量结果 见表1。散点图见图1。
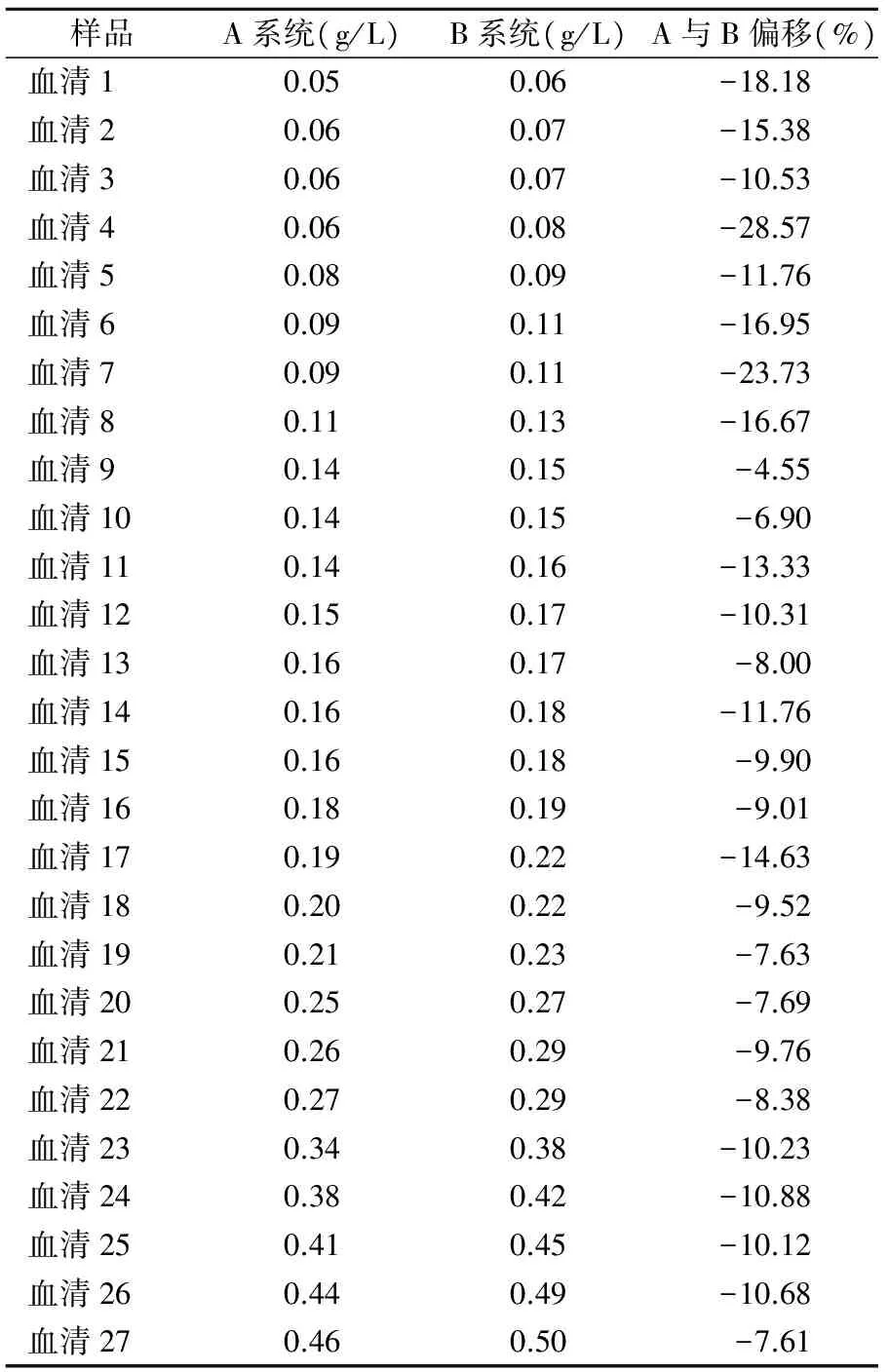
表1 27份新鲜患者血清样品测量结果
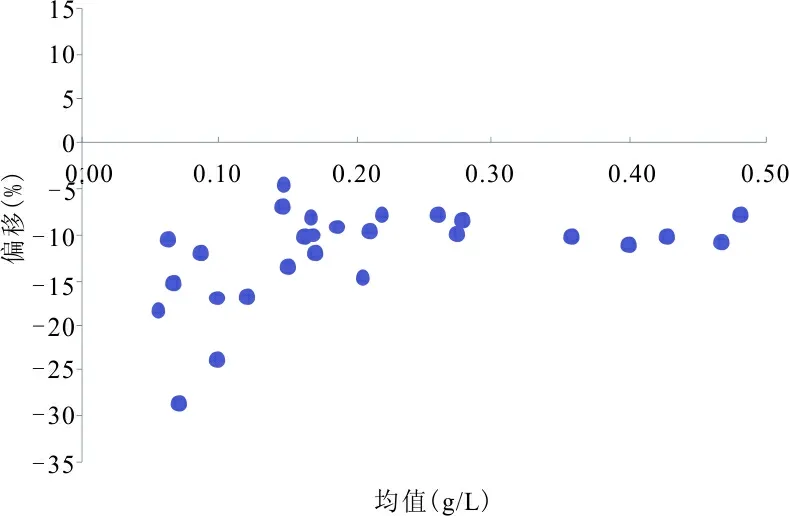
注:横轴为2个系统测量值的均值,纵轴为2个系统测量值的偏移。
图1 2个系统测量结果的偏移
2.3A与B测量系统测量结果差异 用配对t检验评价2种试剂盒检测27份患者样品的结果差异,t值为-10.257,P<0.01,表明A、B试剂盒的检测结果差异具有统计学意义。
3 讨论
如何保证不同测量系统获得的测量结果准确可比是近年检验医学领域的研究热点,也是临床实验室质量管理的核心[3]。从理论上讲,量值溯源是实现临床实验室不同测量系统测量结果准确可比的前提,但通过可溯源到相同标准物质的测量系统获得的检验结果就一定准确可比吗?本研究结果给出了否定的答案。
2015年JCTLM年会上IFCC互换性工作组研究报告中指出厂家系统必须使用有互换性的校准品以保证相同患者样品在不同的厂家测量系统测量时得到一致的检验结果。由于血清前清蛋白目前没有国际公认的参考方法,因此对不同厂家校准品的互换性也无法按相应的国际标准进行评估,这给前清蛋白试剂盒的质量评价带来一定的难度。本研究中采用市场可获得的有证标准物质ERM-470K评价2个测量系统的正确性,发现A、B厂家测量系统测量
结果均在其“示值±不确定度”范围内,即2个厂家测量系统测量结果的正确性均满足要求,但27份新鲜患者血清样品测量结果却显示2个厂家测量系统测量结果存在明显偏差(见表1和图1),分析原因可能为:(1)有证标准物质ERM-470K不确定度过大(为8.2%)导致2个测量系统采用相同的有证标准物质评价时,其测量结果很容易满足正确性评价要求,即判据过于宽松。(2)厂家测量系统校准品定值方案(量值溯源路径)不同,导致溯源至相同有证标准物质ERM-470K的2个厂家测量系统测量结果不一致。
由于血清前清蛋白属于结构复杂的生物大分子,测量具有高度的复杂性,目前无国际公认的参考方法,只能溯源至有证参考物质[4-5]。对于这类可溯源项目,本研究发现有证标准物质测量不确定度过大和量值溯源路径的差异可能是导致声称有溯源性的厂家试剂盒测量结果不一致的重要原因,应引起IVD厂家和临床实验室的高度重视。
[1]李婉筠,林红. 血清前白蛋白测定及其临床意义[J].中国临床研究,1991,4(1):49-50.
[2]吕礼应,刘万利,杨九华. 应用国产前白蛋白试剂盒自建检测系统及其评价[J].检验医学,2007,22(2):163-165.
[3]陈宝荣,孙慧颖,邵燕,等. IFCC参考方法对两种测量系统GGT结果正确性的验证[J]. 标记免疫分析与临床,2011,18(5):336-341.
[4]ISO/IEC 17511:2003. In vitro diagnostic medical devices-Measurement of quantities in biological samples-Metrological traceability of values assigned to calibrators and control materials[S].ISO,2003.
[5]陈宝荣 . 临床检验结果量值溯源存在的问题与思考[J].临床检验杂志,2012,30(12):943-945.
R446
A
2017-07-27)
(本文编辑王海燕)
首都卫生发展科研专项(201622096)。
李敏,1991年生,女,技师,大学本科,主要从事临床化学标准化研究。
陈宝荣,E-mail:jyk711@sina.com。
10.13602/j.cnki.jcls.2017.09.16
