藏药佐太对药物代谢酶CYP2C11和CYP2D1 的活性及蛋白和mRNA表达的影响 ※
2017-10-12年永琼周雪姣乔一杰辛元尧张娟玲李向阳
杨 梦,年永琼,周雪姣,乔一杰,辛元尧,张娟玲,李向阳*
(1.青海大学生态环境工程学院,青海 西宁 810016;2.青海大学医学院,青海 西宁 810001)
藏药佐太对药物代谢酶CYP2C11和CYP2D1的活性及蛋白和mRNA表达的影响※
杨 梦,年永琼1,周雪姣1,乔一杰2,辛元尧1,张娟玲1,李向阳2*
(1.青海大学生态环境工程学院,青海 西宁 810016;2.青海大学医学院,青海 西宁 810001)
目的探讨佐太对药物代谢酶CYP2C11和CYP2D1活性,以及蛋白和mRNA表达的影响。方法140只SD大鼠,雌雄各半,随机分为CYP2C11(给予探针药物苯妥英)和CYP2D1(给予探针药物右美沙芬)两大组,每大组设7个小组,为对照组、小剂量单次给药组、小剂量多次给药组、中剂量单次给药组、中剂量多次给药组、大剂量单次给药组、大剂量多次给药组,每小组10只。采用探针药物法测定大鼠给予佐太后药物代谢酶活性的变化;ELISA法测定大鼠给予佐太后药物代谢酶蛋白表达的变化;实时定量PCR法测定大鼠给予佐太后药物代谢酶mRNA表达的变化。结果与对照组比较,单次给予佐太12.0 mg·kg-1后,CYP2C11的活性显著升高105.3%;单次给予佐太3.8 mg·kg-1后,CYP2D1的活性显著升高193.5%;CYP2D1的蛋白表达显著升高84.3%;CYP2D1的mRNA表达显著升高76.4%,其他组无显著性变化。多次给予佐太1.2、3.8、12.0 mg·kg-1后,CYP2C11的活性分别显著升高436.8%、131.6%、226.3% ;CYP2C11的蛋白表达分别显著升高88.1%、38.7%、54.2%;CYP2C11的mRNA表达分别显著升高126.8%、135.2%、100.0%;CYP2D1的活性分别显著升高145.2%、71.0%、58.1%;CYP2D1的蛋白表达分别显著升高84.5%、73.7%、33.4%;CYP2D1的mRNA表达分别显著升高118.2%、67.3%、36.4%,其他组无显著性变化。结论藏药佐太对CYP2C11和CYP2D1的活性,蛋白质及mRNA表达均具有显著升高效果,显示佐太在作为合剂时可诱导肝药酶代谢加快。
藏药 佐太 CY2C11 CYP2D1
“佐太”(佐塔)作为藏药母本,“佐”为煮煎,“太”为灰或炭,“佐太”即水银煅灰,即在金属汞中加入多种辅助药物,经过洗、涤、煮等炮制工艺,去垢、去锈、除汞毒,煅炭存性而成的水银灰药,谓之佐太[1]。佐太一般不作为单纯内服药物,临床作为辅剂应用。
细胞色素P450超家族(CYP450)是介导人体内药物代谢的主要酶系,其中包含多个亚家族,CYP2C9和CYP2D6为CYP450酶系的重要亚型,参与多种药物代谢过程。研究显示,人CYP2C9、CYP2D6与大鼠CYP2C11、CYP2D1分别具有相同的探针药物,结合CYP450酶系亚型的同源性,可建立两者间的对应关系[2]。研究佐太对大鼠CYP2C11、CYP2D1的影响,可进一步推测人体内对应CYP450酶系CYP2C9、CYP2D6的变化情况。
近年来国内外佐太相关研究取得了很大进展,主要集中在佐太的制备工艺、药理毒理、体内代谢、安全性评价以及临床应用等方面[3]。药效学研究表明,佐太具有镇静、消炎、免疫调制、健脾、强身等作用[4,5]。向丽[6]和李岑[7]等对其毒理学进行了研究,证实了佐太及其制剂安全性较高,对机体无明显毒副作用,长期使用会在肾脏蓄积,提示佐太不宜长期大剂量给药。作者曾研究佐太对药物代谢酶NAT2和CYP1A2的影响,结果显示,佐太显著影响药物代谢酶CYP1A2和NAT2的活性和蛋白及mRNA表达[8]。为进一步研究佐太对其他药物代谢酶的影响,本文探讨了藏药佐太对大鼠体内药物代谢酶CYP2C11、CYP2D1的活性及表达的影响。
1 材料与方法
1.1 实验动物
SD大鼠,体重200±20 g,雌雄各半,购于甘肃中医学院实验动物中心,合格证号:SCXK(甘)2011-0001。分笼饲养,给予标准饲料,自由饮水。
1.2 仪器与试剂
1.2.1 仪器
高效液相色谱仪(LC-10AT,日本shimadzu公司);色谱工作站(N2000,浙江大学智能信息工程研究所);电子分析天平(Sartorius BT224S,德国赛多利斯集团);高速离心机(TGL-16B,上海安亭科学仪器厂);旋涡混合器(XW-80A,上海精科有限公司);生化测定仪(TBA120-FR,日本东芝医疗系统株式会社);酶标仪(680型,美国伯乐公司);荧光定量PCR仪(ABI7500 FAST,美国应用生物系统公司);超速离心机(Optima MAX-XP,美国贝克曼库尔特有限公司)。
1.2.2 药品和试剂
佐太由青海省藏医院研制,批号:20111002,汞、金、铅和铜含量分别为 52.29%、0.14%、0.17%和0.26%[9]。4′-羟化苯妥英(HPPH,Sigma公司,批号:00213DG);苯妥英(PHT,日本东京化成工业株式会社,批号:GF01-FD);右美沙芬(DM,Augsburg Germany,批号:00323);去甲右美沙芬(DX,加拿大Toronto化学试剂公司,批号:6-MIC-142-1);Trizol试剂(Invitrogen)。大鼠酶联免疫试剂盒(武汉优尔生科技股份有限公司,CY2C11批号:E93294Ra;CYP2D1批号: E96192Ra)。氯仿、异丙醇和无水乙醇(AR,国药集团);DEPC H2O(Ambion);Prime Script Reverse Transcriptase(Takara);PCR试剂(promega Taq酶及配套试剂);定量PCR试剂[上海睿安生物科技有限公司,HS qPCR Master Mix(2X)]。色谱纯乙腈、甲醇(山东禹王实业有限公司)。
1.3 试验方法
1.3.1 动物分组及给药
140只SD大鼠,随机分为CYP2C11(给予探针药物PHT)和CYP2D1(给予探针药物DM)两大组,每大组设7个小组(雌雄各半),为对照组、小剂量单次给药组、小剂量多次给药组、中剂量单次给药组、中剂量多次给药组、大剂量单次给药组、大剂量多次给药组,每小组10只大鼠。其中,单次给药组为1次给药,多次给药组为每天1次,连续给药12 d;佐太小、中、大剂量分别为1.2、3.8、12 mg·kg-1,首次灌胃前禁食12 h,自由进水。分别在对照组大鼠、单次给药组大鼠第2天和多次给药组大鼠第13天给予探针药物PHT及DM。
1.3.2 样品采集
灌胃给予大鼠PHT,给药后12 h采集血液,分离血清,冷冻保存;采用两步灌注法,对肝脏进行灌注,分离肝脏组织,于液氮冷冻保存待测。
大鼠灌胃给予探针药物DM,8 h后采集尿液,冷冻保存;采用两步灌注法,对肝脏进行灌注,分离肝脏组织,置液氮冷冻保存待测。
1.3.3 CYP2C11和CYP2D1活性测定
1.3.3.1 CYP2C11的活性测定
活性评价:大鼠灌胃给予探针药物PHT,12 h后采集血液,制备血清,采用RP-HPLC法测定PHT和代谢产物HPPH的血药浓度,以代谢产物HPPH与原型药物PHT的浓度比值评价CYP2C11的活性。
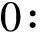
标准系列样品和质控样品的制备:分别精密称取PHT和HPPH的对照品1 mg置于10 mL量瓶中,用甲醇溶解并定容,制备成1 mg·mL-1的PHT和HPPH的储备液。精密量取储备液,用甲醇梯度稀释,得到标准系列样品。取适量上述储备液制备质控样品(QC)储备液,用甲醇梯度稀释为低、中、高浓度的质控样品。用空白血清稀释PHT和HPPH的QC储备液,制备定量下限和低、中、高浓度分别为1和2、8、16 μg·mL-1的质控血清样品。
样品预处理:于离心管中精密加入0.3 mL血清样品,涡旋0.5 min,加入等量乙腈,重复涡旋,离心(16 000 r·min-1)5 min,吸取上清液10 μL,进行HPLC分析。
方法学考察
专属性:分别取对照品溶液(PHT、HPPH),空白血清,空白血清中加入PHT、HPPH的对照品溶液,给药12 h后的大鼠血清,按“样品预处理”项下所示方法操作,进样分析,得对应色谱图。
标准曲线:取0.3 mL空白血清,分别加入适量混合标准工作液,配成含PHT、HPPH均为1.0、2.5、5.0、10.0、15.0、20.0 μg·mL-1的系列浓度血清样品,按“样品预处理”操作,进样分析(各浓度取6个样本),记录PHT、HPPH的峰面积,以浓度为横坐标、峰面积为纵坐标,进行回归计算,求得线性回归方程。
回收率:取低、中、高浓度的质控样品(PHT、HPPH均为2、8、16 μg·mL-1),按“样品预处理”项下所示方法操作并进样分析(各浓度取6个样本),以质控样品峰面积与空白血清(预处理后上清液)加入对照品溶液测得峰面积比值计算回收率。
精密度与准确度:取定量下限和低、中、高浓度的质控样品(PHT、HPPH均为1和2、8、16μg·mL-1),按“样品预处理”项下所示方法操作并进样分析(各浓度取6个样本),测定3天,记录PHT和HPPH的峰面积,代入当日标准曲线回归方程,得到测得浓度,再计算准确度与精密度。
基质效应:分别取6个不同来源的大鼠空白血清,按“样品预处理”项下所示方法操作,取上清液,加入适量对照品溶液(PHT、HPPH),配成低、高浓度分别为2、16 μg·mL-1的质控样品。用水代替空白血清,依上述方法处理。各浓度取3个样本分析,以两种条件下峰面积比值评价基质效应。
稳定性试验:取低、高浓度的质控样品(PHT、HPPH均为2、16μg·mL-1),按“样品预处理”项下所示方法操作并进样分析(各浓度取6个样本),考察室温(25℃)放置8 h、冷冻(-20℃)放置60 d、-20 ℃反复冻融3次、进样器内放置24 h等条件下的稳定性。
1.3.3.2 CYP2D1的活性测定
活性评价:大鼠灌胃给予探针药物DM,8 h后采集尿液,采用RP-HPLC法测定DM和代谢产物DX的尿药浓度,以代谢产物DX与原型药物DM的浓度比值评价CYP2D1的活性。
色谱条件:流动相为乙腈(A)-1%三乙胺水溶液(磷酸调节pH=2.2,B),梯度洗脱,0~15 min,A 20%~35%。色谱柱为Boston Green ODS(250mm×4.6mm,5μm),流速为1.0 mL·min-1,检测波长为280 nm,进样量为10 μL。
标准系列样品和质控样品的制备:分别精密称取DM和DX的对照品1 mg置于10 mL量瓶中,用甲醇溶解并定容,制备成1 mg·mL-1的DM和DX储备液。精密量取储备液,甲醇梯度稀释,得到标准系列样品。取适量上述储备液制备质控样品(QC)储备液,用甲醇梯度稀释为低、中、高浓度的质控样品。用空白尿液稀释DM和DX的QC储备液,制备定量下限和低、中、高浓度分别为1.0、2.5、15.0、35.0 μg·mL-1的质控尿液样品。
样品预处理:于离心管中精密加入0.3 mL尿液样品,涡旋0.5 min,加入0.3 mL乙腈,离心(16 000 r·min-1)5 min,吸取上清液10 μL,进行HPLC分析。
方法学考察
专属性:分别取对照品溶液(DM、DX),空白尿液,空白尿液中加入DM、DX的对照品溶液,给药后8 h的尿液样品,按“样品预处理”项下所示方法操作,进样分析,得对应色谱图。
标准曲线:取离心管数支,加入0.3 mL空白尿液,配成含DM和DX均为1、2、5、10、20、40 μg·mL-1的系列浓度尿液样品。按“样品预处理”项下所示方法操作(各浓度取6个样本),记录DM和DX的峰面积,以平均峰面积为纵坐标,DM和DX浓度为横坐标,得到线性回归方程。
回收率:取低、中、高浓度(DM及DX均为2.5、15.0、35.0 μg·mL-1)的质控样品,按“样品预处理”项下所示方法操作并进样分析(各浓度取6个样本),记录峰面积,以质控样品与空白尿液(预处理后上清液)加对照品溶液测得峰面积的比值计算回收率。
精密度与准确度:配制定量下限和低、中、高浓度的质控样品(DM及DX均为1.0和2.5、15.0、35.0 μg·mL-1),各浓度取6个样本,连续测定3天。按“样品预处理”项下所示方法操作,进样分析,记录DM和DX的峰面积,代入当日标准曲线回归方程,计算出浓度,再计算准确度与精密度。
基质效应:分别取6个不同来源的大鼠空白尿液,按“样品预处理”项下所示方法操作,取上清液,加入适量对照品溶液(DM、DX),配成低、高浓度分别为2.5、35.0 μg·mL-1质控样品。用水代替空白尿液,依上述方法处理。各浓度取3个样本分析,以两种条件下峰面积比值评价基质效应。
稳定性试验:取低、高浓度的质控样品(DM、DX均为2.5、35.0μg·mL-1),按“样品预处理”项下所示方法操作并进样分析,各浓度取6个样本分析,考察室温(25℃)放置12 h、冷冻(-20℃)放置120 d、-20 ℃反复冻融3次、进样器内放置24 h等条件下的稳定性。
1.3.4 蛋白定量
肝微粒体制备:采用超速离心法制备肝微粒体。精密称取大鼠肝组织1 g,加入3 mL 50 mmol·L-1的Tris-HCl缓冲溶液(含200mmol·L-1蔗糖、3mmol·L-1MgCl2和1 mmol·L-1EDTA,调pH值为7.4),制成30%组织匀浆,离心(11 000 r·min-1)30 min,分取上清液,离心(100 000 r·min-1)80 min,所得沉淀即为大鼠肝微粒体,用Tris-HCl溶液清洗,离心(100 000 r·min-1)60 min。上述每一步均在-4 ℃条件下操作。用10 mmol·L-1的Hepes-HCl溶液悬浮肝微粒体置液氮中保存待测。
CYP2C11和CYP2D1的蛋白定量测定均采用ELISA方法。50 μL标准品稀释液加入酶标板标准孔中,40 μL样品稀释液加入待测样品孔中,然后再加10 μL待测样品,混匀,在37 ℃条件下孵育30 min。弃去液体,甩干,每孔加满稀释后洗涤液,振荡30 s后弃去,共重复5次,拍干。除空白孔外,每孔加入50 μL酶标试剂,混匀,37 ℃孵育30 min,弃去液体,加洗涤液洗涤,重复5次后拍干。每孔依次加入50 μL的显色剂A和B,混匀后于37 ℃避光显色10 min,加入50 μL终止液,终止反应,于450 nm波长下立即测量各孔的OD值。将测得的OD值分别代入的回归方程计算对应的蛋白浓度,CYP2C11:C=28.73×OD-1.19,r=0.9974;CYP2D1:C=91.84×OD-8.90,r= 0.9987。
1.3.5 实时荧光定量 PCR
取适量大鼠肝组织,置于研钵中,加入液氮迅速研磨至粉末,用Trizol试剂提取总RNA并定量,取适量RNA用AMV反转录酶制备cDNA。用荧光定量PCR仪进行PCR反应,反应参数:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火 60 s,共40个循环。每次扩增设置β-actin基因内参照。由PCR仪自带软件进行荧光定量分析,得出Ct值。引物和Tag Man荧光探针由Primer Express软件设计,上海美吉生物医药科技有限公司合成。
CYP2C11引物序列:
5′-CGGGAAGTCATACGACATTAGC-3′(上游引物),
5′-GCAGAGAGGCAAATCCATTG-3′(下游引物);
CYP2D1引物序列:
5′-TGGAGCAGTGGGTGACAGA-3′(上游引物),
5′-AAGTCCAGGAGCCTGATGAA-3′(下游引物),
β-actin引物序列:
5′- CAGGTCATCACTATCGGCAAT-3′(上游引物),
5′- TGGCATAGAGGTCTTTACGGA -3′(下游引物),
1.3.6 统计学方法
2 结果
2.1 活性测定方法学考察
2.1.1 CYP2C11
专属性:结果显示在建立的色谱条件下,HPPH、PHT峰形较好,基线平稳,无杂峰,大鼠血清对以上目标检测物无干扰。
标准曲线:回归方程HPPH A=16 020×C+738,r=0.9991;PHT:A=15 330×C+2528,r=0.9995,均在1~20 μg·mL-1范围内线性关系良好,定量限均为1 μg·mL-1。
回收率:结果显示HPPH低、中、高浓度的回收率在86.14%~90.36%之间,PHT低、中、高浓度的回收率在87.44%~91.65%之间。
精密度与准确度:试验结果显示HPPH定量下限和低、中、高浓度的批内和批间精密度均低于8.86%,PHT定量下限和低、中、高浓度的批内和批间精密度均低于8.74%。
基质效应:考察结果显示HPPH、PHT在低、高浓度的基质效应均在89.2%~108.4%,RSD均小于6.8%。
稳定性实验:HPPH及PHT低高浓度血清样品室温(25℃)放置8 h、冷冻(-20℃)放置60 d、-20 ℃反复冻融3次、进样器内放置24 h等条件下回收率(RE)分别在1.8%~4.4%、3.1%~6.9%、-1.5%~5.7%、-1.8%~6.2%之间,样品稳定性良好。
2.1.2 CYP2D1
专属性:结果显示在建立的色谱条件下,DX、DM峰形较好,基线平稳,无杂峰,大鼠尿液对以上目标检测物无干扰。
标准曲线:回归方程DM A=3391×C+1520,r=0.9995;DX:A=3084×C+ 371,r= 0.9997,均在1~40 μg·mL-1范围内线性关系良好,定量限均为1 μg·mL-1。
回收率:结果显示DM低、中、高浓度的回收率在95.03%~96.77%之间,DX低、中、高浓度的回收率在92.89%~95.95%之间。
精密度与准确度:试验结果显示DM低、中、高浓度的批内和批间精密度均低于4.98%,DX低、中、高浓度的批内和批间精密度均低于9.66%。
基质效应:考察结果显示DM、DX在低、高浓度的基质效应均在87.9%~107.6%,RSD均小于5.9%。
稳定性实验:DM及DX低高浓度尿液样品(25℃)放置12 h、冷冻(-20℃)放置120 d、-20 ℃反复冻融3次、进样器内放置24 h等条件下回收率(RE)分别在-3.5%~4.6%、2.5%~7.8%、-1.3%~6.5%、-4.2%~3.8%之间,样品稳定性良好。
2.2 CYP2C11及CYP2D1活性测定
对照组、佐太单次给药组和佐太多次给药组的大鼠CYP2C11及CYP2D1活性测定结果见图1。结果表明,与对照组比较,单次给予佐太12 mg·kg-1后,CYP2C11的活性显著升高105.3%,单次给予佐太3.8 mg·kg-1后,CYP2D1的活性显著升高193.5%;多次给予佐太1.2、3.8 、12.0 mg·kg-1后,CYP2C11的活性分别显著升高436.8%、131.6%、226.3%,CYP2D1的活性分别显著升高145.2%、71.0%、58.1%。其他组无显著性变化。

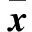
2.3 CYP2C11及CYP2D1蛋白表达
对照组、佐太单次给药组、佐太多次给药组CYP2C11和CYP2D1的蛋白定量测定结果见图2。结果显示,与对照组比较,单次给予佐太3.8 mg·kg-1后,CYP2D1的蛋白表达显著升高84.3%;多次给予佐太1.2、3.8、12.0 mg·kg-1后,CYP2C11的蛋白表达分别显著升高88.1%、38.7%、54.2%,CYP2D1的蛋白表达分别显著升高84.5%、73.7%、33.4%。其他组无显著性变化。
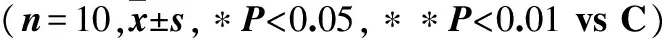
2.4 CYP2C11及CYP2D1 mRNA表达
对照组、佐太单次给药组、佐太多次给药组CYP2C11和CYP2D1的mRNA表达测定结果见图3。结果显示,与对照组比较,单次给予佐太3.8 mg·kg-1后,CYP2D1的mRNA表达显著升高76.4%;多次给予佐太1.2、3.8、12.0 mg·kg-1后,CYP2C11的mRNA表达分别显著升高126.8%、135.2%、100.0%,CYP2D1的mRNA表达分别显著升高118.2%、67.3%、36.4%。其他组无显著性变化。

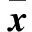
3 讨论
本研究采用探针药物法测定了CYP2C11和CYP2D1活性的变化。结果显示,三个剂量的佐太单次给药对CYP2C11的活性,蛋白以及mRNA表达基本无影响;佐太单次给予1.2、12.0 mg·kg-1对CYP2D1的活性,蛋白以及mRNA表达基本无影响。但佐太单次给予3.8 mg·kg-1后,CYP2D1的活性,蛋白以及mRNA表达均显著升高,原因可能是佐太对酶活性的调节作用与其所含金属离子浓度有关,在一定浓度范围内,酶活性升高效果显著,超过浓度阈值,对酶活性的影响效果反而降低[8]。与单次给药组相比,多次给药组均出现了药物代谢酶活性及相关表达的显著升高,推测原因是佐太的连续给药对机体产生了累积效应,形成了对酶活性的显著影响,但影响程度与剂量缺乏良好的剂量—效应关系,原因还有待于进一步探讨。采用ELISA和实时荧光定量PCR法分别测定了CYP2C11和CYP2D1的蛋白及mRNA表达,发现多次给予佐太后,其蛋白和mRNA表达均发生显著升高,其蛋白和mRNA表达的变化与活性变化的趋势一致,推测两种代谢酶活性的升高分别与其蛋白和mRNA表达的升高有关。
文献报道汞、铅、砷、银、锌等金属显著影响药物代谢酶的活性,佐太是多种金属的复合物,对药物代谢酶具有一定的影响[10,11]。作者曾研究了佐太对药物代谢酶CYP1A2和NAT2的影响,结果显示,佐太显著降低药物代谢酶NAT2和CYP1A2的活性、蛋白和mRNA表达[8]。本文研究结果显示佐太对机体药物代谢酶CYP2C11和CYP2D1活性、蛋白和mRNA表达具有诱导升高作用,提示药物代谢酶的种类不同,佐太的影响也不同。含有佐太的复方制剂临床应用范围较广,主要用于心血管系统、消化系统等相关系统疾病的治疗[12-14],本研究为佐太在方剂中具有协同增效作用提供了相关佐证,并对合理解释藏药中的重金属问题提供了理论依据。
由于佐太在其炮制过程中加入多种重金属及非金属,组成复杂,性质差异也较大,体内的药代动力学过程更加复杂,同时酶活性的影响因素较多,相关作用机制有待于进一步阐明。研究者以临床等效剂量连续给予KM小鼠佐太4.5个月后,对其生长发育状况、血常规指标、血清生化指标、脑组织学结构以及肝肾功能均未产生显著影响[15]。作者曾以汞为检测指标,初步研究了佐太在大鼠体内的吸收和排泄情况。结果显示汞在大鼠体内吸收较少,短期给药对肝肾组织无蓄积及毒性作用[16],提示佐太对药物代谢酶的影响与机体肝肾功能无关。
含重金属药物多为传统中药(诸如雄黄、朱砂、铅丹、轻粉、白降丹、朴消、寒水石等),药材质量常受到环境以及土壤污染的影响。陈朝军等[17]研究了不同产地寒水石的重金属及有害元素含量,发现不同产地的寒水石晶体结构、共生元素、微量元素以及有害元素存在差异。作为藏药母本,佐太在其他藏区也有生产,本实验所用样品为青海省藏医院研制,其他地区佐太能否得到类似结果,对药物代谢酶产生类似影响,都有待于进一步验证。佐太作为藏成药中重金属的主要来源,质量标准应与西药标准中金属含量控制有所区别。目前,关于佐太的质量标准有了初步成果,但是佐太的制备及含量控制尚未出现全面系统的国家药品质量标准,考虑到临床用药的有效性、安全性以及差异性,应加快推进藏药质量的标准统一化。
[1]张炜,刘学良,骆桂法,等.佐太等珍宝矿物类藏药材中总砷、总汞及可溶性砷汞含量的对比[J].药物分析杂志,2016,4(36),721-726.
[2]Videau O,Pitarque S,Troncale S,et al.Can a cocktail designed for phenotyping pharmacokinetics and metabolism enzymes in human be used efficiently in rat? [J].Xenobiotica,2012,42(4):349-354.
[3]杨梦,周雪姣,李向阳.藏药佐太的研究现状与进展[J].药学研究,2016,35(11):663-667.
[4]看召本.透视藏医珍宝类药品中的佐太[J].中国中药杂志,2013,38(10):1621-1623.
[5]黄海波,王奇志,王新为,等.藏药佐太的研究进展[J].中国中药杂志,2013,38(17):2886-2888.
[6]向丽,曾勇,林波,等.藏药“佐太”长期给药对大鼠肾脏潜在氧化损伤的初步研究[J].中药与临床,2015,6(3):39-42.
[7]李岑,王东平,多杰,等.藏药佐太安全性研究及其复方当佐的临床安全观察初探[J].中国中药杂志,2014,39(13):2573-2582.
[8]李向阳,刘永年,李永平,等.藏药佐太对CYP1A2和NAT2的活性及蛋白和mRNA表达的影响[J].药学学报,2014,49(2):267-272.
[9]李向阳,朱俊博,尼玛才让,等.微波消解ICP-AES法同时测定藏药佐太中的4种金属元素[J].中成药,2009,31(9):1472 -1473.
[10]Anwar-Mohamed A,Elbekai RH,El-Kadi AO.Regulation of CYP1A1 by heavy metals and consequences for drug metabolism[J].Expert Opin Drug Metab Toxicol,2009,5(5):501-521.
[11]Anwar-Mohamed A,El-Kadi AO.Down-regulation of the carcinogen metabolizing enzyme cytochrome P450 1a1 by vanadium[J].Drug Metab Dispos,2009,36(9):1819-1827.
[12]万玛才旦.藏药大月晶丸治疗消化性溃疡症55例临床观察[J].中国民族医药杂志,1997,21(4):27-27.
[13]程体娟,杨军英,朱玲,等.仁青芒觉胶囊的耐缺氧及抗心律失常作用[J].中药药理与临床,2003,19(2):40-41.
[14]桑吉措.藏药仁青常觉对101例消化系统疾病的临床观察[J].中国民族医药杂志,1999,5(3):5-6.
[15]朱洪梅,魏立新,杜玉枝,等.藏药佐太长期给药对小鼠毒性的初步研究[J].时珍国医国药,2013,24(8):2022-2024.
[16]李向阳,冯伟力,马祁生,等.藏药佐太中的汞在大鼠体内吸收和排泄的初步研究[J].时珍国医国药,2010,21(2):290-292.
[17]陈朝军,周昊霏,陆景坤,等.不同产地寒水石中重金属及有害元素的含量研究[J].世界科学技术-中医药现代化,2012,14(3):1678-1682.
EffectsofTibetanmedicineZuotaiontheactivity,proteinandmRNAexpressionofCY2C11andCYP2D1
YANG Meng1,NIAN Yong-qiong1,ZHOU Xue-jiao1,QIAO Yi-jie1,XIN Yuan-yao1, ZHANG Juan-ling,LI Xiang-yang2*
(1.College of Ecological Environment Engineering,Qinghai University,Xining,Qinghai,810016,China; 2.Qinghai University Medical college,Xining,Qinghai,810001 China)
ObjectiveTo investigate the effects of Tibetan medicine Zuotai on the activity,protein and mRNA expression of CYP2C11 and CYP2D1.Methods140 SD rats are randomly divided into two groups with half male and female:CYP2C11(treated with probe drug phenytoin)and CYP2D1(treated with probe drug dexamethasone).Each group were divided into seven groups with ten rats which are control group,single low-dose administration group,multiple low-dose,single middle-dose,multiple middle-dose,single high-dose,multiple high-dose.The activity of drug metabolizing enzyme in rats was determined by probe drug method.The protein and mRNA expression of drug metabolizing enzyme in rats were determined by ELISA and real-time quantitative PCR.ResultsCompared with the reference,the activity of CYP2C11 was significantly increased by 105.3% after treated with 12.0 mg·kg-1Zuotai single administration.The activity of CYP2D1 was significantly increased by 193.5% after treated with 3.8 mg·kg-1Zuotai single administration.The protein and mRNA expression of CYP2D1 was drastically enhanced over 84.3% and 76.4%,and there was no significant change in other groups.After treated with Zuotai multiple administration of 1.2,3.8,12.0 mg·kg-1,the activity of CYP2C11 and CYP2D1 show 436.8%,131.6%,226.3% and 145.2%,71.0%,58.1% improvement,respectively.The protein and mRNA expression of CYP2C11 were drastically enhanced over 88.1%,38.7%,54.2% and 126.8%,135.2%,100.0%,respectively.The protein and mRNA expression of CYP2D1 were drastically enhanced over 84.5%,73.7%,33.4% and 118.2%,67.3%,36.4%,respectively.There was no significant change in other groups.ConclusionTibetan medicine Zuotai can drastically enhance the activity,protein and mRNA expression of CYP2C11 and CYP2D1,show that Zuotai as a mixture can induce accelerating liver enzyme metabolism .
Tibetan medicine Zuotai CY2C11 CYP2D1
R969.1
A
10.13452/j.cnki.jqmc.2017.03.006
2017-2-3
※:国家自然科学基金(81460568,81760673);*:通信作者,博士生导师,E-mail:qhmclxy@163.com 杨梦(1993~),女,汉族,安徽籍,青海大学生态环境工程学院2015级硕士研究生
