低氧对大鼠血清bFGF、 VEGF的表达和肺动脉超微结构的影响 #
2017-10-12李小静刘川川刘辉琦曹学锋王生兰
李小静,刘川川,刘辉琦,刘 杰,曹学锋,吴 穹,王生兰*
(1.青海大学医学院病理生理学教研室;2.青海大学附属医院;青海 西宁 810001)
低氧对大鼠血清bFGF、 VEGF的表达和肺动脉超微结构的影响#
李小静1,刘川川2,刘辉琦1,刘 杰1,曹学锋1,吴 穹1,王生兰1*
(1.青海大学医学院病理生理学教研室;2.青海大学附属医院;青海 西宁 810001)
目的通过研究低氧对大鼠血清bFGF、VEGF的表达和肺动脉超微结构的影响,来初步揭示肺动脉高压的形成机制。方法取30只健康雄性SD大鼠,将其随机分成六组:对照组、低氧1天组、低氧7天组、低氧14天组、低氧21天组和低氧30天组。除对照组外,其余五组大鼠分别放在低压氧舱(模拟海拔5000米)1、7、14、21、30天。取各组大鼠血清及肺动脉,运用ELISA法检测大鼠血清中bFGF、VEGF的表达量,通过透射电镜观察肺动脉超微结构。结果与对照组相比,随着低氧时间的延长,大鼠血清bFGF的表达量逐渐升高,变化具有显著性差异(P<0.05);急性低氧时(低氧1天),血清VEGF含量较对照组明显升高,变化具有显著性差异(P<0.05),随着低氧时间的延长(低氧7、14、21、30天),血清VEGF含量较对照组呈逐渐下降趋势。电镜结果显示,低氧可导致肺动脉有不同程度的损伤,主要表现为,血管内皮细胞核染色质聚集、空泡化,甚至内皮细胞脱落;平滑肌细胞内出现核染色质聚集或边集,胞浆内出现空泡,线粒体肿胀,粗面内质网扩张。结论低氧环境中,bFGF的表达明显升高,VEGF的表达在急性缺氧时明显升高随后有下降趋势,表明bFGF参与低氧性病理生理改变的形成,VEGF变化与急性缺氧有关,低氧可导致肺动脉内皮细胞和平滑肌细胞的结构改变。
bFGF VEGF 低氧 透射电镜
高原特殊的高海拔地理特征造成了天然的低氧环境特点。氧分压随着海拔高度的升高逐渐降低,引起机体组织受损,严重时可引起高原特发性疾病的产生。急性低氧可造成高原性脑水肿和肺水肿的发生发展,长期慢性低氧能导致高原性心脏病和高原红细胞增多症的发生。
肺动脉高压(pulmonary hypertension,PH)的主要病理生理变化是肺血管结构的重构,此变化与PASMC的异常增殖密切相关。WHO定义PH的诊断标准:在海平面静息状态下,肺动脉平均压(MPAP)大于25 mmHg,在运动状态下大于30 mmHg。低氧性肺动脉高压(hypoxic pulmonary hypertension,HPH)是肺动脉高压疾病中最为多见的一种类型,是临床心肺疾病发生发展过程中重要的病理环节。HPH指正常人移居高原环境后,低氧致肺小动脉功能改变或器质性变化,从而引起肺动脉压力增高。有研究表明,HPH 的形成机制涉及多个方面,如细胞或离子通道机制,血管活性物质失衡或血管反应性机制等。近年来又有学者证明低氧可使PASMC发生增殖、迁移,从而使肺血管壁增厚,导致肺血管重构,最终发展为PH[1-4]。另有研究表明,PH的形成可能和相关细胞因子及生长因子的作用有关。本研究通过探讨低氧对大鼠血清bFGF、VEGF表达的影响,以及通过观察肺动脉超微结构的变化来初步揭示PH的形成机制,为高原性心血管疾病的预防和治疗提供理论依据。
1 材料与方法
1.1 主要试剂及仪器选择
大鼠VEGF、bFGF ELISA试剂盒购自CUSABIO生物科技有限公司;日立H-600IV型透射电镜购自日立公司。
1.2 实验动物分组
健康雄性SD大鼠48只购于甘肃中医院实验动物中心(合格证号:SYXK(甘)2011-0001)。将大鼠随机分成六组,每组8只,分别为对照组、低氧1天组、低氧7天组、低氧14天组、低氧21天组和低氧30天组。对照组:饲养于青海大学医学院机能实验室(西宁,海拔2260m);低氧组分成五组,每组8只,分别为低氧1天组、低氧7天组、低氧14 天组、低氧21天组和低氧30天组,每组低氧动物分别置于低压氧舱(模拟海拔5000米)中1、7 、14 、21 、30天,每天给予低压低氧处理20 小时。
1.3 血清bFGF、VEGF含量检测
用ELISA法检测血清bFGF、VEGF含量:从大鼠腹主动脉采血,室温静置2小时,离心(1000r/m)20分钟,取上层血清分装(200μL),置-20 ℃冰箱保存。按照大鼠VEGF、bFGF ELISA试剂盒操作说明步骤执行。在酶标仪450 nm波长处测定各孔的OD值。计算样品含量的平均值。
1.4 肺动脉超微结构观察
用透射电镜观察肺动脉超微结构:将SD大鼠麻醉,剖开,取出新鲜肺组织,切成小块(1mm×1mm×1mm)立即投入3%戊二醛固定液中进行预固定(24小时,4℃),用磷酸缓冲液(pH 7.4,0.2mol/L)洗涤3次,每次15分钟,再放入1%四氧化锇中再固定(2小时),用磷酸缓冲液(pH 7.4,0.2mol/L)再次清洗3次,每次15分钟,分别经50%、70%、90%丙酮脱水15分钟、100%丙酮脱水20分钟,用环氧树脂包埋剂包埋,制作超薄、半薄切片,行铀-铅双染色,通过透射电镜观察肺动脉超微结构。
1.5 统计学处理
实验数据用SPSS19.0软件作统计分析,结果用均数±标准差表示,组间比较应用单因素方差分析,两两比较采用SNK法,检验水准α=0.05 。
2 结果
2.1 不同低氧组SD大鼠血清bFGF、VEGF含量的变化
与对照组相比,随着低氧时间的延长(低氧1、7、14、21、30天),大鼠血清bFGF的表达量呈逐渐升高趋势,差异有显著性(P<0.05);急性低氧时(低氧1天),血清VEGF表达量较对照组明显升高,差异有显著性(P<0.05),随低氧时间延长(低氧7、14、21、30天),血清VEGF表达量较对照组呈逐渐下降趋势。结果见表1。
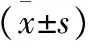
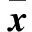
Table 1 Changes of serum bFGF and VEGF in SD rats with different hypoxia groups(±s)
a:与对照组比较变化有显著性(P<0.05),b:与低氧1天组比较变化有显著性(P<0.05),c:与低氧7天组比较变化有显著性(P<0.05),d:与低氧14天组比较变化有显著性(P<0.05),e:与低氧21天组比较变化有显著性(P<0.05).
2.2 不同低压低氧组SD大鼠肺动脉超微结构的变化
透射电镜可见血管内皮细胞和平滑肌细胞有核染色质聚集或边集,出现空泡甚至脱落,线粒体肿胀,粗面内质网扩张(图1)。表明低氧可导致不同程度的肺动脉损伤。
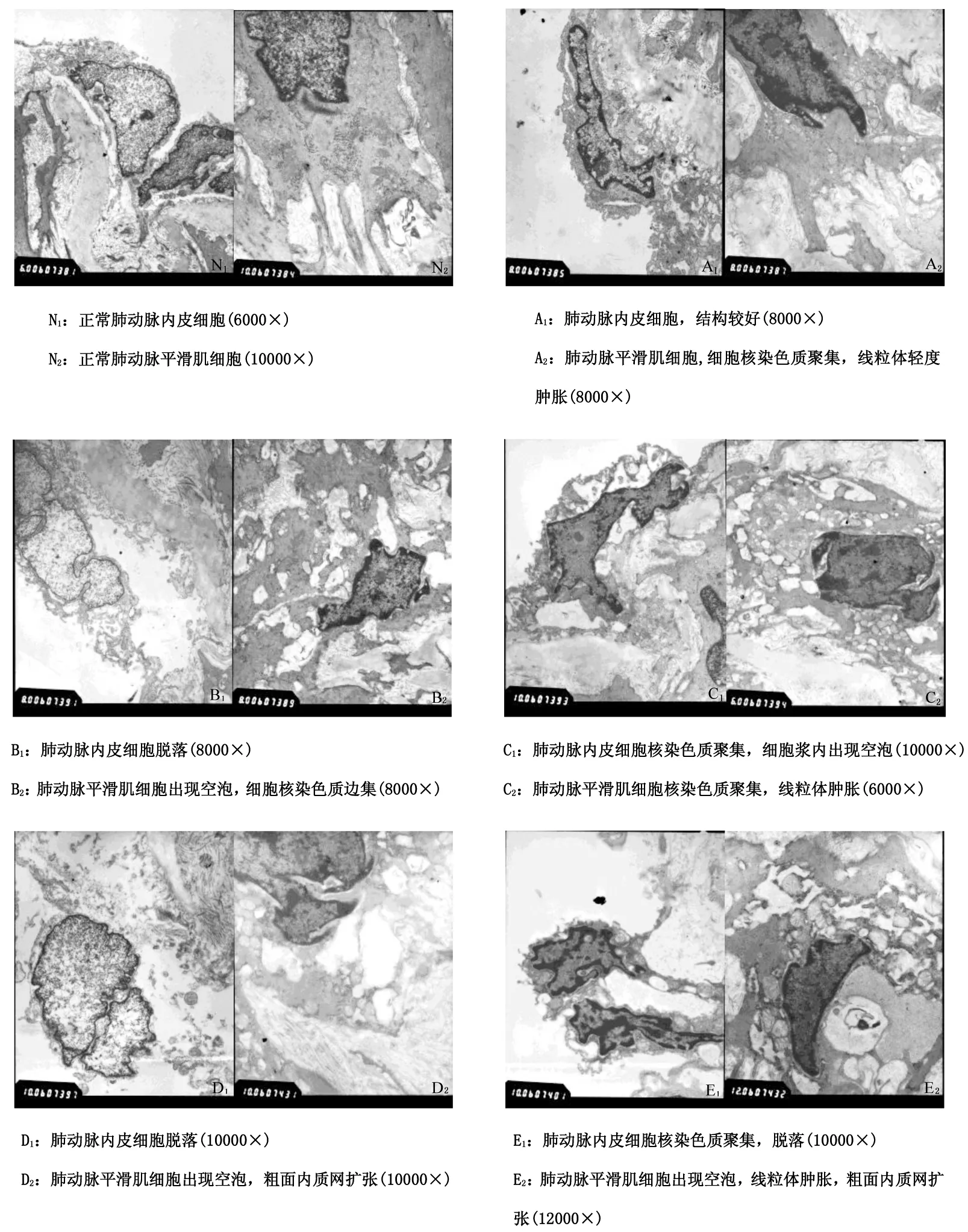
N为对照组,A为低压低氧1天组,B为低压低氧7天组,C为低压低氧14天组,D为低压低氧21组, E为低压低氧30天组
图1不同低压低氧组SD大鼠肺动脉超微结构的变化图
Figure1TheultrastructuralchangesofpulmonaryarteriesinSDratswithdifferenthypobaricandhypoxiccondition
3 讨论
血管内皮生长因子(VEGF),又称血管通透性因子,是涉及血管生成的重要信号蛋白,可在体内诱导血管新生。VEGF生物学功能为通过旁分泌方式作用于肺小动脉内膜,引起肺血管内皮细胞肥大、增殖,诱导血管生成因子产生,从而引起血管内膜增厚、新生血管形成、肺血管发生重构。随着病情的发生发展,血管中膜和内膜增厚、弹性下降,肺细小动脉肌化,使血管狭窄甚至闭塞,最终导致HPH的形成[5]。
本实验结果显示,VEGF 在急性低氧早期(低氧1天)的表达水平显著升高,但随低氧时间延长逐渐下降。其原因可能是VEGF 在急性低氧早期的表达水平显著升高,但随低氧时间延长达到习服后逐渐下降至正常水平[6]。而急性缺氧时VEGF异常升高使血管通透性增加,导致大量血浆蛋白漏出血管外,超出机体的代偿能力,引起肺水肿[7]。VEGF逐渐升高可诱发新生血管形成而不会引起肺水肿,有利于提高机体对高原缺氧的适应能力。
常氧时VEGF表达量甚微,起到维持血管密度平衡的作用,而缺氧时VEGF表达量会明显升高。多数文献证明低氧诱导因子-1(HIF-1)对参与肺动脉高压的调控起到重要作用。HIF-1为氧平衡的重要调控介质,由α亚基和β亚基构成,HIF-1α亚基是关键的氧调节元件,其蛋白稳定性受细胞内氧浓度的影响,决定HIF-1的活性,HIF-1β不是氧调节元件,但只有HIF-1β亚基和HIF-1α亚基聚合后才能发挥HIF-1α的氧调节作用。常氧状态时,HIF-1α被蛋白水解酶迅速降解,因此在细胞中基本检测不到HIF-1α亚基的表达;低氧状态时,HIF-1α蛋白降解系统被抑制,HIF-1α转移至细胞核内与HIF-1β亚基结合形成HIF-1[8,9],与VEGF基因(HIF-1α的下游靶基因)的缺氧反应元件(HRE)结合,使VEGF表达量增加[10]。在缺氧程度加重并持续进行时,HIF-1α亚基可与p53基因结合,使后者稳定性增强[11],p53促进了泛素蛋白水解酶系统对HIF-1α的降解,造成了后者量的减少,从而减少了HIF-1α与VEGF基因的HRE结合,使VEGF下降。
大量文献认为bFGF参与了低氧性肺血管的重构过程,从而导致HPH的发生发展。因此,本实验探讨了低氧对大鼠血清bFGF表达的影响。bFGF是FGF超家族成员,是由154个氨基酸组成的多肽,存在于多种细胞和组织中,可由内皮细胞、平滑肌细胞、巨噬细胞等分泌,既是生长因子,也是丝裂原,最主要的生物学功能是通过细胞表面的受体刺激多种细胞分裂和增殖,具有极强的促进内皮细胞的迁移和平滑肌细胞的增殖作用,参与了新生血管的形成和内皮细胞的修复[12]。张嫚[13]在研究中证明了正常情况下血清中存在低水平的bFGF,而在低氧时,肺血管内皮受损,破坏了细胞的完整性,进而释放出bFGF。蒋凌志等[14]通过研究证明,在低氧介导的培养肺微血管内皮细胞形成毛细血管过程中,可促进血管平滑肌细胞、内皮细胞等分泌bFGF,低氧时肺组织bFGF及其受体充分表达。本实验结果显示,大鼠血清bFGF的表达量随低氧时间的延长呈逐渐升高趋势,与大多数文献结果一致。杨生岳[15]等研究表明,其机制可能是长期的进行性低氧血症,引起血清bFGF水平和MPAP逐渐增高。致慢性肺心病形成。低氧通过促进肺血管壁bFGF mRNA表达,进而促进bFGF的表达增加。另外,低氧也可通过增加硫酸肝素结合部位,易化bFGF与内皮细胞的相互作用,并通过依赖HIF-1α过程上调硫酸肝素的结合,使内皮细胞对bFGF反应增强;bFGF可刺激血管内皮生长因子合成分泌,促进肺血管内皮细胞增殖,造成肺血管结构重建 ,导致肺动脉压力持续升高并出现不可逆转的损害,最终导致HPH的形成。由此可以认为 ,HPH的形成与低氧所致bFGF的表达增加密切相关。
肺动脉内皮细胞(PAEC)和肺动脉平滑肌细胞(PASMC)在参与HPH的形成中发挥至关重要的作用。本实验透视电镜图显示,低氧导致PAEC和PASMC核染色质聚集,出现空泡、脱落,线粒体肿胀,粗面内质网扩张。实验结果表明低氧导致了肺动脉不同程度的损伤。低氧损伤后,血管内皮细胞形态和结构发生改变,细胞皱缩,线粒体肿胀破裂,细胞凋亡增加[16],且低氧对血管内皮细胞造成的损伤还包括存活率的降低和通透性增高、质膜小泡增多等[17],与本实验结果基本一致。陈灵红[18]认为低氧下营养物质和能量不足引起溶酶体内的一些贮存物质消耗、降解,可能是脂质体和空泡增加的原因。
Tjen-A-Looi S[19]认为,低氧可引起肺血管内皮细胞异常肥大、增殖加速和凋亡异常,使肺血管内皮细胞密度增大,导致肺动脉内膜增厚,使肺动脉管腔狭窄。另有研究表明,低氧使血管调节因子和血管活性物质的合成和分泌失衡,导致血管渗透压升高、抗氧化能力降低等多种低氧性疾病和损伤的发生发展[20-21]。Wright JL[22]也认为,低氧使PAEC分泌功能失调、舒血管活性物质下降、缩血管活性物质异常增多,致低氧性肺血管收缩,使肺血管壁细胞异常增殖,促进低氧性肺血管结构重建,最终产生HPH。因为肺动脉大血管中动脉的内皮细胞的连接是通过复杂的黏附结构(如缝隙连接蛋白)组成,细胞间连接较紧密,缺氧时缝隙连接蛋白重新分布,从而增加了肺血管的通透性[23,24],其抗氧化能力降低,导致肺血管内膜损伤,产生增殖作用,严重者致血管内液渗出、肺血管结构重建等,最终引发HPH。
有研究表明,PASMC的增殖和凋亡的相对比值是引起肺血管结构重塑的关键。低氧状态时,PASMC从高分化的收缩型转换为未分化的合成型[25],迁移至肺血管内膜,分泌增殖大量细胞外基质,导致HPAH的肺血管重塑。大量文献表明,PASMC的增殖在肺血管重建过程中起着至关重要的作用,其机制与多种信号通路的传导有关,如RhOA/ROCK信号通路、MAPK信号通路、Notch信号通路等。
综上所述,本实验通过低压氧舱模拟海拔5 000米的高原低氧环境,研究高原低氧对大鼠血清bFGF、VEGF的表达量影响,及通过透视电镜观察肺动脉结构的变化,初步揭示了肺动脉高压形成的可能机制。研究发现肺动脉高压形成机制复杂,可能有较多的相关因素同时参与,需进行更加系统深入的研究。
[1]李书凯,李娟,孙新,等.κ-阿片肽与一氧化氮在低氧性肺动脉高压大鼠血管内皮功能中作用的研究进展[J].心脏杂志,2011,23(4):538-541.
[2]Weng M,Raher M J,Leyton P,et al.Adiponectin modulates pulmonary vascular remodeling by inhibiting pulmonary artery smooth muscle cell proliferation[J].American Thoracic Society International Conference,2010,181(9):A1184-A1185.
[3]崔建华.缺氧性肺动脉高压形成机制的研究进展[J].西北国防医学杂志,2013,34(3):251-255.
[4]Fujita H,Fukumoto Y,Saji K,et al.Acute vasodilator effects of inhaled fasudil,a specific Rho-kinase inhibitor,in patients with pulmonary arterial hypertension[J].Heart and vessels,2010,25(2):144-149.
[5]刘洋,罗兰,代红燕,等.松果菊苷对低氧性肺动脉高压大鼠血管生长因子的影响[J].中南药学,2016,14(3):263-266.
[6]张召华.慢性高原病大鼠模型血清EPO、VEGF及组织中EPO、EPOR蛋白水平研究[D].青海大学,2016.
[7]谢印芝,杨曦明,张波,等.间断缺氧习服大鼠血浆、肺组织血管内皮生长因子变化及意义[J].中华航空航天医学杂志,2001,12(1):40-42.
[8]Kaur B,Khwaja F W,Severson E A,et al.Hypoxia and the hypoxia-inducible-factor pathway in glioma growth and angiogenesis[J].Neuro-oncology,2005,7(2):134-153.
[9]Wang V,Davis D A,Haque M,et al.Differential gene up-regulation by hypoxia-inducible factor-1 alpha and hypoxia-inducible factor-2 alpha in HEK293T cells[J].Cancer research,2005,65(8):3299-3306.
[10]Liu L X,Lu H,Luo Y,et al.Stabilization of vascular endothelial growth factor mRNA by hypoxia-inducible factor 1[J].Biochemical and biophysical research communications,2002,291(4):908-914.
[11]Wang X,Ma S,Qi G.Effect of hypoxia-inducible factor 1-alpha on hypoxia/reoxygenation-induced apoptosis in primary neonatal rat cardiomyocytes[J].Biochemical and biophysical research communications,2012,417(4):1227-1234.
[12]李斐斐,吴皓,陈璐,等.益肺清化颗粒对Lewis肺癌小鼠VEGF、bFGF、Angiostatin、Endostatin影响的研究[J].中国中西医结合杂志,2013,33(8):1086-1092.
[13]张嫚.不同海拔地区AECOPD患者治疗前后血清中bFGF的变化及意义[D].青海大学,2014.
[14]蒋凌志,吴尚洁.碱性成纤维细胞生长因子与低氧性肺血管重构[J].国外医学呼吸系统分册,2005,25(10):759-762.
[15]杨生岳,沈君礼,冯恩志,等.高原地区肺心病患者血清碱性成纤维细胞生长因子水平与肺动脉压的关系[J].中国危重病急救医学,2006,18(12):727-729.
[16]闫镇楠.间歇性低氧对氧化应激、内皮功能的影响及胆碱抗低氧损伤的内皮细胞保护作用[D].天津体育学院,2015.
[17]刘险峰,张国华.同型半胱氨酸与内科常见病[M].北京:人民军医出版社,2007:1-7.
[18]陈灵红,周兆年.急性低氧和复氧对牛主动脉内皮细胞损伤的研究[J].中国应用生理学杂志,1998,14(1):17-21.
[19]Tjen-A-Looi S,Kraiczi H,Ekman R,et al.Sensory CGRP depletion by capsaicin exacerbates hypoxia-induced pulmonary hypertension in rats[J].Regulatory peptides,1998,74(1):1-10.
[20]Venditti P,Pamplona R,Portero-Otin M,et al.Effect of experimental and cold exposure induced hyperthyroidism on H2O2production and susceptibility to oxidative stress of rat liver mitochondria[J].Archives of biochemistry and biophysics,2006,447(1):11-22.
[21]Xiong M,Cheng G Q,Ma S M,et al.Post-ischemic hypothermia promotes generation of neural cells and reduces apoptosis by Bcl-2 in the striatum of neonatal rat brain[J].Neurochemistry international,2011,58(6):625-633.
[22]Wright J L,Levy R D,Churg A.Pulmonary hypertension in chronic obstructive pulmonary disease:current theories of pathogenesis and their implications for treatment[J].Thorax,2005,60(7):605-609.
[23]Wang H,Long C,Duan Z,et al.A new ATP-sensitive potassium channel opener protects endothelial function in cultured aortic endothelial cells[J].Cardiovascular research,2007,73(3):497-503.
[24]Danon A,Zeevi-Levin N,Pinkovich D Y,et al.Hypoxia causes connexin 43 internalization in neonatal rat ventricular myocytes[J].General physiology and biophysics,2010,29(3):222-233.
[25]陈杨,易斌,鲁开智.低氧肺血管重建中肺动脉平滑肌细胞表型转换相关信号通路研究进展[J].医学研究生学报,2013,26(9):984-987.
EffectofhypoxiaontheexpressionofbFGF,VEGFandtheultrastructuralchangesofpulmonaryarteryinrats#
LI Xiao-jing,LIU Chuan-chuan,LIU Hui-qi,LIU Jie,CAO Xue-feng,WU Qiong,WANG Sheng-lan1*
(1.Department of Pathophysiology,Qinghai University Medical College; 2.Affiliated Hospital of Qinghai University,Xining,Qinghai,810001,China)
ObjectiveTo investigate the effects of hypoxia on the expression of bFGF,VEGF and the structure of pulmonary artery in rats,and to reveal the mechanism of pulmonary hypertension.MethodsThirty healthy male SD rats were randomly divided into 6 groups:Control group,hypoxia 1 day group,hypoxia 7 day group,hypoxia 14 day group,hypoxia 21 day group and hypoxia 30 day group.In addition to Control group,the other five groups were placed in simulated hypoxic chamber of 5 000 meters above sea level for 1,7,14,21 and 30 days,respectively,and the serum and pulmonary arteries of each group were taken.The expressions of bFGF and VEGF in serum were detected by ELISA,and ultrastructural changes of pulmonary arteries were observed by transmission electron microscope.ResultsCompared with the control group,the expression of bFGF in serum increased gradually with the prolongation of hypoxia time(P<0.05),the expression of VEGF in acute hypoxia group was significantly higher than that in control group(P<0.05),with the prolongation of hypoxia time(7,14,21,30 days),serum VEGF levels were decreased compared with the control group.Electron microscopic results showed that hypoxia can lead different degrees of pulmonary artery damage,mainly for the endothelial cell nuclear chromatin aggregation,endothelial cell vacuoles,endothelial cell shedding.Smooth muscle cells,nuclear chromatin aggregation or edge set,cytoplasmic vacuoles,mitochondrial swelling,rough endoplasmic reticulum expansion,etc.ConclusionIn hypoxia environment,the expression of bFGF is increased,the expression of VEGF is increased in acute hypoxia and then decreased,the results show that bFGF is involved in the formation of hypoxic pathophysiological changes.The changes of VEGF are related to the regulation of acute hypoxia. Hypoxia can lead to the structural changes of pulmonary artery endothelial cells and smooth muscle cells.
bFGF VEGF Hypoxia Transmission electron microscopy
R363
A
10.13452/j.cnki.jqmc.2017.03.004
2017-5-8
#:国家自然科学基金(81160031);*:通信作者,硕士,教授,E-mail:zlw6996@163.com 李小静(1991~),女,汉族,湖北籍,在读硕士研究生
