HPLC测定玉米中玉米赤霉烯酮和赭曲霉毒素A
2017-10-11郑睿行周子焱傅晓林成栋沈坚
郑睿行,周子焱,傅晓,林成栋,沈坚
(宁波市食品检验检测研究院,浙江宁波315000)
HPLC测定玉米中玉米赤霉烯酮和赭曲霉毒素A
郑睿行,周子焱,傅晓,林成栋,沈坚*
(宁波市食品检验检测研究院,浙江宁波315000)
建立玉米中玉米赤霉烯酮(Zearalenone,ZEN)和赭曲霉毒素A(Ochratoxin A,OTA)的超高效液相色谱检测方法。样品用乙腈/水(90∶10,体积比)振荡提取,过滤后过真菌毒素净化柱,取上清液氮气吹干,用流动相溶解残渣,过0.22 μm有机滤膜于进样瓶,采用高效液相色谱检测法(High Performance Liquid Chromatography,HPLC)分析。在ZORBAX SB-C18反相柱上分离后,ZEN以甲醇/水(60∶40,体积比)作为流动相,OTA以乙腈/水/乙酸(43∶56∶1,体积比)为流动相,荧光检测器检测。ZEN的线性范围为0.5 μg/mL~6.0 μg/mL,相关系数大于0.99;OTA的线性范围为0.05 μg/mL~0.8 μg/mL,相关系数大于0.99。3个不同水平的加标平均回收率为86.4%~114.1%,相对标准偏差不大于10%。ZEN和OTA的检测限分别为5.0 μg/kg和1.0 μg/kg。应用该方法对收集的不同玉米样品进行测定,发现ZEN和OTA污染较严重,超标率均为71.4%。该方法具有操作简单、灵敏度高、重现性好等特点,能够用于玉米样品中真菌毒素的测定。
玉米;玉米赤霉烯酮;赭曲霉毒素A;超高效液相色谱检测
Abstract:Determination method of zearalenone(ZEN)and ochratoxin A(OTA)in corn by high-performance liquid chromatography (HPLC)was established.Acetonitrile/water(90 ∶10,volume ratio)for the extraction solvent extracted zearalenone and ochratoxin A in corn,clean-up column purification;then the supernatant was dried by nitrogen,with the mobile phase to dissolve the residue,through the 0.22 μm organic filter to the inlet,HPLC detection.Methanol/water(60∶40,volume ratio)was used as mobile phase for ZEN,and acetonitrile/water/acetic acid(43 ∶56 ∶1,volume ratio)for OTA.The linearity range of ZEN and OTA were 0.5 μg/mL-6.0 μg/mL and 0.05 μg/mL-0.8 μg/mL,respectively,with correlation coefficient>0.99.Recovery experiments were conducted by adding standard into the corn sample,with recoveries of 86.4%-114.1%,relative standard deviation of less than10%.The detection limit of ZEN and OTA were 5.0 μg/kg and 1.0 μg/kg,respectively.Different corn samples were found to be highly contaminated by ZEN and OTA using the method,with 71.4%of excessive rate.The method is simple and fast,good reproducibility,suitable for ZEN and OTA detection in the actual application.
Key words:corn;zearalenone;ochratoxin A;high performance liquid chromatography(HPLC)
玉米是我国重要的粮食作物和工业原料,经常用作食品配料和饲料原料。由于环境、气候和储藏因素的影响,玉米极易污染霉菌,在适宜的温度、水分和湿度条件下,这些霉菌会产生真菌毒素,其中玉米赤霉烯酮(Zearalenone,ZEN)和赭曲霉毒素A(Ochratoxin A,OTA)是比较常见的两种真菌毒素[1]。ZEN主要是由镰刀菌属(Fusarium)的菌株产生的类雌激素化合物,可对人和动物造成多种毒性作用。而由于ZEN的雌激素作用,生殖系统是其主要的靶器官[2]。研究表明ZEN对雌性和雄性的生殖力都会造成损伤,其中猪对ZEN最为敏感,食用ZEN污染的饲料可导致母猪外阴及乳腺肿胀,甚至引发阴道和直肠脱落[3]。OTA主要是由赭曲霉和青霉属产生的有毒次级代谢产物,在农产品中广泛存在。OTA可对很多动物物种造成毒性,其中肾脏是主要的靶器官。研究表明OTA可以导致肾病和人类巴尔干地方性肾病[4]。国际癌症研究机构将OTA列为可能的人类致癌物。
ZEN和OTA污染的玉米被人和动物食用后,会对人和动物的健康造成极大地危胁,因此建立高效而准确检测玉米中ZEN和OTA的方法十分重要。目前ZEN和OTA的检测方法主要包括免疫法、薄层色谱法、高效液相色谱法、气相色谱-质谱法和高效液相色谱-质谱法等[5-7]。但是免疫法、薄层色谱法的准确度不够高,而质谱法对仪器和操作要求较高,因此目前高效液相色谱法是最常用的检测方法。所用的样品前处理技术包括液-液萃取和固相萃取,前者操作繁琐且需要使用大量的有机溶剂,后者常用到免疫亲和柱。但是免疫亲和柱操作繁琐且价格昂贵。本文通过固液萃取法同时提取玉米中的ZEN和OTA,选用真菌毒素净化柱分离杂质,对国标中的前处理方法进行了简化,高效液相色谱进行分离检测,实现玉米中ZEN和OTA的快速检测。
1 材料与方法
1.1 材料和试剂
ZEN和OTA污染玉米:河南洛阳;ZEN、OTA标品(纯度≥98.0%):上海百灵威公司;甲醇、乙腈(色谱纯):美国Fisher Scientific公司;氮气:江苏无锡新南气体有限公司;其它分析纯试剂均购自上海百灵威公司。
1.2 仪器与设备
Agilent HPLC 1260高效液相色谱仪:美国安捷伦科技有限公司;MD200-1氮气吹干仪:杭州奥盛仪器有限公司;Simplicity UV超纯水制备系统:法国Millipore公司。
1.3 方法
1.3.1 标准溶液的配置
准确称取适量的ZEN和OTA标准品,分别用甲醇和乙腈配成浓度为100 μg/mL的标准储备液,-20℃冰箱中避光保存。使用前用甲醇/水(60∶40,体积比)将ZEN 标准储备液稀释成 0.5、1、2、4、6 μg/mL 的标准工作液,用乙腈/水/乙酸(43∶56∶1,体积比)将 OTA 标准储备液稀释成 0.05、0.1、0.2、0.4、0.6、0.8 μg/mL 的标准工作液。上述标准工作液置于4℃冰箱中待HPLC分析。
1.3.2 玉米样品的前处理
取一定量的玉米籽粒磨粉并过30目筛,然后称量25 g玉米粉于150 mL具塞锥形瓶中。向锥形瓶中加入100 mL乙腈/水(90∶10,体积比)溶液,在摇床上振荡45 min(30℃,200 r/min)。将提取液过滤得到上清液,取4 mL上清液通过净化柱(PuriToxSR M160),收集2 mL流出液于5 mL聚乙烯离心管中;另外取4mL上清液通过赭曲霉毒素A专用净化柱(PuriToxSR O130 Ochratoxin Column),收集2 mL流出液于5 mL聚乙烯离心管中。将上述液体于55℃下氮气吹干后,分别用流动相复溶,漩涡振荡器振荡40 s,过0.22 μm有机滤膜于进样瓶中,等待HPLC分析。
1.3.3 液相色谱条件
色谱柱:ZORBAXSB-C18(150 mm×4.6 mm,5 μm);柱温:30℃;ZEN 流动相:甲醇/水(60∶40,体积比);流速:1.0 mL/min;进样量:20 μL;荧光检测器:激发波长274 nm,发射波长 440 nm;OTA 流动相:乙腈/水/乙酸(43 ∶56 ∶1,体积比);流速:0.9 mL/min;进样量:20 μL;荧光检测器:激发波长333 nm,发射波长477 nm。
1.3.4 定性和定量
根据国标采用外标法定量,保留时间定性,样品中目标化合物色谱峰的保留时间必须与标准品色谱峰一致,同时向污染玉米中加标,通过比较目标峰的变化加以验证。
2 结果与讨论
2.1 提取溶剂的确定
ZEN和OTA都易溶于甲醇、乙腈、丙酮和乙酸乙酯等极性溶剂。考虑到丙酮和乙酸乙酯毒性较大,通常采用甲醇和乙腈作为提取溶剂。根据国标,ZEN采用乙腈/水(90∶10,体积比)作为提取溶剂,而OTA采用甲醇/水(80∶20,体积比)作为提取溶剂,考虑到分别提取过程繁琐,所以采用一种提取剂同时提取两种目标化合物。相比甲醇,乙腈更能减少蛋白质、糖类、氨基酸和酶类的溶解性,避免它们对目标物的干扰,因此选用乙腈/水(90∶10,体积比)作为两者的共同提取溶剂,同时为了考察乙腈/水对于OTA的提取效果,本试验分别用乙腈/水(90∶10,体积比)和甲醇/水(80∶20,体积比)提取玉米中的OTA,见图1和图2。
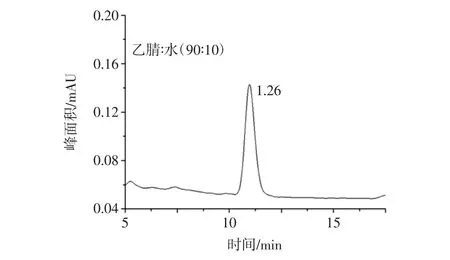
图1 提取溶剂为乙腈∶水(90∶10,体积比)时OTA的峰面积Fig.1 The peak area of OTA by extraction of acetonitrile/water(90 ∶10,volume ratio)

图2 提取溶剂为甲醇∶水(80∶20,体积比)时OTA的峰面积Fig.2 The peak area of OTA by extraction of methanol/water(80 ∶20,volume ratio)
结果表明,当分别采用两种提取剂时,OTA的峰面积没有显著差异,乙腈/水(90∶10,体积比)对OTA同样具有较好的提取效果。因此,本试验确定乙腈/水(90∶10,体积比)为样品提取溶剂。
2.2 分离小柱的选择
在不同过柱条件下ZEN和OTA的回收率见图3。

图3 不同过柱条件下ZEN和OTA的回收率Fig.3 The recoveries of ZEN and OTA by different columns
向玉米粉中添加30 μg/kg的ZEN和10 μg/kg的OTA,按照1.3.2描述的方法进行前处理,除过柱条件不同外,其他步骤均相同。其中免疫亲和柱的步骤参照GB/T 5009.209-2008《谷物中玉米赤霉烯酮的测定免疫亲和层析净化高效液相色谱法》[8]和GB/T 23502-2009《食品中赭曲霉毒素A的测定》[9]。结果表明,当使用净化柱时,玉米粉中ZEN和OTA的回收率最高,对于ZEN,过免疫亲和柱和不过柱子回收率没有显著差异,而对于OTA,不过柱子回收率偏低,且杂峰较多。本试验所用净化柱对玉米样品中真菌毒素的提取回收率比免疫亲和柱回收率要高,其对ZEN和OTA的回收率均在90%~95%;另外其操作步骤更为简便,净化前也不需进行活化、淋洗和洗脱等操作只需直接上样,有效地减少了有机溶剂的使用和浪费。
2.3 样品定性
ZEN、OTA标品加标后的色谱图见图4和图5。

图4 玉米样品中ZEN的定性Fig.4 The qualitative determination of ZEN in corn
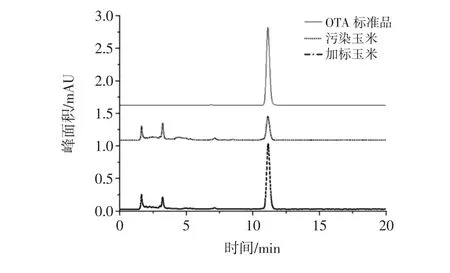
图5 玉米样品中OTA的定性Fig.5 The qualitative determination of OTA in corn
ZEN和OTA的定性采用保留时间,当保留时间和标准品色谱峰的保留时间一致时认为是目标化合物的色谱峰。本研究采用加标法对该定性方法进行确认,防止其他化合物的干扰。结果表明,污染玉米和污染玉米加标后均在与标品的保留时间一致处出现了色谱峰,且加标玉米的色谱峰峰高明显大于污染玉米的色谱峰。这表明采用保留时间定性能够确定目标化合物的存在。
2.4 线性关系、检出限和回收率
测定1.3.1中系列标准液,得到ZEN和OTA的外标工作曲线见表1。
如表1 所示,ZEN 在 0.5 μg/mL~6 μg/mL,OTA 在0.05 μg/mL~0.8 μg/mL 范围内线性良好。方法的检出限以加标样品色谱峰S/N≥3确定,结果见表2。

表1ZEN和OTA的线性曲线Table 1 The standard curve of ZEN and OTA

表2 玉米中ZEN和OTA的加标回收率Table 2 The recoveries of ZEN and OTA
精确称取25 g玉米粉,分别加入ZEN和OTA标准液,使ZEN和OTA在玉米粉中的浓度分别为30、60、120 μg/kg和 2.5、5、10 μg/kg。按照优化的条件进行处理和测定,外标法定量。从表2可以看出,2种目标化合物在各自的3个加标水平下回收率为86.4%~114.1%,RSD小于10%,符合国际上对于食品污染物残留检测的要求。
2.5 实际样品测定
收集不同品种的玉米,按照1.3.2优化方法测定,结果如表3所示。
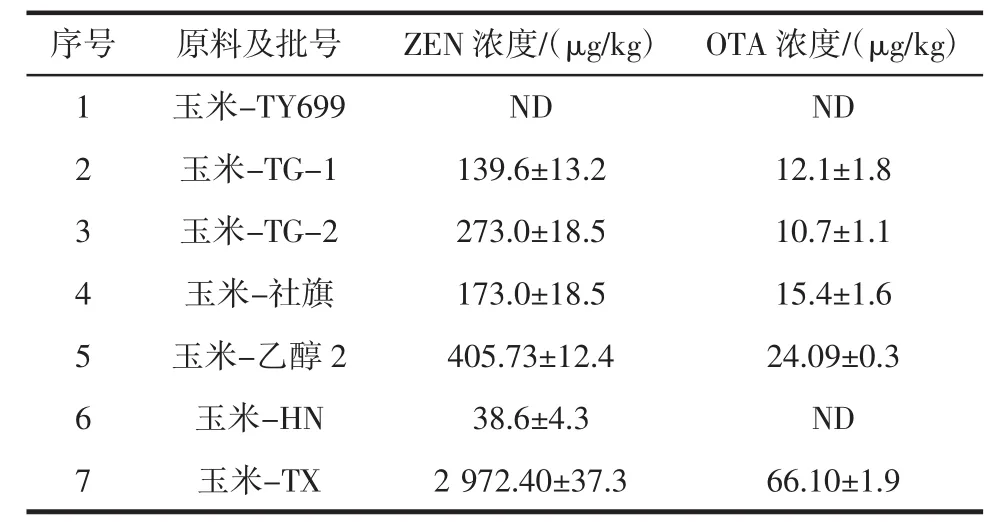
表3 不同玉米样品中ZEN和OTA含量Table 3 Determination of ZEN and OTA in corn samples
数据表明,7个玉米样品中ZEN的阳性检出率为85.7%,超标率 71.4%(≤60 μg/kg)[10];OTA 阳性检出率和超标率均为 71.4%(≤5 μg/kg)[10]。百奥明公司调查了2009年~2011年全球7049份农产品中的真菌毒素含量,其中ZEN和OTA的阳性率分别为45%和28%[11]。李荣涛等[12]利用单克隆抗体生物免疫技术测定了48份小麦样本和33份玉米样本,发现玉米赤霉烯酮的检出率为 100%,含量为 18 μg/kg~730 μg/kg。相比这些结果,本研究中玉米样品中ZEN和OTA污染较严重,这主要是由于取样不同造成的。本试验所采集的样品主要用于后期真菌毒素脱毒研究,因此一般会采集污染较严重玉米。
3 结论
本文建立玉米中ZEN和OTA的超高效液相色谱检测方法。该方法对国标中的方法进行了简化,在所测定的范围内,该方法的线性良好,回收率高,重现性好,符合玉米样品中痕量污染物检测的要求。本方法代替了免疫亲和柱的使用,减少了有机试剂的使用,使操作更加简单。另外对收集的玉米样品进行测定,ZEN和OTA污染较严重,因此应该加强对粮食中真菌毒素的检测和监管工作。
[1]单安山,周长路,张圆圆,等.东北地区不同饲料原料中霉菌毒素含量的测定[J].东北农业大学学报,2013(6):96-100
[2]Zinedine A,Soriano JM,Molto JC,et al.Review on the toxicity,occurrence,metabolism,detoxification,regulations and intake of zearalenone:an oestrogenic mycotoxin[J].Food and chemical toxicology,2007,45(1):1-18
[3]Shier WT,Shier AC,Xie W,et al.Structure-activity relationships for human estrogenic activity in zearalenone mycotoxins[J].Toxicon,2001,39(9):1435-1438
[4]Pfohl-Leszkowicz A,Manderville RA.Ochratoxin A:An overview on toxicity and carcinogenicity in animals and humans[J].Molecular nutrition&food research,2007,51(1):61-99
[5]李沐洁.玉米赤霉烯酮和赭曲霉毒素A免疫快速检测技术的建立与应用[D].杭州:中国计量学院,2012
[6]王向红,刘涛,王忠斌,等.高效液相色谱法同时测定谷物中的赭曲霉毒素和玉米赤霉烯酮[J].中国食品学报,2008(5):148-152
[7]赵孔祥,胡筱芸,何佳,等.免疫亲和净化-液相色谱-串联质谱测定中成药中14个真菌毒素[J].药物分析杂志,2012(5):846-851
[8]中华人民共和国卫生部.GB/T 5009.209-2008谷物中玉米赤霉烯酮的测定[S].北京:中国标准出版社,2008:1-5
[9]中华人民共和国卫生部.GB/T 23502-2009食品中赭曲霉毒素A的测定免疫亲和层析净化高效液相色谱法[S].北京:中国标准出版社,2009:1-6
[10]中华人民共和国卫生部.GB 2761-2011,食品安全国家标准食品中真菌毒素限量[S].北京:中国标准出版社,2011:1-9
[11]Rodrigues I,Naehrer K,张艳,等.百奥明:2012年全球霉菌毒素调查报告[J].中国畜牧杂志,2013(14):15-18,23
[12]谢刚,兰盛斌,张华昌,等.免疫亲合柱在小麦真菌毒素检测中的应用及毒素污染分析[J].粮食储藏,2004(6):37-40
Determination of Zearalenone and Ochratoxin A in Corn by Means of HPLC
ZHENG Rui-hang,ZHOU Zi-yan,FU Xiao,LIN Cheng-dong,SHEN Jian*
(Ningbo Institute for Food Control,Ningbo 315000,Zhejiang,China)
2017-01-19
10.3969/j.issn.1005-6521.2017.19.030
郑睿行(1982—),男(汉),高级工程师,硕士研究生,研究方向:食品质量安全检验。
*通信作者:沈坚(1966—),男(汉),高级工程师,本科,研究方向:食品质量安全检验。
