丁香疫霉热处理方法的比较与分析
2017-10-11刘娟楼阁王娓辰程瑜杨茜姜涛王伟魏亚东
刘娟,楼阁,王娓辰,程瑜,杨茜,姜涛,王伟,魏亚东
(天津出入境检验检疫局,天津300457)
丁香疫霉热处理方法的比较与分析
刘娟,楼阁,王娓辰,程瑜,杨茜,姜涛,王伟,魏亚东*
(天津出入境检验检疫局,天津300457)
对丁香疫霉不同热处理的方法进行比较与分析。对丁香疫霉分别使用热水、干热和蒸热3种不同的热处理方式,每种处理方式均设置不同温度梯度、处理时间进行处理,相同培养条件下观察其菌丝体的生长情况。试验表明热水处理条件下50℃以上,超过2 min离体丁香疫霉菌丝体没有生长。干热处理条件下50℃处理15 min离体丁香疫霉菌丝体没有生长。蒸热处理条件下50℃处理10 min离体丁香疫霉菌丝体没有生长。综合比较分析,得到处理效果热水处理>蒸热处理>干热处理,热水处理作为检疫性丁香疫霉菌丝的最佳抑制方式。
丁香疫霉;热水处理;干热处理;蒸热处理
Abstract:The methods of different heat treatment ofPhytophthora syringaewerecompared and analyzed.Three different heat treatments:hot water,hot air and hot vapor air were used forPhytophthora syringae,and each treatment method was set to different temperature gradients and processing time to observe the growth of mycelium under the same culture conditions.The tests show that:after hot water treatment above 50 ℃ for more than 2 minutes,Phytophthora syringaein vitro did not grow.At 50 ℃ hot air treatment conditions for 15 minutes,Phytophthora syringaein vitro did not grow.Under 50℃ hot vapor air treatment condition for 10 minutes,Phytophthora syringaein vitro did not grow.After a comprehensive comparative analysis,the effect of the three treatments is hot water treatment> hot air treatment> hot vapor air treament,and hot water treatment were proved to be the best suppression mode forPhytophthora syringae.
Key words:Phytophthora syringae;hot water treatment;hot air treatment;hot vapor air treatment
柑橘是我国进口量较大的一种水果,2015年进口21.49万吨,货值2.67亿美元[1]。与2014年[2]相比分别增长了32.82%和16.09%。从进口柑橘的类别来看,我国进口最多的柑橘类水果是甜橙,占进口量一半以上,其次是柠檬来檬、柚类和宽皮柑橘。但柑橘属水果多会携带有害生物,多达350余种,仅美国和意大利柑橘携带的检疫性有害生物就涉及昆虫、螨、线虫、真菌和病毒四大类,39种检疫性有害生物。其中丁香疫霉病菌因危害严重、扩散性强、无有效的检疫处理手段而成为对我国水果生产安全危害最为严重的外来有害生物之一[3-5]。
丁香疫霉菌[Phytophthora syringae(Berk.)Kleb.],属藻菌界(Chromista),卵菌门(Oomycota),腐霉目(Pythiaceae),疫霉属(Phytophthora)。可引起寄主的根、茎、叶、果实的多种病害。病菌在柑橘的所有生长阶段均产生危害,导致果腐(brown rot of fruit)、根腐(root rot)、树干基部的脚腐(foot rot)、果实和枝干的流胶病(gummosis of citrus)[6]。目前,丁香疫霉在欧洲、北美洲、南美洲、非洲和亚洲等均有分布。主要分布于美国、加拿大、阿根廷、巴西、意大利等国家。2011年2月12日,天津出入境检验检疫局从美国进口的脐橙[Citrus sinensis(L.)Osbeck]中截获到丁香疫霉,这是我国首次从进口的水果中截获到丁香疫霉[7]。
对于丁香疫霉的处理方法,目前国内外对此研究的报道甚少。Adaskaveg和Forster[8]使用磷酸钾对丁香疫霉菌丝体进行处理,并取得较好的效果[9-11]。但是长期使用杀菌剂会对环境造成污染,对抗原菌本身造成抗药性。近年来,热处理方法因为具有操作简便、无污染、无残留的优点而广泛应用于柑橘采后病虫害的防治中,成为替代药剂处理的最佳方法[12-14]。
热处理技术能抑制病原菌的原理是利用高于病原菌最适宜生长温度条件,使病原菌蛋白质(酶)、核酸和脂类等重要生物高分子发生降解或改变其空间结构,从而变性或破坏,新陈代谢无法正常进行,最终导致死亡。目前的热处理技术主要有:低温热处理(Curing)、蒸热处理(Vapor air)、干热(Hot air treatment,HAT)、热水处理(Hot water treatment,HWT)和热处理与其他处理相结合等方法。而使用较多的是热水处理和热空气处理[15]。
本文就不同温度、不同时间的热水、蒸热、干热3种方式对丁香疫霉处理后进行日常观测,分析最佳热处理方式,旨在为进境柑橘属水果丁香疫霉的处理工作提供理论依据。
1 材料与方法
1.1 试验材料
供试丁香疫霉菌株:天津检验检疫局截获的美国脐橙;PDA培养基:天津川禾医疗科技有限公司。
WNB20型恒温水浴摇床(控温范围:10℃~95℃,控制精度:±1℃)、UF160Plus型烘箱(控温范围20℃~300℃,精度±0.1 K):德国 Memmert公司;蒸热处理箱(控温范围:-5℃~100℃,均匀度:≤2℃,温度偏差:≤±2℃,湿度范围:30%R.H~98%R.H,湿度偏差:≤±5%R.H):重庆威尔公司;177-T4型温度计(量程:-200℃~1 000℃,测温精度:±0.5%):德国 TESTO 公司;MIR-554-PC低温恒温培养箱(控温范围-10℃~60℃,控制精度±0.5℃):日本Panasonic公司。
1.2 试验方法
1.2.1 丁香疫霉菌丝体离体热水处理
设定45、50、55、60℃4个温度梯度。每个温度梯度下分别设置1、2、3 min 3个时间梯度。每个处理重复3次,每个重复1管丁香疫霉菌丝体。对照组放入25℃无菌水中浸泡2 min。在2 mL的PCR管中加入1.5 mL无菌水,用温度计测量管内水温,调节水浴锅温度,使实测温度与预设温度差值小于0.5℃。从水浴锅中迅速挑出菌丝加入PCR管中,然后放入水浴锅内按预设时间进行处理。处理后立即将带有菌丝体的PCR管插入冰盒中降温,待温度下降后,取出PCR管,将菌丝挑入PDA培养基中。而后将接种有丁香疫霉的培养基放入培养箱中在15℃条件下储存。每天用十字交叉法测量培养皿中的菌落直径。持续观察30 d,如果菌落直径不增长,则视为该处理可杀灭丁香疫霉。试验结果以平均值±标准偏差表示。
1.2.2 丁香疫霉菌丝体离体干热处理
设定 40℃下处理 35、40、45 min,45℃下处理 15、20、25 min,以及 50℃下处理 5、10、15 min,共 9个处理。每处理重复3次,每重复1个培养皿。将丁香疫霉接种到PDA培养基上,15℃下培养12 h后进行干热处理。对照置于室温环境下,不进行干热处理。处理时先将烘箱温度调节到设定的温度,待烘箱实测温度稳定在设定温度的±0.5℃之间时,打开仓门放入培养皿。当烘箱实测温度恢复至设定温度的±0.5℃之间时,开始计时。干热完成后将接种有丁香疫霉的培养基放入培养箱中在15℃条件下储存。每天用十字交叉法测量培养皿中的菌落直径。持续观察30 d,如果菌落直径不增长,则视为该处理可杀灭丁香疫霉。试验结果以平均值±标准偏差表示。
1.2.3 丁香疫霉菌丝体离体蒸热处理
试验在96%饱和蒸汽压下,设定40℃下处理10、15、20 min,45℃下处理 2、5、10 min,以及 50℃下处理2、5、10 min,共9个处理。每处理重复3次,每重复1个培养皿。将丁香疫霉接种到PDA培养基上,15℃下培养12 h~24 h后进行蒸热处理。对照置于室温环境下,不进行蒸热处理。处理时先将蒸热处理箱温度调节到设定的温度,待烘箱实测温度稳定在设定温度的±0.5℃之间,RH达到96%时,打开仓门放入培养皿,培养皿盖打开。当恒温恒湿箱相对湿度达到96%,实测温度温度恢复至设定温度的±0.5℃之间时,开始计时。蒸热完成后将接种有丁香疫霉的培养基放入培养箱中在15℃条件下储存。每天用十字交叉法测量培养皿中的菌落直径。持续观察30 d,如果菌落直径不增长,则视为该处理可杀灭丁香疫霉。试验结果以平均值±标准偏差表示。
2 结果与分析
2.1 丁香疫霉菌丝体离体热水处理效果分析
丁香疫霉菌丝体离体热水处理效果见表1。
由表1可见,对照组的菌落增长速度最快,与热水处理后相比,未处理的丁香疫霉菌落增长值与处理后多个数据能表现出显著差异。对照组在第10天时菌落即将长满培养皿。第10天时,经50℃处理2 min、50℃处理3 min、55℃处理2 min和60℃处理2 min的丁香疫霉菌落均未增长,与对照组相比差异最为显著。经过热水处理后的菌落生长情况依照处理时间长短表现出差异显著。经处理后的菌落生长速度显著低于对照,说明热水处理对丁香疫霉的生长起到了抑制作用。经连续观察30 d,这几个处理的丁香疫霉菌落也未增长,说明50℃热水处理2 min、50℃热水处理3 min、55℃热水处理2 min和60℃热水处理2 min可有效杀灭离体条件下的丁香疫霉。
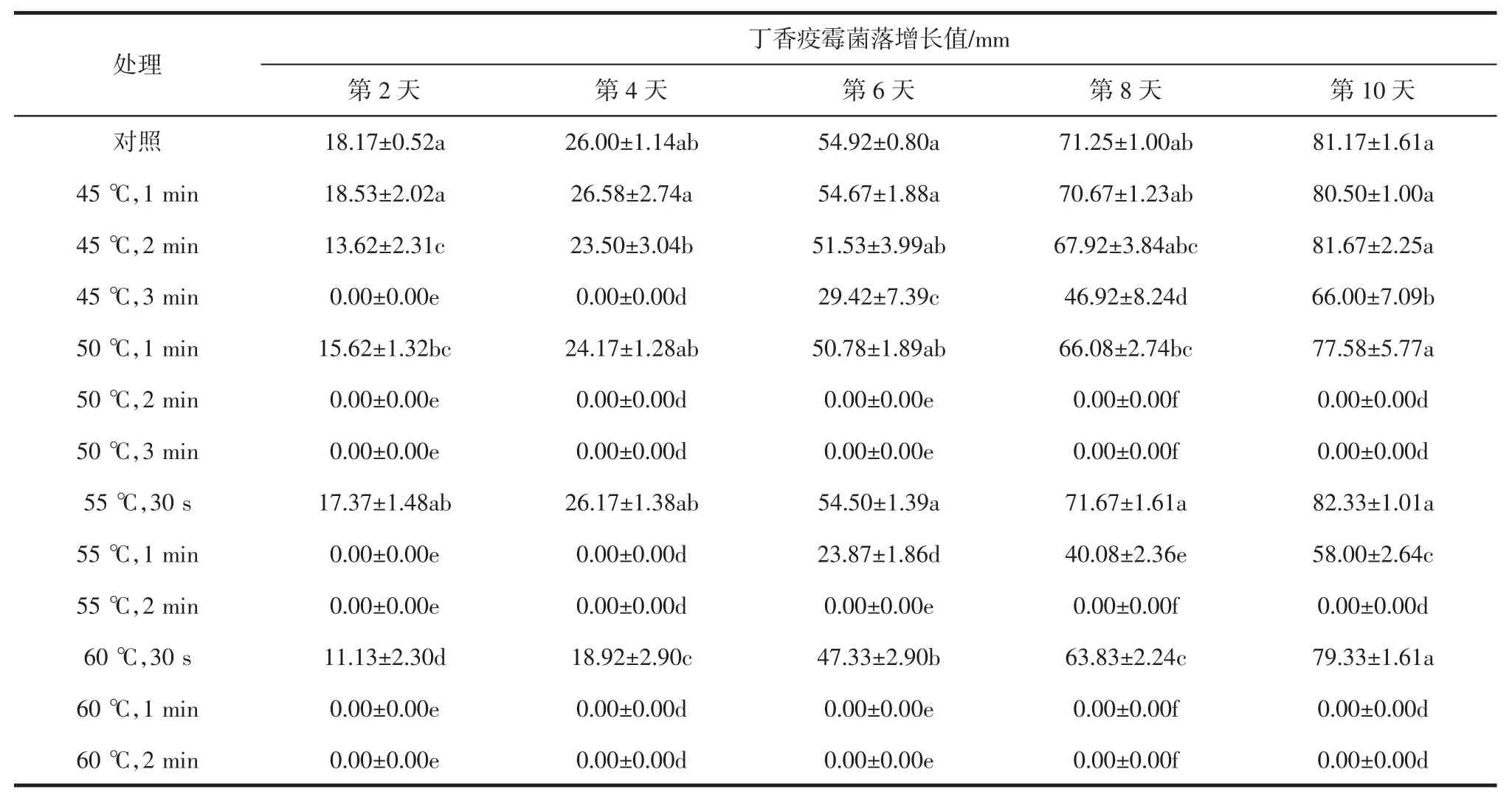
表1 丁香疫霉菌丝体离体热水处理效果Table 1 Effects of Hot water treatment on myceliumofP.syringaein vitro
2.2 丁香疫霉菌丝体离体干热处理效果分析
丁香疫霉菌丝体离体干热处理效果见表2。
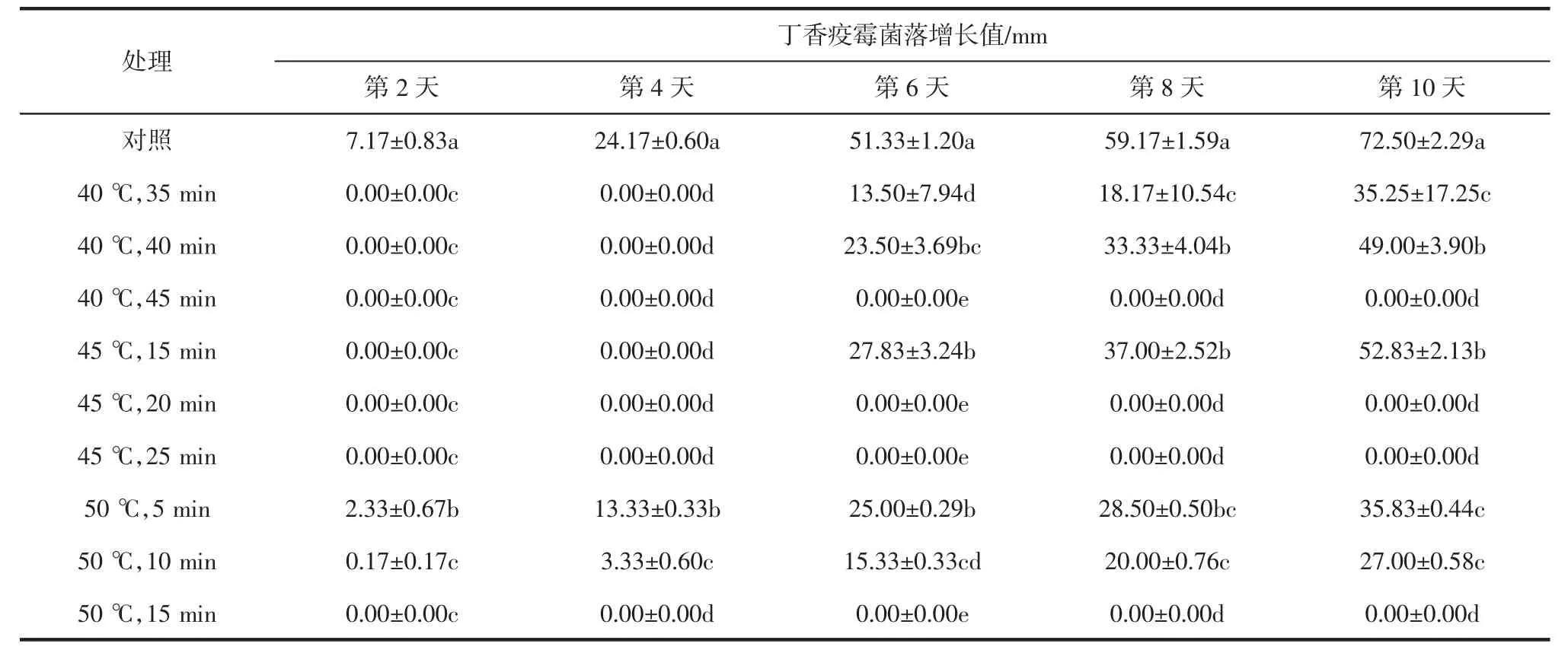
表2 丁香疫霉菌丝体离体干热处理效果Table 2 Effects of Hot air treatment on mycelium ofP.syringae in vitro
由表2可见,对照组的菌落增长速度最快,与干热处理后相比,未处理的丁香疫霉菌落增长值与处理后多个数据能表现出显著差异。对照组在第10天时菌落即将长满培养皿。第10天时,经40℃处理45 min、45℃处理20 min、45℃处理25 min和50℃处理15 min的丁香疫霉菌落均未增长,与对照组相比差异最为显著。经过干热处理的菌落生长速度显著低于对照,说明干热处理对丁香疫霉的生长具有抑制作用。经连续观察30 d,这几个处理的丁香疫霉菌落也未增长,说明40℃干热处理45 min、45℃干热处理20 min和50℃干热处理15 min可有效杀灭离体条件下的丁香疫霉。
2.3 丁香疫霉菌丝体离体蒸热处理效果分析
丁香疫霉菌丝体离体蒸热处理效果见表3。
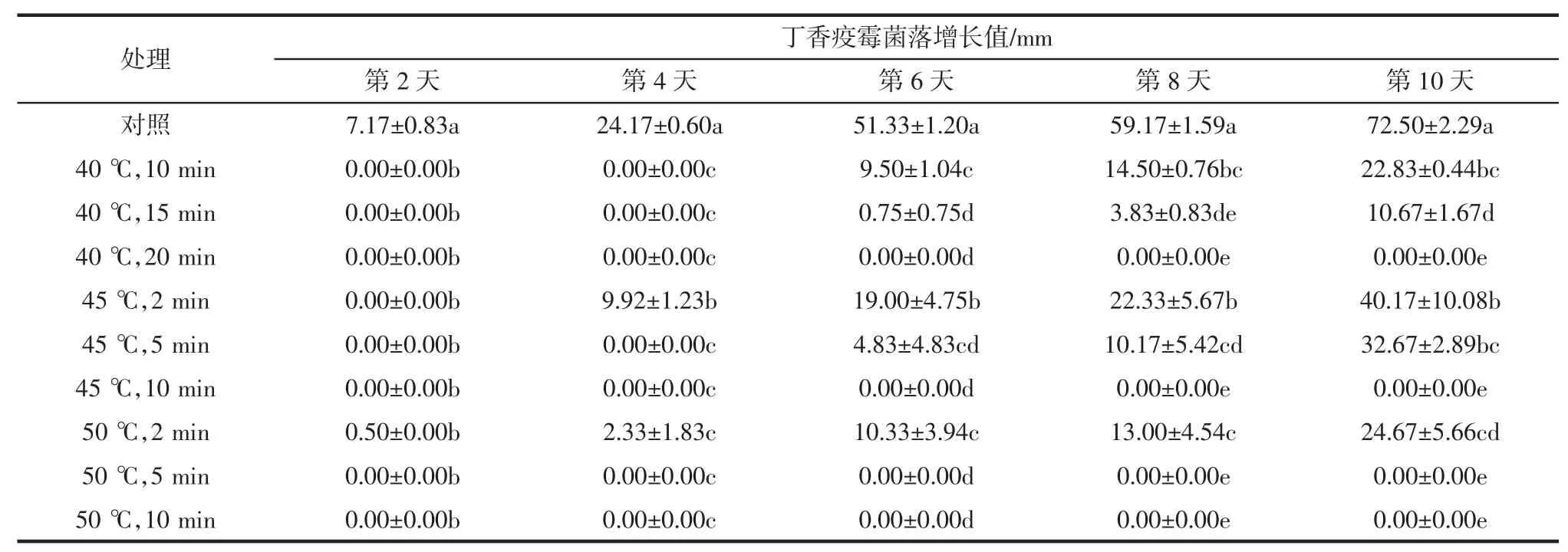
表3 丁香疫霉菌丝体离体蒸热处理效果Table 3 Effects of Hot vapor air treatment on mycelium ofP.syringae in vitro
由表3可见,对照组的菌落增长速度最快,与蒸热处理后相比,未处理的丁香疫霉菌落增长值与处理后多个数据能表现出显著差异。对照组在第10天时菌落即将长满培养皿,第10天时,经40℃处理20 min、45℃处理10 min、50℃处理5 min和50℃处理10 min的丁香疫霉菌落均未增长。与对照组相比差异最为显著。第10天此时经过蒸热处理的菌落均未长满。经处理后的菌落生长速度显著低于对照,说明蒸热处理对丁香疫霉的的生长具有抑制作用。经连续观察30 d,这几个处理的丁香疫霉菌落也未增长,说明40℃蒸热处理20 min、45℃蒸热处理10 min和50℃蒸热处理10 min,可有效杀灭离体条件下的丁香疫霉。
3 结论与讨论
比较离体丁香疫霉菌丝体在热水处理、干热处理、蒸热处理3种不同处理条件下的生长情况。试验表明:1)随处理温度和处理时间的提高,几种处理方式对丁香疫霉具有良好的抑制效果。相同处理温度下,处理时间越长,抑制效果越好。相同处理效果下,处理温度越高,处理所需时间越短。2)热水处理条件下50℃处理2 min、50℃处理3 min、55℃处理2 min和60℃处理2 min可有效杀灭离体条件下的丁香疫霉;干热处理条件时,40℃处理45 min、45℃处理20min和50℃处理15 min可有效杀灭离体条件下的丁香疫霉;蒸热处理时,40℃处理20 min、45℃处理10 min和50℃处理5 min可有效杀灭离体条件下的丁香疫霉。
综上所述,用50℃热水处理超过2 min即可有效杀灭丁香疫霉,相较于干热处理和蒸热处理效果最佳。蒸热处理的效果又优于干热处理。因此,3种热处理的处理效果为热水处理>蒸热处理>干热处理。热水处理效果最佳是因为水比空气的热传递效率更高,并具有清洗消毒的作用。同时,热水处理的加工成本仅为传统热空气处理的10%[16],从处理效果和处理效率上来讲都是一种理想的处理方法。本试验仅对离体条件下的丁香疫霉菌进行了处理,在今后的研究中,应着力研究热水处理对柑橘属水果携带的丁香疫霉菌的处理效果。
[1]吕秋香,张放.2015年我国柑桔鲜果进出口统计分析[J].中国果业信息,2016,33(6):16-24
[2]张放.2014年我国柑桔鲜果进出口统计分析[J].中国果业信息,2015,32(5):14-22
[3]张秋娥,饶玉燕,何友元,等.丁香疫霉随美国柑橘果实传入我国风险分析[J].植物检疫,2012,26(2):37-40
[4]国家质量监督检验检疫总局.美国输华柑橘有害生物风险分析报告[R].北京:中国人民共和国国家质量监督检验检疫总局,2008
[5]国家质量监督检验检疫总局.意大利柑橘风险分析考察报告[R].北京:中国人民共和国国家质量监督检验检疫总局,2012
[6]中华人民共和国国家质量监督检验检疫总局.SN/T 2756-2011丁香疫霉菌检疫鉴定方法[S].北京:中国标准出版社,2011:1-7
[7]国家质量监督检验检疫总局.关于加强对进口美国柑桔检验检疫的警示通报 (质检动函 [2011]62号)[EB/OL].(2011-04-02)[2015-07-03].http://www.xs.zip.gov.cn/dqj/xiaoshan/UploadFiles/dzc/2011070816120374918.doc
[8]Adskaveg J E,Forster H.Integrated postharvest strategies for management of phytophthora brown rot of citrus in the United States//Prusky D,Gullino M L.Post-harvest pathology,plant pathology in 21stcentury[M].Switzerland:Springerinternational publishing,2014:123-131
[9]Smilanick M,Mansour M F,Margosan D A,et al.Influnence of pH and NaHCO3on effectivensess of imazalil to inhibit germination of Penicilluium difitatum and to control postharvest green mold on citrus fruit[J].Plant Disease,2005,89:640-648
[10]Smilanick M,Zhang J.Post-harvest citrus diseases and their control[J].Outlooks Pest Manage,2004,15:29-35
[11]Forster H,Vilchez M,Adaskaveg J E.Phosphonate,carboxylic acid amide,and benzamide treatments for pre and postharvest management of citrus brown rot[J].Phytopathology,2013,2(103):132-138
[12]Couey H M.Heat treatment for control of postharvest diseases and insect pests of fruits[J].Hortscience,1989,24:198-202
[13]Porat R,Daus A,Weiss B,et al.Reduction of postharvest decay in organic citrus fruit by a short hotwater brushing treatment[J].Postharvest biology and technology,2000,2(24):151-157
[14]Lurie S.Postharvest heat treatments[J].Postharvest biology and technology,1998,14:257-269
[15]程瑜,刘娟,魏亚东,等.柑橘采后热处理技术研究进展[J].天津农业科学,2016,22(3):86-91
[16]程瑜,张瑞峰,张莹,等.热水处理对丁香疫霉和脐橙的处理效果研究初报[J].植物检疫,2016,30(1):25-28
Comparison and Analysis of Phytophthora syringae Heat Treatment Method
LIU Juan,LOU Ge,WANG Wei-chen,CHENG Yu,YANG Xi,JIANG Tao,WANG Wei,WEI Ya-dong*
(Tianjin Entry-exit Inspection and Quarantine Bureau,Tianjin 300457,China)
2017-01-04
10.3969/j.issn.1005-6521.2017.19.042
质检公益性行业科研专项(201411054);天津检验检疫科技计划项目(TK074-2013)
刘娟(1984—),女(汉),工程师,硕士研究生,主要从事农产品和植物检疫的研究。
*通信作者:魏亚东,研究员,本科。
