姜黄素对卵巢癌细胞SKOV-3、A2780凋亡的影响及其机制
2017-10-10王翠娟尚明张志虎孙亚昕卫海燕邵华
王翠娟,尚明,张志虎,孙亚昕,卫海燕,邵华
(1山东中医药大学中医学院,济南250355;2山东省职业卫生与职业病防治研究院;3山东省肿瘤医院)
·论著·
姜黄素对卵巢癌细胞SKOV-3、A2780凋亡的影响及其机制
王翠娟1,2,尚明3,张志虎2,孙亚昕2,卫海燕2,邵华2
(1山东中医药大学中医学院,济南250355;2山东省职业卫生与职业病防治研究院;3山东省肿瘤医院)
目的观察姜黄素对卵巢癌细胞凋亡的影响,并探讨其机制。方法将卵巢癌SKOV-3、A2780细胞分为对照组、姜黄素组、N-乙酰半胱氨酸(NAC)+姜黄素组、过氧化氢酶(CAT)+姜黄素组。姜黄素组加20 μmol/L姜黄素培养48 h;NAC+姜黄素组、CAT+姜黄素组分别加入5 nmol/mL的NAC和5 U/mL的CAT提前作用2 h,再加入20 μmol/L姜黄素培养48 h;对照组加入0.1% DMSO培养48 h。采用流式细胞术和AnnexinV-FITC/PI凋亡试剂盒检测各组细胞的凋亡率,用流式细胞术和DCFH-DA试剂盒检测各组细胞内活性氧水平,用流式细胞术和JC-1线粒体膜电位检测试剂盒检测各组细胞线粒体膜电位,用Western blot法检测各组细胞中的自噬相关蛋白LC3、p62和细胞凋亡相关蛋白PARP、cleaved-caspase 3、cleaved-caspase 9的表达水平。结果SKOV-3、A2780细胞凋亡率、活性氧水平、自噬相关蛋白LC3和凋亡相关蛋白PARP、cleaved-caspase 3、cleaved-caspase 9相对表达量姜黄素组均高于对照组、NAC+姜黄素组、CAT+姜黄素组,P均<0.05;线粒体膜电位、p62相对表达量姜黄素组均低于对照组、NAC+姜黄素组、CAT+姜黄素组,P均<0.05。结论姜黄素可以诱导卵巢癌细胞SKOV-3、A2780凋亡。其机制可能是姜黄素诱导卵巢癌SKOV-3、A2780细胞内活性氧积聚,降低线粒体膜电位,启动线粒体自噬失代偿而导致细胞凋亡。
姜黄素;卵巢癌细胞;细胞凋亡;活性氧;线粒体;自噬
Abstract:ObjectiveTo explore the effect and its mechanism of curcumin on the apoptosis of ovarian cancer cells.MethodsThe ovarian cancer cells SKOV-3 and A2780 were divided into the control group, curcumin group, N-acetylcysteine (NAC)+curcumin group, and catalase (CAT)+curcumin group. The curcumin group was treated with 20 μM curcumin for 48 h. NAC+curcumin group and CAT+curcumin group were first treated with 5 nmol/mL NAC and 5U/mL CAT for 2 h, then 20 μM curcumin was added to culture the cells for 48 h. The control group was incubated with 0.1% DMSO for 48 h. The apoptosis rate of each group was detected by flow cytometry and Annexin V-FITC/PI apoptotic kit. Flow cytometry combined with DCFH-DA kit and JC-1 kit were used to detect the intracellular reactive oxygen species and mitochondrial membrane potential changes. The expression levels of autophagy-related proteins LC3, p62 and PARP, cleaved-caspase 3 and cleaved-caspase 9 were detected by Western blotting.ResultsThe levels of apoptotic rate, reactive oxygen species, autophagy-related protein LC3, and apoptosis-related proteins in the curcumin group were higher than those in the control group, NAC+curcumin group, and CAT+curcumin group (allP<0.05). However, mitochondrial membrane potential, p62 expression of the curcumin group were lower than those of the control group, NAC+curcumin group, and CAT+curcumin group (allP<0.05).ConclusionCurcumin can induce the apoptosis of ovarian cancer cells SKOV-3 and A2780 by inducing the accumulation of reactive oxygen species, decreasing the mitochondrial membrane potential, and initiating mitochondrial autophagic decompensation.
Keywords: curcumin; ovarian carcinoma cell; apoptosis; reactive oxygen species; mitochondria; autophagy
姜黄素最初是从姜黄属植物根茎中提取的化合物。美国国立肿瘤研究中心已经将其列为第三代癌化学预防药[1]。在肿瘤治疗方面,姜黄素能够抑制乳腺癌[2]、黑色素瘤[3]、淋巴瘤[4]细胞的生长,促进肿瘤细胞凋亡并降低肿瘤细胞的侵袭、转移能力。但是姜黄素对宫颈癌细胞凋亡的影响及其机制目前尚未完全阐明。活性氧诱导的细胞线粒体途径的凋亡是抗癌药物发挥作用的的重要途径之一。本研究观察了姜黄素对宫颈癌细胞凋亡率的影响,并探讨活性氧诱导的线粒体途径自噬在其中发挥的作用。现报告如下。
1 材料与方法
1.1 细胞株及试剂 卵巢癌细胞株SKOV-3、A2780来源于美国菌种保藏中心(ATCC)和中国典型培养物保藏中心(CCTCC),由山东省肿瘤医院基础研究中心提供。用含10%胎牛血清、1%青霉素-链霉素的RPMI1640培养基,在恒温培养箱中(5%CO2、37 ℃)及饱和湿度条件下传代培养。姜黄素购于美国Sigma公司(批号08511,规格10 mg/支),N-乙酰半胱氨酸(NAC)、过氧化氢酶(CAT)购自美国Sigma公司。RPMI1640培养基、0.25%胰酶消化液、胎牛血清、青霉素-链霉素、PBS缓冲液均购于美国Invitrogen Gibco公司,AnnexinⅤ-FITC/PI凋亡检测试剂盒购于美国BD公司,线粒体膜电位检测试剂盒(JC-1)和活性氧检测试剂盒购于北京碧云天公司,ECL化学发光试剂购于美国Bio-Rad公司,蛋白裂解液、蛋白酶抑制剂购自美国Sigma公司,BCATM Protein Kit蛋白定量试剂盒购自美国Thermofisher公司,SDS-PAGE凝胶制备相关试剂购自康为世纪生物科技有限公司,一抗、山羊抗兔/抗鼠荧光二抗购于美国 CST 公司和武汉 Proteintech 公司。
1.2 卵巢癌细胞分组及姜黄素、NAC、CAT应用方法 将体外培养的卵巢癌SKOV-3、A2780细胞随机分为对照组、姜黄素组、NAC+姜黄素组、CAT+姜黄素组,每组8孔。姜黄素组加20 μmol/L姜黄素培养48 h;NAC+姜黄素组、CAT+姜黄素组分别加入5 nmol/mL的NAC和5 U/mL的CAT提前作用2 h,再加入20 μmol/L姜黄素培养48 h;对照组加入0.1% DMSO培养48 h。
1.3 各组细胞凋亡率测算 采用流式细胞术。按AnnexinV-FITC/PI凋亡试剂盒说明书操作,用流式细胞仪和Flowjo软件测算各组培养48 h后的细胞凋亡率。
1.4 各组细胞活性氧水平检测 采用流式细胞术和荧光探针DCFH-DA试剂盒检测各组细胞内活性氧水平。用无血清的RPMI1640培养基稀释DCFH-DA, 配成终浓度为10 μmol/L的工作液,各组细胞处理结束后加1 mL工作液,在37 ℃培养箱避光孵育30 min,在流式细胞仪上以488 nm激发波长、525 nm发射波长检测DCF的荧光强度(FI),以此表示各组细胞活性氧水平。
1.5 各组细胞线粒体膜电位检测 采用流式细胞仪和JC-1线粒体膜电位检测试剂盒检测各组细胞线粒体膜电位。按试剂盒说明书进行实验操作,孵育结束后,上流式细胞仪检测JC-1的荧光强度(FI),以此表示各组细胞线粒体膜电位。
1.6 各组细胞中自噬相关蛋白LC3、p62和凋亡相关蛋白PARP、cleaved-caspase 3、cleaved-caspase 9检测 收集各组细胞,加入细胞裂解液在冰上裂解30 min。随后在低温高速离心机中12 000 g离心15 min,将上清蛋白样品保存在-20 ℃备用。用Western blotting法检测各蛋白相对表达量,操作按试剂盒说明书进行。各蛋白相对表达量以各蛋白条带灰度值与β-actin条带灰度值之比表示。以对照组为1,计算其他组各蛋白相对表达量。
2 结果
2.1 各组细胞凋亡率比较 对照组、姜黄素组、NAC+姜黄素组、CAT+姜黄素组SKOV-3细胞凋亡率分别为3.50±0.62、13.43±0.80、8.75±0.66、6.63±0.60, A2780细胞凋亡率分别为3.53±0.84、14.82±3.80、7.15±1.44、7.13±2.48。SKOV-3、A2780细胞凋亡率姜黄素组高于对照组、NAC+姜黄素组和CAT+姜黄素组,P均<0.05。
2.2 各组细胞活性氧水平比较 对照组、姜黄素组、NAC+姜黄素组、CAT+姜黄素组SKOV-3细胞活性氧水平分别为5.42±0.78、14.3±0.53、17.17±0.32、21.9±0.75,A2780细胞活性氧水平分别为2.83±0.36、9.75±1.03、11.17±1.75、18.57±1.26。SKOV-3、A2780细胞活性氧水平姜黄素组高于对照组、NAC+姜黄素组和CAT+姜黄素组,P均<0.05。
2.3 各组细胞线粒体膜电位比较 对照组、姜黄素组、NAC+姜黄素组、CAT+姜黄素组SKOV-3细胞线粒体膜电位分别为7.38±0.83、39.40±6.26、16.93±1.80、18.3±3.37,A2780细胞线粒体膜电位分别为8.43±0.57、52.97±11.68、27.67±4.58、25.10±4.50。SKOV-3、A2780细胞线粒体膜电位姜黄素组低于对照组、NAC+姜黄素组和CAT+姜黄素组,P均<0.05。
2.4 各组细胞中自噬相关蛋白LC3、p62和凋亡相关蛋白PARP、cleaved-caspase 3、cleaved-caspase 9相对表达量比较 各组细胞中自噬相关蛋白LC3、p62和凋亡相关蛋白PARP、cleaved-caspase 3、cleaved-caspase 9相对表达量见表1。由表1可见,姜黄素组自噬相关蛋白LC3及凋亡相关蛋白PARP、cleaved-caspase 3、cleaved-caspase的表达量高于对照组、NAC+姜黄素组和CAT+姜黄素组,P均<0.05;而姜黄素组LC3的底物p62表达量低于对照组、NAC+姜黄素组和CAT+姜黄素组,P均<0.05。
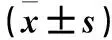
表1 各组SKOV-3、A2780细胞LC3、p62、PARP、cleaved-caspase 3、cleaved-caspase 9相对表达量比较
注:与对照组相比,*P<0.05。
3 讨论
近年来,研究者陆续研究了许多天然化合物在防癌、抗癌方面的作用及其机制,评估作为抗癌新药的应用潜力,这其中就包括姜黄素[5~9]。姜黄素类药物最初是从姜黄属植物根茎中提取的化合物,分子式为C21H20O6,其结构主链由不饱和脂族及芳香族构成,易溶于二甲基亚砜、乙醇、氯仿等有机溶剂,难溶于水。姜黄素可以用于多种癌症的化学预防,发挥抗增殖、抗氧化和致癌阻断作用,调节参与慢性致癌过程的多种分子信号转导通路,促进突变细胞凋亡,阻碍炎性癌症微环境的形成[10,11],但是姜黄素促进肿瘤细胞凋亡的机制一直不明确。本研究结果显示,SKOV-3、A2780细胞凋亡率姜黄素组高于对照组,说明姜黄素可以促进卵巢癌细胞凋亡,且姜黄素浓度越高效果越明显。
活性氧是细胞生物学活动重要的调控因子,它参与调控细胞生长与分化、细胞黏附与细胞凋亡等多种生物学行为,但是过多活性氧聚集对细胞危害十足,它能够氧化修饰DNA、脂质与蛋白质并使其失活,造成细胞的氧化损伤,因此,通过升高细胞内活性氧聚集水平可以促进药物抗肿瘤作用的发挥。目前,活性氧发挥其抗肿瘤作用主要是通过损伤细胞DNA或者诱导细胞凋亡两个方面实现的,主要包括:①直接损伤细胞线粒体DNA;②引起线粒体膜过氧化破坏,诱导细胞内线粒体膜电位下降,启动线粒体途径的凋亡过程;③间接破坏细胞内稳态并激活多种信号通路,激活下游信号通路诱导凋亡。本研究结果显示,姜黄素组的SKOV-3、A2780细胞活性氧水平高于对照组。说明姜黄素可以提高卵巢癌细胞内的活性氧水平,这可能是姜黄素促进卵巢癌细胞凋亡的主要原因。选用两种细胞,避免了细胞株差异对实验结果的影响。在本研究中还应用JC-1探针试剂盒检测了线粒体膜电位,其原理是在线粒体膜电位较高时,JC-1主要聚集在线粒体的基质中,形成聚合物,此时产生红色荧光;而在线粒体膜电位较低时,JC-1不能聚集在线粒体的基质中,单体的JC-1产生绿色荧光,在实验过程中可以通过上述荧光颜色的转变来判断线粒体膜电位的变化。本研究结果显示姜黄素处理细胞后线粒体膜电位降低,而应用ROS清除剂NAC和CAT则可以减弱姜黄素对线粒体电位的影响,说明了姜黄素在引起卵巢癌细胞ROS的大量积聚后,ROS引起了线粒体膜的过氧化破坏,导致细胞内线粒体膜电位下降,启动了细胞线粒体途径的早期凋亡过程,从而发挥其抗癌作用。
自噬是细胞在生理病理条件下都普遍存在的生物学现象,是对刺激的代偿反应。如果自噬能够代偿,则促进细胞的生存,若失代偿则诱发细胞死亡。Lemasters在2005年首次提出线粒体自噬的概念[14],研究表明线粒体自噬的发生发展过程中需要特异性线粒体受体的参与,线粒体受体蛋白含有一段LC3相互作用区域(LIR),能和LC3蛋白上保守疏水结构域结合[15, 16],使得线粒体逐渐被自噬体囊泡包裹从而被降解掉。本研究结果显示,姜黄素组两种细胞自噬相关通路的LC3蛋白表达也增高,而应用ROS清除剂后,LC3蛋白表达增高的趋势减弱。p62作为LC3的底物,其变化趋势和LC3是相反的,说明姜黄素通过ROS增高诱导了自噬的发生。
综上所述,我们的研究结果发现,姜黄素可以抑制卵巢癌细胞SKOV-3和A2780细胞增殖,其机制可能是姜黄素通过增高肿瘤细胞内ROS水平、降低细胞的线粒体膜电位、启动自噬性凋亡途径诱导细胞失代偿性调亡,是一种有应用潜力的抗癌药物。
[1] Chen W, Zheng R, Baade P, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016,66(2):115-132.
[2] 刘宇飞,王飞,罗代珍,等. 姜黄素对MDA-MB-361乳腺癌细胞DLC1基因表达影响及其机制探讨[J]. 中华肿瘤防治杂志,2016,23(7):426-430.
[3] Wu J, Lu WY, Cui LL. Inhibitory effect of curcumin on invasion of skin squamous cell carcinoma A431 cells [J].Asian Pac J Cancer Prev, 2015,16 (7):2813-2818 .
[4] Zhang JR , Lu F, Lu T, et al. Inactivation of FoxM1 transcription factor contributesto curcumin-induced inhibition of survival, angiogenesis,and chemosensitivity in acute myeloid leukemia cells[J]. J Mol Med, 2014,92(9):1319-1330.
[5] 汪丛丛,庄静,冯福彬,等. 姜黄素抑制肺癌细胞血管拟态形成机制探讨[J]. 中华肿瘤防治杂志,2015,22(4):243-246.
[6] 陈茜,陈丽娟,党媛媛,等.姜黄素通过阻滞MAPK/ERK通路抑制人子宫内膜癌HEC-1-B细胞的侵袭转移[J]. 山西医科大学学报,2015,46(8):762-768.
[7] 林妙,姚庆华,王玉琪,等.氧化应激在姜黄素诱导肺癌细胞凋亡中的作用[J]. 中国肿瘤,2015,24(3):229-233.
[8] 赵莹,李英姿.姜黄素对非小细胞肺癌A459细胞增殖及CDH13甲基化状态的的影响[J]. 山东医药,2017,57(6):9-12.
[9] 杨海霞.姜黄素对卵巢癌细胞凋亡的影响[J]. 山东医药,2012,52(46):37-39.
[10] 罗丽萍,彭诗维,朱四红,等.姜黄素协同顺铂对卵巢癌耐药细胞株COC1/DDP抑制作用的实验研究[J]. 江西医药,2016,51(11):1165-1167.
[11] 盛顺良,莫湘琼,欧阳新平.姜黄素对人子宫肌瘤细胞增殖、凋亡的的影响及机制探讨[J]. 山东医药,2012,52(34):27-29.
[12] Lemasters JJ. Selective mitochondrial autophagy, or mitophagy, as a targeted defense against oxidative stress, mitochondrial dysfunction and aging[J]. Rejuvenation Res, 2005,8(1):3-5.
[13] Birgisdottir AB, Lamark T, Johansen T. The LIR motif - crucial for selective autophagy[J]. J Cell Sci,2013,126(15): 3237-3247.
[14] Lemasters JJ. Selective mitochondrial autophagy, or mitophagy, as a targeted defense against oxidative stress, mitochondrial dysfunction, and aging[J]. Rejuvenation Res, 2005,8(1):3-5.
[15] Muhlinen N, Akutsu M, Ravenhill BJ, et al. LC3, bound selectively by a noncanonical LIR motif in NDP52, is required for antibacterial autophagy[J]. Mol Cell, 2012,48(3):329-342.
[16] Birgisdottir AB, Lamark T, Johansen T. The LIR motif-crucial for selective autophagy[J]. J Cell Sci, 2013,126(15):3237-3247.
Effects of curcumin on apoptosis of ovarian cancer cell lines SKOV-3 and A2780
WANGCuijuan1,SHANGMing,ZHANGzhihu,SUNYaxin,WEIHaiyan,SHAOHua
(1InstituteofTraditionalChineseMedicine,ShandongUniversityofTraditionalChineseMedicine,Jinan250062,China)
10.3969/j.issn.1002-266X.2017.35.001
R737.9
A
1002-266X(2017)35-0001-04
2017-06-23)
山东省医药卫生科技发展计划项目(2015WS0167)。
王翠娟(1979-),女,医学博士在读,主要研究方向为中西医结合治疗肿瘤。E-mail:iamcuijuan@163.com
邵华(1963-),男,医学博士,研究员,主要研究方向为医学基础研究。E-mail:Chinashaohua5888@163.com
