吡咯烷二硫代氨基甲酯抑制TNF-α和MMP-9表达延缓大鼠颈椎间盘退变及机制研究
2017-09-23漆启华张遂辉董谢平
漆启华, 李 晨, 肖 强, 邓 亮, 张遂辉, 乐 旸, 董谢平
(江西省人民医院骨二科,江西 南昌 330006)
吡咯烷二硫代氨基甲酯抑制TNF-α和MMP-9表达延缓大鼠颈椎间盘退变及机制研究
漆启华, 李 晨, 肖 强, 邓 亮, 张遂辉, 乐 旸, 董谢平
(江西省人民医院骨二科,江西 南昌 330006)
目的观察吡咯烷二硫代氨基甲酯(PDTC)对大鼠颈椎动力失衡模型颈椎间盘组织形态及肿瘤坏死因子α(TNF-α)、基质金属蛋白酶9(MMP-9)表达的影响,探讨PDTC抑制颈椎间盘退变作用及其机制。方法54只SD大鼠随机分为3组,切断大鼠颈后部浅、深肌群构建颈椎间盘退变动物模型。PDTC给药组(A组):造模术后腹腔每日注射PDTC溶液。模型组(B组):造模术后腹腔每日注射生理盐水。假手术组(C组):手术切开大鼠颈后部皮肤后立即缝合并每日腹腔注射生理盐水。术后10、12、16周分批处死动物,获取C5/6椎间盘组织,光镜下观察椎间盘形态改变,q-PCR检测椎间盘组织中TNF-α mRNA、MMP-9 mRNA表达;Western blot检测椎间盘组织中TNF-α、MMP-9蛋白表达变化。结果PDTC给药组(A组)椎间盘结构破坏减轻,纤维环结构排列有序。模型组(B组)TNF-α、MMP-9 基因表达量随实验时间的延长而增多,早期增速较快,后期逐渐缓慢,在12周达高峰,而蛋白表达量在术后10周即达到较高水平,与12周、16周时间点比较无明显差异(P>0.05)。各时间点PDTC给药组TNF-α mRNA、MMP-9 mRNA及蛋白表达量较模型组(B组)明显降低(P<0.01),但明显高于假手术组(P<0.01)。结论TNF-α、MMP-9是参与大鼠颈椎间盘退变过程的重要炎性因子,TNF-α、MMP-9可能通过NF-κB信号通路参与大鼠颈椎间盘退变,PDTC有望成为颈椎间盘退变的防治药物。
吡咯烷二硫代氨基甲酯(PDTC);颈椎间盘退变;肿瘤坏死因子α;基质金属蛋白酶9;颈椎动力失衡;NF-κB信号通路
颈椎间盘切除植骨融合内固定术是治疗椎间盘源性颈椎病的有效手段之一[1],现研究已证实,除局部生物力学环境的改变参与颈椎间盘退变外,炎性介质被认为是参与颈椎间盘退变的重要因素[2]。但目前关于退变颈椎间盘中炎性介质表达变化规律及调控机制尚不十分清楚,吡咯烷二硫代氨基甲酯(pyrrolidine dithiocarbamate,PDTC)是NF-κB特异性抑制剂,被认为是一种抗炎,抗氧化剂,主要用来治疗金属中毒。,我们通过动物模型模拟颈椎间盘退变过程,并观察PDTC对大鼠颈椎动力失衡模型颈椎间盘组织形态及肿瘤坏死因子α(TNF-α)、基质金属蛋白酶9(MMP-9)表达的影响,以寻找一种可以早期干预颈椎间盘退变的药物,为颈椎间盘退变的防治寻找新的途径。
1 材料与方法
1.1材料PDTC(吡咯烷二硫代氨基甲酯)为Sigma公司产品,TRIzol为美国Invitrogen公司产品,cDNA第一链合成试剂盒(美国 Thermo Fisher K1622),Braford蛋白含量检测试剂盒(南京凯基生物科技发展有限公司 KGA801),TNF-α、MMP-9、GAPDH引物由南京金斯瑞科技有限公司合成,全蛋白抽提试剂盒、Western blot检测试剂盒、ECL检测试剂盒为南京凯基生物科技发展有限公司产品,TNF-α、MMP-9、GAPDH抗体、羊抗兔IgG-HRP为南京凯基生物科技发展有限公司产品产品。其它试剂均为进口或国产分析纯。荧光定量PCR循环仪为美国ABI公司产品,蛋白凝胶电泳仪及转膜系统为美国伯乐Bio-Rad公司产品。
1.2动物分组及模型构建选择6月龄,♀,体质量为220~240 g,SD大鼠54只(南昌大学医学院实验动物中心提供,清结级),随机分为3组,每组18只。参照郝永强等[3]方法构建大鼠颈椎间盘退变模型,A组、B组:氯氨酮( 100 mg·kg-1) 腹腔注射麻醉后,切断颈后部浅肌群及深肌群,其中浅肌群包括颈斜方肌、菱形肌;深肌群包括颈部夹肌、最长肌、头半棘肌,棘上、棘间韧带一并切断(C5/6间隙),手术操作均在无菌条件下完成。假手术组(C组):颈后部正中切开皮肤后间断缝合。动物术后d 1即按分组开始腹腔注射,直至动物处死。PDTC给药组(A组):按体重每天30 mg·kg-1PDTC溶液腹腔注射,模型组(B组)、假手术组(C组):按体重每天对应体积生理盐水腹腔注射。分别在给药后10、12、16周行放血法处死动物,每次每组处死动物6只,立即切取颈椎(C5、C6椎体及C5/6椎间盘),去除软组织后在手术显微镜下沿上、下软骨板切下C5/6椎间盘,液氮速冻保存。整个椎间盘组织分为3份,分别行组织学观察、基因表达检测、蛋白定量分析。
1.3组织形态学观察各标本以10%甲醛固定,常规石蜡包埋、切片,片厚4 μm,取部分切片常规HE染色后,光镜下观察椎间盘结构及纤维环形态学改变,并对椎间盘退变程度进行记录[4]。
1.4q-PCR检测TNF-α、MMP-9基因表达按TRIzol抽提试剂说明书进行提取组织样本中总RNA,cDNA第一链合成试剂盒进行反转录。反应体系为:2×Real time PCR Master Mix(SYBR Green):10 μL;上、下游引物(各10 μmol·L-1),各1 μL;cDNA模板1 μL;加入灭菌蒸馏水使总反应体积至20 μL。标准对照物为GAPDH。引物序列见Tab 1。扩增程序为:95 ℃,5 min,1个循环;(95 ℃,15 s;60 ℃,20 s,72 ℃ 40 s)×40个循环。按照2-△△CT相对定量计算公式计算各样品的目的基因相对定量结果,分析目的基因mRNA转录水平差异。
1.5Westernblot检测TNF-α、MMP-9蛋白表达取50 mg椎间盘组织,用眼科剪剪碎,超声碎裂组织,按全蛋白提取试剂盒提取椎间盘组织中蛋白,待测样品用Bradford法测定蛋白含量后,SDS-PAGE凝胶电泳,电泳湿转膜,丽春红染色观察转移效果,并确定蛋白分子量标准的位置。含5%脱脂奶粉TBST液封闭2h,孵育一抗1 ∶200,4 ℃孵育过夜,TBST洗膜3次,加二抗1 ∶2 000,37 ℃孵育1 h,TBST洗膜3次,用Western blot发光检测试剂盒显影,凝胶成像系统收集图像并对Western blot结果进行吸光度扫描,分析结果。以上实验均重复3次,每次设两个复孔。

2 结果
2.1光镜下观察椎间盘结构假手术组各期光镜下可见椎间盘周围纤维环纤维排列规则,结构完整。模型组术后10周出现椎间盘组织纤维环排列紊乱,并可见纤维间裂隙形成。术后12周可见椎间盘、终板软骨交界处软骨细胞明显增生肥大,排列无规律。术后16周见髓核皱缩,纤维软骨终板开裂。
PDTC给药组术后10周光镜下表现与模型组相似,但椎间盘髓核基质成分增多,术后12周终板软骨细胞周围基质增多,软骨细胞排列有序。术后16周实验组纤维环排列较整齐,软骨终板连续性好(Fig 1、2)。

Tab 1 Primer sequence and PCR product length
2.2椎间盘组织中TNF-αmRNA、MMP-9mRNA表达变化在所有组织中均可见TNF-α mRNA、MMP-9 mRNA的表达,假手术组(C组)各时间点TNF-α mRNA、MMP-9 mRNA表达无明显变化。PDTC给药组(A)及模型组(B)TNF-α mRNA、MMP-9 mRNA表达量随实验时间的推移而增多,但增速早期较快,后期逐渐缓慢。PDTC给药组12周时TNF-α mRNA表达较10周组明显升高(P<0.01),但与16周组比较无统计学意义(P>0.05)。术后10、12、16周各时间点模型组与假手术组TNF-α mRNA、MMP-9 mRNA表达差异明显(P<0.01)。给药后10、12、16周各时间点PDTC组TNF-α mRNA、MMP-9 mRNA表达量较模型组明显降低(P<0.01),但各时间点PDTC给药组表达量仍明显高于假手术组(P<0.01) ,见Fig 2、3。

Fig 1 The disc structure of saline group(HE ×100)
① 10 weeks after surgery: disc fiber ring slightly irregular arranged; ② 12 weeks after surgery: chondrocyte proliferation in cartilage endplate arranged irregularly; ③ 16 weeks after surgery: fiber ring without disturbance but the cartilage endplate crack slightly.
2.3各组各个时间点椎间盘组织中TNF-α、MMP-9蛋白表达变化各时间点假手术组(C组)都可见TNF-α、MMP-9蛋白表达,各组表达量都较低,各时间点间比较差异(P>0.05)。PDTC给药组(A组)TNF-α、MMP-9蛋白表达量随时间延长,蛋白表达量降低越明显。在10周,12周,16周时间点上PDTC给药组(A组)蛋白表达量明显低于模型组(B组)(P<0.01)。PDTC给药组各时间点间TNF-α、MMP-9蛋白表达量差异(P>0.05)。见Fig 3、4,Tab 4、5。
3 讨论
退变颈椎间盘所处的异常力学环境及产生过量的炎性介质是导致椎间盘失去正常功能的两大主因[5],两大因素相互影响,相互促进,加重颈椎间盘退变,引起临床症状。颈椎间盘切除植骨融合术被认为是颈椎病治疗的金标准,但该手术因可能产生严重并发症而令很多颈椎病患者顾虑重重[6-7]。能否有一种治疗方式,不但免除手术治疗,而且可以取得同样的治疗效果。药物治疗一定程度上是一种比手术治疗更优越的治疗方法,在寻找药物有效确切的作用靶点时,透彻的分析疾病的发生、发展过程十分重要,因此建立一个理想的椎间盘退变实验动物模型,对研究椎间盘退变机制是必要的[8]。以往研究一般通过脊柱前方稳定结构的破坏来建立椎间盘退变模型[9],猴、猪、犬等大型动物是常用的造模对象,但是这类动物价格高,制备模型方法复杂,难度大,试验周期长,难以满足需要[10]。我们采用的颈椎动态失衡造模方法,动物死亡率低,获得组织形态学满意,能很好的模拟颈椎间盘退变的发生发展。我们在该动物模型中观察到造模术后随着时间的延长,颈椎间盘退变越来越严重,从纤维环结构紊乱,直到术后16周出现软骨终板的破裂,这与颈椎间盘切除术中的观察一致[11]。TNF-α是一种常见的炎性因子,是很多炎性因子的始动因子,被认为是很多炎症信号通路的上游[12]。目前有很多研究发现退变颈椎间盘中有大量异常表达的炎性介质,但对炎性介质的表达规律尚无详细的描述。我们发现TNF-α基因的表达随时间延长,表达量逐渐增多,在术后16周表达达到高峰,但TNF-α蛋白的表达在术后10周表达趋于稳定,该炎性因子的基因与蛋白表达有一定的差异性。正常椎间盘内胶原的代谢率缓慢而稳定,胶原酶多处于潜伏状态。椎间盘内的产生的TNF-α可以激活潜伏状态的胶原酶,使胶原酶活性增加[13]。基质金属蛋白酶是一族依赖锌离子降解细胞外基质蛋白酶系,大量研究表明椎间盘退变MMPs的含量和活性密切相关[14]。MMP-9的通过分解胶原纤维发挥破坏纤维结构,该基质金属蛋白酶成为椎间盘退变发生的最终执行者之一。在模型组中MMP-9基因随时间延长表达量递增,在术后16周达到最高值,而MMP-9蛋白在术后10周表达量相差无几,作为胶原纤维水解的执行者,蛋白的表达决定了其功能的发挥,术后10周MMP-9蛋白一直处于较高的水平可能与炎症后期组织纤维结构的破坏改建有关。结合椎间盘退变程度,其与基因表达的变化具有较高的一致性, TNF-α、MMP-9基因在转录后水平如:作用多种miRNA、lncRNA,参与椎间盘退变的调控[15]。
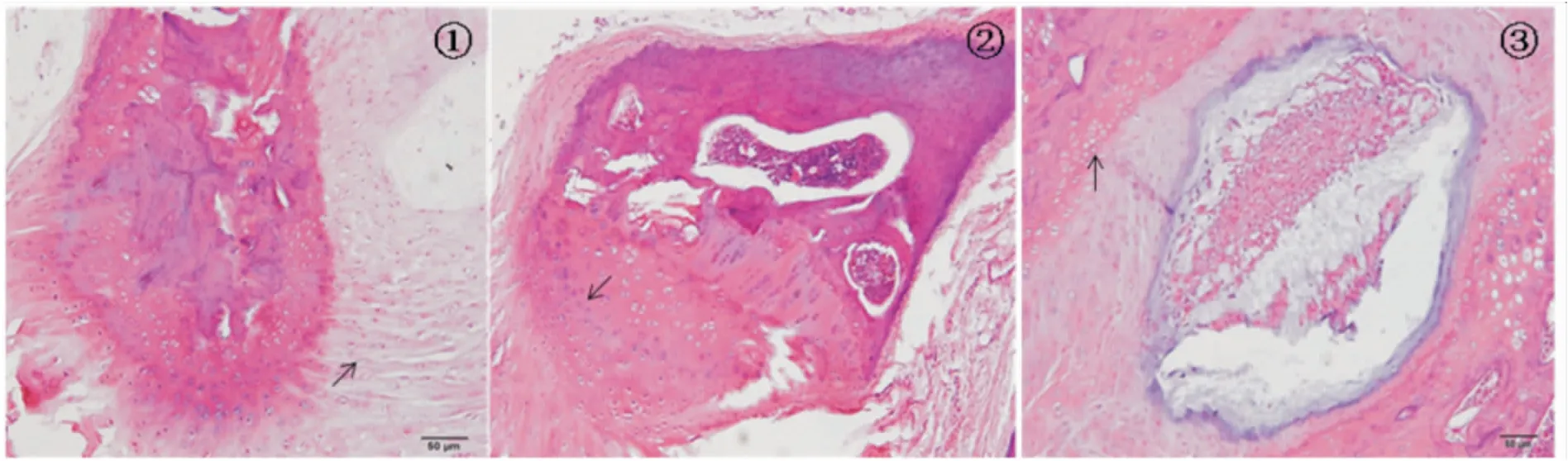
Fig 2 The disc structure of PDTC group(HE×100)
① 10 weeks after surgery: disc fiber ring slightly irregular arranged,but matrix increased obviously; ②12 weeks after surgery: chondrocyte proliferation with much matrix around arranged regularly; ③ 16 weeks after surgery: fiber ring without disturbance and the cartilage endplate without crack.

Tab 2 Expression of TNF-α gene at interval time of each group (2-ΔΔCT, ±s,n=6)
**P<0.01vseach group at the same time point;△△P<0.01vs10 wk.

Tab 3 Expression of MMP-9 gene at interval time of each group (2-ΔΔCT, ±s, n=6)
**P<0.01vseach groups at the same time point;△△P<0.01vs10 wk.

Fig 3 The expression of TNF-α proteinlane 1: blank group;lane 2:model group;lane 3:PDTC group

Fig 4 Expression of MMP-9 proteinlane 1: blank group; lane 2: model group; lane 3: PDTC group

Group10wk12wk16wkBlank0.11±0.0160.05±0.030.06±0.02Model0.72±0.083**0.69±0.029**△0.73±0.063**PDTC0.51±0.0170.40±0.06△0.34±0.12Fvalue232.53346.11108.59Pvalue0.0000.0000.000
**P<0.01vseach groups at the same time point
Tab 5 Expression of MMP-9 protein at interval time of each group(gray ratio, ±s,n=6)
**P<0.01vseach groups at the same time point
目前尚无治疗颈椎病的有效药物,很多研究者尝试各种药物来预防椎间盘退变的发生,但这类药物往往无确切的药物作用靶点,且具体作用机制不明确[16]。NF-κB 作为多种基因表达调控的关键性转录因子,在炎症性疾病的发病机制中起重要作用。PDTC因较好的抗炎性受到众多研究者的青睐。PDTC通过阻止抑制性亚单位IκB的降解,阻碍NF-κB的p65、p50亚基向细胞核的转移等机制,阻断NF-κB激活的信号通路,从而抑制 NF-κB 活化[17]。PDTC组的椎间盘退变程度较生理盐水组有所缓解,同时我们观察到TNF-α、MMP-9无论是基因水平还是蛋白水平,在PDTC的干预下表达较模型组明显降低,但在这些时间点中尚未观察到最佳药物作用时间,这可能与药物代谢及药物浓度曲线有关,目前选用的药物注射剂量也能发挥较好的抑制作用。有研究也证实PDTC抑制NF-κB活化可减少炎性介质产生。在缺氧再给氧时 PDTC 可以下调血管内皮细胞选择素E的表达[18],我们的前期研究发现,PDTC可以通过抑制NF-κB活化而抑制磨损颗粒诱导基质金属蛋白酶的产生[19]。 PDTC对TNF-α、MMP-9基因及蛋白表达抑制有较好的一致性,TNF-α有可能是MMP-9主要调控的上游基因,PDTC可能是通过抑制了NF-κB的活化,降低了TNF-α的产生,最终导致MMP-9合成减少,达到抑制颈椎间盘退变的效果。
大鼠颈椎动力失衡模型能较好的模拟颈椎间盘退变的发生,TNF-α、MMP-9是参与该退变过程的重要炎性因子,NF-κB信号通路是调节上述因子表达变化的重要信号通路,也是抑制TNF-α、MMP-9炎性因子表达的重要作用靶点,PDTC有望成为抑制颈椎间盘退变的防治药物。
本研究的不足之处:基于对样本量的考虑,本实验据以往经验确定药物的使用剂量,如能分多组剂量,则更能反映药物的作用效果。同样,此实验的观察时间有限,且时间间隔较短,如能延长观察时间,则可以得到较完整的椎间盘退变的病理生理过程。颈椎间盘退变是一个复杂的代谢过程,我们目前只观察了退变的部分变化规律及机制,但尚难以完全揭示颈椎间盘退变的过程,MMP-9降解胶原纤维后产生的细胞外基质可能也参与了椎间盘退变的发生,这需我们进一步的研究。
(致谢: 本实验主要是在南昌大学医学院及江西省人民医院中心实验室完成,感谢实验室各位老师的帮助。)
[1] Shi J S, Lin B, Xue C,et al. Clinical and radiological outcomes following hybrid surgery in the treatment of multi-level cervical spondylosis: over a 2-year follow-up[J].JOrthopSurgRes, 2015,10(1): 185.
[2] Liu C, Zhang J F, Sun Z Y,et al. Bioinformatic analysis of the gene expression profiles in human intervertebral disc degeneration associated with inflammatory cytokines[J].JNeurosurgSci, 2015,18(2): 412-7.
[3] 郝永强, 施 杞, 郑松国,等.大鼠颈椎病实验模型的设计与建立[J].中国矫形外科杂志, 1999,6(4): 42-4.
[3] Hao Y Q,Shi Q,Zheng S G,et al.The design and establishment of a model of experimental cervical spondylosis in the rat[J].OrthopedicJChin, 1999,6(4): 42-4.
[4] Han B, Zhu K, Li F C, et al. A simple disc degeneration model induced by percutaneous needle puncture in the rat tail[J].Spine, 2008,33(18): 1925-34.
[5] Willems N, Tellegen A R, Bergknut N,et al. Inflammatory profiles in canine intervertebral disc degeneration[J].BmcVetRes, 2016,12(1): 10.
[6] Elder B D, Sankey E W, Theodros D,et al. Successful anterior fusion following posterior cervical fusion for revision of anterior cervical discectomy and fusion pseudarthrosis[J].JClinNeurosci, 2016,24:57-62.
[7] Weber K T, Jacobsen T D, Maidhof R,et al. Developments in intervertebral disc disease research: pathophysiology, mechanobiology, and therapeutics[J].CurrRevMusculoskeletMed, 2015,8(1): 18-31.
[8] Shi Z, Gu T, Xin H,et al. Intervention of rAAV-hTERT-transducted nucleus pulposus cells in early stage of intervertebral disc degeneration: A study in Canine model[J].TissueEngPartA, 2015,21(15-16): 2186-94.
[9] Wei F, Zhong R, Pan X,et al. Computed tomography guided subendplate injection of pingyangmycin for A novel rabbit model of slowly progressive disc degeneration[J].SpineJ, 2015,10(3): 324-31.
[10] 周满如,李 近,吴敬开,等. 何首乌对泼尼松致大鼠股骨微结构及生物力学改变的预防作用[J]. 中国药理学通报,2015,31(9):1273-9.
[10] Zhou M R,Li J,Wu J K,et al.Preventive effect of polygonum multiflorum on deteriorated micro-structure and biomechanical properties induced by prednisone[J].ChinPharmacolBull,2015,31(9):1273-9
[11] 赵 凯,徐胜春,吴建贤,等. 淫羊藿对大鼠退变颈椎间盘内IL1-β、IL-6、TNF-α含量的影响[J].安徽医科大学学报,2008,43(3):298-300.
[11] Zhao K,Xu S C,Wu J X,et al.Experimental study the effect of epimedium on IL-1,IL-6, TNF-α of degenerated cervical vertebral of rats[J].ActaUnivMedAnhui,2008,43(3):298-300.
[12] 张瑞瑞,冯丽萍,雍志强,等. 补肾化瘀方对PCOS模型大鼠中TNF-α表达的影响[J]. 中国药理学通报,2016,32(9):1331-2
[12] Zhang R R,Feng L P,Yong Z Q,et al.Effects of Bushen huayu recipe on TNF-α expression in PCOS rat model[J].ChinPharmacolBull,2016,32(9):1331-2
[13] Sedowofia K A, Tomlinson I W, Weiss J B,et al. Collagenolytic enzyme systems in human intervertebral disc: their control, mechanism, and their possible role in the initiation of biomechanical failure[J].Spine(PhilaPa1976), 1982,7(3): 213-22.
[14] Li Y, Li K, Hu Y,et al. Piperine mediates LPS induced inflammatory and catabolic effects in rat intervertebral disc[J].IntJClinExpPathol, 2015,8(6): 6203-13.
[15] 张莹莹,周建斌,曾祥伟,等. 葛根素对成骨细胞增殖能力及靶向Runx2的miRNA的影响[J].中国药理学通报,2016,32(10):1457-62.
[15] Zhang Y Y,Zhou J B,Zeng X W,et al. Effects of puerarin on proliferation of osteoblasts and Runx2-targeting miRNAs[J].ChinPharmacolBull, 2016,32(10):1457-62.
[16] Zhang Y, An H S, Tannoury C,et al. Biological treatment for degenerative disc disease: implications for the field of physical medicine and rehabilitation[J].AmJPhysMedRehabil, 2008,87(9): 694-702.
[17] Lauzurica P, Martinez-Martinez S, Marazuela M,et al. Pyrrolidine dithiocarbamate protects mice from lethal shock induced by LPS or TNF-alpha[J].EurJImmunol, 1999,29(6): 1890-900.
[18] 郑立新, 安 琪, 石应康.缺氧-再给氧时PDTC对血管内皮细胞选择素E表达的作用[J].中华胸心血管外科杂志, 2004,16(3): 37-9.
[18] Zheng L X,An Q,Shi Y K,et al. PDTC reduces E-selectin expression on hypoxia/reoxygenation-stimulated endothelial cells[J].ChinJThoracCardiovascSurg, 2004,16(3): 37-9.
[19] 漆启华, 戴 闽, 程 涛,等.姜黄素抑制磨损颗粒诱导炎性介质产生及作用机制[J].中国药理学通报, 2009,14(6): 769-72.
[19] Qi Q H,Dai M,Cheng T, et al. Mechanism of curcumin preventing the expression of mediators of inflammation induced by the particulate debris[J].ChinPharmacolBull, 2009,14(6): 769-72.
Pyrrolidinedithiocarbamatealleviatedratcervicalintervertebraldiscdegenerationviareducingtumornecrosisfactorαandmatrixmetalloproteinase9expressionanditsunderlyingmechanism
QI Qi-hua, LI Chen, XIAO Qiang, DENG Liang, ZHANG Sui-hui, LE Yang, DONG Xie-ping
(The2ndDeptofOrthopaedics,JiangxiPeople’sHospital,Nanchang330006,China)
AimTo observe the effect of pyrimidine dithiocarbamate (PDTC) on the variance of disc morphology and the expressions of TNF-α, MMP-9 in the cervical disc in cervical dynamic equilibrium rat models, and to investigate the roles of PDTC in the process of intervertebral disc degeneration and the mechanism involved.MethodsFifty-four SD rats were divided into three groups randomly, then the dynamic equilibrium rat model was established by cutting the nuchal superficial and deep muscle of the rats. The dynamic equilibrium rats with PDTC solution intraperitoneal injection after operations were defined as PDTC group (group A), the models with saline intraperitoneal injection after operations as saline group (group B), the rats of fake operation with saline intraperitoneal injection as blank group (group C), and the animals were sacrificed in batches 10 weeks, 12 weeks, 16 weeks respectively after operation. The C5, C6 vertebrae and C5/6 discs were harvested, and the disc morphology was observed. TNF-α, MMP-9 mRNA expressions were detected by q-PCR and protein expression was observed by Western blot.ResultsCompared with the saline group, the morphology of disc in PDTC group was destructed slightly and fiber ring arranged orderly. TNF-α, MMP-9 gene and protein expressions had no obvious changes (P>0.05) in blank group (group C) at each time point. The expressions of IL-6, MMP-9 mRNA increased with time in group B, but the amount increased fast firstly, and slow lately, reaching peak in 12 weeks. The expression of TNF-α, MMP-9 protein became steady in group B from 10 weeks compared with other time points(P>0.05). TNF-α, MMP-9 genes and proteins expression decreased obviously in PDTC group (group A) compared with saline group (group B) (P<0.01) at each time point, but higher than blank group C(P<0.01) at each time point.ConclusionsTNF-α and MMP-9 are important inflammatory factors involved in rat cervical disc degeneration, PDTC relieves the degeneration of rat cervical disc by reducing the expression of TNF-α and MMP-9 via disturbing the NF-κB signal pathway probably, and PDTC may become potential medicine for disc degeneration.
pyrimidine dithiocarbamate; cervical disc degeneration; tumor necrosis factor α; matrix metalloproteinases 9; cervical dynamic equilibrium; NF-κB signal pathway
10.3969/j.issn.1001-1978.2017.10.013
A
:1001-1978(2017)10-1393-06
R-332;R323.4; R681.505;R977.3;R977.6
时间:2017-9-5 9:26 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170905.0925.026.html
2017-05-23,
2017-08-06
江西省科技支撑计划资助项目(No 20122BBG70118,20151BBG70119)
漆启华(1983-) 男,硕士,主治医师,研究方向:脊柱外科基础与临床,E-mial:qqhua1938@126.com; 董谢平(1963-),男,主任医师,博士生导师,研究方向:脊柱外科基础与临床,通讯作者,Tel:0791-86895579,E-mail:13576030901@163.com
