川陈皮素纳米结构脂质载体的制备及稳定性评价
2017-09-22黄威窦华亭吴厚玖王华孙志高马亚琴黄林华郭莉王珺黄学根
黄威,窦华亭,吴厚玖,王华,孙志高,马亚琴,黄林华,郭莉,王珺,黄学根
1(西南大学 柑桔研究所食品科学学院,重庆,400712)2(重庆文理学院林学与生命科学学院,重庆,402160)
川陈皮素纳米结构脂质载体的制备及稳定性评价
黄威1,2,窦华亭1*,吴厚玖1,王华1,孙志高1,马亚琴1,黄林华1,郭莉1,王珺1,黄学根1
1(西南大学 柑桔研究所食品科学学院,重庆,400712)2(重庆文理学院林学与生命科学学院,重庆,402160)
纳米结构脂质载体(nanostructured lipid carrier,NLC)是一种新型的纳米脂质载体,将其搭载活性物质已经广泛应用于食品的多个相关领域。川陈皮素(nobiletin,NOB)是柑橘加工皮渣中提取的一种多甲氧基黄酮类化合物,具有多种生理活性,将其制备成纳米结构脂质载体可提高其溶解度、改善其分散性及生物利用率等。采用高压均质法制备了川陈皮素纳米结构脂质载体(NOB-NLC),运用单因素试验考察了脂质用量、乳化剂用量和乳化剂比例对NOB-NLC质量的影响。采用响应面设计优化了制备条件,确定的最适宜制备方案为脂质用量752.20 mg,乳化剂用量1 072.41 mg和乳化剂比例1.23(卵磷脂与泊洛沙姆188的质量比值),依据最适宜处方制备的NOB-NLC平均粒径为(132.63±7.28)nm,多分散指数为(0.253±0.015),Zeta电位为(-38.1±2.17)mV,包封率为(80.25±3.66)%。扫描电子显微镜显示所制备NOB-NLC呈球形或类球形,且大小具有良好的均一度。针对食品体系的应用,探究了贮藏条件对NOB-NLC稳定性的影响,结果表明在温度为25℃且pH为3.50~7.50的条件下贮藏40 d时,其粒径变化小,分散体系稳定性好,可应用于pH值为3.50~7.50的食品体系当中。
纳米结构脂质载体;川陈皮素;Box-Behnken试验;表征;稳定性
我国作为柑橘种植面积及产量第一的国家,其柑橘消费量也是巨大的,柑橘在鲜食和加工过程中都会产生大量的皮渣,皮渣的研究与利用成为柑橘产业发展亟待解决的一个问题。研究指出,柑橘皮渣中含有多种功能性成分,其中多甲氧基黄酮类物质作为柑橘的特征黄酮,因其多种生物学功效及生理活性已经越来越受到了研究者的重视[1-2]。川陈皮素(nobiletin,NOB),又称蜜橘黄酮,是柑橘多甲氧基黄酮类化合物中含量较高的单体物质。川陈皮素具有广泛的生物活性,包括抗氧化性、较强的自由基清除能力、调节糖和脂肪代谢能力等[3]。但川陈皮素结构中的羟基都被甲氧基化,导致其在水中的溶解度极小,在体系中分散性差、生物利用率低,这极大的限制了其在实践中的应用[4],如果能改善其溶解性及生物利用率,将为其在食品领域的应用带来巨大的便利。而国内外学者对该方面的研究较少,有报道将川陈皮素制成纳米乳、川陈皮素自组装前体脂质体、用壳聚糖搭载川陈皮素以及川陈皮素固体脂质纳米粒(solid lipid nanoparticles,SLN)等[5-7]。然而,纳米乳存在絮凝、物质释放、膜渗透性不理想以及贮藏稳定性较差等缺点[8];脂质体制备成本高、荷载低,且其物质释放也较快[9];虽然SLN在包封率、物质释放等方面有了明显提高,但其贮藏期间的多晶型转换会导致包封物质泄露以及搭载能力不高也限制了其应用[10]。
纳米结构脂质载体(nanostructured lipid carrier,NLC)是一种新型的纳米脂质载体系统,相对于SLN,它又被称作第二代纳米脂质载体系统。它采用2种或2种以上的固体和液体脂质原料经过先加热融化后冷却而制得。NLC具有良好的生物相容性,搭载空间大、长期稳定性等优点,且可避免SLN存在的搭载物质泄漏的问题。目前,将NLC用于搭载活性物质,已经在食品检测、食品包装、功能食品等领域有了比较广泛的应用[11-13],但国内外文献未见报道其用于搭载NOB的研究。
本文采用高压均质法制备NOB-NLC,并对NOB-NLC的表观形态、平均粒径、多分散指数、包封率、Zeta电位及其稳定性进行研究,希望为进一步扩大NOB在食品方面的应用,同时提高柑橘加工产品附加值。
1 材料与方法
1.1材料与试剂
川陈皮素标准品,含量≥95%,美国Sigma-Aldrich公司;川陈皮素,含量≥94%,西安利时生物科技有限公司;中链甘油三酯、单硬脂酸甘油酯,含量≥95%,嘉法狮(上海)贸易有限公司;泊洛沙姆188,含量≥95%,巴斯夫(中国)有限公司;大豆卵磷脂,PC≥95%,上海太伟药业有限公司;乙腈、甲醇为色谱纯;其他试剂为分析纯。
1.2仪器与设备
UniCen MR型低温高速离心机,德国Herolab公司;AH100D型高压均质机,加拿大ATS公司(最大压力:180 MPa,额定流量:15 dm3/h);Dionex Ultimate 3000型高效液相色谱仪,美国Dionex公司;ZEN-3600型激光粒度分析仪,英国Malvern Instruments公司;JEM-2100型透射电镜,日本电子株式会社;Direct-QTM超纯水系统,Amicon Ultra-4超滤离心管(500 μL,100 kDa),密理博(上海)贸易有限公司;SRH-S300型高剪切均质机,上海世赫机电设备有限公司;DF-101S型集热式恒温加热磁力搅拌器,郑州长城科工贸有限公司。
1.3实验方法
1.3.1 川陈皮素纳米结构脂质载体的制备
本试验采用高压均质法制备NOB-NLC[14]。称取一定量的单硬脂酸甘油酯、中链甘油三酯及大豆卵磷脂,(75±3)℃水浴加热作为油相;待油相融化混匀后,加入川陈皮素(占总脂质质量分数5%),搅拌使其溶解均匀作为混合油相。将泊洛沙姆188溶解在超纯水中(100 mL),加热到相同温度后,将混合油相注入水相中,高剪切作用下(10 000 r/min),搅拌均匀即得初乳。冷却至室温,用高压均质机(70 MPa)将其均化,均质时间4 min 17 s(10次循环),迅速冷却至室温,得到NOB-NLC。
1.3.2 包封率的测定
1.3.2.1 液相色谱条件
色谱柱:C18柱(250 mm×4.6 mm×5 μm);流动相:V(纯水)∶V(乙腈)= 55∶45;紫外检测波长:333 nm;流速:1 mL/min;柱温:25℃;进样量:20 μL。
1.3.2.2 标准曲线的绘制
准确称取NOB标准品5 mg,定容于10 mL容量瓶,配置成质量浓度为500 μg/mL的NOB标准储备液。分别取NOB标准储备液10、50、100、200、400、600、800 μL,用甲醇定容至1 mL,得到浓度为5、25、50、100、200、300、400 μg/mL的NOB标准溶液。按照1.3.2.1条件进行测定,以NOB峰面积(A)为横坐标,以NOB标准容液质量浓度(C)为纵坐标绘制标准曲线。得到的标准曲线方程为公式(1),方程相关系数R2= 0.999 4,表明NOB在5~400 μg/mL浓度之间存在良好的线性关系[15]。
C=1.224 4A-0.562 3
(1)
1.3.2.3 包封率的测定
精密量取一定质量的NOB-NLC置于超滤离心管上室,于4℃下,3 000 g离心20 min。将离心后的滤出液用甲醇溶解并定容至1 mL,按照1.3.2.1条件进行测定,根据公式(1)计算出游离的NOB的质量(mfree)。另取NOB-NLC 1mL,甲醇破乳,定容至10 mL,测定得到NOB-NLC中NOB的总质量(mtotal)[16]。包封率(encapsulation efficiency,EE)的计算公式如下:
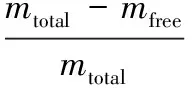
(2)
1.3.3 平均粒径(particle size)及多分散指数(poly ̄disper ̄sity index,PDI)、Zeta电位的测定
用激光粒度分析仪测定其平均粒径、多分散指数、及Zeta电位值,测定温度为25 ℃;其中平均粒径、多分散指数测试角度为173°[17]。
1.3.4 NOB-NLC的形态特征分析
取NOB-NLC适量,加水稀释,然后滴加少量于碳膜铜网上(230孔),室温下干燥24 h,再滴加质量浓度为20 mg/L的磷钨酸水溶液染色,自然干燥后,在透射电子显微镜下(transition electron microscopy,TEM)观察NOB-NLC的大小和形态特征,观测电压200 kV[18]。
1.3.5 单因素试验设计
NOB-NLC的制备受高压均质时间、高压均质功率、融化温度及油相与水相的比、乳化剂与脂质质量比、脂质用量等多种因素影响。本试验固定NOB与脂质总质量比1∶20及其他因素(详见1.3.1),通过改变脂质用量(固体脂质和液体脂质的质量和:120、420、720、1 020、1 320、1 620 mg)、乳化剂用量(卵磷脂与泊洛沙姆188的质量和:360、540、720、960、1 200、1 440 mg)和乳化剂比例(卵磷脂与泊洛沙姆188的质量比值:0.5、1、2、3、4、5)来考察各单因素对NOB-NLC制备的影响。
1.3.6 响应面试验设计
在 “纺纱工艺设计与质量控制”课程实施案例教学法,要根据教学大纲和培养方案,要理论联系实际,培养学生利用理论知识解决实际问题的能力。
在单因素试验的基础上,对各因素对NOB-NLC的影响进行综合考虑,根据Box-Behnken 试验设计原理,选择脂质用量(X1)、乳化剂用量(X2)和乳化剂比例(X3)为自变量,NOB-NLC的平均粒径(Y)为响应值,进行3因素3水平的响应面分析,来确定NOB-NLC最佳制备工艺条件,因素水平设计见表1。利用Design-Expert 8.0.5 进行数据分析并建立如公式(3)的模型。
Y=b0+b1X1+b2X2+b3X3+b12X1X2+b13X1X3+b23X2X3+b11X12+b22X22+b33X32
(3)

1.3.7 稳定性试验
1.3.7.1 温度对NOB-NLC贮藏稳定性的影响
将NOB-NLC溶液置于瓶中密封,分别置于4,25,37 ℃的条件下避光贮藏,分别在第0、10、20、30、40天取样,检测样品的外观、平均粒径、多分散指数,分析NOB-NLC溶液的物理稳定性。
1.3.7.2 pH值对NOB-NLC贮藏稳定性的影响
考虑到大部分食品体系的pH值范围为3.50~7.50,故将此作为考察NOB-NLC的稳定性的pH范围。用磷酸氢二钠-柠檬酸缓冲溶液配置pH值分别为3.50、4.50、5.50、6.50、7.50的缓冲溶液,用不同pH值的缓冲溶液稀释NOB-NLC溶液,测定平均粒径、多分散系数;密封后在25 ℃下避光贮藏40 d后,再次检测样品。
1.3.8 数据分析方法
OriginPro 9.0统计分析所得数据,并计算标准误差并制图;用SPSS Statiscics 软件对数据进行方差分析,利用邓肯式多重比较及t-检验法对差异显著性进行比较分析,p< 0.05表示差异显著,p< 0.01表示差异极显著,n=3。
2 结果与讨论
2.1单因素试验
2.1.1 脂质用量对NOB-NLC平均粒径的影响
由图1中结果可知,随着脂质用量的增加,粒径呈现出总体上升的变化趋势(p<0.05)。脂质用量为720 mg时其粒径接近200 nm,而脂质用量为1 440 mg时,其粒径达到300 nm。有报道指出,脂质含量与纳米体系的粒径大小、粒子形状等性质存在一定的相关性,并且固体和液体脂质的比例也是一个重要的影响因素[19]。另一方面,FLOURY等的研究也指出,随着脂质含量的增加,乳化剂的作用效率降低,从而会导致纳米乳液粒径增加[20]。故将工艺优化试验的脂质用量选在420~1 020 mg。

图1 脂质用量对NOB-NLC粒径的影响Fig.1 Influence of lipid mass on particle size of NOB-NLC注:Duncan法进行多重比较。标注相同小写字母者表示组间差异不显著(p>0.05);标注不同小写字母者表示组间差异显著(p<0.05)。图2同。
2.1.2 乳化剂用量对NOB-NLC平均粒径的影响
图2表明随着乳化剂用量从360 mg增加至960 mg时,NOB-NLC粒径呈现降低的趋势;而当乳化剂用量继续增加时,粒径开始增加(p<0.01)。
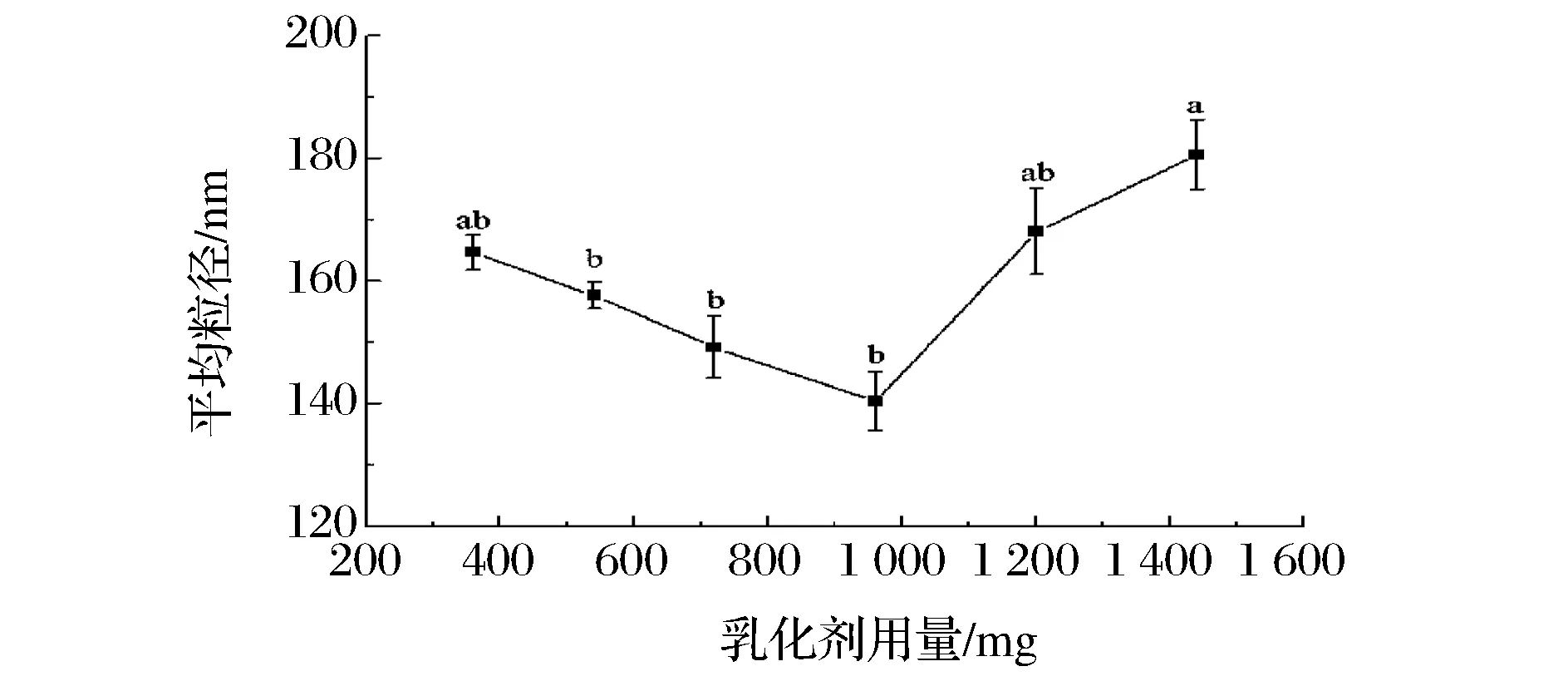
图2 乳化剂用量对NOB-NLC粒径的影响Fig.2 Influence of surfactant mass on particle size of NOB-NLC
乳化剂的浓度对粒径的影响可以通过“乳化剂缺陷区”和“乳化剂丰富区”2种不同的机制进行说明[21]。当乳化剂用量在360~960 mg时,纳米体系中的乳化剂处于缺陷状态,体系中没有足够的乳化剂将均质过程形成的小颗粒进行全面覆盖,未被乳化剂覆盖的纳米颗粒团聚形成小油滴,最后再聚集形成较大的粒子,此时,增加乳化剂的用量会改善这种情况,从而使得粒径减小。当乳化剂用量大于960 mg时,乳化剂的含量已足够覆盖全部纳米颗粒,此时,再向纳米体系中添加乳化剂时,它发挥的乳化作用就比较小了,粒径反而出现了上升的趋势,这可能与乳化剂和脂质等其他物质的比例变化有关。综合以上分析,将乳化剂用量选在720~1 440 mg之间。
2.1.3 乳化剂比例对NOB-NLC平均粒径的影响
图3表明乳化剂比例对粒径变化有较大的影响,呈现先下降后上升的趋势(p<0.01)。当乳化剂比例超过2时,NOB-NLC粒径大小随着比例的增加而急剧增加。卵磷脂的作用是可以在液滴表面形成界面膜,膜性质较稳定,同时还可以提供负电荷屏障,因此使得制备的NLC放置更稳定且包封率也较高。泊洛沙姆188是一种非离子型表面活性剂,它是聚氧乙烯-聚氧丙烯共聚物,其聚氧乙烯链段具亲水性,聚氧丙烯链段具疏水性,能改变纳米载体表面疏水性,使得NLC的稳定性增加。但其用量不宜过大,如超过一定范围,体系黏度增加,NLC易形成胶束;同时使得粒子间相互碰撞机会增加,导致粒子聚合甚至胶凝,体系的稳定性变差。综合考虑将乳化剂比例在0.5~2进行优化。

图3 乳化剂比例对NOB-NLC粒径的影响Fig.3 Influence of surfactant ratio on particle size of NOB-NLC注:Duncan法进行多重比较。标注相同小写字母者表示组间差异不显著(p>0.05);标注不同小写字母者表示组间差异显著(p<0.05);标有不同大写字母者表示组间差异极显著(p<0.01)。
2.2响应面试验
2.2.1 试验模型的建立及其显著性检验
由表2数据可知,平均粒径取值在132.07 nm和193.27 nm之间水平排列,平均值171.40 nm,试验值与观测值之间具有较好的一致性。分析数据得到NOB-NLC平均粒径(Y)对脂质用量(X1)、乳化剂用量(X2)和乳化剂比例(X3)的二次多项回归模型如下式(4),公式中3个因素前的系数均为负,表示粒径随脂质用量、乳化剂用量和乳化剂比例的增加而减少。
Y=563.67-0.45X1-0.36X2-106.19X3+1.16E-005X1X2+0.011X1X3-2.76E-003X2X3+2.80E-004X12+1.64E-004X22+40.79X32
(4)


2.2.2 响应面分析
对响应面方差分析结果做响应曲面及等值线图(图4~图6),响应曲面图是一个变量在零水平时,其余2个变量对NOB-NLC平均粒径交互作用的影响。等值线图越圆,表明交互作用对NOB-NLC平均粒径的影响越小,等值线图越扁平,表示因素间的交互影响越大。从以下的响应面及等值线图中可以看出,任意2个单因素之间均不存在明显的交互作用,最佳工艺点均落在试验考察的区域范围内。

表3 Box-Behnken试验方差分析
注:*为差异显著(p<0.05),**为差异极显著(p<0.01)。
图4表示的是当乳化剂比例为1.25时,脂质用量与乳化剂用量交互作用对NOB-NLC平均粒径的影响。当乳化剂用量一定时,随着脂质用量的增加,粒径呈现先减小后增大的趋势;而当脂质用量一定时,随着乳化剂用量的增大,平均粒径也呈现先减小后增大的趋势,但是变化幅度较脂质用量稍小;脂质用量与乳化剂用量交互作用对粒径大小影响不显著(p>0.05)。

图4 脂质用量与乳化剂用量交互影响NOB-NLC平均粒径的响应面图与等值线图Fig.4 Response surface and contour plots for the effects of lipid mass and surfactant mass on particle size of NOB-NLC
图5为乳化剂用量1 080 mg时,脂质用量与乳化剂比例交互作用对NOB-NLC平均粒径影响的响应面图与等值线图。由图可知:当脂质用量一定时,粒径随着乳化剂比例的增加呈现先减小后增大的趋势;当乳化剂比例一定时,随着脂质用量的增大,NOB-NLC粒径呈现出现反抛物线式的变化,说明脂质用量存在一个最低值。在脂质用量为600~900 mg,乳化剂比例0.8~1.6时,响应值最小。

图5 脂质用量与乳化剂比例交互影响NOB-NLC平均粒径的响应面图与等值线图Fig.5 Response surface and contour plots for the effects of lipid mass and surfactant ratio on particle size of NOB-NLC
图6中所显示的是脂质用量为720 mg时,乳化剂用量与乳化剂比例交互作用对NOB-NLC平均粒径的影响。由图6可看出,当乳化剂比例一定时,随着乳化剂用量的增加,粒径呈现先降低后增加的趋势,变化较明显;乳化剂比例呈现类似的趋势。乳化剂用量在900~1 250 mg,乳化剂比例0.8~1.6时,响应值最小,即平均粒径最小。

图6 乳化剂用量与乳化剂比例交互影响NOB-NLC平均粒径的响应面图与等值线图Fig.6 Response surface and contour plots for the effects of surfactant mass and surfactant ratio on particle size of NOB-NLC
2.2.3 工艺优化及验证实验
根据所建立的模型进行参数最优化分析,得到NOB-NLC平均粒径最小的工艺参数为:脂质用量752.20 mg,乳化剂用量1 072.41 mg,乳化剂比例1.23,在此条件下,NOB-NLC平均粒径的预测值为138.46 nm,按照此工艺参数进行试验,制备的NOB-NLC平均粒径为(132.63±7.28)nm,与模型预测值误差4.21%。
2.3NOB-NLC外观、形态、粒径、Zeta电位分析
由图7-a可以看出,制备的NOB-NLC的外观呈现半透明状态,有淡蓝色乳光;透射电子显微镜结果显示显示(图7-b) 优化后的NOB-NLC微观形态为球形或近似球形,粒径大小均一,且粒子之间没有出现粘连、团聚现象。
NOB-NLC的平均粒径为(132.63±7.28)nm(图8-a),多分散指数为0.253±0.015,表明粒径分布范围较小。Zeta电位为(-38.1±2.17)mV(图8-b),Zeta电位的绝对值大于30 mV,体系稳定性较好。样品包封率为(80.25±3.66)%,表明所制备的样品对NOB有较好的搭载效果。

图7 NOB-NLC的外观及透射电子显微镜图像(标尺表示200 nm)Fig.7 The extrinsic feature (a) TEM photomicrographs of NOB-NLC (b). (Scale bar represents 200 nm)

图8 NOB-NLC的平均粒径及Zeta电位Fig.8 The particle size (a) and zeta potential (b) of NOB-NLC
2.4稳定性试验
2.4.1 温度对NOB-NLC贮藏稳定性的影响
由图9可知,当贮藏温度提高到37℃时,贮藏40 d后,载体体系的粒径和多分散指数均有显著的增大(p< 0.01),粒径从132.63 nm增加至550.76 nm,多分散指数从0.253增加至0.691,体系稳定性大大下降。原因可能是当NOB-NLC贮藏在37℃时,与4、25℃相比,其整个体系的运动能量较高,加速纳米粒子之间的碰撞,从而导致纳米粒子之间团聚的几率增加,使得其粒径增大[22]。在4 ℃下随时间的延长,其平均粒径约增大了360%(p< 0.01),粒度分布范围变宽(p< 0.01),系统稳定性降低,可能是由于温度过低,使得脂质的沉淀结晶加剧,体系稳定性被破坏,导致了絮凝。在贮藏期内,随着时间的延长,25℃下贮藏的NOB-NLC的粒径以及多分散指数小于其他两组,载体体系稳定性最好。NOB-NLC在25 ℃下放置时,外观基本未发生变化,到第40天时体系仍澄清透明,但在4、37 ℃下其外观变化明显,到40天时体系较贮藏开始时明显浑浊,因此,NOB-NLC应尽可能室温条件下贮藏。

图9 温度对NOB-NLC的平均粒径(a)及多分散指数(b)的影响Fig.9 Effect of temperature on particle size (a) and PDI (b) of NOB-NLC注:t-检验法进行分析,同一贮藏时间中其他两组与25℃组相比,**表示差异极显著(p<0.01),*表示差异显著(p<0.05),不标者表示差异不显著(p>0.05)。
2.4.2 pH值对NOB-NLC贮藏稳定性的影响
图10中给出了样品在不同pH条件下贮藏0 d及40 d后,NOB-NLC的粒径及多分散指数随时间的变化关系。由图可知,在pH值为3.50~7.50内,试验开始时,不同pH下NLC的粒径差别不大(p>0.05),样品保持稳定,多分散指数基本低于0.30(p>0.05),粒径分布比较均一,载体体系稳定。40 d贮藏结束时,在不同pH下贮藏的NOB-NLC,其粒径与多分散指数都呈现了上升的趋势,不同pH之间的平均粒径和多分散指数的差异达到了极显著水平(p< 0.01),特别是在pH值为5.50时尤为明显,可能是由于在这一pH条件下,由于体系正电荷的作用使粒子带电量到达等电点附近,因斥力减小而发生了聚集。贮藏结束后,NOB-NLC平均粒径在400 nm以下,多分散指数小于0.50,体系外观良好,故NOB-NLC可以应用于pH值为3.50~7.50的食品体系当中。

图10 温度对NOB-NLC的平均粒径及多分散指数的影响(图a表示0 d时测定结果;图b表示40 d时测定结果)Fig.10 Effect of pH on particle size and PDI of NOB-NLC. (Fig.a represents for 0 d results; Fig.b represents for 0 d results)注:Duncan法进行多重比较。标注相同小写字母者表示组间差异不显著(p>0.05);标注不同小写字母者表示组间差异显著(p<0.05);标注不同大写字母者表示组间差异极显著(p<0.01)。
3 结论
本试验通过单因素试验和Box-Behnken响应面法,以平均粒径为响应值,优化了川陈皮素纳米结构脂质载体的制备工艺。结果显示,脂质含量对平均粒径的影响显著(p<0.05),因素间的交互作用不显著(p>0.05),通过响应面法建立多元二次模型极显著(p<0.01),得到了最佳的处方工艺为脂质用量752.20 mg,乳化剂用量1 072.41 mg,乳化剂比例1.23,NOB-NLC平均粒径的预测值为138.46 nm;在此条件下制备NOB-NLC,得到的纳米载体平均粒径为(132.63±7.28)nm,多分散指数为(0.253±0.015),Zeta电位为(-38.1±2.17)mV,包封率为(80.25±3.66)%;通过透射电子显微镜观察,粒子大小分布均匀,结构完整;在25℃条件下,pH范围3.50~7.50,40 d贮藏期内,显示出良好的稳定性。本试验制备的川陈皮素纳米结构脂质载体体系稳定,各项考察指标均比较理想,可将其作为NOB的一种新的载体形式,应用于食品添加剂、功能食品等方面,为川陈皮素下一步的研究和开发利用奠定了良好基础。
[1] 王磊,苏学素,付陈梅,等. 柑橘中多甲氧基黄酮生物活性及应用研究进展[J]. 食品科学,2009,30(7): 285-290.
[2] 姚晓琳. 锦橙皮中多甲氧基黄酮抑菌抗氧化活性研究[D]. 武汉:华中农业大学,2010.
[3] LI S,WANG H,GUO L,et al. Chemistry and bioactivity of nobiletin and its metabolites[J]. Journal of Functional Foods,2014,6: 2-10.
[4] ONOUE S,UCHIDA A,TAKAHASHI H,et al. Development of high-energy amorphous solid dispersion of nanosized nobiletin,a citrus polymethoxylated flavone,with improved oral bioavailability[J]. Journal of Pharmaceutical Sciences,2011,100(9): 3 793-3 801.
[5] YAO J,ZHOU J P,PING Q N,et al. Distribution of nobiletin chitosan-based microemulsions in brain following i.v. injection in mice[J]. International Journal of Pharmaceutics,2008,352(1/2): 256-262.
[6] WEI L,JING Y,JIANPING Z. Preparation of self-assemble nobiletin proliposomes and its pharmacokinetics in rats[J]. Acta Pharmaceutica Sinica,2009,44(2): 192-196.
[7] LUQUE-ALCARAZ A G,LIZARDI J,GOYCOOLEA F M,et al. Characterization and Antiproliferative Activity of Nobiletin-Loaded Chitosan Nanoparticles[J]. Journal of Nanomaterials,2012,2012: 1-7.
[8] VARSHOSAZ J,ESKANDARI S,TABBAKHIAN M. Freeze-drying of nanostructure lipid carriers by different carbohydrate polymers used as cryoprotectants[J]. Carbohydrate Polymers,2012,88(4): 1 157-1 163.
[9] MU X,ZHONG Z. Preparation and properties of poly(vinyl alcohol)-stabilized liposomes[J]. International Journal of Pharmaceutics,2006,318(1/2): 55-61.
[10] YUAN H,WANG L,DU Y,et al. Preparation and characteristics of nanostructured lipid carriers for control-releasing progesterone by melt-emulsification[J]. Colloids and Surfaces B: Biointerfaces,2007,60(2): 174-179.
[11] MULLER R,PETERSEN R,HOMMOSS A,et al. Nanostructured lipid carriers (NLC) in cosmetic dermal products[J]. Advanced Drug Delivery Reviews,2007,59(6): 522-530.
[12] CHIA-LANG FANG S A A J. Nanostructured lipid carriers (nlcs) for drug delivery and targeting[J]. Recent Patents on Nanotechnology,2013(7): 41-55.
[13] TAMJIDI F,SHAHEDI M,VARSHOSAZ J,et al. Nanostructured lipid carriers (NLC): A potential delivery system for bioactive food molecules[J]. Innovative Food Science & Emerging Technologies,2013,19: 29-43.
[14] MEI LI Y Z F S. Development of ionic-complex-based nanostructured lipid carriers to improve the pharmacokinetic profiles of breviscapine.[J]. Acta Pharmacologica Sinica,2013(34): 1 108-1 115.
[15] 张玉,李洪军,窦华亭,等. 响应面法优化超声波提取川皮苷工艺研究[J]. 食品科学,2012,33(20): 123-127.
[16] SUN M,NIE S,PAN X,et al. Quercetin-nanostructured lipid carriers: Characteristics and anti-breast cancer activities in vitro[J]. Colloids and Surfaces B: Biointerfaces,2014,113: 15-24.
[17] SHANGGUAN M,LU Y,QI J,et al. Binary lipids-based nanostructured lipid carriers for improved oral bioavailability of silymarin[J]. Journal of Biomaterials Applications,2013,28(6): 887-896.
[18] ESPOSITO E,RAVANI L,DRECHSLER M,et al. Cannabinoid antagonist in nanostructured lipid carriers (NLCs): design,characterization andinvivostudy[J]. Materials Science and Engineering: C,2015,48: 328-336.
[19] JORES K,MEHNERT W,DRECHSLER M,et al. Investigations on the structure of solid lipid nanoparticles (SLN) and oil-loaded solid lipid nanoparticles by photon correlation spectroscopy,field-flow fractionation and transmission electron microscopy[J]. Journal of Controlled Release,2004,95(2): 217-227.
[20] JULIANE FLOURYU A D J L. Effect of high-pressure homogenization on droplet size distributions and rheological properties of model oil-in-water emulsions[J]. Innovative Food Science & Emerging Technologies,2000(1): 127-134.
[21] YANG Y,MARSHALL-BRETON C,LESER M E,et al. Fabrication of ultrafine edible emulsions: Comparison of high-energy and low-energy homogenization methods[J]. Food Hydrocolloids,2012,29(2): 398-406.
[22] HU F,JIANG S,DU Y,et al. Preparation and characteristics of monostearin nanostructured lipid carriers[J]. International Journal of Pharmaceutics,2006,314(1): 83-89.
Preparationandstabilityevaluationfornobiletinnanostructuredlipidcarriers
HUANG Wei1,2,DOU Hua-ting1*,WU Hou-jiu1,WANG Hua1,SUN Zhi-gao1,MA Ya-qin1,HUANG Lin-hua1,GUO Li1,WANG Jun1,HUANG Xue-gen1
1(Citrus Research Institute,Southwest University,Beibei,Chongqing 400712,China) 2(College of Forestry and Life Science,Chongqing University of Arts and Sciences,Yongchuan,Chongqing 402160,China)
Nanostructured Lipid Carriers (NLC) are a new lipid nanoparticle system and are wildly used in many fields of food science and process.Nobiletin,a citrus polymethoxylated flavone is extracted from citrus fruit peels,and has many health benefits.Nanostructured NLC can increase its water-solubility and bioavailability.High pressure homogenization was used to prepare nobiletin nanostructured lipid carrier (NOB-NLC).Single factor design was chosen to study the influence of the amount of lipid,emulsifier and emulsifier ratio on the quality of NOB-NLC.Response surface design was used to optimize the preparation parameters.The optimal condition was: 752.20 mg lipid,1072.41 mg emulsifier and 1.23 drug-lipid ratio.NLC -NOB exhibited spherical shape with diameter of (132.63±7.28) nm,polydispersity index (0.253±0.015),zeta potential (-38.1±2.17)mV and an entrapment efficiency (80.25±3.66)%.The scanning electron microscope showed that the NOB-NLC were spherical shape.The influence of storage conditions on the stability of NOB-NLC was studied.The results indicated that NOB-NLC was stable after storage in dark at 25 ℃,pH 3.5-7.5 for 40 d,and the particle size is relatively consistent.It is available to the food systems with pH range of 3.50-7.50.
nanostructured lipid carriers; nobiletin; Box-Behnken design; characterization; stability
10.13995/j.cnki.11-1802/ts.013503
博士研究生,助教(窦华亭教授为通讯作者,E-mail:hdou ̄33880@yahoo.com)。
公益性行业(农业)科研专项(201303076-07);重庆市2016年基础科学与前沿技术研究一般项目(cstc2016 ̄jcyjA ̄0552)
2016-11-28,改回日期:2017-01-17
