敲除aceA和gogat及过表达gltA对谷氨酸棒状杆菌GKGD合成α-酮戊二酸的影响
2017-09-22薛宁李智祥战俊杰赵磊梁云龙冯甲刘涛徐庆阳张成林陈宁
薛宁,李智祥,战俊杰,赵磊,梁云龙,冯甲,刘涛,徐庆阳, 2, 3,张成林, 2, 3,陈宁, 2, 3*
1(天津科技大学 生物工程学院,天津,300457)2(代谢控制发酵技术国家地方联合工程实验室,天津,300457) 3(天津市氨基酸高效绿色制造工程实验室,天津,300457)
敲除aceA和gogat及过表达gltA对谷氨酸棒状杆菌GKGD合成α-酮戊二酸的影响
薛宁1,李智祥1,战俊杰1,赵磊1,梁云龙1,冯甲1,刘涛1,徐庆阳1, 2, 3,张成林1, 2, 3,陈宁1, 2, 3*
1(天津科技大学 生物工程学院,天津,300457)2(代谢控制发酵技术国家地方联合工程实验室,天津,300457) 3(天津市氨基酸高效绿色制造工程实验室,天津,300457)
α-酮戊二酸(α-ketoglutarate,α-KG)在生命活动中具有重要的作用,被广泛应用于食品、医药等领域。以α-KG生产菌谷氨酸棒状杆菌GKGD为出发菌株,敲除其异柠檬酸裂解酶编码基因aceA以增加异柠檬酸供应,获得GKGD-1,摇瓶发酵条件下其α-KG产量和转化率分别提高14.72%和9.76%;敲除谷氨酸合酶编码基因gogat以降低L-谷氨酸生成量,获得GKGD-2,其α-KG产量和转化率分别提高7.39%和5.43%,L-谷氨酸生成量降低52.87%;过表达柠檬酸合酶编码基因gltA以进一步增加前体物供应,获得GKGD-3,其α-KG产量提高35.9%;于7.5 L发酵罐经30 h发酵,GKGD-3 α-KG产量达49.5 g/L,较出发菌株提高36.4%,L-谷氨酸生成量降低50%。敲除aceA和gogat并过表达gltA可显著提高α-KG产量并降低L-谷氨酸生成量。
α-酮戊二酸;L-谷氨酸;谷氨酸合酶;异柠檬酸裂解酶;柠檬酸合酶
α-酮戊二酸(α-ketoglutarate,α-KG)是TCA循环中的重要中间产物,参与氨基酸、维生素、有机酸及能量代谢[1-2],被广泛应用于化工、食品、医药、日化等领域[3-6]。目前主要采用化学法生产α-KG,但因收率低、氰化物污染等问题制约了其在医药和食品等领域的应用[7]。发酵法生产α-KG因具有成本低、收率高、副产物少等优点而被认为具有很大的工业化生产的潜力。
发酵法生产α-酮戊二酸最早始于LOCKWOOD和STODOLA对利用荧光假单胞菌(Pseudomonasfluorescens)生物合成α-酮戊二酸的研究[7-9]。自20世纪70年代,人们陆续发现耶罗维亚酵母(Yarrowialipolytica)等酵母菌亦能过量合成α-酮戊二酸[10-15]。然而利用酵母合成α-KG周期较长(大于120 h)[10-15]。谷氨酸棒杆菌(Corynebacteriumglutamicum)具有过量合成L-谷氨酸的能力,而L-谷氨酸主要来源于α-KG的氨基化,因此被认为是具有α-KG生产潜力的微生物[16-17]。在前期研究中,我们以L-谷氨酸生产菌C.glutamicumGDK-9为出发菌株经代谢工程改造获得的C.glutamicumGKGD α-KG产量达到45.6 g/L[18]。

图1 谷氨酸棒杆菌α-KG合成途径及本研究改造策略Fig.1 α-KG synthesis pathway in C.glutamicum and strategy for strain genetic modification in this study
如图1所示,在谷氨酸棒状杆菌中,葡萄糖经糖酵解途径生成丙酮酸并被催化生成草酰乙酸和乙酰-CoA,二者经柠檬酸合酶催化生成柠檬酸,后者经催化生成异柠檬酸,进而经异柠檬酸脱氢酶催化合成α-KG[19]。同时,异柠檬酸可经异柠檬酸裂解酶催化生成乙醛酸和琥珀酸。α-KG主要存在3条代谢途径:(1) 经α-酮戊二酸脱氢酶氧化为琥珀酸;(2) 经谷氨酸脱氢酶氨基化为L-谷氨酸;(3) 经谷氨酸合酶催化生成L-谷氨酸。在GKGD中,途径(1)被弱化,途径(2)被阻断[18-19]。因此,本研究以GKGD为出发菌株拟采用阻断乙醛酸循环和谷氨酸合成途径并增强柠檬酸合成代谢流策略通过敲除异柠檬酸裂解酶编码基因aceA和谷氨酸合酶编码基因gogat并过表达柠檬酸合酶编码基因gltA以期增加α-KG的合成(图1)。
1 材料与方法
1.1材料与试剂
1.1.1 菌株及质粒
本研究所用菌株及质粒如表1所示。

表1 菌株及质粒
1.1.2 引物
参考NCBI中C.glutamicumATCC13032aceA和gltA及gogat序列,采用Primer5.0软件设计引物(表2)。

表2 引物
1.1.3 培养基
利用LB培养基培养大肠杆菌和谷氨酸棒杆菌,必要时添加卡那霉素(50 μg/mL)或氯霉素(30 μg/mL)。
摇瓶种子培养基:葡萄糖 25 g/L,K2HPO4·3H2O 2.2 g/L,MgSO4·7H2O 0.9 g/L,尿素3.5 g/L,玉米浆 40 mL/L,豆粕水解液 15 mL/L, pH 7.0~7.2,121 ℃高压蒸汽灭菌20 min。
摇瓶发酵培养基:葡萄糖 80 g/L, MgSO4·7H2O 1.8 g/L,Na2HPO42.8 g/L,KCl 1.3 g/L,VB10.23 mg/L,MgSO4·7H2O 2.3 mg/L,FeSO4·7H2O 2.3 mg/L,玉米浆 1 mL/L,豆粕水解液 15 mL/L,pH 7.0~7.2,121 ℃高压蒸汽灭菌20 min。
发酵罐种子培养基:葡萄糖30 g/L,玉米浆35 mL/L,豆粕水解液20 mL/L,K2HPO4·3H2O 2.2 g/L,MgSO4·7H2O 0.9 g/L,pH 7.0~7.2,121 ℃高压蒸汽灭菌20 min。
发酵罐发酵培养基:葡萄糖80 g/L,Na2HPO43 g/L,KCl 1.5 g/L,MgSO4·7H2O 2 g/L,MnSO4·7H2O 5 mg/L,FeSO4·7H2O 5 mg/L,ZnSO45 mg/L,VB10.4 mg/L,玉米浆 3 mL/L,豆粕水解液20 mL/L,必要时加入谷氨酸钠 2 g/L,pH 7.0~7.2,121 ℃高压蒸汽灭菌20 min。
1.1.4 试剂
限制性内切酶、T4DNA 连接酶、ExTaq DNA 聚合酶,宝生物工程(大连)有限公司;PCR 产物纯化试剂盒、胶回收试剂盒及质粒提取试剂盒,北京博迈德生物技术有限公司;异柠檬酸裂解酶试剂盒、柠檬酸合酶试剂盒,北京索莱宝科技有限公司;α-KG:分析纯,美国Sigma-Aldrich公司。
1.2仪器与设备
生物传感仪(SBA-40C),山东省科学院生物研究所;高效液相色谱仪(Agilent 1100),美国安捷伦科技公司。
1.3实验方法
1.3.1 用于aceA和gogat敲除及gltA基因过表达重组质粒的构建
以GKGD基因组为模板利用引物aceA-1和aceA-2及aceA-3和aceA-4获得aceA基因上下游同源片段,并以其为模板利用引物aceA-1和aceA-4获得重组片段。回收后经EcoR I和SalI双酶切、电泳、回收并连接pK18mobsacB后转化至E.coliDH5α中。经筛选后提取重组质粒进行酶切验证,将重组质粒命名为pK18mobsacB△aceA。同理获得用于gogat敲除的重组质粒pK18mobsacB△gogat。
以GKGD基因组DNA为模板利用引物gltA-1和gltA-2扩增获得gltA片段,回收后经HindI和EcoRI酶切、回收并连接pXMJ19后转化至E.coliDH5α中。经筛选后提取重组质粒进行酶切验证,将重组质粒命名为pX-gltA。
1.3.2 重组菌株GKGD-1、GKGD-2和GKGD-3的构建
取适宜浓度的pK18mobsacB△aceA电转化至GKGD感受态细胞(2.5 kV,25 μF,200 Ω,1 mm电击杯)[22]。将电转后的菌液涂布于含卡那霉素的LB平板上,32 ℃倒置培养36 h后,挑取单菌落活化后提取其基因组DNA并进行PCR鉴定。将阳性转化子在10%蔗糖的LB摇管中反复传代后,筛选在LB平板上生长、在含卡那霉素平板上不生长的单菌落,提取其基因组DNA进行PCR验证,获得aceA基因缺失菌株GKGD-1。采用相同方法获得gogat敲除菌株GKGD-2。
提取质粒pXMJ19及pX-gltA电转化至GKGD-2、将pXMJ19电转化至GKGD,经活化后涂布于含氯霉素平板进行筛选,挑选单菌落并提取质粒经酶切验证,分别获得GKGDpX、GKGD-3和GKGDpM。
1.3.3 酶活性测定
收集培养至对数中期的菌体,分别按异柠檬酸裂解酶试剂盒和柠檬酸合酶试剂盒说明书处理菌体并测定异柠檬酸裂解酶和柠檬酸合酶活性。
1.3.4 摇瓶发酵
将种子培养物按10%的接种量接种至含30 mL摇瓶发酵培养基的500 mL挡板瓶中,于34℃ 200 r/min振荡培养,维持pH 7.0~7.2。GKGDpM、GKGDpX和GKGD-3 生长至OD600=0.6~0.8时添加0.2 mmol/L的IPTG。
1.3.5 发酵罐发酵
以15%接种量将种子培养物接至含4.5 L发酵培养基的7.5 L发酵罐中,发酵温度为34℃;通气量为2~5 L/min,搅拌转速200~1 000 r/min;分阶段控制溶氧:发酵初期维持30%,稳定期维持50%~60%,发酵后期维持40%。待细胞转型后,以25% NaOH调节pH 7.0~7.2;根据需要流加泡敌消泡。发酵过程中,流加80%~90%的葡萄糖溶液,维持残糖1%~2%。
1.3.6 葡萄糖、L-谷氨酸和α-KG含量测定及数据分析
采用SBA-40C生物传感仪测定葡萄糖和L-谷氨酸浓度。
采用Agilent 1100高效液相色谱仪测定α-KG浓度。色谱柱 Bio-Rad Aminex HPX-87H(300 mm×7.8 mm,L×I.D.);流动相 0.005 mol/L H2SO4;柱温 30℃;流速 0.5 mL/min;检测波长 215 nm。
根据公式 DCW= 0.244 5×OD600-0.012 6计算菌体干重(dry cell weight,DCW)。
1.4数据分析
每组实验均设3个平行并重复3次,利用Origin 8.0和SPSS 13.0统计软件对实验数据进行分析和处理。
2 结果与讨论
2.1异柠檬酸裂解酶编码基因aceA敲除对α-KG合成的影响
异柠檬酸经异柠檬酸裂解酶催化生成乙醛酸和琥珀酸[19],从而减弱α-KG合成代谢流,故认为阻断该途径可为α-KG提供更多的前体物异柠檬酸。将重组质粒pK18mobsacB△aceA转化至GKGD后经筛选,挑选重组子利用引物aceA-1和aceA-4对其进行PCR鉴定,获得碱基数约为2 000 bp和1 200 bp的片段,与理论值2 104 bp和1 240 bp一致(图2),表明pK18mobsacB△aceA成功整合至GKGD基因组。利用引物aceA-1和aceA-4对第二次重组的重组子进行PCR鉴定,获得碱基数约为1 200 bp的片段,与理论值1 240 bp一致,表明aceA被成功敲除,命名为GKGD-1。

M-DNA marker;1-以第1次重组的菌株基因组DNA为模板的PCR产物电泳图谱;2-以第2次重组的菌株(即GKGD-1)基因组DNA为模板的PCR产物电泳图谱;3-以GKGD基因组DNA为模板的PCR产物电泳图谱图2 aceA基因敲除株GKGD-1的PCR鉴定图谱Fig.2 Map for identification of aceA-knockout strain GKGD-1
分别收集培养至对数中期的GKGD 和GKGD-1菌体细胞测定其异柠檬酸裂解酶活性,结果表明,GKGD-1未检测到异柠檬酸裂解酶活性,进一步说明aceA被成功敲除(表3)。

表3 各菌株异柠檬酸裂解酶和柠檬酸合酶活性
注:*未检测到; **:未检测。
利用GKGD-1进行摇瓶发酵,以测定aceA敲除对其α-KG合成的影响。结果如表4所示,GKGD-1的α-KG产量和转化率分别为12.86 g/L和8.66%,较出发菌株GKGD分别提高14.72%和9.76%,而其生物量未见明显变化。
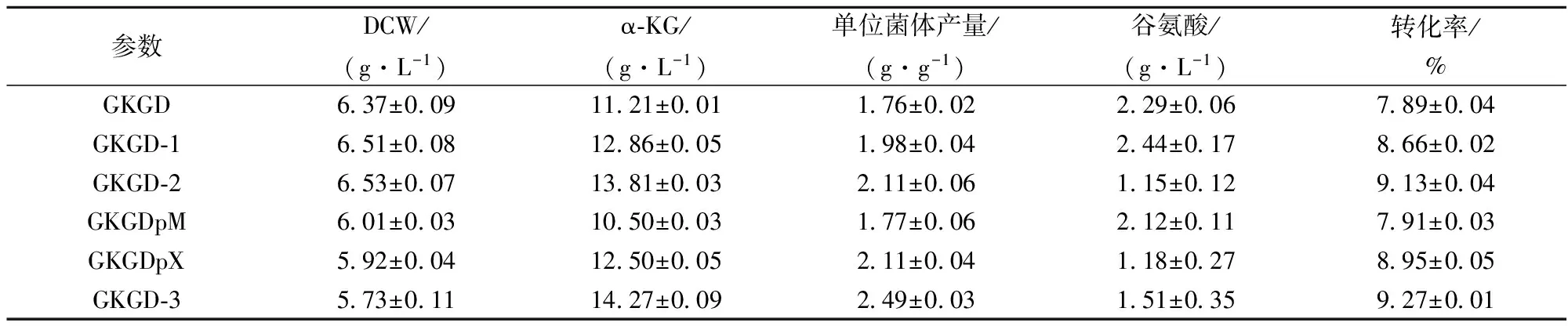
表4 各菌株摇瓶发酵参数
2.2谷氨酸合酶编码基因gogat敲除对α-KG合成的影响
1分子α-KG和谷氨酰胺经谷氨酸合酶催化生成2分子L-谷氨酸[19],故推测阻断该途径可增强α-KG的积累并减少副产物L-谷氨酸的合成。将重组质粒pK18mobsacB△gogat转化至GKGD-1后经筛选,挑选重组子利用引物gogat-1和gogat-4对其进行PCR鉴定,获得碱基数约为4 000 bp 和1 000 bp的片段,与理论值4 328 bp和1 184 bp一致(图3),表明pK18mobsacB△gogat成功整合至GKGD-1基因组。利用引物gogat-1和gogat-4对第二次重组的重组子进行PCR鉴定,获得碱基数约为1 000 bp的片段,与理论值1 184 bp一致,表明gogat被成功敲除,命名为GKGD-2。
利用GKGD-2进行摇瓶发酵,以测定gogat敲除对其α-KG合成的影响。结果如表4所示,GKGD-2的α-KG产量和转化率分别为13.81 g/L和9.13%,较出发菌株GKGD-1分别提高7.39%和5.43%,较GKGD分别提高21.19%和15.72%,其L-谷氨酸积累量为1.15 g/L,较GKGD-1降低52.87%,而其生物量未见明显变化。由此可见,阻断谷氨酸合酶途径可显著增强α-KG的积累并减少副产物L-谷氨酸的合成。
2.3过表达柠檬酸合酶编码基因gltA对α-KG合成的影响
柠檬酸合酶催化柠檬酸合成,是TCA循环中的关键酶[19]。以GKGD基因组为模板利用引物gltA-1和gltA-2扩增获得柠檬酸合酶编码基因gltA片段(图3A),将其克隆并转化至大肠杆菌E.coliDH5α感受态细胞。将筛选获得的转化子活化后提取质粒进行PCR和酶切鉴定。质粒经PCR扩增获得碱基数为约1 300 bp的片段与理论值1 314 bp一致;质粒经单、双酶切分别获得碱基数约为8 000 bp及7 000 bp和1 300 bp的片段,与理论值7 915 bp及6 601 bp和1 314 bp一致(图4A),表明质粒构建成功,命名为pX-gltA。将重组质粒pX-gltA转化至GKGD-2,筛选获得的转化子活化后提取质粒进行PCR和酶切鉴定,获得片段的碱基数与理论值一致(图4B),表明菌株构建成功,命名为GKGD-3。分别收集培养至对数中期的GKGD 和GKGD-3菌体细胞测定其柠檬酸合酶活性,发现GKGD-3的柠檬酸合酶活性较GKGD提高112.9%,由此可见,过表达gltA可有效提高柠檬酸合酶活性(表3)。

M-DNA marker;1-以第1次重组的菌株基因组DNA为模板的PCR产物电泳图谱;2-以第2次重组的菌株(即GKGD-2)基因组DNA为模板的PCR产物电泳图谱;3-以GKGD-1基因组DNA为模板的PCR产物电泳图谱图3 gogat基因敲除株GKGD-2的PCR鉴定图谱Fig.3 Map for identification of gogat-knockout strain GKGD-2
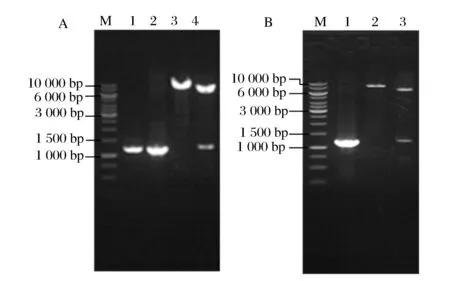
A:pX-gltA的PCR及酶切鉴定图谱M-marker;1-以GKGD基因组DNA为模板的PCR产物电泳图谱;2-以重组质粒pX-gltA为模板PCR产物电泳图谱;3-重组质粒pX-gltA单酶切产物电泳图谱; 4-重组质粒pX-gltA双酶切产物电泳图谱 B:从GKGD-3提取质粒的PCR及酶切鉴定图谱 M-marker;1-以从GKGD-3提取质粒的重组质粒pX-gltA为模板PCR产物电泳图谱;2-从GKGD-3提取质粒的重组质粒pX-gltA的单酶切产物电泳图谱;3-从GKGD-3提取质粒的重组质粒pX-gltA的双酶切产物电泳图谱图4 gltA基因过表达重组质粒pX-gltA及菌株GKGD-3 PCR鉴定图谱Fig.4 Map for identification of pX-gltA and GKGD-3
利用GKGD-3进行摇瓶发酵,以测定过表达柠檬酸合酶对其α-KG合成的影响。结果如表4所示,GKGD-3的α-KG产量为14.27 g/L,分别较对照菌株GKGDpX和GKGDpM提高14.16%和35.9%。值得注意的是,与GKGD-2相比GKGD-3 α-KG产量提高不显著,但其单位菌体产量提高18.01%。其原因可能是质粒造成菌体生长和代谢负担致使生物量下降12.4%。因此在后续研究中可采用基因整合的方式将gltA启动子替换为强启子(如Ptuf等)以增强gltA的表达量同时不影响菌体生物量。
2.4发酵罐条件下GKGD-3的发酵特性
利用重组菌株GKGD-3于7.5 L发酵罐进行发酵实验,以GKGD和GKGDpM为对照,结果如表5和图5所示。经30 h发酵,GKGD-3 α-KG产量达到49.5 g/L,分别较对照菌株GKGDpM和GKGD提高36.4 %和9.8%;其单位菌体产量为3.9 g/g,分别较GKGDpM和GKGD提高39.3%和50.0%;L-谷氨酸积累量分别降低60.8%和50.0%;其转化率分别提高8.8%和4.5%。

表5 菌株于7.5 L发酵罐条件下的发酵参数

图5 菌株发酵过程曲线Fig.5 Fermentation process curve of strains方形和圆形分别代表生物量和α-KG产量;黑色实心为GKGD;灰色实心为GKGDpM;空心为GKGD-3
3 结论
本研究以α-KG生产菌GKGD为出发菌株,采用增强柠檬酸合成代谢流、阻断乙醛酸循环及谷氨酸合成途径策略通过敲除异柠檬酸裂解酶编码基因aceA和谷氨酸酶编码基因gogat并过表达柠檬酸合酶编码基因gltA使得α-KG产量分别于摇瓶条件和7.5 L发酵罐条件下提高35.9%和36.4%,使得L-谷氨酸生成量分别降低28.8%和50%。由此可见,敲除aceA和gogat并过表达gltA可显著提高α-KG产量并降低L-谷氨酸生成量。
[1] 王镜岩, 朱圣庚, 徐长法 主编. 生物化学[M]. 北京: 高等教育出版社, 2002: 92-113.
[2] FINOGENOVA T V, MORGUNOV I G, KAMZOLOVA SV, et al. Organic acid production by the yeastYarrowialipolytica[J]. Prikladnaia Biokhimiia I Mikrobiologiia, 2005, 41 (5): 478-486.
[3] COOPERA J L, GINOS J Z, MEISTER A. Synthesis and properties of the α-keto acids[J]. Chemical Reviews, 1983, 83: 321-358.
[4] HUA Q, YANG C, SHIMIZU K. Metabolic flux analysis for efficient pyruvate fermentation using vitamin-auxotrophic yeast ofTorulopsisglabrata[J]. Journal of Bioscience and Bioengineering,1999, 87(2): 206-213.
[5] OTTO C, YOVKOVA V, BARTH G. Overproduction and secretion of α-ketoglutaric acid by microorganisms[J]. Applied Microbiology and Biotechnology, 2011, 92(4): 689-695.
[6] STOTTMEISTER U, AURICH A, Wilde H, et al. White biotechnology for green chemistry: fermentative 2-oxocarboxylic acids as novel building blocks for subsequent chemical syntheses[J]. Journal of Industrial Microbiology & Biotechnology, 2005, 32 (11-12): 651-64.
[7] BARRETT D G, YOUSAF M N. Poly(triol-α-ketoglutarate) as biodegradable, chemoselective and mechanically tunable elastomers[J]. Macromolecules, 2008, 41:6 347-6 352.
[8] LOCKWOOD L B, STODOLA F H. Preliminary studies of the production of alpha-ketoglutaric acic byPseudomonasfluorescens[J]. Journal of Biological Chemistry, 1946, 164(1): 81-83.
[9] ASAI T, AIDA K, SUGISAKI Z, YAKEISHI N. On α-ketoglutaric acid fermentation[J]. Journal of General and Applied Microbiology, 1955, 1:308-346.
[10] TSUGAWA R, NAKASE T, KOBAYSH T, et al. Fermentation of n-paraffins by yeast. I. Fermentative production of alpha-ketoglutaric acid byCandidalipolytica[J]. Agricultural and Biological Chemistry, 1969, 33(2): 158-167.
[11] CHERNYAVSKAYA O G, SHISHKANOVA N V, IL’CHENKO AP, et al. Synthesis of alpha-ketoglutaric acid byYarrowialipolyticayeast grown on ethanol[J]. Applied Microbiology and Biotechnology, 2000, 53(2): 152-158.
[12] CHERNYAVSKAYA O G, SHISHKANOVA N V, IL'CHENKO A P, et al. Metabolic characteristics of the mutantYarrowialipolyticastrain 1 producing alpha-ketoglutaric and citric acids from ethanol and the effect of [NH4+] and [O2] on yeast respiration and acidogenesis[J]. Microbiology, 2001, 70(2):151-157.
[13] CHERNYAVSKAYA O G, SHISHKANOVA N V, IL'CHENKO A P, et al. Metabolism ofYarrowialipolyticagrown on ethanol under conditions promoting the production of alpha-ketoglutaric and citric acids: A comparative study of the central metabolism enzymes[J]. Microbiology, 2002, 71(3): 269-274.
[14] CHERNYAVSKAYA O G, SHISHKANOVA N V, IL'CHENKO A P, et al. Biochemical characterization of the yeastYarrowidlipolyticaoverproducing carboxylic acids from ethanol: Nitrogen metabolism enzymes[J]. Microbiology, 2003, 72(4): 418-422.
[15] Zhou J W, YIN X X,Madzak C, et al. Enhanced α-ketoglutarate production inYarrowialipolyticaWSH-Z06 by alteration of the acetyl-CoA metabolism[J]. Journal of Biotechnology, 2012, 161(3):257-264.
[16] SCHNEIDER J, NIERMANN K, WENDISCH VF. Production of the amino acidsL-glutamate,L-lysine,L-ornithine andL-arginine from arabinose by recombinantCorynebacteriumglutamicum[J]. Journal of Biotechnology, 2011, 154(2-3): 191-198.
[17] VERSECK S, KARAU A, WEBER M. Fermentative production of alpha-ketoglutaric acid: USA, 2009053489[P]. 2009-05-01.
[18] LI Y, SUN L, FENG J, et al. Efficient production of a-ketoglutarate in the gdh deletedCorynebacteriumglutamicumby novel double-phase pH and biotin control strategy[J]. Bioprocess and Biosystems Engineering, 2016, 39(6):967-976.
[19] EGGELING L, BOTT M. Handbook ofCorynebacteriumglutamicum[M]. New York: CRC Press Taylor & Francis Group, 2005, 439-457.
[20] GRANT S G, JESSEE J, BLOOM F R, et al. Differential plasmid rescue from transgenic mouse DNAs intoEscherichiacolimethylation-restriction mutants[J]. Proceedings of the National Academy of Sciences of the United States of America, 1990, 87(12): 4 645-4 649.
[21] SCHäFER A, TAUCH A, JäGER W, et al. Small mobilizable multi-purpose cloning vectors derived from theEscherichiacoliplasmids pK18 and pK19: selection of defined deletions in the chromosome ofCorynebacteriumglutamicum[J]. Gene, 1994, 145(1): 69-73.
[22] LIEBLW, BAYERL A, SCHEIN B, et al. High efficiency electroporation of intactCorynebacteriumglutamicumcells[J]. FEMS Microbiology Letters, 1989, 65(3): 299-303.
EffectofaceAandgogatknockoutcombinedgltAoverexpressioninGKGDonα-ketoglutarateproduction
XUE Ning1, LI Zhi-xiang1, ZHAN Jun-jie1, Zhao Lei1, LIANG Yun-long1,FENG Jia1, LIU Tao1, XU Qing-yang1, 2, 3, ZHANG Cheng-lin1, 2, 3, CHEN Ning1, 2, 3*
1 (Tianjin University of Science and Technology, Tianjin 300457, China) 2 (National and Local United Engineering Lab of Metabolic Control Fermentation Technology, Tianjin 300457, China) 3 (Tianjin Engineering Lab of Efficient and Green Amino Acid Manufacture, Tianjin 300457, China)
α-Ketoglutarate (α-KG) plays an important role in life activities and has been widely applied in food and medicine. Isocitrate lyase encoding geneaceAwas knocked out to improve isocitrate supply and obtain GKGD-1, by which the α-KG production and yield was increased by 14.72% and 9.76%. In order, glutamate synthase encodinggenegogat was knocked out to reduceL-glutamate accumulation and thus obtain GKGD-2, by which the α-KG production and yield was increased by 7.39% and 5.43% andL-glutamate was decreased by 52.87%. Citrate synthase encoding genegltAwas overexpressed to further increase precursor supply and thus obtain GKGD-3, by which α-KG production was increased by 35.9%. Fermentation assay was performed in 7.5-L fermentor with GKGD-3, α-KG production achieve 49.5 g/L (increased by 36.4%) andL-glutamate accumulation was decreased by 50%. In summary,aceAandgogatknockout combined withgltAoverexpression in GKGD remarkably improved α-ketoglutarate production.
α-ketoglutarate;L-glutamate; glutamate synthase; lsocitrate lyase; citrate synthase
10.13995/j.cnki.11-1802/ts.014419
博士研究生(陈宁教授为通讯作者,E-mail:ningch@tust.edu.cn)。
国家自然科学基金项目(31300069);天津科技大学青年教师创新基金(2016LG07);天津市科技支撑计划重点项目(12ZCZDSY01900);天津市科委科技特派员项目(15JCTPJC62800);天津市大学生创新创业训练计划项目(201710057039、201510057063)
2017-03-30,改回日期:2017-04-20
