新鲜薏仁米与异味薏仁米挥发性成分对比分析
2017-09-22杨忠全
杨忠全
阚建全1,2
陈光静1
夏 季1
(1. 西南大学食品科学学院,重庆 400715;2. 重庆市农产品加工及贮藏重点实验室,重庆 400715)
新鲜薏仁米与异味薏仁米挥发性成分对比分析
杨忠全1
阚建全1,2
陈光静1
夏 季1
(1. 西南大学食品科学学院,重庆 400715;2. 重庆市农产品加工及贮藏重点实验室,重庆 400715)
以新鲜薏仁米和异味薏仁米为原料,采用顶空—固相微萃取—气质联用法分别对新鲜薏仁米和异味薏仁米的挥发性成分进行分析。研究结果表明:从新鲜薏仁米和异味薏仁米中共鉴定出85种挥发性成分,其中新鲜薏仁米中鉴定出47种化合物(主要包括12种醇类、11种醛酮类、22种烃类),其主要挥发性成分为右旋萜二烯、苯、2-戊基呋喃、己醛、壬醛、正辛醛、2-庚酮、正戊醇、正己醇、1-辛烯-3-醇和芳樟醇;异味薏仁米中鉴定出58种化合物(主要包括17种烃类、8种醇类、14种醛酮类、10种酯类和5种酸类),其主要挥发性成分为1-十五烯、己醛、壬醛、癸醛、正辛醛、正辛醇、己酸、庚酸、辛酸和壬酸。造成新鲜薏仁米与异味薏仁米的主要挥发性成分中酸类化合物种类和含量差异的主要原因,可能是新鲜薏仁米在贮藏过程中油脂的氧化。
薏仁米;顶空固相—微萃取;挥发性成分;气相色谱—质谱联用
薏仁米(Coixlachryma-jobiL. var. ma-yuen Stapf)又名薏米、薏仁、薏苡仁、六谷子等,是禾本科玉蜀黍族薏苡属植物薏苡的种仁,是中国传统的药食两用功能性食品原料[1]。现代药理学研究表明,薏仁米具有抗氧化[2-3]、抗炎症[4-5]、抗癌[6-7]、抗肿瘤[8-9]、降血糖[10]和止痛[11]等功效。与中国传统主粮相比,薏仁米在贮藏过程中易发生劣变,产生异味,降低了薏仁米的食用品质和商品价值。
目前,国内外对薏仁米的研究主要集中在薏仁米淀粉[12-13]、油脂[14]、多酚[15-16]、薏苡素等生物活性成分的提取[17-18]、功能特性[19-20]及薏仁米产品[21-22]的研发上,对薏仁米中挥发性成分特别是新鲜薏仁米和异味薏仁米中挥发性成分差异还未曾有研究和报道。本试验采用顶空—固相微萃取法(HS-SPME)提取薏仁米中的挥发性成分,结合气相色谱—质谱联用(GC-MS)技术对新鲜薏仁米和异味薏仁米中的挥发性成分进行鉴定分析,对比2种薏仁米的挥发性成分差异,为后续薏仁米中异味物质的研究提供理论依据。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
新鲜薏仁米:兴仁薏仁米,购于北碚永辉超市;
异味薏仁米:将新鲜薏仁米置于人工气候箱中贮藏24个月,贮藏温度30 ℃,湿度11%,未出现发霉和腐烂等现象;
正癸烷标准品:99.9%,美国Sigma-Aldrich公司;
C5~C25正构烷烃混标:色谱纯,百灵威科技有限公司。
1.1.2 主要仪器设备
气质联用仪:QP 2010型,日本岛津公司;
顶空微萃取瓶:20 mL,美国Aglient公司;
固相微萃取装置(50/30μm DVB/CAR/PDMS萃取头):MW40-275型,美国Supelco公司;
数显恒温水浴锅:HH-2型,邦西仪器科技(上海)有限公司。
1.2 方法
1.2.1 顶空—固相微萃取 称取5.0 g新鲜薏米和1.0 g异味薏米样品,分别置于20 mL螺口顶空样品瓶中,加入等质量的水以加速挥发性成分的扩散。再向瓶内加入25 μL 1 mg/mL的正癸烷标准品作为内标物,密封后置于60 ℃恒温水浴中平衡4 min,将萃取头插入顶空瓶中吸附40 min,然后在GC-MS进样口250 ℃解析5 min。
1.2.2 色谱分析条件 采用DB-5MS(30 m×0.25 mm×0.25 μm)毛细管柱;程序升温:起始温度40 ℃,保持2 min;以8 ℃/min上升到70 ℃,保持4 min;以4 ℃/min上升到80 ℃,保持2 min;以4 ℃/min上升到145 ℃;以10 ℃/min上升到220 ℃,保持3 min;载气:He;氦气流速1 mL/min;进样口温度250 ℃;压力49.3 kPa;分流比为2∶1。
1.2.3 质谱条件 电子轰击(EI)离子源;离子源温度250 ℃;接口温度250 ℃;检测器电压830 eV;溶剂延迟时间2.5 min;扫描范围m/z40~400;扫描速度666 u/s;采集方式:Scan。
1.2.4 挥发性成分的定性与定量分析
(1) 定性分析:由计算机检索与NIST08、NIST08s、PESTEI_3、PEST_EI谱库匹配求得,选择匹配度>80的鉴定结果,并结合保留指数(Kovats retention indice,RI)进行确定。采用相同的升温程序,以C10~C25的正构烷烃为混标,通过保留时间按式(1)计算样品中各挥发物的RI,与GC-MS谱库中该挥发物的RI进行比对,以对未知挥发物进行定性。
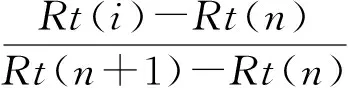
(1)
式中:
RI——保留指数;
Rt(i)、Rt(n)、Rt(n+1)——待测未知物、含n及n+1个碳原子的正构烷烃保留时间。
(2) 定量分析:各挥发性组分的相对含量采用面积归一化法计算。以正癸烷为内标,根据内标峰面积、内标浓度及样品中各挥发性组分的峰面积,按式(2)计算样品中各挥发性组分的绝对含量。
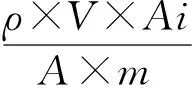
(2)
式中:
M——挥发性组分的绝对含量,μg/g;
ρ——正癸烷内标的质量浓度,μg/μL;
m——样品的质量,g;
V——内标物体积,μL;
A——内标物质的峰面积;
Ai——各挥发性组分的峰面积。
1.3 试验数据分析处理方法
采用Excel 2013和OriginPro 2015(Version 9.2)软件对试验数据进行处理与分析。
2 结果与分析
2.1 新鲜薏仁米和异味薏仁米中挥发性组分的定性和定量
图1为采用顶空固相—微萃取法对新鲜薏仁米和异味薏仁米进行萃取后,经GC-MS检测得到的总离子流色谱图,新鲜薏仁米和异味薏仁米中各挥发性组分的定性和定量结果见表1。由表1可知,从新鲜薏仁米和异味薏仁米中共萃取出85种挥发性成分,其中新鲜薏仁米中鉴定出47种,异味薏仁米中鉴定出58种。只存在于新鲜薏仁米中的挥发性成分有27种;而在异味薏仁米中被检出但未在新鲜薏仁米中检测到的挥发性成分有38种。
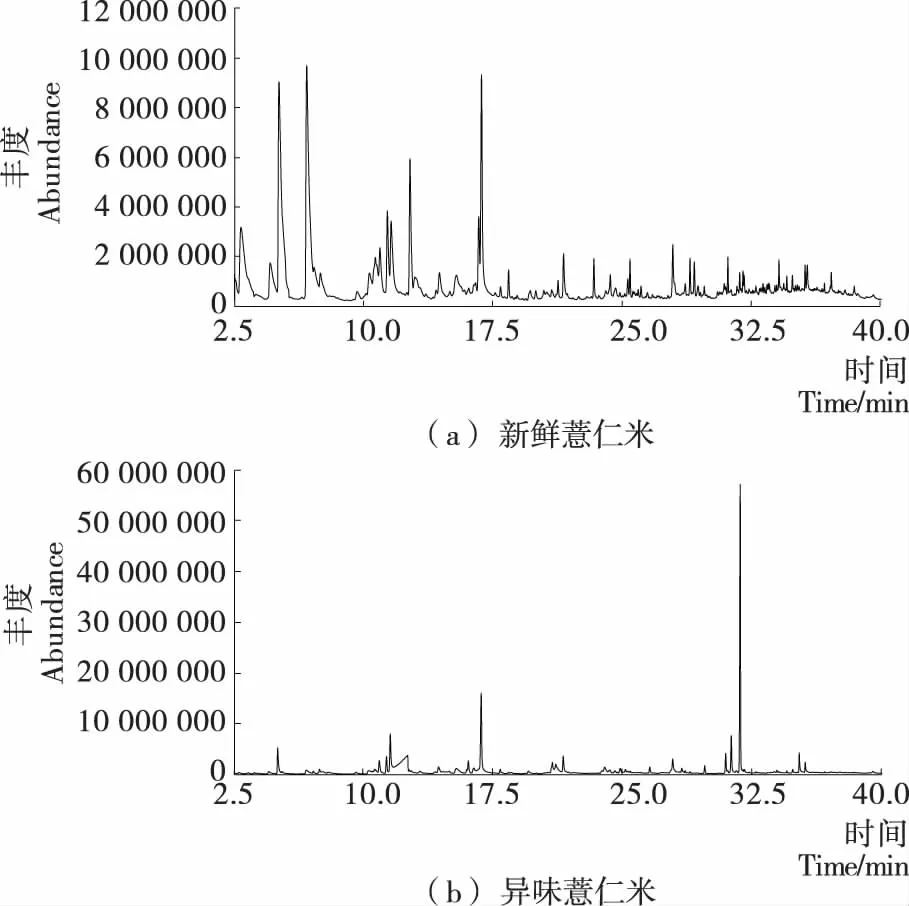
图1 HS-SPME提取新鲜薏仁米和异味薏仁米挥发性成分的GC-MS总离子流图
Figure 1 GC-MS of volatiles extracted by HS-SPME from fresh adlay seeds and adlay seeds with off-flavor
2.2 新鲜薏仁米和异味薏仁米中挥发性组分分析
表2比较了新鲜薏仁米与异味薏仁米中挥发性成分的总组成,从新鲜薏仁米中鉴定出22种烃类、12种醇类、11种醛酮类,未鉴定出酯类和酸类化合物;从异味薏仁米中鉴定出17种烃类、8种醇类、14种醛酮类、10种酯类和5种酸类。由测定结果可知,新鲜薏仁米和异味薏仁米中挥发性成分种类数量最多的均为烃类化合物,异味薏仁米的挥发性成分中较新鲜薏米增加了多种酯类和酸类化合物,醛酮类化合物的数量略有增加,而醇类和烃类化合物数量有所减少。新鲜薏仁米和异味薏仁米中挥发性成分种类的区别主要是酯类和酸类化合物的数量不同。
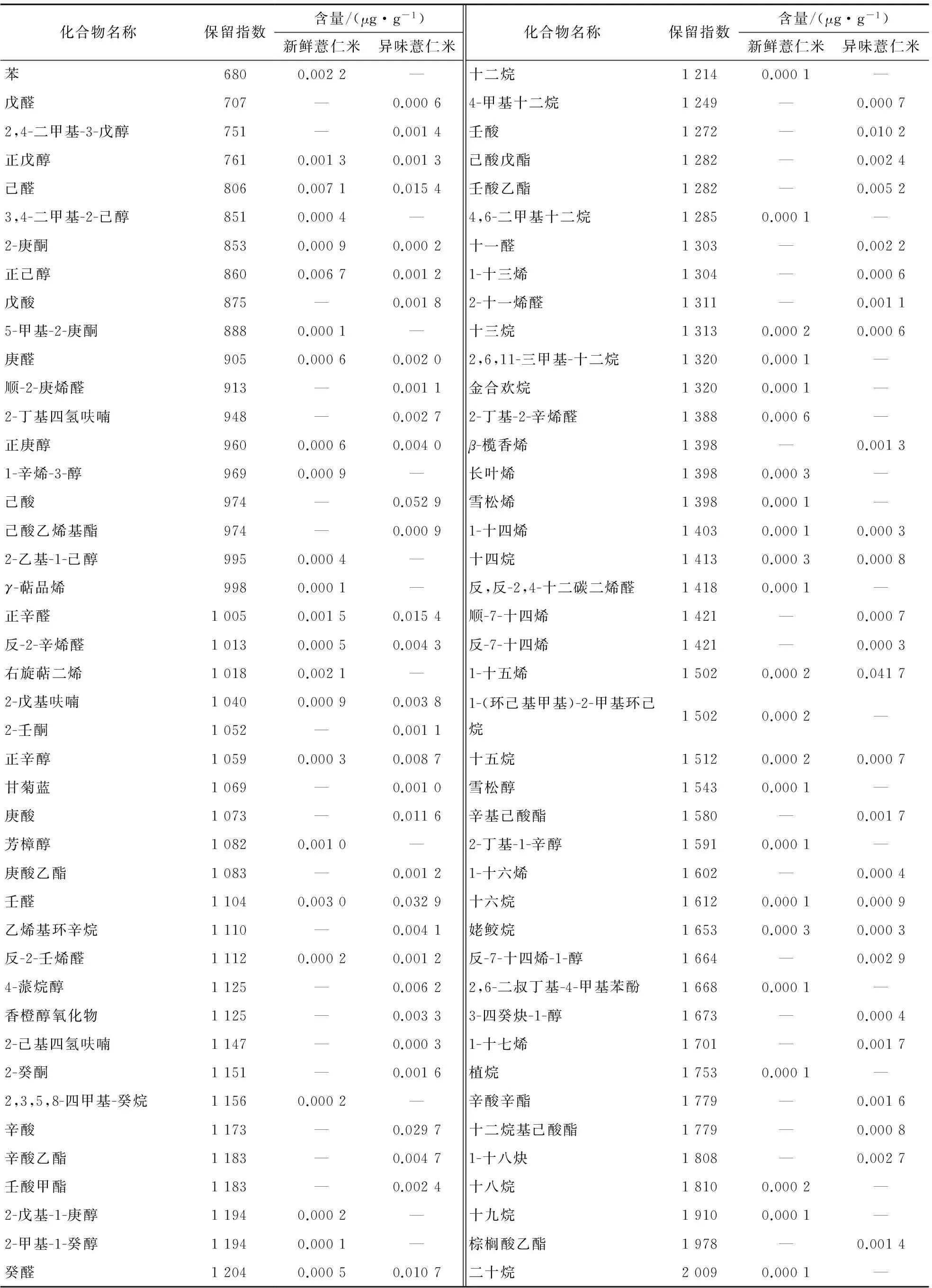
表1 新鲜薏仁米和异味薏仁米挥发性成分的GC-MS分析结果†
† “—”表示未检出。
由表2可知,异味薏仁米中所有挥发性成分的绝对含量较新鲜薏仁米都有较大幅度的增加,其中增加幅度最大的是酸类化合物,从无增加到0.106 2 μg/g,其次是醛酮类、烃类和酯类化合物,醇类和其他类化合物增幅相对较小。各类挥发性成分的含量占挥发性组分总含量比例差异较大。在新鲜薏仁米中,主要挥发性成分是醛酮类、醇类和烃类化合物,分别为0.014 9,0.011 0,0.008 2 μg/g,分别占新鲜薏仁米挥发性成分总量的40.85%,30.13%,22.42%;而异味薏仁米中的主要挥发性成分是酸类、醛酮类和烃类化合物,分别为0.106 2,0.089 6,0.058 5 μg/g,分别占异味薏仁米挥发性成分总量的33.30%,28.10%,18.34%。
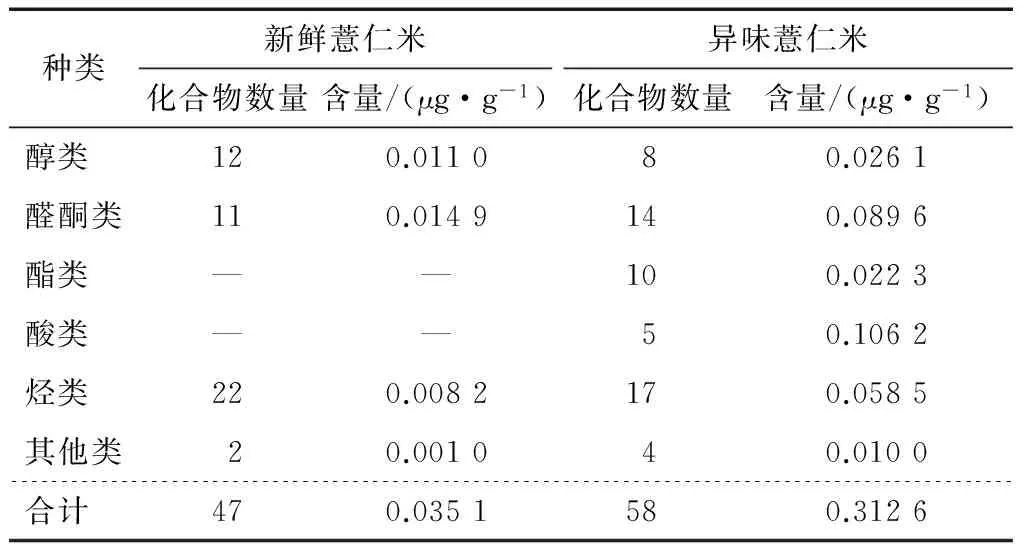
表2 顶空固相—微萃取提取薏米挥发性成分的组成†
† “—”表示未检出。
由表3可知,新鲜薏仁米和异味薏仁米中主要挥发性成分差异较大。新鲜薏仁米中主要挥发性成分为右旋萜二烯、苯、2-戊基呋喃、己醛、壬醛、正辛醛、2-庚酮、正戊醇、正己醇、1-辛烯-3-醇和芳樟醇,含量最高的2种化合物是己醛和正己醇,相对含量分别为19.3%和18.2%;异味薏仁米中主要挥发性成分为1-十五烯、己醛、壬醛、癸醛、正辛醛、正辛醇、己酸、庚酸、辛酸和壬酸,含量最高的2种化合物是己酸和1-十五烯,其相对含量分别为16.6%和10.33%。新鲜薏仁米与异味薏仁米的主要挥发性成分中共有组分为己醛、壬醛和正辛醛,其在新鲜薏仁米中的绝对含量都低于在异味薏仁米中的。
新鲜薏仁米与异味薏仁米的主要挥发性成分差异性较大,新鲜薏仁米中醛类和醇类化合物含量较高,异味薏仁米中酸类、醛类和烃类化合物含量较高。主要区别为异味薏仁米的主要挥发性成分中有己酸、庚酸、辛酸和壬酸等酸类化合物,且己酸的相对含量高达16.6%,而新鲜薏仁米中未鉴定出酸类化合物。薏仁米属于脂肪含量较高的谷物,其脂肪含量高于大米、小麦、玉米、小米等谷物(分别为1.7%,1.8%,4.3%,3.5%)[23],使得薏仁米在贮藏过程中容易发生油脂氧化。油脂中的不饱和脂肪酸在空气中受光照、热等影响容易发生氧化反应,氢过氧化物是最主要的氧化初级产物,但氢过氧化物不稳定,容易进一步分解成为醛、酮、酸、醇等小分子物质。因此,推测造成新鲜薏仁米与异味薏仁米的主要挥发性成分中酸类化合物种类和含量差异的主要原因可能是新鲜薏仁米在贮藏过程中油脂氧化。张立庆等[24]在开发薏仁米饮品时发现薏仁米由于油脂氧化产生哈味,吴传茂等[25]在研制薏苡豆奶、李美玲等[26]在开发Viili薏仁米酸奶时有同样的发现。Lin等[27]研究表明,由于薏仁米的油脂容易发生氧化,加工薏米的货架期相对较短,移除薏米中的油脂成分可以防止薏米产品中异味的产生。
表3新鲜薏仁米和异味薏仁米挥发性成分的主要特征物质†
Table 3 Main characteristic substances of volatile components in fresh adlay seeds and adlay seeds with off-flavor
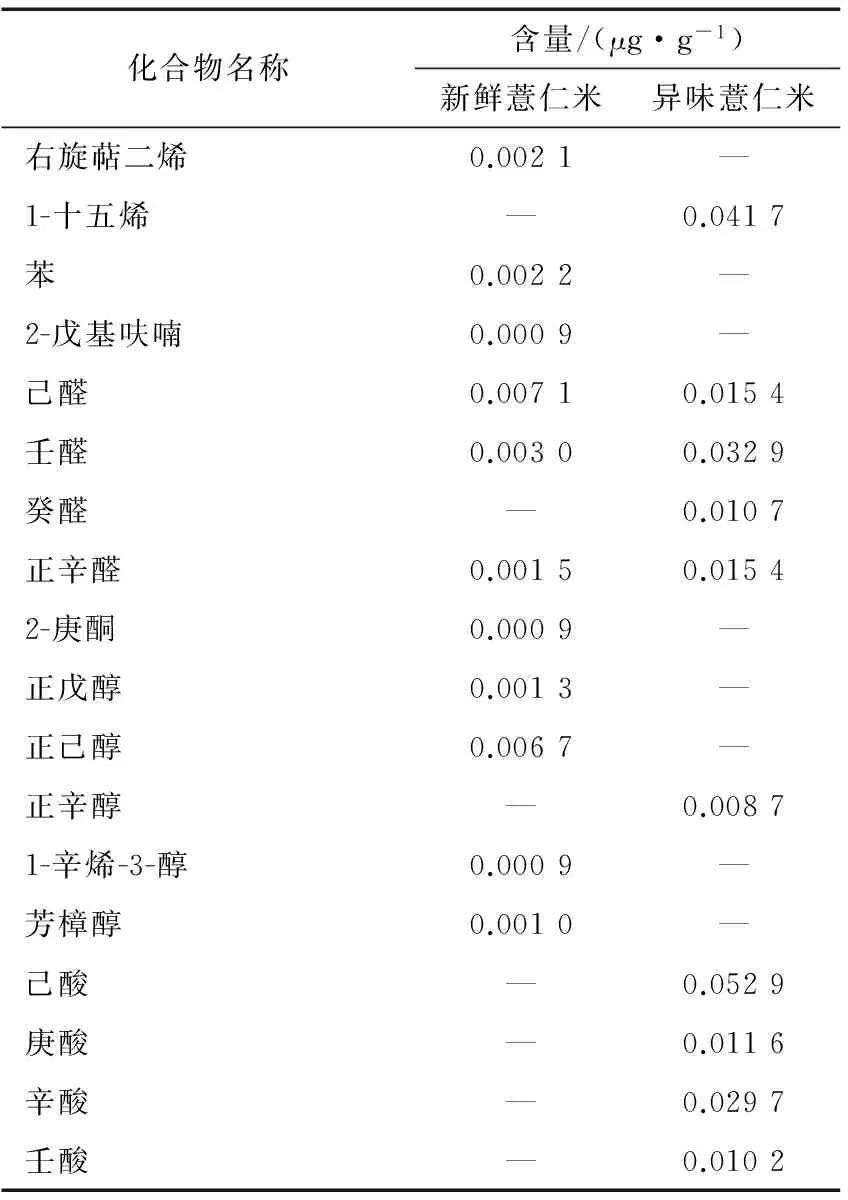
化合物名称含量/(μg·g-1)新鲜薏仁米异味薏仁米右旋萜二烯0.0021—1-十五烯—0.0417苯0.0022—2-戊基呋喃0.0009—己醛0.00710.0154壬醛0.00300.0329癸醛—0.0107正辛醛0.00150.01542-庚酮0.0009—正戊醇0.0013—正己醇0.0067—正辛醇—0.00871-辛烯-3-醇0.0009—芳樟醇0.0010—己酸—0.0529庚酸—0.0116辛酸—0.0297壬酸—0.0102
† “—”表示此物质非主要特征物质。
3 结论
通过顶空固相微萃取—气质联用分析对新鲜薏仁米与异味薏仁米的挥发性成分进行分析,共鉴定出85种挥发性成分,其中新鲜薏仁米中鉴定出47种,异味薏仁米中鉴定出58种。新鲜薏仁米与异味薏仁米的主要挥发性成分差异性较大,新鲜薏仁米中醛类和醇类化合物含量较高,异味薏仁米中酸类、醛类和烃类化合物含量较高。造成新鲜薏仁米与异味薏仁米的主要挥发性成分中酸类化合物种类和含量差异的主要原因可能是新鲜薏仁米在贮藏过程中油脂的氧化。目前并未见薏仁米产生异味具体机理的研究报道,后续有必要进一步对薏仁米贮藏过程中异味产生的机理进行探讨,进而找到控制薏米产生异味的措施。
[1] HSIA S M, CHIANG W, KUO Y H, et al. Downregulation of progesterone biosynthesis in rat granulosa cells by adlay (Coixlachryma-jobiL. var.ma-yuenStapf) bran extracts[J]. International Journal of Impotence Research, 2006, 18(3): 264-274.
[2] ZHAO Mou-ming, ZHU Da-shuai, SUN-WATERHOUSE Dong-xiao, et al. In vitro and in vivo studies on adlay-derived seed extracts: phenolic profiles, antioxidant activities, serum uric acid suppression, and xanthine oxidase inhibitory effects[J]. Journal of Agriculture and Food Chemistry, 2014, 62: 7 771-7 778.
[3] WANG Li-feng, CHEN Jing-yi, XIE Hui-hui, et al. Phytochemical profiles and antioxidant activity of adlay varieties[J]. Journal of Agriculture and Food Chemistry, 2013, 61(21): 5 103-5 113.
[4] CHEN H J, CHUNG C P, CHIANG W, et al. Anti-inflammatory effects and chemical study of a flavonoid-enriched fraction from adlay bran[J]. Food Chemistry, 2011, 126(4): 1 741-1 748.
[5] CHOI G, HAN A, LEE J, et al. A Comparative study on hulled adlay and unhulled adlay through evaluation of their lps-induced anti-inflammatory effects, and isolation of pure compounds[J]. Chemistry & Biodiversity, 2015, 12(3): 380-387.
[6] CHUNG C P, HSU H Y, HUANG D W, et al. Ethyl acetate fraction of adlay bran ethanolic extract inhibits oncogene expression and suppresses DMH-induced preneoplastic lesions of the colon in F344 rats through an anti-inflammatory pathway[J]. Journal of Agriculture and Food Chemistry, 2010, 58: 7 616-7 623.
[7] LU Xiang-yi, LIU Wei, WU Jun-hua, et al. A polysaccharide fraction of adlay seed (Coixlachryma-jobiL.) induces apoptosis in human non-small cell lung cancer A549 cells[J]. Biochemical and Biophysical Research Communications, 2013, 430(2): 846-851.
[8] CHEN Chao, ZHANG Yi-yi, GAO Yu-long, et al. Identification and anti-tumour activities of phenolic compounds isolated from defatted adlay (Coixlachryiena-jobiL. var. ma-yuen Stapf) seed meal[J]. Journal of Functional Foods, 2016, 26: 394-405.
[9] HUANG Din-wen, WU Chi-hao, SHIH Chun-kuang, et al. Application of the solvent extraction technique to investigation of the anti-inflammatory activity of adlay bran[J]. Food Chemistry, 2014, 145: 445-453.
[10] WATANABE M, KATO M, AYUGASE J. Anti-diabetic effects of adlay protein in type 2 diabetic db/db mice[J]. Food Science and Technology Research, 2012, 18(3): 383-390.
[11] LIN L J, HSIAO E S L, TSENG H S, et al. Molecular cloning, mass spectrometric identification, and nutritional evaluation of 10 coixins in adlay (Coixlachryma-jobiL.)[J]. Journal of Agriculture and Food Chemistry, 2009, 57: 10 916-10 921.
[12] KIM E J, KIM H R, CHOI S J, et al. Lowdigestion property of amylosucrase-modified waxy adlay starch[J]. Food Science and Biotechnology, 2016, 25(2): 457-460.
[13] YAO Yang, ZHU Ying-ying, GAO Yue, et al. Effect of ultrasonic treatment on immunological activities of polysaccharides from adlay[J]. International Journal of Biological Macromolecules, 2015, 80: 246-252.
[14] HU Ai-jun, ZHANG Zhi-hua, ZHENG Jie, et al. Optimiza-tions and comparison of two supercritical extractions of adlay oil[J]. Innovative Food Science & Emerging Technologies, 2012, 13: 128-133.
[15] WANG Li-feng, CHEN Chao, SU An-xiang, et al. Structural characterization of phenolic compounds and antioxidant activity of the phenolic-rich fraction from defatted adlay (Coixlachryma-jobiL. var. ma-yuen Stapf) seed meal[J]. Food Chemistry, 2016, 196: 509-517.
[16] WANG Qing-yu, DU Zhong-yao, ZHANG Hao, et al. Modulation of gut microbiota by polyphenols from adlay (Coixlacryma-jobiL. var. ma-yuen Stapf.) in rats fed a high-cholesterol diet[J]. International Journal of Food Sciences and Nutrition, 2015, 66(7): 783-789.
[17] AN T J, SHIN K S, PAUL N C, et al. Prevalence, characterization, and mycotoxin production ability of fusarium species on Korean adlay (Coixlacrymal-jobiL.) Seeds[J]. Toxins, 2016, 8(11): 310.
[18] 王立峰, 陈静宜, 谢慧慧, 等. 薏米多酚细胞抗氧化及HepG2细胞毒性和抗增殖作用[J]. 中国农业科学, 2013, 46(14): 2 990-3 002.
[19] 解铁民, 高扬, 张英蕾, 等. 挤压参数对薏米挤出产品物理特性的影响[J]. 食品与机械, 2013, 29(1): 18-22, 101.
[20] 林莉, 秦礼康, 杨先龙, 等. 不同热处理对薏米糠贮藏品质的影响[J]. 食品与机械, 2013, 29(5): 185-189.
[21] CHOI H J, AN T J, KIM J, et al. Postharvest strategies for deoxynivalenol and zearalenone reduction in stored adlay (Coixlachryma-jobiL.) Grains[J]. Journal of Food Protections, 2014, 77(3): 466-471.
[22] 商珊, 秦礼康, 杨先龙. 分段热加工对薏米营养与功能成分的影响[J]. 食品科学, 2014, 35(5): 81-84.
[23] 王颖. 薏仁成分及薏仁醋的生产技术研究[D]. 重庆: 西南大学, 2013: 2-3.
[24] 张立庆, 蔡笑今. 薏米饮品的开发与研制[J]. 食品科学, 1995, 16(2): 31-36.
[25] 吴传茂, 石勇, 吴周和, 等. 薏苡豆奶的研制[J]. 粮食与饲料工业, 1998(5): 34-35.
[26] 李美龄, 张景凯, 罗成. Viili薏米酸奶的研究工艺[J]. 食品工业, 2014, 35(7): 110-112.
[27] LIN Y, TSAI C E. A study of adlay on lowering serum and liver lipids in hamsters[J]. Journal of Food Lipids, 2008, 15(2): 176-189.
Contrastive analysis of volatile compounds from fresh adlay seeds and those with off-flavor
YANGZhong-quan1
KANJian-quan1,2
CHENGuang-jing1
XIAJi1
(1.CollegeofFoodScience,SouthwestUniversity,Chongqing400715,China;2.ChongqingKeyLaboratoryofProduceProcessingandStorage,Chongqing400715,China)
Headspace-solid phase micro-extraction (HS-SPME) coupled to gas chromatography-mass spectrometry (GC-MS) was applied to analyze the volatile compounds of the fresh adlay seeds and those with off-flavor. The results showed: more than 85 of volatile compounds which belonged to distinct chemical families were analyzed. A total of 47 compounds in fresh adlay seeds were identified (including 12 alcohols, 11 aldehydes and ketones and 22 hydrocarbons), the major volatile components in fresh adlay seeds were (+)-Limonene, benzene, 2-pentyl furan, hexanal, 1-nonanal, n-octanal, 2-heptanone, 1-pentanol, 1-hexanol, 1-octen-3-ol and linalool; While, there were 58 compounds in adlay seeds with off-flavor (including 17 hydrocarbons, 8 alcohols, 10 esters, 5 acids, 14 aldehydes and ketones), the major volatile components in adlay seeds with off-flavor were 1-pentadecene, hexanal, 1-nonanal, decanal, n-octanal, 1-octanol, hexanoic acid, heptanoic acid, octanoic acid and nonanoic acid. The main reason for the difference in the type and content of acid compounds in the main volatile components from fresh adlay seeds and those with 0ff-flavor may be the oxidation of fresh adlay seeds during storage.
adlay (Coixlachryma-jobivar. ma-yuen Stapf); headspace solid phase micro-extraction (HS-SPME); volatile compounds; gas chromatography-mass spectrometry (GC-MS)
杨忠全,男,西南大学在读硕士研究生。
阚建全(1965—),男,西南大学教授,博士。 E-mail:kanjq1965@163.com
2017—05—15
10.13652/j.issn.1003-5788.2017.07.008
