一株产乙醇细菌的分离筛选与鉴定
2017-09-22陈梦娟
陈梦娟
周红丽2
蒋立文2
邓青青1
朱韵奕1
(1. 湖南农业大学食品科技学院,湖南 长沙 410128;2. 食品科学与生物技术湖南省重点实验室,湖南 长沙 410128)
一株产乙醇细菌的分离筛选与鉴定
陈梦娟1
周红丽2
蒋立文2
邓青青1
朱韵奕1
(1. 湖南农业大学食品科技学院,湖南 长沙 410128;2. 食品科学与生物技术湖南省重点实验室,湖南 长沙 410128)
以湖南省盛产的4种刺葡萄为原料,经过分离筛选与鉴定,从米刺葡萄表面获得编号为MUY3的一株产乙醇的细菌。MUY3在28 ℃发酵48 h后,其发酵液中乙醇体积分数可达到10.67%。通过绘制生长曲线、同化试验、甲基红试验、耐高渗透压试验等对其生理生化特征进行研究。同时采用16S rDNA序列鉴定及进化树分析对该细菌进行鉴定。结果表明,MUY3与Enterobacterxiangfangensis strain 10-17最为接近,相似度达100%,所以该菌种为Enterobacterxiangfangensis strain 10-17。
刺葡萄;乙醇;16S rDNA;Enterobacterxiangfangensis strain 10-17;生理生化特征
随着中国人均GDP的不断增长以及中西方文化的深入交流,葡萄酒文化越来越受到国人的重视,中国的葡萄酒产业取得了长足发展[1],葡萄酒的年均消费量也在不断的增加[2]。近几十年,许多葡萄酒生产商采用国外进口酵母进行纯种发酵,以提高生产效率并且使酿造过程便于控制,保证安全高效生产[3],但这也导致葡萄酒生产出现较为严重的“同质化”现象[4],对中国的葡萄酒产业的发展带来冲击。因此,为了酿造出风格独特又具有典型性[5]的葡萄酒已经成为了一个世界性的课题。
刺葡萄在湖南凤凰、吉首等地已有较大的种植基地,果实产量较高,品质优良并含丰富的营养物质[6-7],是酿造葡萄酒的优质原料。用刺葡萄酿制的葡萄酒,颜色深红艳丽,并且风味品质极佳[8]。目前,刺葡萄酒的酿造中多采用已有活性干酵母[9]进行纯种发酵,虽然提高了产品的稳定性和可预测性[10],但产品缺乏特色。本研究拟从成熟葡萄果实的果皮和果肉[11]、葡萄酒的自然发酵醪[12]、葡萄种植园的土壤[13-14]等相关环境中筛选适合本土葡萄酿造的葡萄酒酿造菌种,为刺葡萄酒酿造做好菌种储备。目前已有学者[15]从上述环境中分离得到酵母菌并应用于葡萄酒的酿造中,然而从葡萄果皮上筛选具有优良发酵性能的细菌菌种则暂未有报道。
本研究从湖南怀化刺葡萄的表面分离得到的一株产乙醇能力较强的细菌,通过对该细菌进行菌种鉴定及碳源同化、氮源同化、耐高渗透压试验[16]等生理生化研究,以期将其运用于葡萄酒酿造领域中。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
刺葡萄:米刺葡萄,湖南省怀化市;
氯化钠、无水乙醇:分析纯,国药集团化学试剂有限公司。
1.1.2 培养基
(1) TTC(2,3,5-氯化三苯基四氮唑)上层培养基:胰蛋白胨17.0 g,大豆胨3.0 g,葡萄糖6.0 g,氯化钠2.5 g,硫代硫酸钠0.5 g,琼脂15 g,L-盐酸胱氨酸0.25 g,维生素K 1 g,亚硫酸钠0.1 g,TTC 0.5 g,蒸馏水1 000 mL。
(2) TTC底层培养基(即PDA培养基):马铃薯浸出粉300 g,葡萄糖20 g,琼脂15 g,氯霉素0.1 g,蒸馏水1 000 mL,最终pH为(6.0±0.2)。
(3) 发酵培养基:酵母膏10 g,蛋白胨20 g,葡萄糖20 g,蒸馏水1 000 mL。
(4) 12.5%豆芽汁培养基:称取125 g黄豆芽放入1 L水中,煮沸0.5 h后过滤,并补充蒸馏水至1 L,即成12.5%豆芽汁培养基,在121 ℃灭菌20 min。
(5) 无氮培养基:葡萄糖10 g,磷酸二氢钾0.2 g,七水合硫酸镁0.2 g,二水合硫酸钙0.2 g,琼脂20 g,碳酸钙0.2 g,蒸馏水1 000 mL。
(6) 缓冲葡萄糖蛋白水:磷酸二氢钾5 g,多胨7 g,葡萄糖5 g,蒸馏水1 000 mL,矫正pH为7.0。
1.1.3 主要仪器设备
分光光度计:722N型,上海菁华科技仪器有限公司;
电子天平:TP-620A型,湘仪天平仪器设备有限公司;
智能生化培养箱:LRH-250型,上海飞越实验仪器有限公司;
低温高速离心机:Centrifuge 5424R型,德国Eppendorf公司;
数显三用恒温水箱:HH-420型,上海浦东物理光学仪器厂;
PCR仪:T100型,美国BIO-RAD公司。
1.2 菌种分离与筛选
1.2.1 分离培养 取25 g新鲜成熟的米刺葡萄果实放入225 mL的已灭菌生理盐水中,在24 ℃ 40 KHz的超声清洗器中超声2 min制成混浊液。经过梯度稀释后,选取适当的稀释倍数取100 μL均匀涂布在PDA培养基上,于(28±1) ℃倒置培养2~3 d。挑取具有典型特征的菌落进行染色镜检,并进行平板反复划线纯化后,将其接到斜面培养基上于4 ℃保藏备用。
1.2.2 TTC平板初筛 TTC(2,3,5-氯化三苯基四氮唑)是一种显色剂,当TTC接受细菌脱氢酶作用而释放出游离氢后会产生显色反应使菌落显出红色,此过程中释放的氢越多,红色越深,反之,则红色越浅[17-18]。
将斜面培养基上保藏的菌株接入TTC底层培养基上,在28 ℃恒温条件下倒置培养48 h,待菌落充分长成后,倒入一层较薄的TTC上层培养基将底层培养基完全覆盖,然后在(28±1) ℃条件下培养24 h,挑取颜色较深的菌落将其保藏备用。
1.2.3 摇瓶复筛 将TTC平板初筛得到的菌株分别接入装有100 mL发酵培养基的三角瓶中,在(28±1) ℃条件下发酵48 h后,测定发酵液中是否有乙醇产生,及发酵液中乙醇的含量,挑选出乙醇产量高的菌株做进一步的鉴定。试验设置3个平行。
1.3 生长曲线的绘制
首先将低温保藏的菌种接入100 mL的发酵培养基中,(28±1) ℃恒温培养24 h进行活化。然后按照5%的接种量接入到装有300 mL发酵培养基的三角瓶中,于(28±1) ℃培养,每2 h取一次样,用可见光光度计测定OD600值,根据测定得到的光密度值绘制该菌种的生长曲线[19]。
1.4 菌种的鉴定
使用TIANGEN细菌基因组DNA提取试剂盒提取待测菌株的DNA,对提取的DNA进行PCR扩增16S rDNA,通用引物为(27-F: AGAGTTTGATCMTGGCTCAG;1492-R: TACGGYTACCTTGTTACGACTT)。PCR反应体系为50 μL(DNA模板2 μL、上下游引物各为1 μL、缓冲液5 μL、dNTPs 4 μL、Tap酶0.25 μL、MgCl24 μL、ddH2O 32.75 μL)。PCR反应条件:95 ℃预变性5 min,95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,循环30次,最后72 ℃延伸10 min。将PCR扩增产物送至测序公司进行测序,将测序得到的基因序列在NCBI上进行BLAST比对,从中选取同源性高的菌株,再使用MEGA 7.0软件,NJ方法,构建系统进化树。
1.5 生理生化鉴定
1.5.1 碳源同化试验 采用的碳源有:葡萄糖、蔗糖、麦芽糖、乳糖、半乳糖、鼠李糖、D-木糖、D-阿拉伯糖、柠檬酸、可溶性淀粉、甘露醇、纤维二糖、山梨醇、棉子糖。将12.5%的豆芽汁培养基进行分装,每只试管中装入10 mL培养基,并于121 ℃灭菌20 min,待培养基冷却至40~50 ℃时,加入10%的无菌糖溶液625 μL。然后将待测试菌种进行活化后,按照5%的接种量接入到已准备好的培养基中,(28±1) ℃培养3~5 d,观察是否出现浑浊,如果培养基出现浑浊则为阳性,反之则为阴性。以不含糖的试管为阴性对照管,每种碳源试验设置3个平行。
1.5.2 氮源同化试验 采用的氮源有:L-赖氨酸、硝酸钾、亚硝酸钠、硝酸铵、天门冬素。在无氮培养基上分别加入以上氮源作为培养基的唯一氮源,加入量为0.078%,并于115 ℃灭菌20 min。按5%的接种量将已活化的菌种接入制备好的培养基中,于(28±1) ℃培养48 h。试验设置3个平行,以不加氮源的无氮培养基作为阴性对照。根据菌种在不同氮源培养基上生长情况,判断氮源是否能够被菌株同化。
1.5.3 甲基红试验 挑取少量新鲜的待测试培养物接种于缓冲葡萄糖蛋白胨水中,于(28±1) ℃恒温培养3~5 d,48 h后每24 h取培养液加入甲基红试剂1~2滴,立即观察现象。直至发现阳性或第5天仍为阴性即可判定结果。滴入指示剂,呈鲜红色或橘红色为阳性;橘黄色或黄色为阴性。
1.5.4 耐乙醇试验 向带有杜氏小管且已灭菌的培养基中添加乙醇,使发酵培养基中的乙醇体积分数达到10%,15%,20%,25%,30%,35%,40%,混匀后接入已活化好的菌种,(28±1) ℃培养2~3 d,观察菌体生长情况和产气情况。通过试验结果缩小耐受限值范围,并再进行试验确定。
1.5.5 耐高渗透压试验 将经过隔夜活化的菌种划线接种于葡萄糖浓度为25%,30%,35%,40%,45%的PDA培养基上,放置于(28±1) ℃恒温培养箱中培养4周,进行检查。试验过程中需采取蜡纸封口等措施预防培养基干燥。
2 结果与分析
2.1 菌种的筛选
从米刺葡萄表面筛选出一株产乙醇能力较强的细菌,编号为MUY3,在(28±1) ℃的恒温条件下静置发酵48 h后,其发酵液中的乙醇浓度可达到10.67%。
2.2 MUY3的形态特征
MUY3在PDA培养基上培养3 d后,菌落呈规则的圆形,白色,表面光滑且凸起,直径达1.5~2.0 mm,见图1。经过革兰氏染色后在油镜下观察,细胞为直杆状、无芽孢的革兰氏阴性细菌,见图2。图3为MUY3在TTC平板上生长48 h的菌落特征。
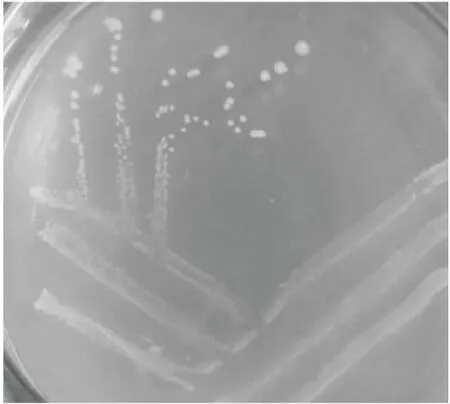
图1 菌落形态
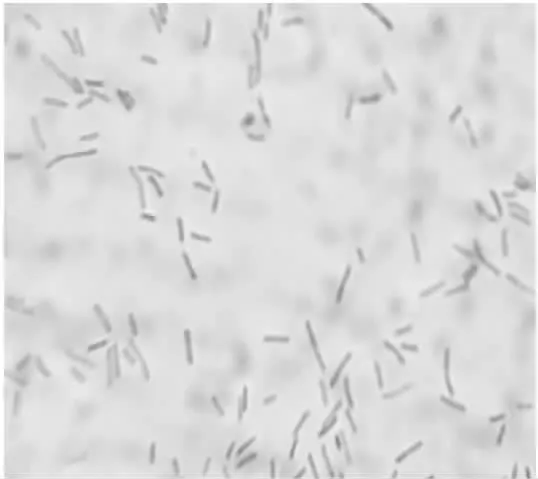
图2 革兰氏染色结果(1 000×)

图3 TTC平板结果
2.3 MUY3的鉴定
采用细菌通用引物对MUY3的高度保守序列区域进行PCR扩增,得到了大约1 500 bp的扩增片段,其扩增产物较纯,见图4。在NCBI上对比后选择同源性较高的菌株并构建系统进化树,见图5。从进化树可知MUY3与Enterobacterxiangfangensis strain 10-17 的亲缘关系最近,同源性可信度为100%。因此,MUY3可以初步判定为Enterobacterxiangfangensis strain 10-17。
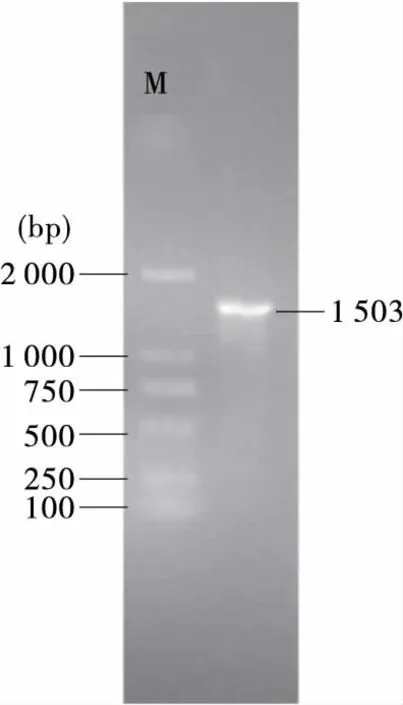
图4 MUY3 16S rDNA PCR扩增结果
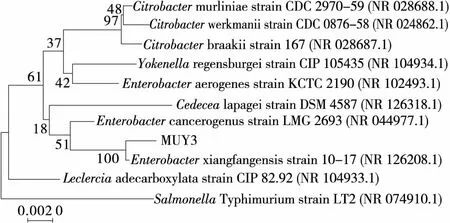
图5 菌株MUY3的系统进化树
2.4 菌株的生长曲线
由图6可知,当菌种接种入培养基8 h后进入对数期,18 h后进入稳定期。如果在试验或生产中为获得生理特性稳定、代谢旺盛[20]的细菌则可活化10~18 h。
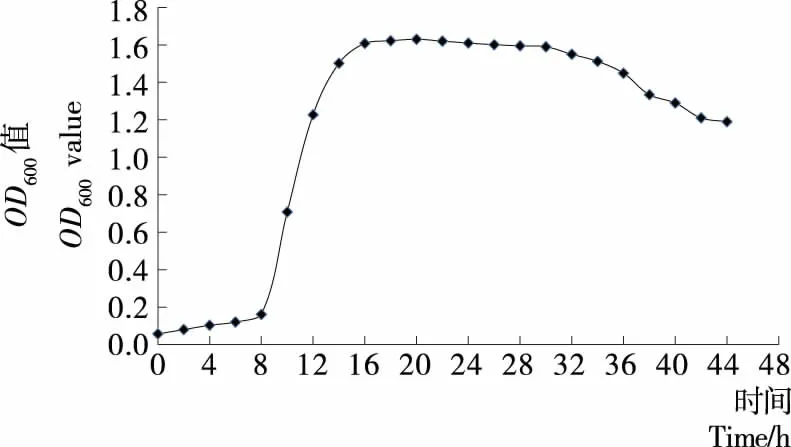
图6 MUY3的生长曲线
2.5 生理生化试验
2.5.1 同化试验 MUY3可以利用的碳源、氮源范围较广,并且该菌种利用葡萄糖和蔗糖作为碳源时,其发酵液中浑浊度和产气量明显高于其他碳源,试验结果见表1、2。
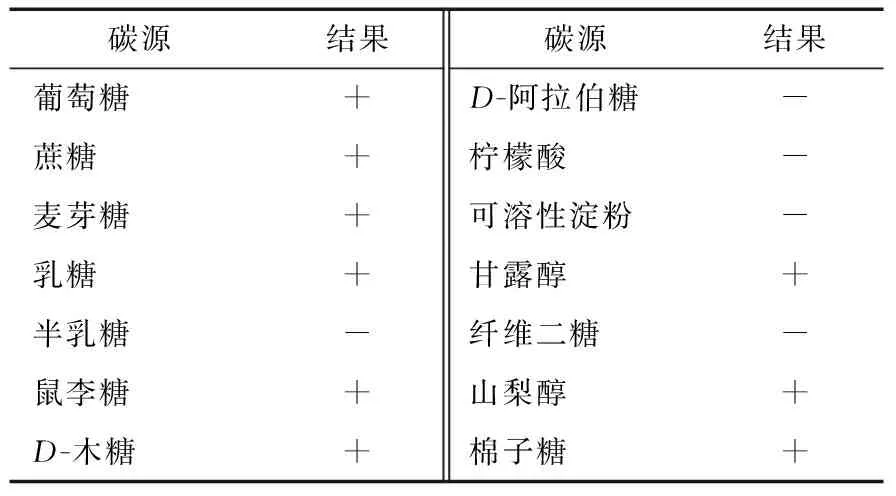
表1 碳源同化试验†
† “+”表示培养基中出现浑浊;“-”表示培养基中无浑浊。

表2 氮源同化试验†
† “+”表示培养基上有菌落长成;“-”表示培养基上无菌落长成。
2.5.2 甲基红试验 培养48 h后,每24 h取培养液滴入少量甲基红试剂观察培养液颜色的变化。结果显示,培养48,72,96 h时培养液为淡黄色,培养120 h时(即第5天)培养液变为黄色,记为MR试验为“-”,表明MUY3产酸能力较弱,见图7。

图7 甲基红试验
2.5.3 耐乙醇试验 一般葡萄酒含乙醇的体积分数在10%~15%[21]。由表3可知,MUY3对乙醇有较高的耐受性,当体积分数为10%~15%时,对该菌种的发酵无明显影响,并且其最大耐受限度范围为30%~35%。因此,使发酵液中的乙醇体积分数达到30%,31%,32%,33%,34%,35%,以同样的方法再进行试验,得到结果见表4。所以得出菌种MUY3对乙醇的最大耐受限度为30%(体积分数)。
2.5.4 耐高渗透压试验 本试验采用葡萄糖进行培养基中糖浓度的调节,见表5,其耐渗透压的极限值为40%,且在该浓度下MUY3存活率偏低。
3 结论
本研究从湖南怀化米刺葡萄表面筛选出一株能产乙醇的细菌,编号为MUY3,被初步鉴定为Enterobacterxiang-fangensis strain 10-17,并对其部分发酵特性进行了研究。菌株MUY3能耐高渗透压,具有较强的发酵性能,在28 ℃恒温培养条件下发酵48 h后,其发酵液中产乙醇量为10.67%,而耐受乙醇体积分数可达到30%,并且该菌种能利用多种碳源(葡萄糖、蔗糖、麦芽糖、乳糖、鼠李糖、D-木糖、甘露醇、山梨醇、棉子糖)和氮源(L-赖氨酸、硝酸铵、天门冬素)。
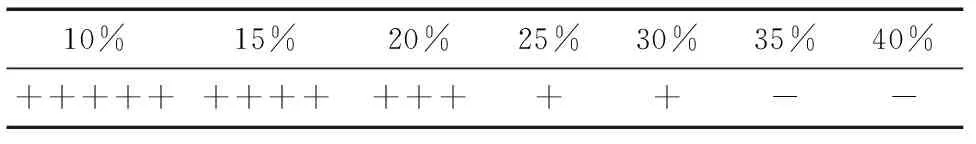
表3 MUY3在不同体积分数乙醇中的产气情况†
† “-”表示不产气;“+”表示产气量为杜氏小管的1/5;“++”表示产气量为杜氏小管的2/5;“+++”表示产气量为杜氏小管的3/5;“++++”表示产气量为杜氏小管的4/5;“+++++”表示气体量充满杜氏小管。
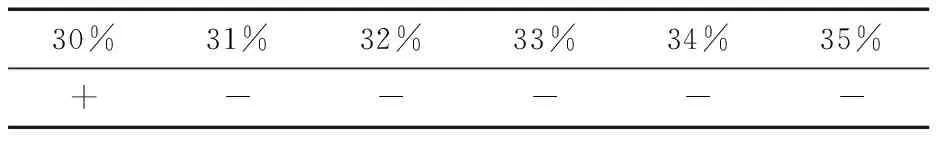
表4 MUY3的乙醇耐受限度†
† “-”表示不产气;“+”表示产气量为杜氏小管的1/5。
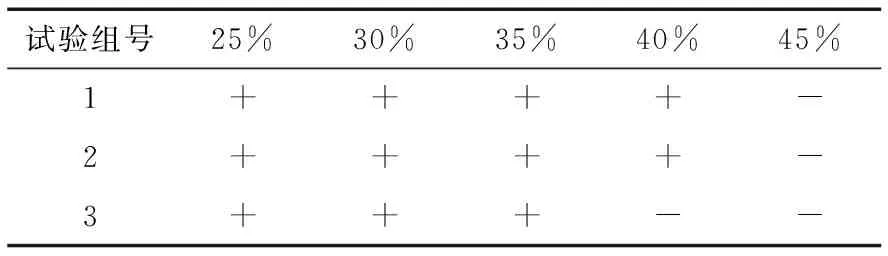
表5 高渗透压试验†
† “-”表示无菌落长成;“+”表示有菌落长成。
目前菌种Enterobacterxiangfangensis strain 10-17的相关研究较少,暂时无法取代酵母菌在葡萄酒酿造中的应用,主要的原因是无法确定发酵过程中有哪些副产物的产生,同时也无法确定副产物对葡萄酒品质是否有影响。为解决上述问题,对Enterobacterxiangfangensis strain 10-17进行菌种改良及发酵副产物的研究将成为今后科研工作者的研究方向。
[1] 李甲贵. 我国葡萄酒消费者行为研究[D]. 杨凌: 西北农林科技大学, 2014: 5-7.
[2] 朱艳. 中国葡萄酒产业竞争力及其影响因素研究[D]. 无锡: 江南大学, 2014: 8-9.
[3] 朱力, SIECZKOWSKI N, BELANCIC A, 等. 更完美的展现葡萄品种的个性: “品种酵母”的筛选和应用[J]. 中外葡萄与葡萄酒, 2007(1): 58-61.
[4] 易新萍, 许东滨, 周文革. 西北地区葡萄酒国家监督抽查检测结果与分析[J]. 中国卫生检验杂志, 2010, 20(4): 848-849.
[5] 程超, 韩北忠, 陈晶瑜, 等. 本土葡萄酒酿酒酵母发酵性能的比较[J]. 中国酿造, 2008, 27(17): 8-10.
[6] 郭蓉. 低高级醇刺葡萄酒酵母菌的筛选及应用研究[D]. 长沙: 湖南农业大学, 2013: 8-11.
[7] 欧阳建文, 熊兴耀, 刘东波, 等. 刺葡萄综合开发利用研究[J]. 广西园艺, 2007, 18(2): 29-31.
[8] 鲍瑞峰, 秦丹, 唐明, 等. 刺葡萄酒香气成分的研究[J]. 酿酒科技, 2010(2): 53-56.
[9] 翁连海, 逯家富, 王军, 等. 进口葡萄酒酿造用活性干酵母在我国山葡萄酒生产中的应用研究[J]. 酿酒, 2006, 33(2): 61-62.
[10] MARO E D, ERCOLINI D, COPPOLA S. Yeast dynamics during spontaneous wine fermentation of the Catalanesca grape[J]. International Journal of Food Microbiology, 2007, 117(2): 201-210.
[11] BECHER P G, FLICK G, ROZP DOWSKA E, et al. Yeast, not fruit volatiles mediate Drosophila melanogaster attraction, oviposition and development[J]. Functional Ecology, 2012, 26(4): 822-828.
[12] 时月. 玫瑰香葡萄酒自然酿造过程和酵母的分离鉴定与特性分析[D]. 秦皇岛: 河北科技师范学院, 2015: 38-40.
[13] 王国平, 宋育阳, 裴颖芳, 等. 宁夏御马葡萄酒厂野生酵母菌株的分离筛选及分子鉴定[J]. 中国酿造, 2009, 28(8): 38-41.
[14] ILIEVA F, KOSTADINOVI V S, DIMOVSKA V, et al. Selection of 80 newly isolated autochthonous yeast strains from the Tikves region of Macedonia and their impact on the quality of red wines produced from Vranec and Cabernet Sauvignon grape varieties.[J]. Food Chemistry, 2017, 216: 309-315.
[15] 杨莹, 管敬喜, 谢林君, 等. 广西毛葡萄产区野生葡萄酒酵母种群分布与系统进化分析[J]. 南方农业学报, 2016, 47(7): 1 123-1 128.
[16] 巴尼特 J A. 酵母菌的特征与鉴定手册[M]. 胡瑞卿, 译. 青岛: 青岛海洋大学出版社, 1991: 20-27.
[17] 龚国利, 史政豪, 张甜, 等. 运动发酵单胞菌的筛选与鉴定[J]. 陕西科技大学学报, 2015(6): 138-141.
[18] GUNASEKARAN P, RAJ K C. Ethanol fermentation technology-Zymomonas mobilis[J]. Currentence, 1999, 77(1): 56-68.
[19] 祁国振, 毛志泉, 胡秀娜, 等. 苹果根际自毒物质降解菌的筛选鉴定及降解特性研究[J]. 微生物学通报, 2016, 43(2): 330-342.
[20] 杰伊, 罗西里尼, 戈尔登, 等. 现代食品微生物学: 食品微生物学[M]. 何国庆, 丁立孝, 宫春波, 译. 北京: 中国农业大学出版社, 2008: 36-39.
[21] 王染霖, 董新平, 刘怀锋. 新疆天山北麓赤霞珠干红葡萄酒品质分析[J]. 新疆农垦科技, 2015(6): 66-69.
Isolation, screening and identification of an ethanol-producing bacterium
CHENMeng-juan1
ZHOUHong-li2
JIANGLi-wen2
DENGQing-qing1
ZHUYun-yi1
(1.CollegeofFoodScienceandTechnology,HunanAgriculturalUniversity,Changsha,Hunan410128,China; 2.HunanKeyLaboratoryofFoodBiotechnology,Changsha,Hunan410128,China)
From four kinds ofVitisdavidii, widely planted in Hunan Province, an ethanol-producing bacterium named MUY3 was obtained from the surface of the rice grape by separation screening and identification. Its physiological and biochemical characteristics were investigated, including the cultivation of growth curve, assimilation test, methyl red test and high osmotic pressure test. Moreover, its 16S rDNA sequence was analyzed, and the phylogenetic tree analysis were used to identify this bacterium. The results showed that MUY3 was close toEnterobacterxiangfangensis and the similarity was 100%. Therefore, the strain was identified asEnterobacterxiangfangensis 10-17.
Vitisdavidii; ethanol; 16S rDNA;Enterobacterxiangfangensis strain 10-17; Physiological and biochemical characteristics
湖南省教育厅重点项目(编号:14A072)
陈梦娟,女,湖南农业大学在读硕士研究生。
周红丽(1972—),女,湖南农业大学食品科技学院教授,博士,硕士生导师。E-mail: xuanxuan310@126.com
2017—01—28
10.13652/j.issn.1003-5788.2017.07.007
